 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
IONUL SODIU (NATRIU) Na+
Numar de oxidare + 1. Pentru executarea reactiilor se foloseste o solutie ce contine ionul Na+, de exmplu NaCl.
Reactii pe cale uscata
Reactia de culoare a flacarii
Sarurile de sodiu coloreaza flacara incolora a unui bec in galben intens. Aceasta reactie este foarte sensibila.
Reactii pe cale umeda
Hexahidroxostibiatul de potasiu K Sb(OH)6 formeaza in solutie neutra sau slab alcalina un precipitat alb, cristalin, de hexahidroxostibiat de sodiu, Na Sb(OH)6 . Precipitarea se poate grabi frecand peretii interiori ai eprubetei cu o bagheta de sticla.
(Na+ + Cl-) + (K+ + Sb(OH)6 -) Na Sb(OH)6 + (K+ + Cl)
Hexahidroxostibiatul de sodiu se descompune sub actiunea acizilor, formand acid stibic (precipitat alb, amorf).
Na Sb(OH)6 + (H+ + Cl-) H3SbO4 + 2 H2O + (Na+ + Cl-)
Datorita acestei comportari reactia nu se efectueaza niciodata in mediu acid. Hexahidroxostibiatul de potasiu este reactivul specific al ionului de sodiu, insa solutia nu trebuie sa contina alti ioni.
IONUL POTASIU (KALIU) K+
Numarul de oxidare: 1+. Pentru executarea reactiilor se foloseste o solutie ce contine ionul K+ , de exemplu KCl.
Reactii pe cale uscata
Reactia de culoare a flacarii
Sarurile de potasiu coloreaza flacara incolora a unui bec in albastru violet. In prezenta sarurilor de sodiu, culoarea galben intens mascheaza culoarea violeta. Culoarea violet se poate observa privind flacara printr-o sticla de cobalt, care absoarbe radiatiile galbene ale sodiului, lasand sa treaca numai pe cele violete ale potasiului.
Reactii pe cale umeda
1. Acidul percloric, HClO4, formeaza cu ionul K+ un precipitat alb, cristalin, de perclorat de potasiu.
(K+ + Cl) + (H+ + ClO4-) = KClO4 + (H+ + Cl-)
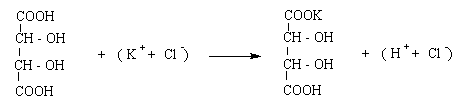
2. Acidul tartric, C4O6H6,
formeaza in solutii neutre si nu prea diluate ale sarurilor de potasiu si in
prezenta acetatului de sodiu un precipitat alb de tartrat acid de potasiu
(bitartrat de potasiu) usor solubil in acizi minerali sau hidroxid de sodiu,
greu solubil in acid acetic si alcool.
(H+ + Cl-) + (Na+ + CH3COO-) = CH3COOH + (Na+ + Cl-)
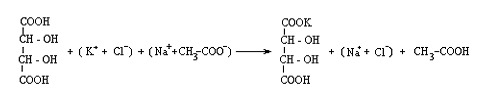
Deoarece precipitatul este
dizolvat de catre acidul mineral care rezulta din reactie, precipitarea este
incompleta; pentru a inlatura dizolvarea partiala a bitartratului, precipitarea
se face in prezenta acetatului de sodiu care formeaza cu acidul acetic rezultat
din reactie un amestec tampon care mentine o concentratie a ionilor hidroniu
favorabila precipitarii.
Aparitia precipitatului este favorizata de frecarea peretilor eprubetei cu o bagheta.
3. Hexanitrocobaltiatul trisodic, Na3 Co(NO2)6 , formeaza in solutii neutre sau slab acetice un precipitat galben cristalin, de hexanitrocobaltiat de sodiu si potasiu.
2(K+ + Cl-) + (3Na+ + Co(NO2)6 3-) = K2Na Co(No2)6 + 2(Na+ + Cl-)
Aceasta este una din cele mai sensibile reactii pentru identificarea potasiului (reactia specifica). Solutia nu trebuie sa fie alcalina, pentru ca precipita Co(OH)3 verde brun, de asemeni nu trebuie sa contina ioni NH4+ care formeaza cu reactivul un precipitat galben cristalin.
IONUL AMONIU (NH4+)
Pentru efectuarea reactiilor se foloseste o solutie ce contine ionul NH4+, de exemplu NH4Cl.
Reactii pe cale uscata
Sarurile de amoniu se descompun prin incalzire in acid (sau derivati ai acestuia) si in amoniac (ce se recunoaste dupa mirosul caracteristic).
De exemplu: NH4Cl NH3 + HCl
NH4NO3 N2O + 2H2O
3(NH4)2SO4 3SO2 + 4NH3 + N2 + 6H2O
Reactii pe cale umeda
1. Bazele: NaOH, KOH, Ca(OH)2, descompun prin incalzire sarurile de amoniu, degajand amoniacul. Acesta se recunoaste dupa miros sau prin inalbastrirea hartiei umede roz de turnesol.
(NH4+
+ Cl-) + (Na+ +
2. Reactivul Nessler, care este o
solutie alcalina de tetraiodomercuriat de potasiu
(NH4+
+ Cl-) + (Na+ +
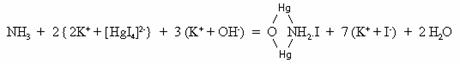
Este o reactie sensibila si serveste la identificarea urmelor de amoniac din apele de baut (reactie specifica).
Prepararea si titrarea unei solutii 0,05 N de NaOH cu ajutorul unei solutii de acid oxalic
Principiul metodei
Metoda se bazeaza pe reactia de neutralizare dintre acidul oxalic si hidroxidul de sodiu in prezenta fenolftaleinei care serveste ca indicator.
COOH COONa
+ 2NaOH = + 2H2O
COOH COONa
Reactivi:
1) - acid oxalic 0,05 N, F = 1,0000
Acidul oxalic este o titrosubstanta, astfel incat putem prepara o solutie de normalitate exacta. Masa moleculara a acidului oxalic: MH2C2O4 2H2O = 126,068
Echivalentul chimic: = ![]()
Pentru prepararea a 1000 ml solutie 0,05 N sunt necesare 63,034 . 0,05 = 3,1517 grame, care se cantaresc cu precizie la balanta analitica pe o sticla de ceas. Substanta cantarita se trece cantitativ intr-un balon cotat de 1000 ml cu apa distilata; dupa dizolvarea substantei, solutia se aduce la semn cu apa distilata si se omogenizeaza prin agitare. Solutia este exact 0,05 N cu factorul de corectie F = 1.
2) - hidroxid de sodiu 0,05 N
Masa moleculara a hidroxidului de sodiu = 40. Echivalentul chimic = 40/1 = 40. 1000 ml solutie 0,05 N de NaOH contin 0,05 40 = 2g NaOH.
Pentru a prepara 1000 ml solutie de NaOH 0,05 N, vom cantari la balanta tehnica 2,5-3g de hidroxid de sodiu; substanta se clateste de 2-3 ori cu apa distilata pentru a indeparta stratul de carbonat de la suprafata, apoi se trece intr-un balon cotat de 1000 ml cu apa distilata si dupa dizolvarea substantei se aduce la semn cu apa distilata; se omogenizeaza prin agitare.
Solutia preparata este aproximativ 0,05 N deoarece NaOH nu este stabil in aer (se carbonateaza) si nu se poate cantari exact. Pentru a-i stabili concentratia, ea se titreaza cu o solutie etalon, care in cazul nostru este solutia de acid oxalic de concentratie cunoscuta.
3) - Fenolftaleina 0,1% solutie alcoolica
Se dizolva 0,1g fenolftaleina, cantarita la balanta analitica, intr-un balon cotat de 100 ml si se aduce la semn cu alcool etilic.
Mod de lucru
Intr-un pahar Berzelius de 100 ml se masoara cu ajutorul unei pipete 5 ml solutie de acid oxalic 0,05 N, F=1, se clatesc peretii paharului cu putina apa distilata si solutia din pahar se incalzeste pe sita, la flacara unui bec de gaz pana la temperatura de 70 - 800C (pana apar primele bule de aer) pentru indepartarea dioxidului de carbon dizolvat in solutie, in prezenta caruia fenolftaleina nu este sensibila. Se evita fierberea solutiei pentru a nu se descompune acidul oxalic. Se adauga 1 - 2 picaturi de fenolftaleina si solutia fierbinte se titreaza cu o solutie de hidroxid de sodiu din biureta, pana la aparitia unei coloratii roz deschis. Coloratia trebuie sa persiste un minut. Se masoara volumul de solutie de hidroxid de sodiu folosit la titrare (V1).
Calcul
5 ml (COOH)2, 0,05 N, F = 1. V1 ml NaOH N = ? T = ? F = ?
MNaOH = 40; M(COOH)2 . 2H2O = 126. ENaOH = 40; E(COOH)2 = 63
1. Calcularea gramelor de acid oxalic din volumul de 5 ml solutie 0,05 N F = 1;
1000 ml (COOH)2 ----- ----- ----- ----- ----0,05 63 1g
5 ml-------- ----- ------ -----------x1
__________ ______ ____ __________
x1 = 63 5 0,05 / 1000
2. Calcularea gramelor de NaOH din volumul V1:
(COOH)2 + 2NaOH = (COONa)2 + 2H2O
1 mol 2 moli
126g (COOH)2----- ----- ----- ----- -----2 40g NaOH
63g (COOH )2----- ----- ----- ----- ------40g
63 5 0,05 / 1000x2
__________ ______ ____ _________
x2 = 40 5 0,05 /1000
3. Calcularea Tr (g NaOH/1000 ml si g NaOH/1 ml)
V1 ml NaOH----- ----- ----- ----- ------- 40 5 0,05 /1000g
1000 ml ----- ----- --------- ----- --------Tr
__________ ______ ____ _________
Tr = 40 5 0,05 /V1 g NaOH/1000 ml
g NaOH/1 ml = 40 5 0,05 /V1 1000
4. Calcularea normalitatii N:
N = Tr / E = 40 5 0,05 /V1 40
Normalitatea se calculeaza efectiv, luandu-se cu aproximatie.
5. Calcularea Tt Tt = E N
6. Calcularea factorului de corectie volumetrica:
F = ![]()
Copyright © 2026 - Toate drepturile rezervate