 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
PROPRIETATI COLIGATIVE
DEF: Acele proprietati ale solutiilor care se modifica in functie de concentratia de solvat si nu au legatura cu structura chimica.
Reducere presiunii vaporilor
Crestere punctului de fierbere a solutiilor
ΔT = C Keb
Reducerea punctului de topire
ΔT = C Kcrio
Osmoza
1. Reducerea presiunii vaporilor
Legea lui Raoult
P = P0 · x1
x1 = fractia molara a solventului
(2) ![]() = x2
= x2
x2 = fractia molara a solvatului
Presiunea vaporilor unei solutii continand o substanta non-volatila este direct proportionala cu concentratia de solvent. Cu cat fractia molara a solventului este mai mare cu atat presiune vaporilor este mai mare.
Ex. 1.
Presiunea vaporilor unei solutii continand o substanta non-volatila la 28ºC este 27.371 mm. Presiunea vaporilor solventului pur este 28.065 mm la aceeasi temperatura. Calculati fractia molara a solventului si solvatului.
4. Osmoza
Osmoza este trecerea apei dintr-o regiune cu concentratie mare de apa spre una cu concentratie mica printr-o membrana semipermeabila
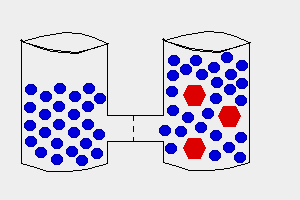
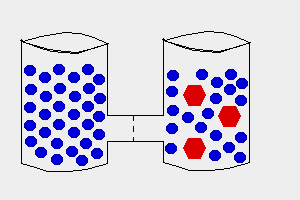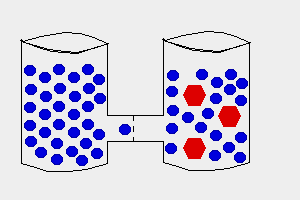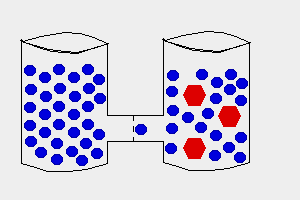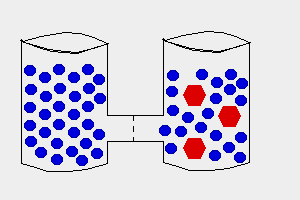

Solutii - hipotonica
hipertonica
izotonica
Osmoza este implicata in diferite procese fiziologice:
a) O celula introdusa intr-o solutie izotonica nu va influenta volumul celulei pentru ca nu exista nici un schimb de substanta
b) O celula introdusa intr-o solutie hipotonica, apa intra in celula, ii mareste volumul (endosmoza)
c) O celula introdusa intr-o solutie hipertonica, celula va suferi un fenomen de micsorare a volumului (exosmoza)
d) Edemele = reprezinta acumulari de lichid fara proteine in spatiile interstitiale. Pomparea acestui lichid in tesuturi se poate face in mod normal pana ce presiunea hidrostatica este egalata de cea osmotica (oncotica).
Π = CRT legea Van't Hoff
C - concentratia molara
R - constanta generala
T - temperature absoluta
Ex. 2.
Fluidul din anumite protoplaste are o presiune osmotica de 5 atm. Care va fi concentratia molara a unei solutii de sucroza daca ea este iso-osmotica cu presiunea din aceste celule la 30 ºC?
Ex. 3.
Calculati cate grame de glucoza sunt necesare pentru a prepara 200 ml solutie fiziologica 0.31 osm. (Mg=180g/mol)
Ex. 4.
Pentru solutia considerata anterior calculati temperatura de congelare, constanta crioscopica fiind Kcr=1.86˚C/M.
1. Formarea edemelor se explica prin:
a) dezechilibrul dintre presiunea hidrostatica si presiunea coloid-osmotica
b) cresterea presiunii coloid osmotice
c) reducerea presiunii coloid osmotice
d) reducerea presiunii hidrostatice
e) cresterea presiunii hidrostatice
Copyright © 2025 - Toate drepturile rezervate