 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
METODE ELECTROCHIMICE DE ANALIZA
Metodele electrochimice de analiza se bazeaza pe utilizarea curentului electric si a proprietatilor acestuia, pentru determinarea cantitatii unui component dintr-o proba.
Metodele de analiza cele mai des utilizate sub denumirea de metode electrochimice, sunt:
metoda conductometrica;
metoda potentiometrica;
metoda polarografica;
metoda electrogravimetrica;
electroforeza.
METODA CONDUCTOMETRICA DE ANALIZA
Analiza conductometrica reprezinta metoda de analiza electro-analitica bazata pe determinarea conductantei electrice ale solutiilor. Conductanta electrica a corpurilor este legata de migrarea sarcinilor electrice sub influenta unui camp electric. In cazul conductorilor metalici, se deplaseaza electronii, iar in solutiile si topiturile de electroliti, ionii. Conductanta unei coloane de electrolit delungime l si sectiune A, aflata intre doi electrozi este definita ca inversul rezistentei Ra ectrolitului:
![]() (1)
(1)
si are valoarea:
![]() (2)
(2)
ρ - rezistenta in cazul in care A si l sunt numeric egali, denumita rezistenta specifica, [Ω·cm];
x = l/ρ - conductanta specifica sau conductivitate, [Ω·cm];
Conductanta electrolitului depinde de natura si concentratia acestuia. In solutiile foarte diluate, conductivitatea variaza liniar cu concentratia (Figura nr.1). In practica analitica, este mai convenabil exprimarea normalizata a conductivitatii la 1 echivalent - gram.
Conductanta echivalenta a unui electrolit, Λ [Ω-1·cm2], este conductanta specifica a unei solutii care contine un echivalent-gram intr-un cm3.
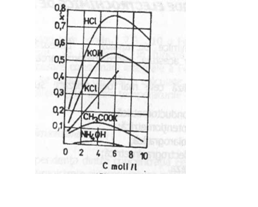
Variatia conductantei specifice a
unor electroliti in functie de concentratie
In aceste conditii, ea va fi data de relatia:
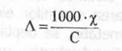 (3)
(3)
C - concentratia normala a solutiei (echivalenti-gram la 1000 cm3 solutie).
Considerand ca:
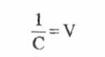 (4)
(4)
In care:
V- volumul solutiei, [cm3]
Se obtine:
![]() (5)
(5)
inlocuind valoarea lui X din relatia (3.) in relatia (2.), obtinem:
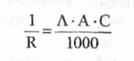 (6)
(6)
Valoarea efectiva a raportului l/A se numeste constanta a celulei, si se noteaza cu θ:
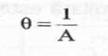 (7)
(7)
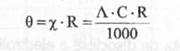 (8)
(8)
Din relatiile (2.) si (3.), rezulta:
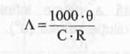 (9)
(9)
Respectiv:
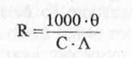 (10)
(10)
Constanta unei celule se determina pe baza ecuatiei (8.), prin ilclerminarea experimentala a rezistentei R a unei celule cu electrolit, cu x bine cunoscut (de exemplu, pentru o solutie de KCI).
In cazurile ideale, conductanta echivalenta a solutiilor de electroliti este independenta de concentratie. Practic insa, A descreste cu concentratia (Figura 2).
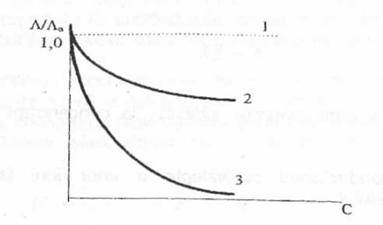
Figura 2. Variapa conductivitatii echivalente a electroliplor cu concentratia; 1 - electrolit ideal; 2 - electrolip tari; 3 - electroliti slabi; A0 - consductanta echivalenta pentru concentratie zero (dilutia infinita)
In cazul electrolitilor tari si la concentratii nu prea mari, variatia conductantei echivalente cu concentratia se poate reda prin ecuatia:
![]() (11)
(11)
Pentru electrolitii slabi, relatia similara este redata prin legea dilutiei:
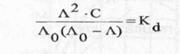 (12)
(12)
unde:
Kd - constanta de disociere a electrolitului respectiv;
Conductanta echivalenta a dilutie infinita este proportionala cu surra mobilitatilor ionice relative la dilutie infinita (u°). In cazul unui electrolit binar, vom avea:
![]() (13)
(13)
Unde:
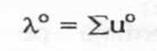 (14)
(14)
este coductanta echivalenta ionica la dilutie infinita.
In general:
![]() (15)
(15)
respectiv:
![]() (16)
(16)
unde:
X si A sunt marimile indicate, la concentratii finite mai mari decat dilutia infinita.
Valoarea conductantei echivalente a unor ioni la dilutie infinita estt prezentata in Tabelul de mai jos:
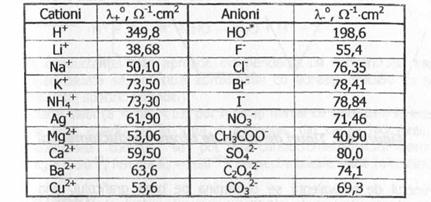
Din datele prezentate, se observa ca mobilitatea relativa a ionilor, respectiv curentul transportat de fiecare ion, difera foarte mult ionii de hidrogen si hidroxil, au mobilitati foarte mari, datorita unui mecanism specific de transport al lor in solutii apoase.
inlocuind relatia (14) in relatia (10) se obtine expresia:
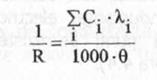 (17)
(17)
cea ce indica, existenta unei relatii liniare intre concentratia unui ion din solutie si contributia ionului respectiv, la conductanta totala a solutiei. Din acest motiv, metoda conductometrica se poate folosi la determinarea concentratiilor unor ioni din solutii.
Relatia liniara dintre concentratia unui ion dintr-o solutie si contributia ionului respectiv la conductanta totala a solutiei, permite urmarirea reactiilor chimice pe cale conductometrica, constituind baza titrarilor conductometrice.
Consideram titrarea electrolitului AB cu titrantul CD, pe baza ecuatiei chimice:
B+ + A + C+ + D' -> BD + C+ + A
Produsul BD este o substanta putin disociata, o combinatie complexa sau un precipitat. La inceputul titrarii, in solutie sunt prezenti numai ionii B+ si A', iar in cursul titrarii, concentratia ionilor B+ scade in favoarea formarii ionilor C+ . Variatia conductantei pe parcursul titrarii si deci forma curbei de titrare, va depinde de diferenta dintre mobilitatea ionilor B+ fata de cea a ionilor C+ care isi schimba locul pe parcursul titrarii. inaintea punctului de echivalenta (titrarea .icizilor tari si a bazelor tari) conductibilitatea poate sa scada , sa inmana neschimbata (titrarea prin precipitare), sau poate sa creasca (titrarea acizilor si a bazelor slabe). Dupa atingerea punctului de echivalenta in general, conductanta solutiei creste, sau ramane constanta.
Titrari conductometrice acido-bazice
Metoda are la baza reactia de neutralizare a unui acid cu o baza:
H+ + X- + M+ + HO--> H2O + M+ + X-
Variatia conductantei este aproape independenta de concentratia solutiilor folosite: solutiile diluate se pot titra aproximativ cu aceeasi precizie ca si cele mai concentrate (avantaj specific metodei).
Acizii foarte slabi (8 < pKa <10) pot fi titrati numai cu baze tari, la inceputul titrarii variatia fiind liniara, iar in jurul echivalentei, din cauza hidrolizei, va fi curbata. In asemenea conditii, se pot titra conductometric acizii foarte slabi (acidul boric Ka = 610-10, fenolul Ka =10-10), respectiv bazele slabe (alcaloizii).
Aparatura si reactivi
celula de conductivitate;
conductometru;
acizi tari, acizi slabi;
baze tari, baze slabe.
Modul de lucru
Se introduce in celula de conductanta acidul (sau baza) si se urmareste variatia conductantei electrice a solutiei, in functie de volumul de titrant adaugat (baza sau acid).
Prelucrarea datelor experimentale
Se reprezinta grafic, conductanta electrica in functie de volumul de titrant adaugat, pentru titrari diferite:
acid tare - baza tare;
acid tare - baza slaba;
acid slab - baza tare;
acid slab - baza slaba;
iar de pe graficele obtinute, se determina punctele de echivalenta.
De asemenea, se pot titra cu baze, amestecuri de acizi tari cu acizi slabi, respectiv, se pot titra cu acizi, amestecuri de baze tari cu baze slabe.
Titrari conductometrice cu formare de precipitate
Aceste titrari pot fi realizate prin metoda conductometrica, dar exactiatea determinarilor depinde de cinetica formarii precipitatelor, de solubilitatea precipitatului format, de adsorbtia ionilor la suprafata precipitatului si de fenomenul de co-precipitare. Cu cat precipitatul este mai solubil, curba de titrare este mai rotunjita in jurul punctului de echivalenta si finalul titrarii este mai greu de sesizat.
Aparatura si reactivi
celula de conductivitate;
conductometru;
reactivi care permit, in urma reactiei chimice, formarea de precipitate greu solubile (Ag+ cu CI-, Ba2+ cu S042- etc.).
Modul de lucru
Se procedeaza asemanator cu modul de lucru de la titrarile conductometrice acido-bazice. in cazul de fata, se va titra, conductometric, un volum cunoscut de solutie continand ioni de S042- cu o solutie de concentratie cunoscuta de BaCI2.
Prelucrarea rezultatelor experimentale
Se va trasa curba de variatie a conductantei solutiei in functie de volumul de titrant adaugat, din forma ei determinandu-se punctul final al titrarii si concentratia ionilor S042- in solutie.
Titrari conductometrice cu formare de complecsi
In cazul reactiilor cu formare de complecsi, conductometria se poate folosi atunci cand complexul format este suficient de stabil. Aceasta metoda de determinare, se foloseste in dozari mercurimetrice, dar mai ales, la indicarea echivalentei in titrarile complexonometrice, pe baza ecuatiei generale:
Me2+ + H2Y -> MeY + 2H+
in care:
H2Y este acidul etilen di-amino tetra acetic (EDTA).
Punctul de echivalenta se sesizeaza mai bine daca, se utilizeaza un sistem tampon care leaga ionii de hidrogen formati.
Aparatura si reactivi
celula de conductivitate;
conductometru;
solutie de EDTA;
solutie care contine ioni metalici in concentratie necunoscuta, care reactioneaza cu EDTA.
Modul de lucru
Se va titra un volum cunoscut de solutie, continand un metal care va reactiona cu EDTA, cu o solutie cu concentratie cunoscuta de EDTA. Se vor adauga volume mici de titrant si se vor efectua citiri de conductanta.
Prelucrarea rezultatelor experimentale
In baza curbei de variatie a conductantei in functie de volumul solutiei de EDTA adaugat la titrare, se va determina punctul de echivalenta si implicit, concentratia in metal a probei analizate.
Determinarea conductometrica a zincului din minereuri si concentrate
Zincul din proba de analizat este adus in solutie prin dezagregare acida oxidanta. Dupa separarea elementelor interferente prin precipitare, zincul este iitrat cu solutie de EDTA, folosind ca indicator xilenoranjul, sau, se efectueaza o titrare conductometrica.
Aparatura si reactivi
acid azotic d = 1,40;
acid clorhidric d = 1,19 si diluat 1+1 si 1+2;
acid sulfuric d = 11,84 si diluat 1+1 si 3+97;
perhidrol;
clorura de amoniu solutie 2%;
fluorura de sodiu solutie 4%;
persulfat de amoniu;
tiosulfat de sodiu solutie 20%;
indicator: 1 g xilenoranj se amesteca prin mojarare cu 99 g azotat de potasiu;
solutie tampon cu pH=5,7: 96 ml acid acetic glacial si 115 ml amoniac cu d = 0,91 se dilueaza cu apa la 1000 ml;
EDTA (sarea disodica a acidului etilen-diamino-tetraacetic), solutie 0,025 m;
hartie de filtru cu porozitate mica si medie.
Modul de lucru
Dezagregarea probei
In functie de continutul de zinc din proba, se cantaresc 0,2-1,0 grame proba, care se introduc intr-un pahar de laborator de 400 ml, se umezeste cu apa si se adauga, in portiuni mici, 15 ml acid clorhidric cu d = 1,19, se incalzeste timp de 10 min. pe baia de nisip, se adauga 5 ml acid azotic, se acopera cu sticla de ceas si se continua incalzirea. Dupa incetarea degajarii de vapori nitrosi, se adauga 10 mlacid sulfuric 1+1 si se incalzeste pe baia de nisip 15 minute, apoi se ridici sticla de ceas, spaland-o cu putina apa si se continua incalzirea, pana la degajarea vaporiloi albi abundenti. Se raceste, se spala peretii paharului cu un jet de apa, se incalzesti! din nou pe baie de nisip pana la degajarea abundenta de vapori albi, se acopera paharul cu sticla de ceas si se continua incalzirea inca 10 minute.
Indepartarea plumbului si silicei
Reziduul obtinut dupa dezagregare se reia cu 60-70 ml apa, se fierbe pentru dizolvarea sulfatilor solubili si se lasa in repaos pentru coagularea reziduului. Solutia se filtreaza prin hartie de filtru cu porozitate mica, intr-un pahar uscat. Hartia de filtru cu reziduu si paharul se spala cu 100 ml acid sulfuric 3+97.
Indepartarea fierului si manganului
in solutia obtinuta se adauga amoniac pana la inceperea precipitarii hidroxizilor, care se dizolva prin agitare, se adauga apoi 0,3-0,5 g persulfat de amoniu, se incalzeste la fierbere si se adauga amoniac 1+1 pana la precipitarea completa a hidroxizilor, apoi 10 ml in exces. Solutia cu precipitat se tine la 60-70 °C timp de 15 min si se filtreaza prin hartie de filtru cu porozitate medie intr-un vas conic de 500 ml. Hartia cu precipitat se spala de doua ori cu solutie fierbinte de clorura de amoniu. Reziduul de pe hartia de filtru se trece cantitativ in paharul in care s-a facut prima precipitare a hidroxizilor, se adauga 2-3 ml acid sulfuric 1+1, doua sau trei picaturi de perhidrol si se repeta precipitarea cu amoniac. Reziduul se filtreaza in acelasi vas conic spaland de 6-8 ori cu solutie fierbinte de clorura de amoniu. Filtratul se fierbe pana la disparitia mirosului de amoniac.
Determinarea zincului in solutia finala, se poate face prin doua variante: titrare in prezenta de indicator, sau titrare conductometrica.
1. Titrarea cu indicator
Se raceste solutia, se adauga 5 ml solutie de fluorura de sodiu si 0,05 - 0,1 g amestec indicator. Daca culoarea solutie este violeta, se adauga cateva picaturi de acid clorhidric 1+2, pana la schimbarea culorii in galben si un exces de 5 - 7 picaturi de acid. Se adauga apoi 5-10 ml solutie de tiosulfat de sodiu si amoniac 1+1, pana la virarea solutiei in violet, 10 ml solutie tampon si se titreza cu solutie de EDTA, pana la virarea culorii din violet in galben.
Prelucrarea rezultatelor experimentale
Continutul de zinc se calculeaza dupa formula:
![]()
ui ii Ic:
V - volumul solutiei de EDTA 0,025 m utilizat la titrare, [ml]; T - titrul solutiei de EDTA (cantitatea de zinc in grame ce corespund la i ml solutie de EDTA 0,025 m;
m - masa probei luata in lucru, [g].
2. Titrarea conductometrica
Determinarea se executa in solutia racita la temperatura camerei, prin Introducerea in solutie a unei sonde de temperatura si a celulei conductometrice, care se cupleaza la conductometru. Solutia se va agita utilizand un agitator electromagnetic. Se va inregistra conductivitatea solutiei in functie de volumul de solutie de EDTA adaugat. Punctul de echivalenta se va determina grafic, din curba de variatie a conductivitatii in functie de volumul solutiei de titrare. Cunoscand volumul solutiei, cantitatea de proba luata in lucru, punctul de echivalenta, volumul si concentratia solutiei de titrare, se va determina continutul in zinc al probei analizate.
Determinarea punctului izoelectric al proteinelor
Proteinele sunt aminoacizi legati prin punti poli-peptidice. Cunoasterea punctului izoelectric al proteinelor are o importanta deosebita in practica separarii preparatelor de proteina din tesuturi animale si vegetale. Structura primara a unei pioteine poate fi reprezentata astfel:

La un capat al catenei polipetidice exista o grupare -NH2 libera, iar la celalalt o grupare -COOH libera. Prezenta celor doua tipuri de grupari functionale libere, care au caracter chimic opus, conditioneaza o gama diversa de proprietati fizico-chimice ale proteinelor. Astfel, gruparile carboxil pot reactiona cu bazele, formand saruri (numite proteinati), sau pot ioniza, cu formare de ioni de hidrogen, in timp ce, gruparile amino reactioneaza cu acizii micsorand concentratia ionilor de hidrogen in solutie si in consecinta, aceste grupari conditioneaza proprietatile bazice ale proteinei. in functie de raportul dintre numarul gruparilor carboxil si amino, proteina se comporta ca un acid, sau, ca o baza.
Exemplu:
Gruparea carboxil este protogena si disociaza, formand ion de hidrogen si ion carboxilat, astfel proteina dobandind sarcina electrica negativa:
![]()
Gruparea amino este protofila si prin urmare, se poate protona, dobandind sarcina electrica pozitiva:
![]()
Sarcina globala a oricarei proteine reprezinta suma algebrica a sarcinilor pozitive si negative si depinde de reactia mediului: in mediu alcalin, proteina poseda sarcina electrica negativa, iar in mediu acid, sarcina electrica pozitiva.
Exista un pH caracteristic fiecarei proteine, la care suma algebrica a sarcinilor de semne contrare ale proteinei este egala cu zero.
Se numeste punct izoelectric, pH-ul mediului de reactie in care suma sarcinilor electrice negative a proteinei este egala cu suma sarcinilor electrice pozitive ale proteinei.
La punctul izoelectric, proteina precipita, datorita faptului ca ea poseda cea mai mica presiune osmotica, solublitate si vascozitate scazute si de asemenea conductanta electrica minima. Comportarea proteinelor la punctul izoelectric poate fi intuita corect daca se considera ca, proteinele se gasesc la punctul izoelectric in stare de amfioni, avand suma sarcinilor electrice nula.
![]()
Metoda de determinare a punctului izoelectric al proteinelor se bazeaza pe determinarea conductantei electrice si a pH-ului unor solutii proteice.
Aparatura si reactivi
pH-metru;
conductometru;
celula de conductanta;
acid acetic IN;
solutie de cazeina 0,4% preparata astfel: 0,2 grame de cazeina uscata se dizolva in 5 ml acetat de sodiu 0,1 M la cald apoi se aduce cantitativ intr-unbalon cotat de 50 ml si se aduce la semn.
Modul de lucru
Se pregatesc solutiile indicate in Tabelul de mai jos. Dupa adaugarea reactivilor, se agita bine, se lasa in repaos 5 - 10 min si se determina conductanta si pH-ul acestor solutii. Cazeina precipita la punctul izoelectric, fara a fi necesara prezenta in solutie a unor cantitati de substante deshidratante (etanol, acetona, tanin), asa cum este necesar in cazul albuminei sau gelatinei.
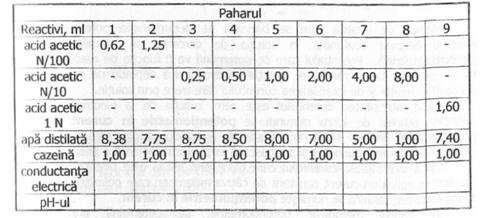
Se reprezinta grafic conductanta electrica a fiecarei solutii, in functie de pH-iil «icesteia si se evidentiaza punctul izoelectric.
Copyright © 2025 - Toate drepturile rezervate