 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
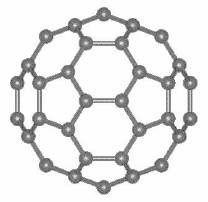
Fulerena C 60
Istoric
"Exista acolo, in natura, comportamente ale unor intregi sisteme neprevazute din partile componente ale acestora ? Aceasta este ceea ce chimistul a desoperit ca fiind adevarat"
Richard Buckminster Fuller
Inainte de 1985 se cunosteau doar doua forme alotropice ale carbonului : diamantul si grafitul. Cea de a treia forma alotropica a carbonului, fulerenele, a fost descoprita de H. W. Kroto, R. E. Smalley, R. F. Curl si colaboratorii acestora.
Prima publicatie care a prezentat fulerena este revista "Nature" in numarul din 4-20 noiembrie 1985. Sase ani mai tarziu, in 1991, revista Science va declara fulerena molecula anului.
Dupa ce au elucidat structura fulerenei, cei trei descoperitori ai acesteia au luat premiul Nobel pentru chimie in 1996 pentru descoperirea si cercetarea fulerenelor.
|
C70 |
C76 |
C84 |
Fulerene cu numar de atomi de carbon mai mare decat 60
Proprietati chimice
Fulerenele reprezinta un exemplu al unei clase complet noua de compusi organici .Una din primele intrebari pe care si le-au pus chimistii organicieni a fost " Care sunt proprietatile chimice ale acestor substante?"
Se stie ca atomii de carbon din fulerene sunt hibridizati sp2 , C60 se poate asemana cu benzenul, C6H6, sau ca etena, care este o alchena tipica. Dubla legatura in alchene este reactiva, ea putand aditiona multi compusi, modificandu-si hibridizarea de la sp2 la sp3. Moleculele aromatice sunt destul de stabile in comparatie cu alte clase de substante care au legaturi duble. Cei sase electroni ai celor 3 legaturi din molecula de benzen conduc la o stabilitate mare si o reactivitate scazuta la legaturile duble.
Astfel, substante care in mod obisnuit reactioneaza la dubla legatura a alchenelor au tendinta de a nu ataca benzenul. Daca reactia are loc cu un derivat al benzenului, produsul este de obicei un produs de substitutie, in care legatura C-H din benzen este inlocuita cu o legatura C-X (X fiind gruparea cu care s-a substituit nucleul aromatic), dar C60 nu are legaturi C-H care pot fi substituite. O alta curiozitate a chimiei fulerenelor este faptul ca C60 poate aditiona diferite cate gorii de substante in doua moduri diferite la o dubla legatura impartita de doua hexagoane ( o legatura 6-6) sau la o dubla legatura impartita de un hexagon si un pentagon ( o legatura 6-5). Acest fapt conduce la posibilitatea aparitiei unui numar mare de izomeri la aditia unor substante la C60.
Reactiile fulerenei C60 nu sunt rectii guvernate de caracterul aromatic in adevaratul sens al cuvantului. Din acest motiv exista 2 proprietati care influenteaza mecanismul de reactie al fulerenelor:
Delocalizarea electronica este slaba
C60 poate fi privita mai degraba ca o mare sfera formata din alchene conjugate decat ca o molecula aromatica
Deoarece toti atomii de carbon ai moleculei sunt hibridizati sp2 ei exercita un efect -I la fiecare legatura dubla . Acest fapt duce la o crestere a deficitului de lectroni si la favorizarea unui atac nucleofilasipra acestei molecule.Acest lucra se observa si in modul sau de oxidare si din caracterul electrofil al acesteia. Datorita proprietatilor mentionate mai sus C60 actioneaza ca un excelent reactant electrofil. O alta curiozitate este faptul ca legatura ce uneste doua hexagoane este mai scurta decat legatura ce uneste un hexagon de un pentagon, motiv pentru care aditiile au de obicei loc la legatura dintre doua hexagoane. Prezenta a 30 de astfel de legaturi in C60 este o alta cauza ce duce la obtinerea unei varietati de aducti.
Descompunerea fulerenelor sub actiunea laserului
S-a descoperit ca daca se supun fulerenele la actiunea unui laser nu foarte puternic atunci structura lor de tip cusca nu se va distruge imediat ci se va restrange pierzand treptat cate 2 atomi de carbon, pana cand se ajunge la C32. Dupa aceea clusterul se sparge in fragmente. A fost propus un mecanism pentru aceasta pierdere a unui fragment C2, exemplificat in figura urmatoare:
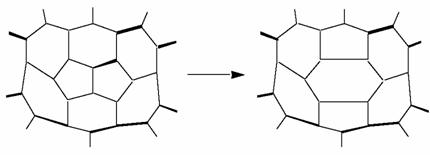
Pierderea unui fragment de C2 si rearanjarea legaturilor intr-o fulerena sub actiunea laserului
Reactii redox
C60 si C70 au proprietati similare putand fi supuse la sase reduceri reversibile a cate un electron. Au fost astfel obtinuti toti anionii de la C60- pana la C606 - si de la C70- pana la C706 - . Oxidarea C60 si a C70 este, insa, ireversibila. Primul potential de reducere, pentru ambele fulerene, este de aproximativ 1,0 V (pentru cuplul C60 C60-), indicand ca au proprietati de acceptor de electroni. C76 prezinta atat proprietati de donor cat si de acceptor de electroni.
Comportarea C60 in reactiile de halogenare
C60 are tendinta de a evita prezenta dublelor legaturi in cadrul pentagoanelor ceea ce conduce la diminuarea delocalizarii electronice si a aromaticitatii sale. Aceasta se comporta in unele cazuri ca o alchena cu deficit electronic, reactionand cu specii bogate in electroni, iar in alte cazuri se comporta ca compusii aromatici.
Un exemplu pentru comportarea de tip alchenic este reactia cu halogenii. Formarea compusului C60Br24 prin reactia dintre C60 solid cu brom lichid pur dureaza de obicei 5-8 zile, dar in septembrie 1996 o noua metoda a fost dezvoltata la Widener University, care reduce timpul de reactie la aproximativ o ora.
Mecanismul se crede a fi similar unei substitutii electrofile aromatice. Se formeaza din sarma de fier introdusa si brom FeBr3 (un acid Lewis), care catalizeaza reactia prin polarizarea moleculei de Br2 pentru atacul electrofil.
Un alt exemplu de substitutie electrofila aromatica este formarea compusului C60Ph5H, care se obtine atat prin reducerea compusului C60Ph5Cl, rezultat din reactia C60Cl6 cu benzen si FeCl3, cat si prin reactia dintre C60 si Br2 / FeCl3 / benzen ca produs principal.
Bromurarea fulerenei C60
Alchenele aditioneaza brom la dubla legatura mult mai usor decat hidrocarburile aromatice. Deoarece bromul este un lichid galben-brun aceasta reactie poate fi urmarita prin simpla observare a schimbarii culorii solutiei, aceasta decolorandu-se pe masura ce se consuma bromul. Oricum daca produsul organic ce se obtine in reactie este colorat s-ar putea sa nu se observe o decolorare ci doar o modificare de culoare.
Pentru a observa mai bine modul de reactionare al bromului cu C60 se va face un test comparativ intre aceasta fulerena, un compus aromatic, in cazul de fata naftalina si o alchena tipica: ciclohexena. Pentru acest experiment se vor folosi trei solutii de proba: C60 (0.5mg/mL in tetracloroetilena - in acest caz se foloseste un solvent inert), o alchena : ciclohexena ( 5% in volume dizolvata in tetracloroetilena) si compusul aromatic : naftalina in aceeasi concentratie si solvent ca alchena. Peste un mL din fiecare solutie se adauga intr-un pahar Erlenmeyer mic 2.5 mL solutie Winkler KBrO si KBr in solutie apoasa ) si 2.5mL de HCl 2M. Acest amestec genereaza brom care este solubil in solventi organici si in apa. Dupa aceea se va agita amestecul de reactie. Se va observa ce se intampla cu coloratia fiecarei solutii, fapt ce va da informatii despre modul de reactionare al fiecarei probe cu bromul. Cel mai repede se va decolora solutia de ciclohexena, urmata de fulerena si cel mai greu se va decolora solutia de naftalina. Din aceste viteze de reactie se poate deduce usor faptul ca in reactiile de aditie si in special de bromurare fulerenele vor reactiona intr-un mod intermediar fata de alchene si arene, dar insa exista si unele reactii in care se observa o comportare diferita a fulerenelor, comportare datorata particularitatii structurale a acestora. In cazul acestei reactii se dupa cateva minute se va adauga 2 mL de Na S O care va reactiona cu restul de brom care se mai afla in amestecul reactie. In acest fel toate modificarile de culoare ce vor mai avea loc se vor datora doar culorii produsilor de reactie.
Tot pentru a evidentia modul de reactie al fulerenelor in cazul aditiilor se va efectua testul cu permanganat de potasiu in mediu apos. Permanganatul de potasiu se aditioneaza la dublele legaturi ale alchenelor, dar nu si la hidrocarburile aromatice, pentru a forma dioli vicinali. In timpul acestei reactii culoarea violeta a permanganatului este inlocuita de catre culoarea bruna a formei reduse de Mn ce se afla in MnO2 . Se vor folosi cate 1 mL de alchena, hidrocarbura aromatica si fulerena, ca in cazul precedent, doar ca aici solventul este toluenul. Peste aceste probe se va adauga cate 1 mL de KMnO4 0.01% si H2SO4 0.1M. Amestecul se amesteca timp de cateva minute. Modificarile de culoare vor indica faptul ca reactia are loc. Din acest test se poate observa ca fulerenele reactioneaza dupa un mod mai apropiat de cel al alchenelor decat cel al substantelor aromatice.
C 60 poate participa foarte usor la reactii de aditie bromurativa. Primul derivat bromurat obtinut al C60 a fost C60Br24, dar insa la scurt timp dupa au mai fost obtinuti si derivati bromurati ce contin 2,4,6,8 atomi de brom in molecula. In timpul reactiei de bromurare care de obicei are loc la temperatura camerei, fulerena se adauga peste brom lichid. Produsul cristalin, numit bromofulerena, precipita dupa o perioada ce poate varia intre cateva ore si cateva zile si poate adopta o culoare de la galben-portocaliu pana la brun- inchis. Bromofulerenele se dizolva incet in solventi organici, cu posibilitatea pierderii de atomi de brom in urma acestui proces. Toti derivatii bromurati se distrug daca molecula este incalzita la o temperatura de circa 1500 C.
Metoda de bromurare a fulerenei C60:
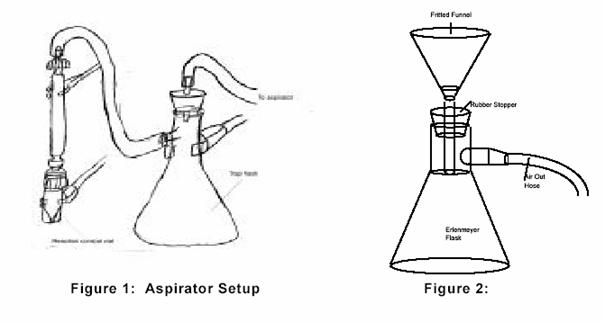
Se cantaresc 0.0449g de C60 de puritate 99.8% intr-un pahar, peste care se pun exact 2.0 ml de brom. Coloratia solutiei va deveni rosu-violet inchis si va produce o emanare de vapori portocalii. Amestecul de reactie se va lasa timp de sase zile sub agitare continua pe un agitator magnetic. Produsul se poate izola folosind o pompa de vid. O proba test de funingine de carbon si brom au fost introduse intr-o fiola conica pentru verificarea metodei de separare. Vidarea are rolul de a reduce presiunea in vas si astfel de a facilita evaporarea bromului care a ramas nereactionat in urma reactiei noastre. Aceasta metoda a fost imbunatatita fata de varianta initila deoarece in variantele incipiente au aparut unele probleme ca de exemplu faptul ca bromul dizolva platicul, material ce era folosit la inceput pentru etansarea instalatiei. Dizolvarea plasticului in amestecul de reactie duce la impurificare a probei si la o deteriorare a instalatiei de lucru.
Varianta finala a instalatiei de separare este prezentata in figura 1. Aceasta instalatie este alcatuita dintr-un pahar conic legat de un tub de sticla care ajuta la izolarea bromului din fiola, si care apoi este retinut de catre paharul conic. La tubul de sticla s-a conectat un furtun de cauciuc care va face legatura cu vasul conic. Toate legaturile de sticla au fost izolate cu banda de teflon pentru a reduce riscul contaminarii probei. In variantele initiale a fost folosit ca material pentru furtunul de cauciuc neoprenul, dar acesta a fost inlocuit cu un alt material mai bun deoarece primul s-a deteriorat. Dupa cateva zile , 1.2mL de brom au mai ramas in amestec cu proba. Pentru a se putea precipita produsul s-a adaugat 2mL disulfura de carbon ( CS2 ). Derivatii bromurati ai fulerenelor sunt insolubili in acest solvent si vor precipita din amestecul de reactie, spre deosebire de celelalte substante care inca se mai afla in amestecul de reactie. Pentru separarea precipitatului se va filtra la vid asa cum se poate observa in figura 2. Produsul de reactie este un derivat cu 24 atomi de brom legati de o molecula de C60. In varianta initiala a experimentului produsul de reactie a fost contaminat cu plastic datorita deteriorarii izolatiilor facute din materiale plastice, dar in experimentele urmatoare acest material care era dizolvat de catre vaporii de brom a fost inlocuit de catre teflon care este un material recunoscut pentru reactivitatea sa foarte redusa. Produsul final a avut o masa de 0.0705g putandu-se astfel calcula un randament al acestei reactii de aproximativ 45,45%, care poate fi considerat un randament bun daca se tine cont de faptul ca s-a calculat pentru varianta initiala a acestui experiment si ca au avut loc unele impurificari pe parcursul experimentului.
![]()
Bromurarea fulerenei C60 in disulfura de carbon
Aceasta a doua metoda de bromurare spre deosebire de prima foloseste drept solvent sulfura de carbon. Se amesteca 0.005 g de fulerena cu 0.5mL sulfura de carbon intr-o fiola conica. Dupa adaugarea solventului solutia va capata o coloratie violeta , coloratie datorata dizolvarii fulerenei in acest solvent. Pasul urmator consta in adaugarea 0.5mL brom in fiola si apoi punerea acesteia sub agitare magnetica timp de doua zile, timp in care se va forma produsul de reactie in forma solida. Pentru separarea acestui produs se va face o filtrare la vid amestecului de reactie.
5. Reactia de cicloaditie a fulerenei C60 la compusi nesaturati care contin heteroatomi de sulf si azot
Aceasta reactie a fost studiata de catre un grup de cercetatori de la Institute of Petrochemistry and Catalysis din Rusia .
S-a studiat o noua reactie de cicloaditie ce se desfasoara la temperatura si in prezenta de catalizatori a fulerenelor la 3-sulfone alchil substituite, imidazole, triazoli nesaturati si baza Shiff.
In urma interactiei fulerenelor cu 3-sulfonele si 3-metil-sulfonele in prezenta de catalizator de complecsi de Pd, Zr si Ti la 80-1000 C in toluen timp de opt ore se observa obtinerea C60-dihidrotiefin-1,1dioxid si derivatii sai alchil substituiti - aducti 1,4 la legatura 6,6 a fulerenei. O cicloaditie termica a 3- sulfonei, 3-metil si 3,4 dimetil-3-sulfonei la fulerena in aceleasi conditii (80-1000 C, toluen) conduce la substante similare si la derivatii acestora.
Mecanisme probabile ale formarii aductilor 3-sulfonelor si ai derivatilor acestora cu C60 la temperatura si in prezenta de catalizatori inca se mai discuta, pana acum nefiind nici un mecanism unanim acceptat.
Conditiile de reactie : 2000 C, opt ore timp de reactie, toluen ca solvent si catalizatori de Zr si Ti sub forma de complecsi, au fost alesi pentru reactia de cicloaditie [2+2] a triazolilor nesaturati , benzotriazolilor, imidazolilor si derivatiilor acestora, bazelor Shiff in toluen dau C60 derivati continand heterociclul corespunzator cu atom de azot.
Pentru o cunoastere mai buna a modului de reactie a fost studiata influenta raportului intre cantitatile initiale de reactanti si conditiile de reactie in producerea unei selectivitati in formarea derivatilor C60 continand N si S heterocicli. Structura compusilor ce s-au obtinut a fost confirmata de catre spectrele IR, UV, 1H si 13C RMN si totodata si prin metode spectroscopice de masa. Aceste cercetari au fost suportate de catre "Russian Foundation for Basic Research"
Ca o incheiere la acest eseu as vrea sa spun ca acest domeniu nou care a inceput sa creasca acum mai putin de doua decenii are un ritm de dezvoltare ascendent, ritm dat de numarul si spectaculozitatea aplicatiilor acestor materiale, iar acesta trebuie sustinut de o imbogatire a cunostintelor legate de proprietatile chimice ale acestor substante.
Copyright © 2025 - Toate drepturile rezervate