 | Aeronautica | Comunicatii | Constructii | Electronica | Navigatie | Pompieri |
| Tehnica mecanica |
TEORIA ALIAJELOR. DIAGRAME DE ECHILIBRU
1. CONSTITUTIA FIZICO-CHIMICA A ALIAJELOR
Materialele metalice se impart in metale si aliaje. În cazul metalelor, existand o singura specie de
atomi, la solidificare se va forma o singura faza, respectiv metal pur.
Aliajele sunt materiale metalice obtinute prin amestecul intim, uneori la scara atomica, a unui
metal de baza cu alte elemente metalice sau nemetalice, aceste amestecuri realizandu-se de cele mai multe
ori prin topire si solidificare.
Totalitatea aliajelor alcatuite din aceiasi componenti, formeaza un sistem de aliaje. Dupa numarul
componentilor (speciilor atomice din aliaj), aliajele pot fi binare, ternare, cuaternare sau polinare,
respectiv pe langa componentul de baza mai sunt prezenti unul, doi, trei sau mai multi alti componenti,
numiti si componenti de aliere sau elemente de aliere. Componentul de baza este intotdeauna metalic, iar
elementele de aliere pot fi, fie metalice fie nemetalice.
Din punct de vedere al constitutiei fizico-chimice, componentii unui aliaj se pot asocia in
urmatoarele moduri:
- formeaza o combinatie sau un compus chimic;
- formeaza cristale separate de metal pur;
- atomii elementelor de aliere se incorporeaza in reteaua cristalina a metalului de baza formand
cristale de solutie solida. Exista deci trei tipuri de faze in aliajele solide: metal pur, solutie solida, compus
chimic.
CONSTITUENTI METALOGRAFICI
La examinarea microscopica, fazele dintr-un material metalic prezinta aspecte structurale
caracteristice, numite constituenti structurali sau metalografici.
Proprietatile aliajelor sunt determinate de tipul fazelor prezente in aliaj, dar si de modul in care
sunt distribuiti constituentii metalografici, de forma si de raportul lor cantitativ. Deci, in timpul cercetarii
microscopice, prin studierea tipului, formei, cantitatii si distributiei constituentilor metalografici, se vor
putea face aprecieri asupra proprietatilor metalelor sau aliajelor.
Constituentii metalografici pot fi grupati in patru categorii distincte:
- metalul pur;
- solutia solida;
- compusul chimic;
- amestecul mecanic.
1. Metalul pur
Metalul pur se caracterizeaza prin conductibilitate electrica si termica ridicata, plasticitate mare,
dar cu duritate, limita de curgere si rezistenta la rupere, scazute.
Solutia solida
Grauntii de solutie solida sunt formati din atomi ai unor componenti diferiti care sunt distribuiti
intamplator in cadrul retelei. Componentul care predomina este numit component de baza sau solvent, iar
in reteaua sa cristalina vor fi inglobati atomii componentului de aliere, respectiv componentului dizolvat.
Dupa modul in care se incadreaza atomii componentilor dizolvati in reteaua cristalina a solventului, vor
rezulta solutii solide de substitutie, de interstitie si complexe. În solutiile solide de substitutie, atomii
componentului de aliere inlocuiesc in nodurile retelei cristaline o parte din atomii metalului de baza. În
solutiile solide de interstitie atomii componentului de aliere ocupa pozitii interstitiale ale retelei metalului
de baza. În solutiile solide complexe apar atomi straini, atat in nodurile retelei, cat si in spatiile
interstitiale.
În figurile 1, 2 si 3. sunt prezentate schematic principalele tipuri de solutii solide, respectiv
solutiile de substitutie, solutiile solide de interstitie si solutiile solide complexe.
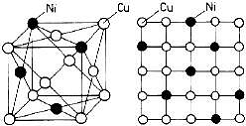
 Figura
1. Solutie solida de substitutie
in sistemul Cu-Ni:
Figura
1. Solutie solida de substitutie
in sistemul Cu-Ni:
a) reprezentare in spatiu; b) reprezentare in plan
a b
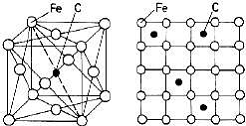
Figura Solutie solida de interstitie de carbon in Feγ:
a) reprezentare in spatiu; b) reprezentare in plan.
a b
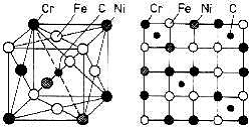
Figura 3. Solutie solida complexa in aliajul polinar Fe-Cr-Ni-C:
a) reprezentare in spatiu; b) reprezentare in plan.
b) Pentru a se putea forma solutii solide cu solubilitate nelimitata (solutii solide totale), componentii
c) aliajului trebuie sa indeplineasca urmatoarele conditii:
d) a) sa aiba acelasi tip de retea cristalina;
e) b) diferenta dintre diametrele atomilor sa nu fie mai mare de 8 %;
f) c) sa ocupe pozitii apropiate in tabelul periodic al elementelor, adica sa aiba un caracter
g) electrochimic asemanator;
h) d) sa aiba temperaturi de topire apropiate.
i) 3. Compusul chimic
j) În conditiile in care intre atomii metalului de baza si atomii elementelor de aliere se stabilesc
k) legaturi chimice, iau nastere asa numitii compusi chimici. Compusul chimic este un constituent
l) metalografic care prezinta o compozitie chimica constanta si bine definita, iar reteaua sa cristalina este
m) diferita de cea a componentilor.
n) Datorita legaturilor chimice complexe care apar intre atomii componentilor aliajelor, compusii
o) chimici prezinta de regula o duritate ridicata, dar si o fragilitate mare. De asemeni compusii chimici
p) prezinta de obicei temperaturi de topire mai mari decat elementele componente. Astfel, prezenta in aliaje
q) a compusilor chimici, va determina cresterea duritatii si deci si a rezistentei la uzare, cresterea fragilitatii
r) si ridicarea temperaturii de topire. Se pot deosebi trei tipuri de compusi chimici: compusi electrochimici,
s) compusi chimici electronici si compusi chimici interstitiali.
t) Compusii electrochimici (cu valenta normala) se formeaza intre componentii aliajului, pe baza
u) respectarii legii valentelor. Formulele chimice ale acestor compusi, vor exprima proportia ce exista intre
v) elementele componente. Se pot forma compusi electrochimici intre atomii unui element metalic si atomii
w) unui element cu caracter nemetalic (Al O , BeS, FeS, ) sau intre atomi metalici de specii diferite
x) (CuBe , MgCu , ZrFe
y) Compusii chimici electronici se caracterizeaza prin raportul ce exista intre numarul electronilor
z) de valenta si numarul atomilor din formula compusului chimic.
aa) Compusii chimici interstitiali se formeaza intre atomii unor elemente metalice si atomii unor
bb) elemente nemetalice care au un diametru atomic foarte mic (H, N, C, B). Se formeaza astfel, asa numitele
cc) hidruri, nitruri, carburi si boruri.
dd) 4. Amestecul mecanic
ee) Amestecul mecanic este un constituent format din doua sau mai multe faze solide, care s-au
ff) separat fie dintr-o solutie lichida (amestec mecanic eutectic), fie dintr-o solutie solida suprasaturata
gg) (amestec mecanic eutectoid).
hh) În diverse aliaje se formeaza amestecuri mecanice intre un metal pur si o solutie solida, sau intre
ii) un metal pur si un compus chimic, sau intre un compus chimic si o solutie solida etc. Fazele constituente
jj) ale amestecurilor mecanice se pot prezenta ca lamele sau globule ale unei faze, in masa celeilalte faze.
kk) Amestecurile mecanice eutectoide prezinta o dispersie mai ridicata a fazelor, ele sunt deci mai
ll) fine decat amestecurile mecanice eutectice. Proprietatile amestecurilor mecanice sunt determinate de
mm) proprietatile fazelor constituente, respectiv proprietatile sunt intermediare. De asemeni proprietatile
nn) amestecurilor mecanice sunt influentate si de dispersia fazelor, cu cat aceasta este mai avansata cu atat
oo) rezistenta la rupere este mai mare.
pp) 3. DIAGRAMELE DE ECHILIBRU ALE ALIAJELOR BINARE
qq) Construirea diagramelor de echilibru se face experimental urmarindu-se transformarile ce se
rr) produc la incalzire si racire in conditii de echilibru, ale unui mare numar de aliaje dintr-un sistem dat.
ss) 3.1. Clasificarea sistemelor de aliaje binare
3. Diagramele de echilibru ale sistemelor cu componenti insolubili atat in stare lichida cat si in
stare solida
În fig
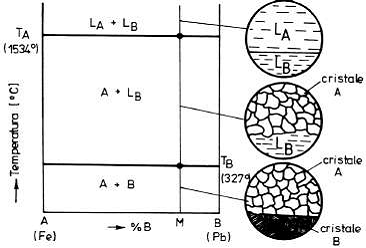 În
figura 4. este prezentata diagrama
În
figura 4. este prezentata diagrama
de echilibru a unui sistem cu componenti
insolubili in stare lichida si solida,
particularizandu-se diagrama pentru sistemul
Fe-Pb La temperaturi superioare temperaturii
TA , cele doua lichide metalice nu sunt
miscibile. La temperatura TA , se va solidifica
metalul A, pastrandu-se metalul B in stare
lichida pana la temperatura TB , cand si acesta
se va solidifica. În final se vor obtine cristale
de metal pur A si cristale de metal pur B.
Figura 4. Diagrama de echilibru a unui sistem cu componenti
insolubili in stare lichida si solida.
3.3. Diagramele de echilibru ale sistemelor cu componenti partial solubili in stare lichida si
insolubili in stare solida
Un exemplu pentru un astfel de sistem este prezentat in figura 5particularizandu-se diagrama
pentru sistemul Pb-Zn.
Figura 5. Diagrama de echilibru a unui sistem cu componenti
partial solubili in stare lichida si insolubili in stare solida
3.4. Diagramele
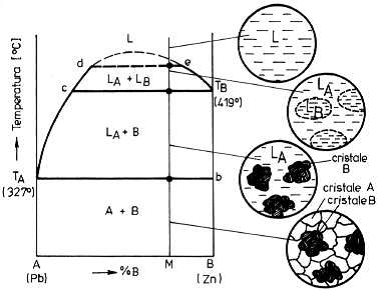 Figura
5. Diagrama de echilibru a unui sistem cu
componenti
Figura
5. Diagrama de echilibru a unui sistem cu
componenti
partial solubili in stare lichida si insolubili in stare solida
3.4. Diagramele de echilibru ale sistemelor cu componenti complet solubili in stare lichida
3.4.1. Sisteme binare cu componenti complet solubili atat in stare lichida cat si in stare solida
Sistemele binare cu componenti complet solubili in stare lichida si in stare solida, se mai numescsi sisteme binare cu solutie solida totala, sau cu solutie solida izomorfa. În figura 6. este prezentata
diagrama de echilibru a unui sistem cu solutie solida totala (izomorfa), particularizandu-se diagrama
pentru sistemul Cu-Ni.
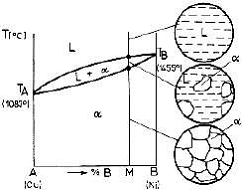 Figura 6. Diagrama de echilibru a unui sistem cu solutie
solida totala.
Figura 6. Diagrama de echilibru a unui sistem cu solutie
solida totala.
3.4. Regula orizontalei
Regula orizontalei se aplica in studiul diagramelor de echilibru binare, pentru determinarea
compozitiei chimice a fazelor aflate in echilibru la o anumita temperatura.
Fie aliajul M din sistemul binar cu solutie solida izomorfa (fig. 7), incalzit la o temperatura
superioara curbei lichidus. La scaderea temperaturii, in momentul cand este atinsa temperatura T , in
lichidul metalic vor lua nastere primii germeni de cristalizare. Trasand o orizontala Ia nivelul temperaturii
T , aceasta va intersecta curbele lichidus si solidus, pe fiecare intr-un punct. Proiectand pe axa
concentratiilor aceste puncte, vor rezulta punctele M si alfa , punctul M va indica compozitia chimica a
lichidului, iar punctul alfa - compozitia chimica a germenilor de cristalizare. Se observa ca germenii de
cristalizare sunt de solutie solida cu o concentratie ridicata de atomi ai componentului B.
Odata cu scaderea temperaturii germenii de cristalizare se vor dezvolta, modificandu-se echilibrul
dintre faze. La temperatura T , orizontala va intersecta curbele lichidus si solidus, proiectia punctelor de
intersectie fiind l si alfa . Punctul l indica compozitia chimica a fazei
lichide, iar punctul alfa indica compozitia chimica a fazei solide
(cristalelor de solutie solida), la temperatura T . Se poate observa ca
pe masura ce temperatura scade, concentratia de component B din
cristale scade, iar concentratia de component A din lichid creste.
La temperatura T , este atinsa curba solidus. Orizontala
trasata la aceasta temperatura, indica faptul ca grauntii au ajuns Ia
compozitia chimica M, iar ultimele parti lichide ale aliajului care s-a
solidificat, au avut compozitia chimica l . Presupunand deci ca in
timpul solidificarii si racirii nu s-au manifestat difuzii ai atomilor
componentilor A si B, grauntii vor prezenta in centrul lor compozitia
chimica alfa , iar la suprafata lor compozitia chimica l
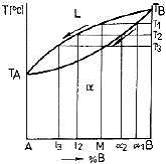 Figura
7. Regula orizontalei aplicate
Figura
7. Regula orizontalei aplicate
la o diagrama binara cu solutie solida izomorfa.
3.4.3. Regula parghiei
Pe langa regula orizontalei, in studiul diagramelor de echilibru este utilizata si regula parghiei. Cu
ajutorul regulii parghiei, este posibila determinarea raportului cantitativ, care exista intre fazele aflate in
echilibru Ia o anumita temperatura.
Între curbele lichidus si solidus, aliajele prezinta un amestec de doua faze, respectiv una solida si alta
lichida, raportul dintre cantitatea de solid si cea de lichid variind cu
temperatura. La temperaturi apropiate de T (fig. 7), cantitatea de solid
este foarte mica, iar cea de lichid foarte mare, iar la temperaturi apropiate
de T , cantitatea de faza solida este foarte mare, pe cand cea de lichid
este redusa. Cantitatea fazelor solide si lichide, existente la o anumita
temperatura, poate fi determinata cu ajutorul regulii parghiei.
Referindu-ne la figura 8, se presupune ca dorim sa determinam
cantitatea de lichid si solid a aliajului M, aflat la temperatura Tm . Notam
intersectia dintre verticala concentratiei M si orizontala temperaturii Tm
cu "m". Orizontala trasata prin punctul "m", intersecteaza curba lichidus
in punctul "l" , iar curba solidus in "s".
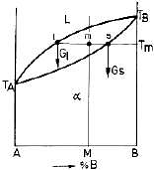
Figura 8. Regula parghiei aplicata la o
diagrama binara cu solutie solida izomorfa.
Aliajul aflandu-se in echilibru, punctul "m" poate fi considerat ca punct de sprijin al parghiei "ls",
parghie aflata si ea in echilibru sub actiunea greutatii lichidului Gl si a solidului Gs.
Ecuatia
momentelor acestei parghii este: ![]()
de
unde: ![]()
Rezulta ca greutatea fazei lichide este proportionala cu segmentul "sm", iar greutatea fazei solide
cu segmentul "lm". Daca se imparte parghia "ls" in 100 de diviziuni, respectiv 100 %, segmentul "sm" va
exprima procentual cantitatea de lichid, iar segmentul "lm", cantitatea de solid. Din acest motiv regula
parghiei mai poarta denumirea de regula segmentelor inverse.
3.4.4. Sisteme binare cu componenti solubili in stare lichida si insolubili in stare solida
a) Diagrama cu eutectic
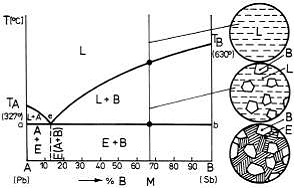
Un exemplu pentru o diagrama cu eutectic, dintr-un
sistem cu componenti insolubili in stare solida si
solubili in stare lichida, este prezentat in figura 9,
particularizandu-se diagrama pentru sistemul Pb-Sb.
Figura 9. Diagrama de echilibru cu eutectic pentru un sistem binar
cu componenti solubili in stare lichida si insolubili in stare solida.
Cristalizarea lichidului cu concentratie eutectica poate fi exprimata prin relatia:
![]()
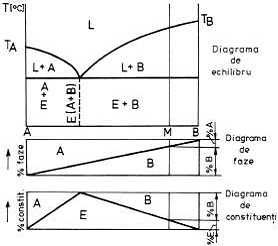
Pentru determinarea rapida a raportului
cantitativ dintre fazele constituente ale unui aliaj,
respectiv dintre constituentii metalografici, sub
diagramele de echilibru pot fi construite diagramele de
faze si de constituenti (fig. 10
Figura 10. Diagramele de faze si de
constituenti intr-un sistem binar cu eutectic.
b) Diagrama cu compus chimic stabil
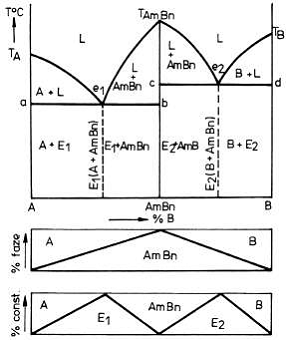
Acest gen de diagrame de echilibru apar in
sistemele in care la o anumita compozitie chimica se
formeaza un compus chimic stabil AmBn , care nu se poate
dizolva in componentii A si B. În figura 11. este prezentat
un exemplu pentru o astfel de diagrama.
Figura 11. Diagrama de echilibru cu compus chimic
pentru un sistem binar cu componenti solubili in stare
in stare lichida si insolubili in stare solida.
c) Diagrame cu punct peritectic
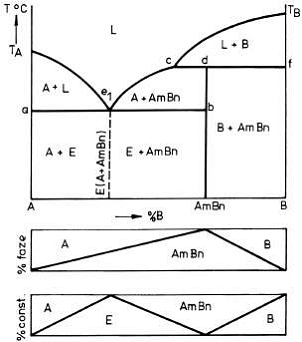
O diagrama cu componenti insolubili in stare solida, care
prezinta un punct peritectic este prezentata in figura 1
Figura 1 Diagrama de echilibru cu punct peritectic pentru un sistem binar
cu componenti solubili in stare lichida si insolubili in stare solida.
3.4.5. Sisteme binare cu componenti solubili in stare lichida si partial solubili in stare solida
a) Diagrame cu eutectic
În figura 13 sunt prezentate diagramele de echilibru cu eutectic ale sistemelor cu componenti complet
solubili in stare lichida si partial solubili in stare solida. În cazul "a" solubilitatea componentilor nu
variaza cu temperatura, iar in cazul "b" solubilitatea componentilor variaza cu temperatura
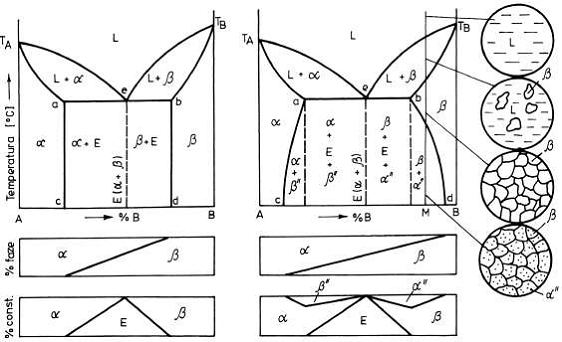
Figura 13. Diagrame de echilibru cu eutectic pentru un sistem binar cu componenti solubili in stare
lichida si partial solubili in stare solida:
a) solubilitatea componentilor nu variaza cu temperatura;
b) solubilitatea componentilor variaza cu temperature
În
ambele diagrame transformarea eutectica se produce astfel: ![]()
deci amestecul mecanic eutectic este constituit din doua solutii solide (alfa si beta).
b) Diagrame cu compus chimic
În figura 14. sunt prezentate doua diagrame cu compus chimic cu componenti solubili in stare
lichida si partial solubili in stare solida. În stanga este prezentat cazul cand solubilitatea nu variaza cu
temperatura, iar in dreapta, cazul cand solubilitatea variaza cu temperatura.
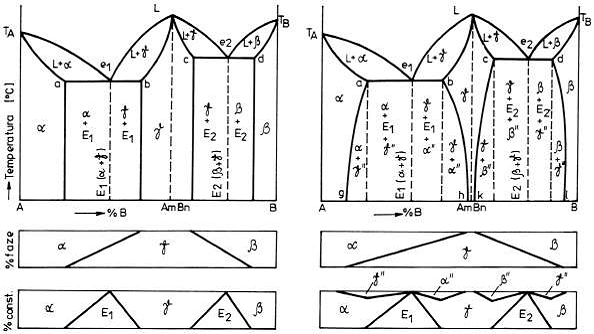
Figura 14. Diagrama de echilibru cu compus chimic pentru sisteme binare cu componenti solubili in
stare lichida si partial solubili in stare solida:
a) solubilitatea componentilor nu variaza cu temperatura;
b) solubilitatea componentilor variaza cu temperatura.
Copyright © 2026 - Toate drepturile rezervate