 | Aeronautica | Comunicatii | Constructii | Electronica | Navigatie | Pompieri |
| Tehnica mecanica |
Coroziunea
este una din cauzele principale ce determina scoaterea din uz a pieselor,
instalatiilor si lucrarilor din metal. Otelul carbon este
vulnerabil la actiunea coroziva a acizilor, gazelor si umezelii
atmosferice. Otelul carbon folosit in medii in care este
posibila aparitia actiunilor corozive trebuie protejat prin acoperiri,
inlocuit cu oteluri rezistente la coroziune sau metale neferoase.
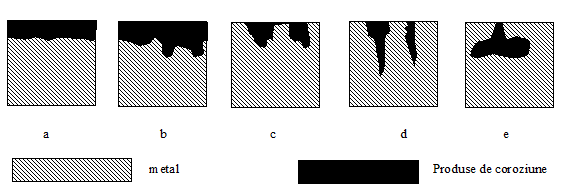
Coroziunea poate fi generala sau localizata.
Coroziunea
generala poate fi uniforma - adancimea de penetrare fiind
aceeasi (fig.
Coroziunea localizata poate fi:
in pete (fig. 9. c);
in puncte (fig.9. d);
pungi deschise in interior (fig.9. e).
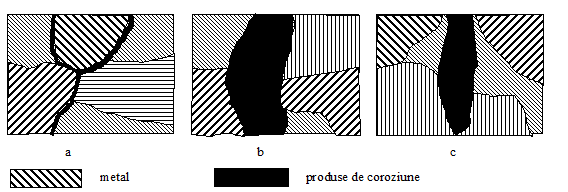
Dupa modul de distrugere a structurii metalului, coroziunea poate fi:
intercristalina (fig.10. a);
selectiva (fig.10.b);
transcristalina (fig.10.c).
Coroziunea poate fi chimica si electrochimica (urmare a aparitiei unor curenti electrici).
Toate metalele au o afinitate pentru oxigen, majoritatea metalelor fiind obtinute din oxizii lor, care constituie in principal, starea in care se gasesc in natura.
Metalele se combina cu oxigenul formand un strat de oxizi la suprafata.
Coroziunea apare datorita prezentei umiditatii in aer, viteza de coroziune fiind marita in prezenta unor impuritati ca acizi si gaze (SO2).
Fierul si otelul formeaza la suprafata un strat rosiatic de oxizi, numit rugina, strat care este poros si usor penetrat de oxigen, astfel incat procesul de oxidare continua pana la distrugerea completa a metalului.
Distrugerea gradata a metalului poate conduce la un moment dat la cedarea structurii de rezistenta sub actiunea incarcarilor exterioare. Odata inceputa, ruginirea continua cu o viteza depinzand de umiditatea, precum si de cantitatea de impuritati prezente in aer.
Pentru stoparea procesului de ruginire, se utilizeaza tratamente cu substante - inhibitori de coroziune sau indepartarea completa a ruginii si protejarea metalului cu un strat de vopsea.
Unele metale neferoase ca aluminiul, plumbul sau titanul, au o mare afinitate pentru oxigen si formeaza rapid un strat de oxizi atunci cand sunt in contact cu aerul. Acest film de oxizi este dens si aderent, impiedicand oxidarea in profunzime a metalului. Acest strat dens si aderent este responsabil de buna rezistenta la coroziune a acestor metale.
Cuprul si zincul formeaza de asemenea filme protectoare de oxizi, care insa sunt intarite de produsii rezultati in urma unor reactii chimice cu impuritatile acide din aer, rezultand suprafete foarte rezistente la coroziune.
Rezistenta la coroziune a otelului este mult imbunatatita de alierea cu Cr, in cantitati de pana la 20%, care produce la suprafata aliajului un strat subtire dar aderent de oxizi protectori. Aceste aliaje se numesc oteluri inoxidabile si sunt utilizate in principal in industria chimica si alimentara.
Cand doua metale diferite, imersate intr-un electrolit lichid, sunt asezate la mica distanta unul de celalalt, apare un curent electric. În pila electrochimica cu electrozi de zinc si cupru, Zn se afla la un potential negativ fata de solutie si electrodul de cupru si se corodeaza.
Cand doua metale sunt in contact in prezenta umiditatii, apa ce contine substante dizolvate actioneaza ca un electrolit lichid si metalul care are potentialul mai negativ decat celalalt va fi corodat. În orice pereche de doua metale, cel care va fi corodat este decis de pozitia sa (de potentialul sau de electrod) in seria electrochimica prezentata in tabelul 2.
Metalul ce constituie electrodul unei celule electrochimice, care are potentialul de electrod mai negativ este denumit anodic fata de celalalt.
Într-o celula electrochimica, anodul este cel ce sufera procesul de coroziune.
De exemplu, otelul (-0.44V) este anodic fata de staniu (-0.14V); daca stratul protector de staniu se degradeaza local si apa este in contact cu amandoua metalele, atunci otelul va fi corodat.
În procesul de galvanizare, tabla de otel este protejata prin acoperire cu zinc. Daca stratul protector de zinc este deteriorat partial si apa ajunge in contact cu cele doua metale, apare coroziunea electrochimica, de aceasta data fiind corodat zincul.
Acest tip de protectie poarta numele de protectie cu anod de sacrificiu, fiind utilizata si la protectia instalatiilor ingropate, a sasiurilor autovehiculelor, a carenelor navelor, etc.
|
Metal |
Potential de electrod (V) |
|
Magneziu | |
|
Titan | |
|
Aluminiu | |
|
Zinc | |
|
Crom | |
|
Fier/otel | |
|
Cadmiu | |
|
Nichel | |
|
Staniu | |
|
Plumb | |
|
Cupru | |
|
Argint | |
|
Platina | |
|
Aur |
Coroziunea poate fi cauzata si de eterogenitatile fizice sau chimice ale metalului. Viteza de coroziune va depinde de temperatura, felul si concentratia electrolitului. Acizii si bazele ataca otelul deoarece sunt capabile sa dizolve produsii de reactie rezultati.
Otelul este foarte utilizat in majoritatea activitatilor din constructii, el fiind totusi foarte vulnerabil in fata actiunilor corozive ale mediului, astfel incat el trebuie protejat prin acoperiri anticorozive.
Principalele metode de protejare a suprafetei otelului sunt:
acoperirea cu uleiuri, unsori sau inhibitori de coroziune;
vopsire;
placari cu metale rezistente la coroziune;
acoperiri metalice;
acoperiri prin electrodepunere;
acoperiri cu materiale plastice.
prelucrare la cald - cand otelul este prelucrat la cald, la temperaturi inalte, de exemplu laminarea, se formeaza la suprafata lui un strat compus din oxid negru de fier, rezultat din combinarea Fe cu O. Acest strat este dens si aderent, prevenind contactul dintre otel si oxigen.
Uleiurile si unsorile - uleiurile minerale si unsorile utilizate ca lubrifianti protejeaza suprafata pe care sunt intinse, impiedicand apa sa condenseze si sa intre in contact cu metalul. Aceste materiale ofera protectie numai pe o perioada limitata de timp.
Inhibitorii de coroziune - pot fi adaugati uleiurilor minerale pentru a obtine uleiuri anticorozive care pot asigura o protectie pe o perioda mai lunga.
Vopsirea - este protejarea otelului prin acoperirea suprafetei sale cu un strat de vopsea sau un material ce nu se oxideaza, ca bitum, asfalt. Înaintea vopsirii, suprafata metalului trebuie curatata temeinic de stratul de oxizi, rugina, grasimi.
Acoperirea cu vopsea trebuie privita ca o protectie semipermeabila, deoarece vopsirea trebuie repetata periodic pentru a preveni atacul coroziv ce apare in locurile in care vopseaua s-a fisurat sau a fost indepartata accidental.
Este utilizata cu bune rezultate, fosfatarea suprafetelor degresate, inainte de vopsire.
Placarile cu metale rezistente la coroziune - utilizeaza metale neferoase sub forma de foi, pentru protejarea suprafetei metalului. Tabla de otel este introdusa intre doua foi de metal neferos rezistent la coroziune si este apoi laminata la grosimea dorita.
Acoperirile metalice - pot fi realizate utilizand mai multe metode:
cimentarea pulberilor neferoase;
imersare in baie de metal topit;
pulverizare.
Cimentarea pulberilor neferoase este procesul in care otelul este incalzit pentru cateva ore in strans contact cu pulberea de metal neferos. Temperatura este mentinuta putin sub temperatura de topire a metalului neferos. Pulberea neferoasa se cimenteaza de suprafata otelului prin difuziune si formeaza un strat compact .
Imersarea in baie de topitura se aplica in cazul acoperirii metalului cu staniu sau zinc.
Pulverizarea unei topituri metalice este metoda prin care otelul poate fi acoperit cu metale neferoase, in special aluminiu si zinc. Metoda consta in imprastierea topiturii metalice, in picaturi mici (spraiere) utilizand un dispozitiv special.
Electrodepunerea este un proces ce consta in acoperirea otelului cu un strat de metal neferos, utilizand pentru aceasta procedee electrochimice. Dintre metalele utilizate pentru acoperiri, cele mai utilizate sunt: staniu, zinc, cupru, crom, nichel, cadmiu.
Acoperirile cu materiale plastice - o gama larga de materiale plastice poate fi folosita pentru obtinerea de invelisuri pentru otel, rezistente la coroziune.
Aceste acoperiri permanente exclud contactul dintre otel si atmosfera, impiedicand aparitia coroziunii.
Aceste invelisuri sunt rezistente si la alte tipuri de atac chimic si pot avea proprietati antiaderente, care le fac foarte utile in unele domenii ale industriei.
Acoperirile cu materiale plastice se pot aplica prin imersare in topitura, pulverizare, sau manual, avand urmatoarele avantaje fata de acoperirile metalice:
proprietati decorative combinate cu o senzatie placuta la atingere;
izolator electric;
termoizolatori;
umplu golurile si neuniformitatile metalului de baza;
rezistenta buna la agentii corozivi ai metalelor.
Copyright © 2025 - Toate drepturile rezervate