 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
FIZIOLOGIA SI FIZIOPATOLOGIA METABOLISMULUI ACIDO-BAZIC
pH-ul exprima gradul de aciditate sau de alcalinitate a unei solutii. El este cuprins intre 0 si 14: de la 0 la 7, vorbim de aciditate; cifra 7 corespunde neutralitatii; de la 7 la 14, vorbim de alcalinitate. Mentinerea echilibrului acido-bazic normal reprezinta o conditie indispensabila vietii unui organism. Exista numerosi factori care pot perturba acest echilibru.
Metabolismul celular produce: dioxid de carbon, acizi volatili si acizi nevolatili:
Acizii volatili sau "slabi" sunt: acidul oxalic, piruvic, acetilacetic si se transforma in acid carbonic in cursul proceselor metabolice. Acesta este eliminat la nivelul plamanilor sub forma de dioxid de carbon.
Acizii nevolatili sau "tari" sunt acidul uric, sulfuric, fosforic, care sunt eliminati la nivelul rinichilor.
REGLAREA pH-ului SANGUIN
pH-ul sanguin normal variaza intre 7,35 - 7,45.. Valorile sale sunt mentinute in aceste limite stranse prin interventia:
Sistemelelor tampon ale sangelui si lichidului interstitial (mecanisme cu actiune rapida);
Mecanismelor viscerale, a caror suport anatomic este reprezentat de plamani (figura 1) care controleaza concentratia sanguina de CO2 (si de H2CO3) si de rinichi care regleaza concentratia de HCO3- (mecanisme de reglare pe termen lung).
1. Sistemele tampon
Sistemele tampon reprezinta asocieri intre un acid slab si o sare alcalina (o baza tare) capabile sa amortizeze sau sa reduca variatiile de pH ale unei solutii careia ii adaugam un acid sau o baza tare (capabile sa cedeze sau sa accepte protoni).
Principalul sistem tampon care participa la reglarea pH-lui este reprezentat de sistemul acid carbonic/bicarbonat. Acidul carbonic este considerat a fi factorul respirator al sistemului tampon, iar bicarbonatul factorul metabolic al sistemului tampon bicarbonat/acid carbonic (HCO3-/ H2CO3).
Acidul carbonic se formeaza in urma reactiei reversibile CO2+H2O H2CO3 catalizata de anhidraza carbonica. Concentratia de acid carbonic depinde de presiunea arteriala a dioxidului de carbon (normal, PaCO2 = 40 mmHg) si de coeficientul de solubilitate a dioxidului de carbon in apa (a = 0,03) dupa formula a PaCO2 = 0,03 40 = 1,2 mEq/l (concentratia sanguina a acidului carbonic).
Bicarbonatul are o concentratie sanguina medie de aproximativ 24 mEq/l (23 - 28 mEq/l).
pH-ul depinde de raportul dintre concentratia de bicarbonat ([HCO3-]) si cea de acid carbonic ([H2CO3]), fiind calculat dupa urmatoarea formula (Henderson - Hasselbalch):
pH = pK + log (HCO3-] / [H2CO3 = pK + log (HCO3-] /0,03xPaCO2
unde pK este constanta de disociatie a acidului carbonic; pentru sistemul HCO3- / H2CO3, pK = 6,10
pH = 6,1 + log (24/1,2) = 6,1 + log 20 = 6,1 + 1,3 = 7,4
Aasadar, raportul normal HCO3- / H2CO3 este de 20/1, iar pH-ul sanguin normal este de 7,40 (cu variatii intre 7,35 si 7,45).
pH-ul depinde, deci de raportul HCO3-/paCO2.
2. Mecanismele viscerale (plamanii si rinichii)
Plamanii participa la reglarea echilibrului acido-bazic prin:
Eliminarea dioxidului de carbon din sange (CO2 se combina cu apa pentru a forma H2CO3, astfel ca eliminarea CO2 este echivalenta cu eliminarea acidului).
Ritmul respirator se modifica in functie de aciditatea corpului, acesta accelerandu-se in conditii de aciditate pentru a se elimina mai mult CO2 (hiperventilatie) sau incetinindu-se in conditii de alcalinitate pentru a retine acidul si pentru a reduce alcalinitatea (hipoventilatie).
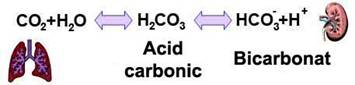
Figura 1. Mecanismele pulmonare de compensare.
Rinichii participa la reglarea echilibrului acido-bazic prin:
Reabsorbtia bicarbonatului (HCO3-) la nivelul tubului contort proximal urmata de tamponarea ionilor H+ (figura 2)
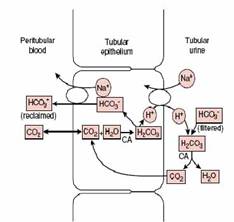
Figura 2. Reabsorbtia renala a bicarbonatului.
La baza reabsorbtiei de bicarbonat sta reactia dintre CO 2 si apa catalizata de anhidraza carbonica, rezultand acid carbonic. Acidul carbonic disociaza in: H+ si HCO3-. Protonii secretati active in lumenul tubular substituie Na+ din bicarbonatul filtrat (la nivelul tubilor renali). Na+ intra in celula tubulara unde formeaza impreuna cu anionul bicarbonic: bicarbonatul de sodiu. Bicarbonatul de sodiu trece in sangele peritubular, refacand rezerva de bicarbonat a organismului.
Excretia H+ la nivelul tubului contort distal care se realizeaza sub doua forme:
acidifierea urinii (figura 3) si amoniogeneza renala (figura 4)
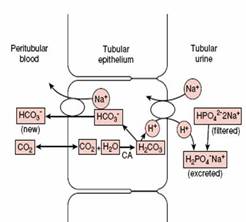
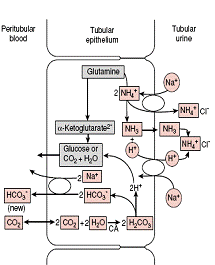
Figura 3. Acidifierea urinii Figura 4. Amoniogeneza renala
Acidifierea urinii:
Principalul sistem tampon care da aciditatea titrabila a urinii este sistemul
fosfat disodic Na2HPO4/fosfat monosodic NaH2PO4. In celula tubulara, sub
actiunea anhidrazei carbonice rezulta acid carbonic din CO2 si apa, care
discociaza in H+ si HCO3-. Protonii ies din celula tubulara la schimb cu Na+,
care intra in celula tubulara formand impreuna cu HCO3- bicarbonat de sodiu,
ce trece in sange (reabsorbtia bicarbonatului). Protonii formeaza impreuna cu
HPO4-Na+ , fosfatul monosodic (NaH2PO4).
Amoniogeneza renala:
Amoniacul se formeaza in celulele tubulare prin dezaminarea glutaminei. Amoniacul difuzeaza liber din celule in lumenul tubular, unde la pH-ul urinar acid, se cupleaza cu H+ si formeaza cationul NH4+ . Cationul NH4+ substituie Na din NaCl filtrat si rezulta clorura de amoniu care se elimina in urina. Na eliberat astfel va fi reabsorbit in celula tubulara, de unde, impreuna cu anionul HCO3- trec in sange sub forma de bicarbonat (figura 4).
DEZECHILIBRE ACIDO-BAZICE
Definitie: Fiecare modificare a raportului HCO3- / H2CO3 care determina devierea pH-lui in afara limitelor normale, va cauza tulburari sau dezechilibre acido-bazice.
Clasificare:
Modificarea raportului HCO3- / H2CO3 determina 2 tipuri de tulburari acido-bazice: metabolice si respiratorii:
Modificarea primara a acidului carbonic va da nastere unor dezechilibre respiratorii:
Modificarea primara a bicarbonatului va da nastere unor dezechilibre metabolice:
cresterea primara a HCO3- determina alcaloza metabolica
scaderea primara a HCO3- determina acidoza metabolica
3. Cauze de dezechilibre acido-bazice respiratorii
Acidoza respiratorie cresterea primara a H2CO3). Se produce in starile insotite de hipoventilatie alveolara, cand plamanii nu elimina dioxidul de carbon care se acumuleaza, cu formare de acid carbonic in exces, PaCO2 creste, iar echilibrul reactiei CO2 + H2O H2CO3 este deviat la dreapta. Rezulta o crestere primara a H2CO3 care determina scaderea raportului [HCO3-]/[H2CO3] sub 20/1 si a pH-lui sub 7,35.
Afectiunile insotite de o hipoventilatie alveolara in care poate apare acidoza respiratorie sunt: bolile respiratorii (restrictive, obstructive si mixte), depresia acuta a centrilor respiratori bulbari (barbiturice, supradoza de anestezice).
Cresterea PaCO2 determina hipercapnie, vasodilatatia cerebrala, cu hipertensiune intracraniana si chiar stare de coma
3.2 Alcaloza respiratorie (scaderea primara a H2CO3 Se produce in starile insotite de hiperventilatie alveolara, cand plamanii elimina in exces dioxidul de carbon, concentratia acestuia scazand in sange; PaCO2 scade, iar echilibrul reactiei CO2 + H2O H2CO3 este deviat la stanga. Scaderea primara a H2CO3 determina cresterea raportului [HCO3-]/[H2CO3] peste 20/1 si a pH-lui peste 7,45.
Apare in afectiunile insotite de o hiperventilatie alveolara ca: stimularea centrilor respiratori (anxietate, febra, intoxicatii cu salicilati - faza initiala) sau efortul fizic moderat.
Scaderea PaCO2 se poate manifesta prin vasoconstrictia cerebrala
4. Cauze de dezechilibre acido-bazice metabolice
4.1 Acidoza metabolica (scaderea primara a HCO3-). In acidoza metabolica defectul primar este reprezentat de scaderea concentratiei de bicarbonat in lichidul extracelular. Scaderea concentratiei plasmatice de bicarbonat determina scaderea raportului [HCO3-]/[H2CO3] sub 20/1 si in consecinta scaderea pH-lui sub valoarea de 7,35.
Cauzele sunt urmatoarele:
diaree severa (pierderea bicarbonatului la nivelul intestinului)
insuficienta renala (scaderea reabsorbtiei/formarii de HCO3-)
hipoaldosteronismul (scaderea reabsorbtiei sodiului si bicarbonatului la nivelul nefronului distal
tulburari metabolice: acidoza lactica (stari de soc, efort fizic intens la bolnavii hepatici) si cetoacidoza (diabetul zaharat)
intoxicatii medicamentoase (salicilati - faza avansata) sau substante chimice (metanol)
4.2 Alcaloza metabolica (cresterea primara a HCO3-). In alcaloza metabolica defectul primar este reprezentat de excesul de bicarbonat plasmatic, cu cresterea raportului [HCO3-]/[H2CO3] peste 20/1 si a pH-lui peste 7,45. Alcalozele metabolice pot fi cauzate de: varsaturi prelungite si hiperaldosteronism.
1. Mecanisme de compensare:
Plamanii si rinichii vor incerca sa compenseze tulburarile echilibrului acido-bazic si sa normalizeze pH-ul sanguin prin declansarea mecanismelor compensatorii:
o alcaloza respiratorie (scaderea primara a H2CO3) va fi compensata prin scaderea secundara a reabsorbtiei renale a HCO3- ;
o acidoza respiratorie (cresterea primara a H2CO3) va fi compensata prin cresterea reabsorbtiei si formarii HCO3- la nivel renal.
o alcaloza metabolica cresterea primara a HCO3-) poate fi compensata teoretic prin hipoventilatie, dar acest tip de compensare este limitata (figura 5); alcaloza inhiba centrii respiratori determinand hipoventilatie alveolara.
o acidoza metabolica (scaderea primara a HCO3-) poate fi compensata prin scaderea secundara respiratorie a concentratiei plasmatice de CO2 (hiperventilatie) (figura 5). Acidoza stimuleaza centrul respirator determinand hiperventilatie alveolara.
2. Manifestari:
Consecintele alcalozei sunt urmatoarele:
hipokaliemie (schimb cu protonii, care ies din celula; intra in schimb K in celula) (figura 7)
scaderea concentratiei de calciu plasmatic liber (creste cantitatea de Ca2+ legata de proteinele plasmatice)
cresterea excitabilitatii neuromusculare asociata cu crampe musculare (datorate in parte unei scaderi a concentratiei de calciu plasmatic liber, dar mai ales vasoconstrictiei cerebrale)
alcaloza favorizeaza hipoglicemia.
Consecintele acidozei sunt urmatoarele:
hiperkaliemie (protonii intra in celula, iesind in schimb potasiul) (figura 6)
inhibarea Na+/K+ ATPazei, avand ca si consecinta intrarea Na+ si iesirea K+ cu agravarea hiperkaliemiei
actiune inotrop negativa asupra inimii, favorizand si aparitia aritmiilor (risc de aritmii si de tulburari de conducere)
o acidoza persistenta declanseaza o demineralizare osoasa (sarurile minerale din os trec in mediu acid solubilizandu-se)
acidoza intracelulara favorizeaza hiperglicemia
acidoza celulara va inhiba mecanismele de semnalizare intracelulara si va induce moarte celulara.
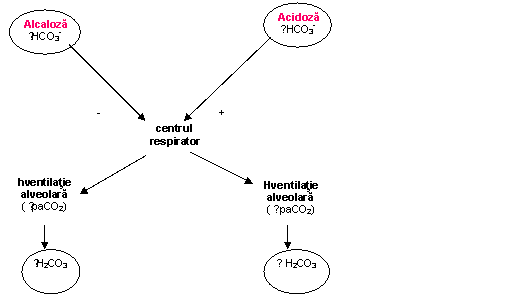
Figura 5. Compensarea respiratorie
Inhibitorii anhidrazei carbonice
Sunt diuretice care blocheaza anhidraza carbonica (enzima ce catalizeaza reactia dintre CO2 si apa cu formarea de acid carbonic). Produce pierdere de bicarbonat si acidoza. Sunt utili in tratamentul glaucomului si alcalozei metabolice. Pot produce acidoza metabolica.
Reabsorbtia Na in tubul proximal este legata de reabsorbtia de bicarbonat. Acetazolamida (un inhibitor al anhidrazei carbonice) isi exercita efectul diuretic impiedicand reabsorbtia Na.
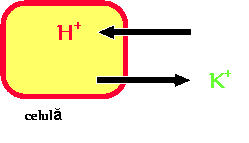
Figura 6. Migrarea intracelulara a protonilor in acidoza; la schimb iese potasiul din celula.
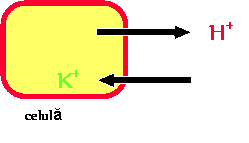
Figura 7. Hipopotasemia din alcaloza.
Copyright © 2025 - Toate drepturile rezervate