 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Echilibrul chimic omogen
1. Izoterma de reactie
Se considera o reactie chimica reversibila de forma generala:
![]()
ni = coeficienti stoechiometrici ai reactantilor Ai
n'i = coeficienti stoechiometrici ai produsilor A'i
Amestecul de reactie este un sistem inchis policomponent monofazic si de compozitie variabila constituit din gaze perfecte. Energia Gibbs a sistemului depinde de T, p si numerele de moli din fiecare participant la reactie.
![]()
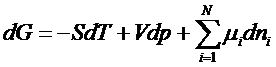
unde: mi = potentialul chimic al componentului i.
In conditii izoterm - izobare, dG se reduce la:
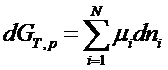
![]() Avansarea reactiei λ є este considerata uniforma in
intreg volumul de reactie.
Avansarea reactiei λ є este considerata uniforma in
intreg volumul de reactie.
ni = numarul de moli ai participantului la reactie in momentul
evaluarii marimii l
n0 = numarul de moli al aceleiasi specii chimice, la momentul
initial
n = coeficientul stoechiometric al compusului respectiv.
![]()
![]()
pentru reactantul i
![]()
pentru produsul i'
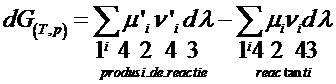
sau:
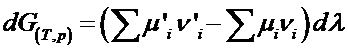
si:
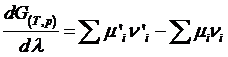
Membrul al 2-lea reprezinta o marime de bilant, energia Gibbs de reactie DrG(T,p):
![]()
Rezulta ca energia Gibbs de reactie DrG este egala nu numai cu variatia stoechiometrica a marimii G de la starea initiala la cea finala dar si cu derivata acesteia in raport cu avansarea reactiei, la T si p constante:
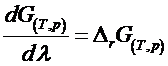
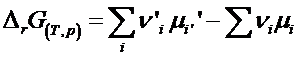
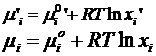
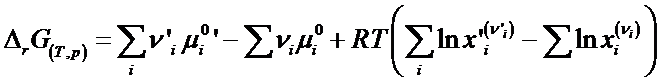
![]() deoarece
deoarece
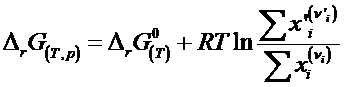
rezulta
![]() La echilibru functia G este
minima si constanta rezulta
La echilibru functia G este
minima si constanta rezulta
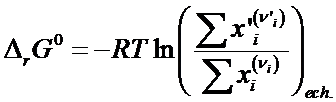
Se regrupeaza termenii sub forma:
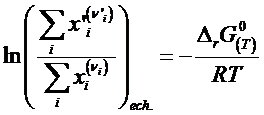
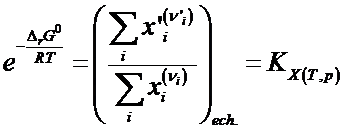
Reulta legea actiunii maselor
stabilita pe baza ec.
termodinamicii chimice
![]() KX(T,p) constanta de echilibru a reactiei
la T si p constante exprimata prin fractii
molare.
KX(T,p) constanta de echilibru a reactiei
la T si p constante exprimata prin fractii
molare.
Se obtine izoterma de reactie:
Constanta de echilibru la gaze perfecte poate fi exprimata prin presiuni (Kp) si la gaze reale prin fugacitate (Kf). La solutii ideale diluate intervine raportul concentratiilor de echilibru (Kc) iar la solutii reale activitatile (Ka).
O reactie chimica evolueaza spontan in sensul in care DrG scade
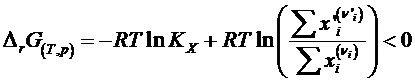
Rezulta astfel o alta formulare a izotermei de reactie in care argumentul logaritmului contine concentratii diferite fata de cele de la echilibru.
Corelatia dintre energia Gibbs standard de reactie (Dr 0G) si constanta de echilibru Kx poate fi dedusa prin metoda grafica a potentialelor chimice.
![]() La o reactie reversibila
simpla de tipul:
La o reactie reversibila
simpla de tipul:
![]()
![]()
![]()
![]()
![]()
![]() la
echilibru:
la
echilibru:
![]()
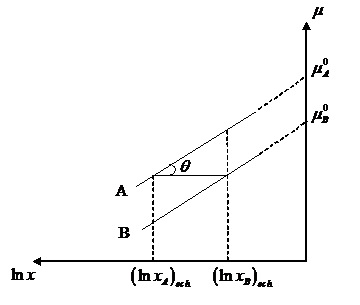
![]() Graficul mi =f(lnxi) pentru reactia
Graficul mi =f(lnxi) pentru reactia
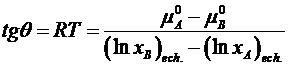
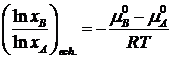
rezulta
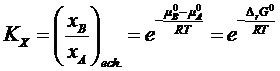
si
![]()
![]() ecuatia
izotermei pentru reactia considerata
ecuatia
izotermei pentru reactia considerata
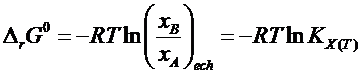
Copyright © 2025 - Toate drepturile rezervate