 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Grupa a III-a anionica
Recunoasterea anionului CO![]()
Substante si ustensile:
- stativ cu eprubete, spatule, pipete, pahare Berzelius.
- sarea solubila carbonat de sodiu
Reactii care se executa:
1.Acizii minerali diluati si concentrati
deplaseaza H![]() CO
CO![]() din carbonati, acesta instabil, se descompune instantaneu in
CO
din carbonati, acesta instabil, se descompune instantaneu in
CO![]() si H
si H![]() O. Degajarea CO
O. Degajarea CO![]() din solutie se recunoaste prin efervescenta produsa:
din solutie se recunoaste prin efervescenta produsa:
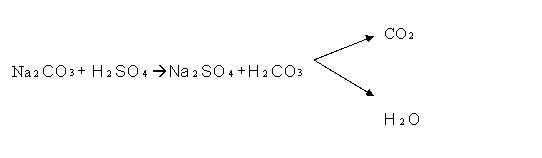
Bagheta umezita cu solutie Ba(OH)![]() tinuta deasupra eprubetei din care se degaja CO
tinuta deasupra eprubetei din care se degaja CO![]() capata opalescenta datorita BaCO
capata opalescenta datorita BaCO![]() format.
format.
2. Azotatul de argint - AgNO![]() - formeaza cu anionul CO32- un
precipitat alb, solubil in acid azotic si hidroxid de amoniu:
- formeaza cu anionul CO32- un
precipitat alb, solubil in acid azotic si hidroxid de amoniu:
Na![]() CO
CO![]() + 2AgNO
+ 2AgNO![]() =Ag
=Ag![]() CO
CO![]() + 2NaNO
+ 2NaNO![]()
alb
Ag![]() CO
CO![]() + NH
+ NH![]() à[Ag(NH
à[Ag(NH![]() )
)![]() ]
]![]() CO
CO![]()
Prin fierbere cu multa apa in urma hidrolizei de separa Ag![]() O de culoare neagra.
O de culoare neagra.
3. Azotatul de Ba precipita
BaCO![]() alb;
alb;
Na![]() CO
CO![]() +Ba(NO
+Ba(NO![]() )
)![]() =BaCO
=BaCO![]() ↓+2NaNO
↓+2NaNO![]()
BaCO![]() este solubil in acizi minerali si in CH
este solubil in acizi minerali si in CH![]() COOH.
COOH.
4. Acetatul de plumb -Pb(CH3COO)2 - precipita carbonatul bazic de plumb de culoare alba:
3Na2CO3 + 3 Pb(CH3COO)2 +2H2O → 2PbCO3∙ Pb(OH)2 + 6CH3COONa +H2CO3a
Recunoasterea SO![]()
sarea solubila sulfit de sodiu
1.Acizii minerali deplaseaza SO![]() din sulfiti;
din sulfiti;
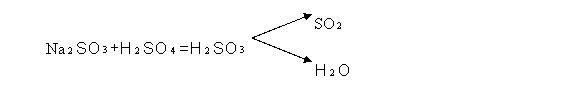
SO![]() degajat poate fi pus in evidenta cu ajutorul hartiei de
filtru umezita cu I
degajat poate fi pus in evidenta cu ajutorul hartiei de
filtru umezita cu I![]() galbena (albastru) plasata in gura eprubetei.
galbena (albastru) plasata in gura eprubetei.
2.AgNO![]() formeaza cu sulfitii un precipitat alb cristalin de Ag
formeaza cu sulfitii un precipitat alb cristalin de Ag![]() SO
SO![]() :
:
2 AgNO![]() +Na
+Na![]() SO
SO![]() =2NaNO
=2NaNO![]() +Ag
+Ag![]() SO
SO![]()
alb
Ag![]() SO
SO![]() este solubil in acizi minerali si in NH
este solubil in acizi minerali si in NH![]() , greu solubil in CH
, greu solubil in CH![]() COOH.
COOH.
Ag![]() SO
SO![]() +4NH
+4NH![]() à[Ag(NH
à[Ag(NH![]() )
)![]() ]
]![]() SO
SO![]()
Dizolvarea are loc si in exces de sulfit alcalin
Ag![]() SO
SO![]() +3Na
+3Na![]() SO
SO![]() = 2Na
= 2Na![]() [Ag
[Ag![]() (SO
(SO![]() )
)![]()
3. Ba(NO![]() )
)![]() precipita BaSO
precipita BaSO![]() alb solubil in acizi minerali diluati:
alb solubil in acizi minerali diluati:
Ba(NO![]() )
)![]() +Na
+Na![]() SO
SO![]() àBaSO
àBaSO![]() +2NaNO
+2NaNO![]()
5.Reactiile de oxidare ale
anionului S![]() O
O![]()
-Solutia de iod este decolorata de sulfiti care actioneaza ca reducatori.
Na![]() S
S![]() O
O![]() +I
+I![]() +H
+H![]() O=Na S
O=Na S![]() O
O![]() +HI
+HI![]()
-Decolorarea solutiei de oxidanti
KMnO![]() ;
;
3H![]() SO
SO![]() +5Na
+5Na![]() SO
SO![]() +2KMnO
+2KMnO![]() =2MnSO
=2MnSO![]() +K
+K![]() SO
SO![]() + 5Na
+ 5Na![]() SO
SO![]() + 3H
+ 3H![]() O
O
violet incolor
-Sulfitii manifesta caracter
oxidant fata de solutiile puternic acide ale Sn![]() ; precipita sulfura stanica de culoare galbena.
; precipita sulfura stanica de culoare galbena.
H![]() SO
SO![]() +3H
+3H![]() Sn
Sn![]() Cl
Cl![]() +6HCl=H
+6HCl=H![]() S+3H
S+3H![]() SnCl
SnCl![]() + 3H
+ 3H![]() O
O
Recunoasterea anionului oxalic C2O4-2
sarea solubila oxalat de amoniu
1. Azotatul de argint - AgNO3 formeaza oxalatul de argint AgOOC-COOAg alb, solubil in HNO3 si NH3.
2. Clorura de bariu - BaCl2 precipita oxalatul de bariu, Ba(COO)2, solubil in acizi minerali, acid acetic si un mare exces de reactiv.
3. Clorura de calciu - CaCl2 precipita in prezenta ionilor de oxalate, oxalatul de calciu, alb, insolubil in acid acetic si ammoniac.
4. Permanganatul de potasiu - KMnO4 in mediu de acid sulfuric oxideaza ionul oxalic la CO2, permanganatul reducandu-se la sare manganoasa, cand are loc decolorarea solutiei:
5 HOOC-COOH + 2 KMnO4 + 3H2SO4 → 2MnSO4 + 10CO2 + K2SO4 + 8HOH
grupa IV anionica
Reactiile anionului tiosulfuric S2O32-
-Acidul sulfuric diluat, la cald, determina descompunerea tiosulfatilor, cu degajare de SO2 si separare de sulf.
![]() Na S2 O3
+ H2 SO4 → Na SO ↓ + SO2↑ + S
+ H2O
Na S2 O3
+ H2 SO4 → Na SO ↓ + SO2↑ + S
+ H2O
-Azotatul de argint, AgNO3, formeaza la inceput precipitat alb de tiosulfat de argint, care apoi devine galben, brun si in final negru datorita sulfurii de argint.
![]()
![]() Na S O + 2AgNO3 → Ag2S2O3 +
2NaNO3
Na S O + 2AgNO3 → Ag2S2O3 +
2NaNO3
Ag S O + H2O → Ag2S↓ + H2SO4
-Azotatul de bariu, Ba(NO3)2, formeaza tiosulfatul de bariu,alb cristalin, solubil in acizi minerali si apa calda.
Na S O + Ba(NO3)2 → BaS2O3 ↓ + 2NaNO3
Acetatul de pulumb, Pb(CH3COO)2, formeaza un precipitat alb de tiosilfat de plumb, solubil in exces de tiosulfat:
Pb(CH3COO2) + Na2S2O3 → PbS2O3 ↓ + 2CH3COONa
Prin fierbere se formeaza un precipitat cu volum mare format din PbSO4 si PbS.
Recunoasterea SO![]()
1.Solutii neutre
de sulfati diluate nu precipita cu AgNO![]() .Numai solutii foarte concentrate formeaza Ag
.Numai solutii foarte concentrate formeaza Ag![]() SO
SO![]() alb.
alb.
FeSO![]() +2AgNO
+2AgNO![]() →Ag
→Ag![]() SO
SO![]() +Fe(NO
+Fe(NO![]() )
)![]()
2. Solutii neutre
de sulfati formeaza BaSO![]() alb insolubil in acizi minerali. BaSO
alb insolubil in acizi minerali. BaSO![]() se dizolva in H
se dizolva in H![]() SO
SO![]() concentrat la fierbere formeaza sulfat acid.
concentrat la fierbere formeaza sulfat acid.
FeSO![]() + Ba(NO
+ Ba(NO![]() )
)![]() →BaSO
→BaSO![]() +Fe(NO
+Fe(NO![]() )
)![]()
BaSO![]() + H
+ H![]() SO
SO![]() =Ba(HSO
=Ba(HSO![]() )
)![]()
Copyright © 2026 - Toate drepturile rezervate