 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Echilibre cu transfer de ioni sau molecule. Echilibre de complexare
Consideratii teoretice
Reactia de complexare. Complecsi
In cursul analizei chimice, adeseori, se utilizeaza reactii la care prin interactiunile ionilor sau ale moleculelor cu molecule polare sau ioni, se formeaza specii chimice denumite complecsi, formate dintr-un ion metalic central asociat cu un numar oarecare de molecule neutre sau de ioni.
Asemenea reactii, denumite reactii de complexare, se utilizeaza frecvent la separarea, identificarea si determinarea ionilor. Un ion complex este acela in care sunt ocupate toate pozitiile de coordinare sau o parte din ele.
Considerand sarcina si dimensiunile ionilor metalici, este usor de inteles ca acesti ioni nu pot exista liber in solutie, ei asociindu-se cu ioni de semn contrar sau alte specii din solutie cu perechi de electroni neparticipanti, formand ioni complecsi. In primul rand se asociaza cu moleculele de solvent formand solvo-complecsi, in mediu apos acvo-complecsi. Gradul de solvatare (hidratare) si numarul de molecule de solvent (apa) coordinate este determinat de tipul ionului metalic si de solvent. Ionii metalici "simpli" din solutie apoasa in general sunt acvocomplecsi, iar reactia de complexare propriu zisa este o reactie in cursul careia una sau mai multe molecule de solvent legate de ionul metalic sunt substituite prin alte grupari.
Practic, aproape toti ionii metalici formeaza cu diversi complexanti (liganzi), in conditii favorabile, complecsi mai mult sau mai putin stabili.
Echilibrul general (cu transfer de particula) :
D A + p (2.99)
in care particula caracteristica este un ion sau o molecula, reprezinta un echilibru de complexare.
Combinatiile complexe sunt compusi chimici care iau nastere prin unirea mai multor ioni sau molecule. Orice donor complex implica un acceptor conjugat. Ionul metalic (acceptor primar, cation metalic) din complex, se numeste ion central sau generator de complex, iar ionii sau moleculele, liganzi sau adenzi.
Notand cu M generatorul de complex, iar cu L liganzii fara a indica sarcina, echilibrele de formare succesiva a complecsilor se scriu :
M + L ML
ML + L ML2
.. . . . . . .. (2.100)
MLn-1 + L MLn
In echilibrele (2.100), se formeaza complecsi succesivi MLj de ordin j, complexul de ordinul maxim fiind MLn.
Numarul liganzilor j din complex, reprezinta indicele de coordinare al generatorului de complex, numarul maxim fiind notat cu n.
Combinatiile pentru care i < n se numesc combinatii nesaturate.
Numarul de coordinare n, este cel mai frecvent 6 (Cr3+, Co2+, Co3+, Fe2+, Fe3+, Ni2+ etc.), 4 (Cd2+, Cu2+, Cu+, Hg2+ etc.), valorile 2,3 si 8 intalnindu-se mai rar. Fiecare tip de coordinare are o geometrie proprie. In chimia analitica cel mai des intalnite numere de coordinare sunt 2, 4 si 6.
Cunoscand valoarea numarului de coordinare, se poate scrie formula complexului, sarcina fiind egala cu suma algebrica a sarcinii ionului central si a liganzilor. Este evident ca in cazul cand liganzii sunt molecule sarcina complexului va fi egala cu sarcina ionului central.
Complecsii inglobeaza totalitatea compusilor de coordinatie, care contin un atom sau ion central inconjurat de un anumit numar de ioni sau molecule neutre. Combinatiile complexe ofera posibilitati multiple de aplicabilitate in analiza chimica (calitativa, cantitativa si instrumentala), fie sub forma unor compusi greu solubili, fie sub forma unor compusi solubili stabili, care stau la baza numeroaselor procedee de separare, identificare sau determinare de componenti.
Combinatiile complexe interne se deosebesc de celelalte combinatii complexe prin aceea ca sunt insolubile in apa, dar solubile in solventi organici, sunt neelectroliti, sunt puternic colorate permitand instituirea unor metode de analiza pentru ionii care le formeaza. Deoarece reactivii organici au masa moleculara mare in raport cu ionul anorganic cu care formeaza complexul intern se pot elabora metode sensibile de determinare a acestui ion.
Stabilitatea si taria complecsilor. Constante de stabilitate
Intelegerea formarii si disocierii complecsilor permite anticiparea si/sau calcularea conditiilor experimentale optime pentru analizele bazate pe reactii de complexare.
Constantele care caracterizeaza formarea si disocierea complecsilor, deriva din principiile echilibrului chimic.
Echilibrele de formare ale complecsilor pot fi reprezentate in doua moduri :
a) ca o reactie in trepte, fiecare treapta fiind redata printr-un echilibru de combinare a unei specii cu un singur ligand si caracterizata printr-o constanta de echilibru notata cu Kj , denumita constanta succesiva (individuala, partiala) de formare (stabilitate);
b) ca o reactie globala, fiecare echilibru fiind considerat stabilit prin combinarea ionului metalic cu toti liganzii deodata si va fi caracterizat prin constanta totala de stabilitate (formare) notata cu bj
Procesele de formare si de disociere ale combinatiilor complexe mononucleare MLn in solutie sunt in general reactii in trepte de forma:
M + L ML K1 = ![]() (2.101)
(2.101)
ML + L ML2 K2 = ![]() (2.102)
(2.102)
. . . . . . . . . . . . . . . . . . . . . .
MLn-1
+ L MLn Kn = ![]() (2.103)
(2.103)
Pentru simplificarea scrierii, s-a neglijat sarcina electrica atat a ionului metalic cat si a ligandului L. Constantele, K1, K2, Kj , . Kn , se numesc constante succesive de formare(constante succesive de stabilitate). In expresiile constantelor succesive de formare, marimile din paranteza reprezinta concentratiile molare la echilibru ale speciilor respective. Valorile constantelor succesive de formare fiind exprimate in aceleasi unitati (mol/l) pot fi comparate, pentru a aprecia taria complecsilor formati. Cu cat o constanta succesiva de formare Kj este mai mare, cu atat complexul respectiv MLj este mai stabil si deci este un donor mai slab al ligandului, deci complex slab. Cu cat constanta succesiva de stabilitate Kj este mai mica, complexul este mai instabil, el cedeaza mai usor ligandul L, deci un complex mai tare.
Echilibrele de formare a complecsilor ML, ML2,.., MLj, .., MLn, pot fi scrise si ca reactii globale sub forma :
M + L ML b ![]() (2.104)
(2.104)
M + 2L ML2 b = 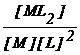 (2.105)
(2.105)
M
M + (n-1)L MLn-1 bn-1 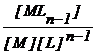 (2.106)
(2.106)
M + nL MLn bn ![]() (2.107)
(2.107)
unde b b bn-1 si bn , reprezinta constantele totale de stabilitate.
Intre constantele succesive de stabilitate si constantele totale de stabilitate exista o legatura, deoarece in acest sistem pot exista doar n echilibre independente.
Intre constantele totale de stabilitate si constantele succesive de stabilitate se stabilesc relatiile :
b = K
b = K1 · K2 ;
. . . . . . . .
bc = K1 · K2 · L · Kc ;
bn = K1 · K2 · . . . · Kc · . . · Kn. (2.109)
Valorile constantele totale de stabilitate de ordinul j, 1 ≤ j ≤ n, sunt corelate cu valorile constantele succesive de stabilitate prin relatia :
bj ![]()
Constantele totale de stabilitate permit calculul concentratiilor de echilibru in solutiile de complecsi.
In majoritatea cazurilor, constantele succesive de stabilitate pentru un sistem dat descresc, respectand urmatoarea ordine :
K1 > K2 > . . . > Kn.
Constantele succesive de stabilitate si cele totale, redau formarea combinatiilor complexe si cu cat ele vor fi mai mari cu atat complexul va fi mai stabil, echilibrul de formare fiind deplasat spre dreapta.
Stabilitatea complecsilor mai poate fi redata considerand reactiile de disociere a acestora, deci luand echilibre de complexare in sensul descompunerii(disocierii) complecsilor. In acest caz se utilizeaza constantele de instabilitate totale sau constantele succesive de instabilitate ale complecsilor, numite si constante de disociere, care sunt inversul constantelor de stabilitate :
K′c = Ki(c) = 1/Kc si b′c = bi(c) bc
Astfel : Ki(c) = 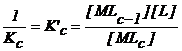 (2.111)
(2.111)
bi(c) ![]() (2.112)
(2.112)
In calculele concentratiilor de echilibru se folosesc logaritmi zecimali ai constantelor de stabilitate, pKc si pbc, sau cologaritmii constantelor de instabilitate, pKi(c) = pK'c si pbi(c) = pb'c
In forma logaritmica, relatia (2.110 sau 2.111) pentru complexul de ordinul c, se scrie :
pbc = 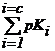 = pK1 + pK2 + . . .
+ pKc (2.113)
= pK1 + pK2 + . . .
+ pKc (2.113)
In mod obisnuit, constantele de stabilitate sunt determinate la tarii ionice fixe, in solutii diluate.
Daca se iau in considerare efectele tuturor reactiilor in care M si L intervin drept componenti ai unor procese de echilibru, se obtin asa-zisele constante conditionale(efective, aparente) de stabilitate.
Constantele conditionale de stabilitate depind de conditiile experimentale, reprezentand de fapt constantele de stabilitate in conditiile reale de lucru.
Luand ca exemplu, complexul MLc, constanta conditionala de stabilitate totala este definita de relatia :
br(c) = ![]() (2.114)
(2.114)
unde
[M]r este suma concentratiilor tuturor formelor ce contin ionul M in solutie ce nu reactioneaza cu agentul de complexare (concentratia totala a ionului metalic necomplexat in reactia principala) ;
[L]r - reprezinta in mod analog suma concentratiilor tuturor speciilor ligandului ce nu au reactionat cu ionul metalic (concentratia totala a ligandului necomplexat in raport cu reactia principala).
Constantele conditionale depind de conditiile experimentale, adica de concentratiile altor specii prezente in sistem.
Pentru calcularea constantelor conditionale se pot utiliza coeficientii aM si aL (coeficientii Schwarzenbach), definiti de expresiile :
aM = ![]() si aL =
si aL = ![]() (2.115)
(2.115)
Coeficientii a, masoara gradul de extindere al reactiilor secundare. Daca M (Mn+) reactioneaza numai cu ligandul L, atunci aM , iar cand da reactii secundare cu alte specii prezente in solutie, atunci aM > 1. In mod analog, o valoare mai mare decat unitatea a lui aL , indica prezenta unor procese secundare la care participa ligandul L.
Constanta conditionala de stabilitate poate fi calculata din valorile a, dupa o relatie de forma :
br(c) = 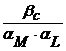 (2.116)
(2.116)
Valorile aM si aL , depind de constantele echilibrelor secundare la care participa M si respectiv L. Daca M da reactii secundare cu liganzii A, formand diversi compusi, MA, MA2, . , MAp , si daca L formeaza compusi cu cationii B de tip, BL, BL2, . , BLm , atunci relatiile matematice dupa care se calculeaza aM si aL sunt :
aM bMA[A] + bMA2 [A]2 + + bMAp[A]p
aL bBL[B] + bBL2[B]2 + +bBLm[L]m
![]()
![]() (2.120)
(2.120)
unde AMA AMA2 AMAp , sunt constantele totale de stabilitate ale speciilor, MA, MA2, . , MAp, iar, ABL ABL2 ABLm sunt constantele totale de formare ale speciilor, BL, BL2, . , BLm.
Coeficientul, AM (notat corect AM(A) este coeficientul care exprima influenta reactiilor secundare dintre M si A asupra reactiei principale dintre M si L.
Coeficientul AL (notat corect AL(B)), este coeficientul ce arata influenta reactiilor secundare dintre ligandul L si cationul B asupra reactiei principale dintre M si L.
Pentru sisteme mai complexe, cand in solutie exista mai multi componenti ce pot sa interfere, ca de exemplu mai multi liganzi, A1, A2, . , Ap, ce reactioneaza cu ionul M si mai multi cationi, B1, B2, . , Bq, ce reactioneaza cu ligandul L, se pot calcula coeficientii AL si AM totali, AL(t) si AM(t) , din valorile AL si AM ale diferitelor sisteme ce coexista in solutie, utilizand relatiile :
![]() (2.121)
(2.121)
![]()
unde: p si q sunt numarul speciilor chimice.
Pentru valori mari ale lui AL si AM , termenii (1 - p) si (1 - q) pot fi neglijati.
Stabilitatea oricarei combinatii complexe este dependenta si de o serie de termeni fizici (sarcina electrica, raza ionica, structura electronica, actiunea polarizanta, polarizabilitatea etc.) care sunt functii atat de natura generatorului de complex cat si de natura liganzilor respectivi. Stabilitatea unor complecsi poate fi in mod considerabil marita si prin extragerea lor in medii neapoase, adica prin interventia solventilor secundari, precum si prin aplicarea altor procedee sau tehnici de laborator.
Constanta de instabilitate constituie un criteriu cantitativ pentru exprimarea stabilitatii sferei interioare a unei combinatii complexe. Cu cat tendinta de disociere a unui ion complex este mai mica, cu atat combinatia complexa respectiva este mai stabila. Gradul de stabilitate al unei combinatii complexe se poate aprecia si dupa valoarea constantei de stabilitate sau de formare a complexului. Cu cat tendinta de disociere a unui ion complex este mai mica, cu atat stabilitatea complexului este mai mare.
Pentru caracterizarea formarii si stabilitatii combinatiilor complexe, adica pentru determinarea valorilor constantelor de stabilitate sau de instabilitate, se aplica diverse metode spectrofotometrice, electrometrice, de susceptibilitate magnetica, de distributie etc, precum si unele procedee grafice sau matematice. In literatura de specialitate, valorile constantelor de stabilitate succesive, valorile constantelor de stabilitate totale sau a pK - urilor si pA - urilor corespunzatoare, sunt tabelate pe elemente si pe clase de complecsi anorganici si organici.
Influenta pH - lui asupra echilibrelor de complexare
Cunoasterea concentratiei ionice de hidrogen in cazul reactiilor de complexare in solutii apoase este deosebit de importanta, atat in cazul combinatiilor complexe stabile, cat si in cazul combinatiilor complexe mai putin stabile. Liganzii sunt, in general, ioni sau molecule neutre, dar cu polaritate ridicata. In consecinta, ligandul unei combinatii complexe este susceptibil sa participe si la o reactie cu schimb de protoni (acid-baza). Efectul concentratiei ionilor de H+ sau a pH - lui intervine intotdeauna cand liganzii sunt baze conjugate ale unor acizi slabi si deci pot fi angajate atat in echilibre de complexare cat si in echilibre cu transfer de protoni. Astfel de echilibre, care se produc concomitent si la care participa aceeasi specie chimica intervin frecvent in chimia analitica.
Constanta totala de instabilitate a complexului MLn, a unui cation Mn+ cu un
ligand L− este :
MLn Mn+
+ nL− ![]() (2.123)
(2.123)
Daca, L− va reactiona cu un proton din mediul de reactie,
L− + H+ HL ![]() (2.124)
(2.124)
concentratia lui L− va scade, iar pentru respectarea valorii
constantei de echilibru, ![]() , va trebui sa creasca concentratia [Mn+], prin disocierea unei
noi cantitati de complex.
, va trebui sa creasca concentratia [Mn+], prin disocierea unei
noi cantitati de complex.
Daca
un ion metalic formator de complecsi interactioneaza cu liganzi L− ce provin din acizi
slabi (de exemplu HL) putin
disociati, odata cu formarea complexului se va diminua
concentratia liganzilor L−
din echilibrul cu transfer de protoni, iar pentru respectarea valorii
constantei de echilibru (constantei de disociere a acidului): ![]() , concentratia ionilor de hidrogen va trebuie sa
creasca, iar solutia respectiva va deveni mai acida.
, concentratia ionilor de hidrogen va trebuie sa
creasca, iar solutia respectiva va deveni mai acida.
Daca
la solutia unei baze slabe, de exemplu M(OH)2,
se adauga un agent complexant L
al ionului M2+, ionul
metalic se va angaja in reactia de complexare formand complexul M![]() :
:
M2+ + nL M![]()
are drept efect
scaderea concentratiei ionilor M2+.
Pentru pastrarea valorii constantei de bazicitate, ![]() , concentratia [OH−]
va trebui sa creasca, iar solutia respectiva va deveni mai
bazica.
, concentratia [OH−]
va trebui sa creasca, iar solutia respectiva va deveni mai
bazica.
Procesele de complexare pot fi dirijate prin reglarea pH -lui solutiei, fapt care isi gaseste multiple aplicatii in practica analitica, in procesele de mascare, demascare sau direct in metodele de analiza fizico-chimica.
Corespunzator echilibrului (2.123) se poate scrie constanta totala de stabilitate :
![]()
iar conform echilibrului
(2.124) constanta de aciditate: ![]() .
.
Concentratia
[L−] din ![]() este alcatuita
din [L-]echilibru
si [HL] si in
consecinta :
este alcatuita
din [L-]echilibru
si [HL] si in
consecinta :
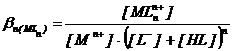 (2.127)
(2.127)
Inlocuind [HL] din Ka, se obtine :
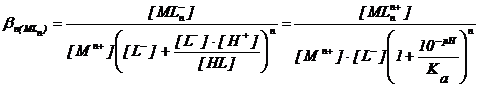 (2.128)
(2.128)
Din relatia 2.128, reiese ca echilibrul de complexare este dependent de pH - ul solutiei. De multe ori ligandul L este anionul unui acid slab polibazic HnL, combinandu-se cu protonul. In acest caz ligandul nelegat de M (nu se va tine seama de sarcina pentru cationul M, anionul L si speciile protonate ale anionului L) va fi prezent in solutie in functie de pH, atat in forma neprotonata L cat si in diferitele forme protonate, HL, H2L, . , HnL. Suma tuturor acestor forme va fi :
[L]H
= [L] + [HL] + . + [HnL] = ![]() (2.129)
(2.129)
fiind o functie de concentratia ligandului liber L.
Aceasta functie se poate scrie :
[L]H = aL[H] [L] (2.130)
unde aL[H] este coeficientul reactiei competitive (secundare)
Constanta conditionala de stabilitate a complexului in prezenta protonilor, KML(H), va fi :
![]() (2.131)
(2.131)
respectiv :
lgKML(H) = lgKML - lgaL(H) (2.132)
Constanta KML(H) se poate calcula din valorile lui KML (constanta exprimata prin concentratii, adeseori considerata drept constanta absoluta ce este data in tabelele constantelor de stabilitate ale complecsilor), daca se cunoaste aL(H) (ce este de obicei calculata in functie de pH pentru liganzii L mai des utilizati ca de exemplu, complexoni).
Din (2.130) si (2.231) rezulta :
aL(H) = ![]() (2.133)
(2.133)
[L]H
= [L]![]() (2.134)
(2.134)
Termenii acestei sume se pot exprima considerand echilibrele de disociere in trepte a acidului HnL :
HnL Hn-1L−
+ H+ ![]()
Hn-1L− Hn-2L2−
+ H+ ![]()
HL−(n-1) L−
+ [H+] ![]()
Astfel,
pentru a calcula ![]() , se va tine
seama de ultima treapta de disociere (relatia 2.137) rezultand :
, se va tine
seama de ultima treapta de disociere (relatia 2.137) rezultand :
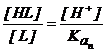 . (2.138)
. (2.138)
Urmand acelasi procedeu, se obtine :
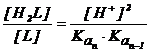
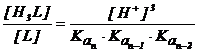
![]()
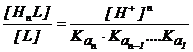 (2.139)
(2.139)
Tinand seama de cele de mai sus se obtine :
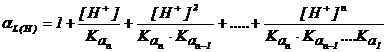 (2.140)
(2.140)
[L]H
= [L]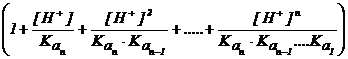
sau : [L]H = [L]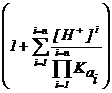 (2.142)
(2.142)
Cu ajutorul ecuatiei 2.140 , se poate calcula aL(H la o anumita valoare data a concentratiei ionilor H+.
Intre constantele de stabilitate bML(KML) ale unui complex ML in absenta echilibrelor acid - baza si constantele de stabilitate KML(H) (bML(H) in prezenta echilibrelor acid - baza se stabileste interdependenta :
KML = aL(H) KML(H (2.143)
Tinand seama de reactiile de formare in trepte a protonocomplecsilor, HL, H2L, . si HnL , ale caror constante succesive de stabilitate sunt K1, K2, . ,Kn si de constantele de disociere succesive ale acidului HnL, rezulta :
K1 = ![]() K2 =
K2 = 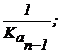 . . ..si Kn =
. . ..si Kn = ![]()
si deci ecuatia 2.140, exprimata prin constantele de formare succesive ale protonocomplecsilor lui L, are forma :
aL(H) = 1+K1[H+] + K1 K2[H+]2 + . ..+K1 K2 K3 . Kn[H+]n
Valorile aL(H) in functie de pH pentru liganzii mai des utilizati sunt reprezentate grafic sau date in tabele.
Influenta altor liganzi asupra echilibrului de complexare
Pentru explicarea efectului liganzilor straini, se considera ca la solutia unui complex al ionului Mn+ cu ligandul L−, de formula generala MLn, se adauga un alt ligand X− cu proprietati complexante fata de Mn+.
Reactia ce poate avea loc se scrie :
MLn + n X− MXn + nL−
care va fi mai
deplasata spre dreapta sau spre stanga in functie de
concentratia lui X−
si de constanta de stabilitate ![]() a complexului MXn.
a complexului MXn.
Constantele totale de instabilitate ale celor doi complecsi sunt date de expresiile :
![]() (2.147)
(2.147)
![]() (2.148)
(2.148)
Concentratia
de ioni metalici liberi Mn+
din solutie, in prezenta celor doi liganzi, se deduce din expresiile
constantelor totale de instabilitate, ![]() si
si ![]() :
:
[Mn+] = ![]() (2.149)
(2.149)
Din 2.146 , reiese ca in orice moment : n · [HXn] = [L−]
Ordonand termenii din relatiile de mai sus si tinand seama de ultima egalitate, se poate scrie :
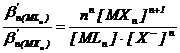 (2.150)
(2.150)
Pentru
o concentratie data de ligand strain X−, deplasarea lui L− din complexul MLn va fi cu atat mai evidenta cu cat ![]() este mai mare decat
este mai mare decat ![]() , iar pentru o anumita valoare a raportului
, iar pentru o anumita valoare a raportului ![]() , aceasta deplasare este functie de
concentratia ligandului strain X−.
, aceasta deplasare este functie de
concentratia ligandului strain X−.
Pentru a deduce relatia ce exprima influenta ligandului strain asupra echilibrului de disociere a complexului MLn , se considera echilibrul de disociere totala a complexului MLn cu formarea cationului Mn+ :
MLn Mn+ + nL− (2.151)
caracterizat de constanta totala de instabilitate ,
![]() (2.152)
(2.152)
si echilibrele de
formare in trepte a complecsilor MX+(n-1),
M![]() , . .., MXn :
, . .., MXn :
Mn+ + X− MX+(n-1)
MX+(n-1)
+ X− M![]()
. . . . . . . . . . . . . . . . .
M![]() + X− MXn
+ X− MXn
caracterizate de constantele succesive de stabilitate :
K1
= ![]() (2.153)
(2.153)
K2
= ![]() (2.154)
(2.154)
Kn-1
= ![]() (2.155)
(2.155)
Kn
= ![]() (2.156)
(2.156)
Daca in expresia constantei de stabilitate a complexului MLn ,
![]() (2.157)
(2.157)
se inlocuieste [Mn+] cu suma
[Mn+] + [MX+(n-1)] + [M![]() + . + [MXn] =
+ . + [MXn] = ![]() = [M]X ,
= [M]X ,
se obtine :
![]() (2.158)
(2.158)
Din, (2.153) - (2.156) si (2.157), rezulta :
![]() =[Mn+]
+ K1[X−] · [Mn+] + K1 · K2
· [X−]2 · [Mn+] + . . . .. + K1 ·
K2 · . · Kn-1 · Kn · [X−]n (2.159)
=[Mn+]
+ K1[X−] · [Mn+] + K1 · K2
· [X−]2 · [Mn+] + . . . .. + K1 ·
K2 · . · Kn-1 · Kn · [X−]n (2.159)
![]() = [Mn+]
= [Mn+]![]() (2.160)
(2.160)
Notand : 1+![]() = aX, se
obtine :
= aX, se
obtine :
[Mn+]X = [Mn+] aX (2.161)
![]() (2.162)
(2.162)
Daca la solutia complexului MLn se adauga un ion metalic strain Nn+ ce poate forma complecsi cu L− , este posibila si reactia :
MLn + Nn+ NLn + Mn+ (2.163)
Tinand seama de expresiile constantelor totale de stabilitate ale celor doi complecsi :
![]() si
si ![]()
si tinand seama ca : [Mn+] = [NLn], se obtine relatia :
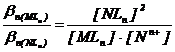 (2.164)
(2.164)
Pentru
o concentratie data a cationului strain Nn+(formator de complecsi), deplasarea lui Mn+ din complexul MLn va fi cu atat mai
evidenta cu cat ![]() este mai mare decat
este mai mare decat ![]() , iar pentru o anumita valoare a raportului,
, iar pentru o anumita valoare a raportului, 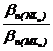 , aceasta deplasare este functie de
concentratia cationului strain [Nn+].
, aceasta deplasare este functie de
concentratia cationului strain [Nn+].
Pentru
a demonstra efectul agentului precipitant, fie o solutie 0,1 m de ![]() , in care se stabileste echilibrul :
, in care se stabileste echilibrul :
[Ag(NH3)2]+ Ag+
+ 2NH3 ![]() .
.
Valoarea lui b arata ca echilibrul de disociere este deplasat spre stanga si deci se poate considera ca valoarea concentratiei ionului complex tinde spre 10−1 m.
Din echilibrul de disociere a ionului complex [Ag(NH3)]+ :
[Ag+]=![]() si
si![]()
![]() ,
,
rezulta : ![]()
Ionii Ag+ din aceasta solutie formeaza precipitat cu ionii Cl−, incepand chiar de la cantitati relativ mici ale acestora :
![]() ion-g /l.
ion-g /l.
Din cele de mai sus, se deduce ca atat pentru dizolvarea AgCl in amoniac, cat si pentru stabilizarea ionului complex [Ag(NH3)2]+ in prezenta de ioni Cl−, este necesar sa se utilizeze un exces de NH3.
De exemplu, dupa dizolvarea AgCl in suspensie de 0,1 moli/litru prin adaugare de NH3 in solutie , concentratiile ionilor din solutie vor fi :
![]() si
si ![]()
Din ![]() , se deduce concentratia minima de NH3 din solutie ce
permite dizolvarea a 0,1 moli AgCl /l, ca fiind :
, se deduce concentratia minima de NH3 din solutie ce
permite dizolvarea a 0,1 moli AgCl /l, ca fiind : ![]() .
.
Se considera echilibrul de disociere :
Hg(SCN)42− Hg(SCN)3− + SCN−
Complexul Hg(SCN)42− este stabil si va pune in libertate prin echilibrul (2.165) ioni SCN−, numai in masura in care in solutie exista un acceptor al acestor ioni. Astfel, daca in solutia complexului Hg(SCN)42- se introduc ioni de Fe3+ acestia pot fixa ionii SCN− conform echilibrului :
Fe3+ + SCN− Fe(SCN)2+
Insumand echilibrele 2.165 2.166, se obtine :
Hg(SCN)42− + Fe3+ Hg(SCN)3− + Fe(SCN)2+ (2.167)
care reprezinta echilibrul cu transfer al ionului SCN− de la donorul Hg(SCN)42− la acceptorul Fe3+.
Constanta acestui echilibru :
K = 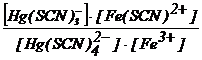 (2.168)
(2.168)
Echilibrul 2.167 este de tip donor - acceptor de ioni sau molecule si poate fi generalizat sub forma :
D1 + A2 A1 + D2
ce are constanta de
echilibru : K
= 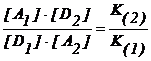 (2.169)
(2.169)
in care K(1) si K(2) sunt constantele succesive de stabilitate ale cuplurilor donor - acceptor 1 si respectiv 2 implicate in reactie. In exemplul de mai sus, K(2) este constanta de stabilitate K1 din seria de complecsi a acceptorului Fe3+ si ligandului CN−, iar K(1) este constanta succesiva de stabilitate K4 , din seria complecsilor Hg2+ cu acelasi ligand SCN−. Utilizarea relatiei 2.169 pentru calcularea constantelor de echilibru ale reactiilor de complexare, necesita utilizarea tabelelor cu constantele de stabilitate ale complecsilor.
Pe baza constantelor de echilibru se pot prevedea reactiile posibile intre acceptori si donori diferiti.
Deoarece constanta K, data de relatia 2.169, indica in ce masura reactia de schimb intre D1 si A2 are loc, pentru a prevedea posibilitatea de utilizare practica a reactiilor de complexare este necesar sa se cunoasca constantele de stabilitate ale complecsilor implicati in reactie (care se iau din tabele).
Se vor considera spre exemplificare, complecsii formati de cationii metalici cu anionul provenit de la EDTA (prescurtat H4Y), care formeaza ligandul Y4−: H4Y + 4H2O Y4− + 4H3O+
Anionul Y4− formeaza complecsi stabili cu foarte multi ioni metalici. Tinand seama de constantele de stabilitate K ale acestor complecsi, se observa ca tendinta complexonatilor de a accepta complexonul(care joaca rolul particulei p), scade de la LiY3− la CoY−, iar tendinta de a accepta complexonul creste de la Li+ la Co3+.
Daca se ordoneaza complexonati in ordinea crescatoare a stabilitatii lor, oricare acceptor din serie poate reactiona cu toti donorii situati deasupra sa.
De exemplu :
TlY3− + Bi3+ Tl+ + BiY−
Constanta echilibrului 2.171 este :
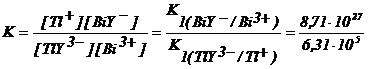
Care este diferenta dintre o constanta de disociere si o constanta de formare in cazul ionilor complecsi ?
De ce complecsii EDTA - metal sunt foarte stabili ?
La adaugarea de amoniac intr-o solutie ce contine ioni Cu2+, se formeaza, nu numai ionul complex [Cu(NH3)4]2+ ce are constanta totala de stabilitate A , ci si ionii complecsi intermediari, [Cu(NH3)]2+, [Cu(NH3)2]2+ si [Cu(NH3)3]2+, caracterizati de constantele partiale (succesive) de stabilitate K1, K2 si respectiv K3. Constanta partiala de formare a ionului complex [Cu(NH3)4]2+ este K3. Care este relatia ce leaga constanta totala de stabilitate A de constantele partiale (succesive) de stabilitate K1, K2 , K3 si K4
a)
A =![]() ; b) A =
K1·K2·K3·K4 ; c) A =
K2·K3·K4 ;
; b) A =
K1·K2·K3·K4 ; c) A =
K2·K3·K4 ;
d) A =![]() ; e) A =
; e) A = ![]() .
.
Valoarea constantei totale de formare a ionului complex [Ag(NH3)2]+ este 1,7·107. Intr-un litru de apa se dizolva 1·10−3 moli AgNO3 si 5·10−1 moli amoniac. La aceasta solutie se adauga 0,1 moli Cl- si 0,01 moli I-. Care dintre afirmatiile de mai jos referitoare la amestecul final corespunde realitatii ?
a) Apare un precipitat format din AgCl si AgI;
b) Apare un precipitat format din AgCl;
c) Apare un precipitat format din AgI;
d) Nu apare nici un precipitat;
e) In solutie nu are loc nici o interactie intre particulele existente.
Care este sarcina cationului metalic din ionii complecsi :
1) [Ag(NH3)2]+; 2) [Zn(CN)4]2−; 3) [Ag(C2O4)2]3− ?
a) 1 ; b) 2 ; c) 3 ; d) 4.
a) 1 ; b) 2 ; c) 3 ; d) 4.
a) 1 ; b) 2 ; c) 3 ; d) 4.
Care este sarcina x a urmatorilor ioni complecsi si a ionului central ?
[Fe(CN)6]x :
a) -4 si +2 ; b) -4 si +3 ; c) -3 si +3 ; d) -6 si +2.
Ag(S2O3)2]x :
a) -4 si +1 ; b) -4 si +3 ; c) -3 si +1 ; d) -3 si +2.
[HgI4]x :
a) -4 si +1 ; b) -4 si +2 ; c) -4 si +1 ; d) -2 si +2.
Care este sarcina agentului de complexare din combinatiile complexe de mai jos ?
Pt(NH3)6 Cl4 : a) +2 ; b) 0 ; c) -2 ; d) -1.
K2[Co(SCN)4] : a) +1 ; b) -4 ; c) -3 ; d) -1.
K2Na[Co(NO2)6] ; a) -6 ; b) -4 ; c) -3 ; d) -2.
Combinatiile complexe sunt electroliti tari in majoritatea cazurilor. Ce intelegeti prin electroliti tari in acest caz ? Cum ionizeaza in solutie apoasa combinatia complexa Na2 Sn(OH)4
a) 2Na+ + Sn2+ + 4OH−; b) 2Na+ + Sn4+ + 4OH− ;
c) 2Na+ + Sn(OH)4 ; d) 2Na+ + Sn(OH)2 + OH−.
Care din reactiile cu schimb de ioni, 1, 2 si 3, date mai jos sunt posibile de la stanga la dreapta ?
LiY3− + Bi3+ BiY− + Li+.
2. Ag(CN)![]() + Hg2+ Hg(CN)2 + Ag+.
+ Hg2+ Hg(CN)2 + Ag+.
3. FeF2+ + 2SCN− Fe(SCN)![]() + F−.
+ F−.
a) 1 si 2 ; b) 1 si 3 ; c) 2 si 3 ; d) 1, 2 si 3.
Constantele
de stabilitate constituie un criteriu cantitativ de apreciere a
stabilitatii unor ioni complecsi. Constantele totale de
instabilitate ![]() ale ionilor
complecsi, [HgCl4]2−, [HgBr4]2−,
HgI4]2− si [Hg(SCN)4]2−,
au valorile 8 · 10 si
respectiv 1 · 10 . Care este ordinea cresterii
stabilitatii ionilor complecsi ?
ale ionilor
complecsi, [HgCl4]2−, [HgBr4]2−,
HgI4]2− si [Hg(SCN)4]2−,
au valorile 8 · 10 si
respectiv 1 · 10 . Care este ordinea cresterii
stabilitatii ionilor complecsi ?
a) [HgCl4]2− < [HgBr4]2− < [Hg(SCN)4]2− < [HgI4]2−.
b) [HgCl4]2− < [Hg(SCN)4]2− < [HgBr4]2− < [HgI4]2−.
c) [HgBr4]2− < [HgCl4]2− < [Hg(SCN)4]2− < [HgI4]2−.
d) [HgI4]2− < [HgBr4]2− < [HgCl4]2− < [Hg(SCN)4]2−.
In tabelul de mai jos sunt dati cativa ioni complecsi ce au ca ligand ionul CN− :
|
Ion complex |
Constanta
totala de instabilitate, |
|
[Cu(CN)4]2 [Au(CN)4] [Cd(CN)4]2 [Zn(CN)4]2- [Hg(CN)4]2- |
Care este ordinea cresterii stabilitatii ionilor complecsi din tabelul de mai sus ?
a) [Zn(CN)4]2−<[Cd(CN)4]2−<[Cu(CN)4]3−<[Hg(CN)4]2−<[Au(CN)4]−.
b) [Cd(CN)4]2−< Hg(CN)4]2−< [Zn(CN)4]2−<[Cu(CN)4]3− <[Au(CN)4]−.
c)[Cd(CN)4]2−<[Zn(CN)4]2−<[Cu(CN)4]3−< [Au(CN)4]− <[Hg(CN)4]2−.
d) [Zn(CN)4]2−<[Cu(CN)4]3−<[Hg(CN)4]2−<[Au(CN)4]− <[Cd(CN)4]2−.
f) [Cd(CN)4]2−<[Zn(CN)4]2−<[Cu(CN)4]3−<[Hg(CN)4]2−<[Au(CN)4]−.
Considerand ca la dizolvarea clorurii de argint(Ps(AgCl) = 1,8 ·10 ) in amoniac se formeaza numai ionul complex Ag(NH3)2 care are contanta totala de formare A = 1,7 · 107, ce valoare are constanta echilibrului de dizolvare K a AgCl in amoniac ?
a) K = 3,06 · 10−2 ; b) K = 3,06 · 10−3 ; b) K = 3,06 · 10−4 ;
d) K = 3,06 · 10−5 ; e) K = 3,06 · 10−6.
Fie solutiile 0,1 m de Ag(NH3)2 Cl si de K Ag(S2O3) . In care din solutii concentratia ionilor Ag+ este mai mare ?
a) K Ag(S2O3) ; b) Ag(NH3)2 Cl ; c) aceeasi in ambele solutii ;
d) Ag(NH3)2 nu disociaza ; e) Ag(S2O3) nu disociaza.
Stabilitatea complecsilor chelati este influentata de tipul heterociclului care se formeaza . Care dintre liganzii de mai jos poate forma cel mai stabil complex chelat cu un ion metalic M2+ ?
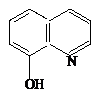
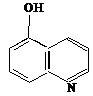 1) CO32− ; 2) 3)
1) CO32− ; 2) 3)
4) CH3―CH―CH2―CH2―CH―CH3 5) CH3―CO―NH2
│ │
SH SH
a) 1 ; b) 2 ; c) 3 ; d) 4 ; e) 5.
Stabilitatea complecsilor chelati este influentata de tipul heterociclului care se formeaza . Care dintre liganzii de mai jos nu formeaza un complex chelat cu un ion metalic M2+ ?
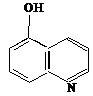
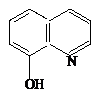
1) CO32− ; 2) 3)
4) CH3―CH―CH2―CH2―CH―CH3 5) CH3―CO―NH2
SH SH
a) 1 ; b) 2 ; c) 3 ; d) 4 ; e) 5.
Se da : A Ag(NH3)2 A Ag(S2O3)2 )=2,88·1013. De cate ori concentratia ionului Ag+ este mai mare in solutie de Ag(NH3)2 NO3 10−3 m, decat in solutie de Na3 Ag(S2O3)2 10-3 m ?
a) 118 ori ; b) 168 ori ; c) 218 ori ; d) 268 ori ; e) 318 ori.
Care dintre reactivii de mai jos, nu poate forma combinatii complexe chelate?
1) CO32−; 2) H2N-CH2-COO− 3) CH3-CO-CH2-CO-CH3
4) CH3-CO-CH3 5) ![]() -dipiridil 6) ditizona.
-dipiridil 6) ditizona.
a) 1 ; b) 2 si 3 ; c) 3 ; d) 4 ; e) 5 si 6.
Un rol deosebit de important in chimia analitica calitativa si cantitativa il au asa - numitele combinatii complexe "chelate", care sunt compusi de coordinatie in care ligandul se coordineaza la ionul metalic central, prin doua sau mai multe puncte de coordinare formand cicluri. La care din reactivii de mai jos , nu este de asteptat un efect de chelatizare ?
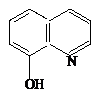
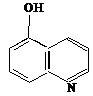 1)
CO32-; 2) 3)
1)
CO32-; 2) 3)
4) CH3―CH―CH2―CH2―CH―CH3 5) CH3―CO―NH2
│ │
SH SH
a) 1 si 6 ; b) 3; c) 2 si 5 ; d) 4 ; e) 5.
Fie urmatoarea ecuatie chimica de complexare :
Ag+ + 2CN− ![]()
Care
dintre substante determina cresterea concentratiei![]() ?
?
Care dintre substante determina
scaderea concentratiei![]() ?
?
Care din reactiile de complexare de mai jos sunt posibile ?
1) FeF2+ + SCN ; 2) LiY3 + Bi3+
3) ![]() + Hg2+.
+ Hg2+.
Sa se calculeze concentratia de amoniac din solutie necesara dizolvarii totale a 5 · 10 moli de clorura de argint intr-un litru de solutie. Se da Ps(AgCl) = 1,8 · 10 A
Rezolvare:
AgCl(s) Ag+ + Cl− Ps = Ag+ Cl−
Ag+ + 2NH3
Ag(NH3)![]() A =
A = ![]() = 1,7 · 107
= 1,7 · 107
AgCl(s) + 2NH3
Ag(NH3)![]() + Cl−,
+ Cl−,
K = ![]() = Ps · A
= Ps · A
La dizolvarea totala a 0,05 moli
AgCl /l, Cl− = 5 · 10−2 ion - g/l si Ag+ total Ag+ Ag(NH3)![]()
Pentru a nu se mai forma precipitat de AgCl in solutia ce contine ioni Cl− in concentratie 5 · 10−2 ion - g/l , trebuie ca produsul concentratilor ionilor Cl− si Ag+ sa fie mai mic decat valoarea produsului de solubilitate al clorurii de argint si deci:
Ag+ = ![]() =
= ![]() = 3,6 · 10−2 ion - g/l.
= 3,6 · 10−2 ion - g/l.
In aceste conditii, Ag(NH3)![]() s Ag+ total
= 5 · 10−2 ion - g/l.
s Ag+ total
= 5 · 10−2 ion - g/l.
Din expresia si valoarea
constantei echilibrului de dizolvare a AgCl prin reactia cu NH3, K =![]() = Ps· A =
3,06·10−3 rezulta
= Ps· A =
3,06·10−3 rezulta
NH3 = 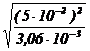 = 0,9 mol /l .
= 0,9 mol /l .
Valoarea concentratiei totale de amoniac din solutie este
c![]() = NH3 Ag(NH3)
= NH3 Ag(NH3)![]() = 0,9 + 2 · 5 · 10−2 = 1
mol /l.
= 0,9 + 2 · 5 · 10−2 = 1
mol /l.
Utilizand ecuatiile echilibrate corespunzatoare sa se explice de ce clorura de argint, desi aparent insolubila in apa este solubila in solutie de amoniac in apa, in timp ce iodura de argint este insolubila atat in apa cat si in solutie amoniacala.
Rezolvare:
AgCl(s) Ag+ + Cl− si Ag+ + 2NH3 Ag(NH3)2+
sau AgCl(s) + 2NH3 Ag(NH3)2+ + Cl−
K = ![]() = Ps(AgCl)· A (Ag(NH3)2+)
= 3,5 · 10−3
= Ps(AgCl)· A (Ag(NH3)2+)
= 3,5 · 10−3
valoare ce permite prin cresterea concentratiei NH3 sa fie posibila deplasarea echilibrului de dizolvare a AgCl(s) spre dreapta.
AgI(s) Ag+ + I− si Ag+ + 2NH3 Ag(NH3)2+
sau : AgI(s) + 2NH3 Ag(NH3)2+ + I−
K = ![]() = Ps(AgI) · A (Ag(NH3)2+)
= 1,4 · 10−9 , valoare
foarte mica(echilibru deplasat practic total spre stanga) ce arata
ca echilibru de dizolvare al AgI(s) in solutie de amoniac nu este
posibil sa fie deplasat spre dreapta, nici chiar in solutii
concentrate de amoniac.
= Ps(AgI) · A (Ag(NH3)2+)
= 1,4 · 10−9 , valoare
foarte mica(echilibru deplasat practic total spre stanga) ce arata
ca echilibru de dizolvare al AgI(s) in solutie de amoniac nu este
posibil sa fie deplasat spre dreapta, nici chiar in solutii
concentrate de amoniac.
Produsul de solubilitate al AgSCN este 1,1·10−12, iar constantele succesive de stabilitate ale ionilor complecsi amoniacali ai ionului de argint sunt, lg K1 = 3.32 si lg K2 = 3,92. Calculati solubilitatea molara (Sm, mol/l ) a AgSCN intr-o solutie tampon NH4SCN 10−2m si NH3 10−3m.
Rezolvare:
AgSCN(s) Ag+ + SCN− Ps = Ag+ SCN−
Ag+
+ NH3 Ag(NH3)+ K1 = ![]()
Ag(NH3)++ NH3 Ag(NH3)![]() K2
=
K2
= ![]()
Sm = ![]() = [Ag+] + [Ag(NH3)+] + [Ag(NH3)
= [Ag+] + [Ag(NH3)+] + [Ag(NH3)![]() ]
]
Tinand seama de expresiile matematice ale Ps , K1 , K2 si de valoarea concentratiei ionului SCN− care este practic cea din NH4SCN(cea care rezulta din disocierea AgSCN este foarte mica si prin urmare poate fi neglijata) rezulta :
Sm =![]() =
=![]() (1 + K1 · [NH3] + K1 · K2
· [NH3]2)
(1 + K1 · [NH3] + K1 · K2
· [NH3]2)
si solubilitatea molara a AgSCN in solutia data :
Sm = 2,25 · 10−9 mol /l.
Sa se calculeze concentratia ionilor Ag+ din solutiile 10−3 mol /l ale urmatoarelor substante
a) Ag(NH3)2 NO3 , A Ag(NH3)2
b) Na3 Ag(S2O3)2 A Ag(S2O3)2
c) K Ag(CN)2 A Ag(CN)2
Ce concluzie puteti trage din valorile concentratiilor Ag+ obtinute ?
Rezolvare:
Pentru calcularea valorii concentratiei ionilor Ag+ din solutiile date se tine
seama de ecuatia reactiei de formare a ionului complex si de expresia matematica
a constantei de stabilitate.
a) Ag(NH3)2 NO3 + apa Ag(NH3)2 + ![]()
Ag+
+ 2NH3 Ag(NH3)2 A =![]() = 1,74 · 107.
= 1,74 · 107.
Tinand seama de reactia de disociere a ionului complex si de faptul ca este destul de stabil
Ag(NH3)2+ s 10−3 m si NH3 = 2 Ag+
Inlocuind in A si rezolvand, se obtine
Ag+ = 2,43 · 10−4 ion - g / l.
b) Na3 Ag(S2O3)2 + apa 3Na+ + Ag(S2O3)2
Ag+ + 2S2O32−
Ag(S2O3)2 A =![]() = 2,88 · 1013.
= 2,88 · 1013.
Facand aceleasi considerente ca la punctul a si rezolvand, se obtine
Ag+ = 2,06 · 10−6 ion - g / l.
c) K Ag(CN)2 + apa K+ + Ag(CN)2
Ag+ + 2CN− Ag(CN)2 A = 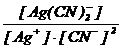 = 7,08 · 1019.
= 7,08 · 1019.
Ag+ = 1,52 · 10−8 ion - g / l.
Valorile concentratiei ionului Ag+ din cele trei solutii de aceeasi concentratie de combinatii complexe ale aceluiasi cation, cu liganzi diferiti, dovedesc ca la echilibru concentratia cationului este foarte diferita si depinde de stabilitatea ionului complex. Cu cat valoarea constantei de stabilitate a ionului complex este mai mare(ionul complex mai stabil), cu atat valoarea concentratiei cationului generator de complex este mai mica.
Sa se calculeze concentratia ligandului din solutiile 10−3 mol /l ale urmatoarelor combinatii complexe
a) Ag(NH3)2 NO3 , A Ag(NH3)2
b) Na3 Ag(S2O3)2 A Ag(S2O3)2
c) K Ag(CN)2 A Ag(CN)2
Ce concluzie puteti trage din valorile concentratiei ligandului obtinute pentru cele trei solutii ?
Rezolvare:
Pentru calcularea valorii concentratiei ligandului din fiecare solutie, se tine seama de ecuatia reactiei de formare a ionului complex si de expresia matematica a constantei de stabilitate.
a) Ag(NH3)2 NO3 + apa Ag(NH3)2 + ![]()
Ag+ + 2NH3 Ag(NH3)2 A =![]() = 1,74 · 107.
= 1,74 · 107.
Tinand seama de reactia de disociere a ionului complex si de faptul ca este destul de stabil
Ag(NH3)2+ s m si NH3 = 2 Ag+
Inlocuind in A si rezolvand, se obtine
NH3 = 4,86 · 10−4 mol /l.
b) Na3 Ag(S2O3)2 + apa 3Na+ + Ag(S2O3)2
Ag+ + 2S2O32−
Ag(S2O3)2 A =![]() = 2,88 · 1013.
= 2,88 · 1013.
Facand aceleasi considerente ca la punctul a si rezolvand
S2O32− = 4,12 · 10−6 ion - g / l.
c) K Ag(CN)2 + apa K+ + Ag(CN)2
Ag+
+ 2CN− Ag(CN)2 A =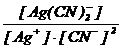 = 7,08 · 1019.
= 7,08 · 1019.
CN = 3,04 · 10−8 ion - g / l.
Valorile concentratiei liganzilor din cele trei solutii de combinatii complexe, de aceeasi concentratie, ale aceluiasi cation cu liganzi diferiti, dovedesc ca la echilibru concentratia ligandului este foarte diferita si depinde de stabilitatea ionului complex. Cu cat valoarea constantei de stabilitate a ionului complex este mai mare(ionul complex mai stabil), cu atat valoarea concentratiei ligandului este mai mica.
Intr-un litru de apa se dizolva 10−3
moli azotat de argint si 1 mol amoniac. In aceasta solutie se adauga 0,1 moli NaCl si 0,01 moli KI. Cunoscand, Ps(AgCl)
=1,8 · 10 ,
Ps(AgI) = 8 · 10
si A Ag(NH3)![]() ) = 1,7 · 107 si considerand ca volumul nu se
modifica la dizolvarea substantelor, sa se calculeze concentratia ionului I−
si concentratia ionului Ag+ din solutia finala.
Ce concluzie puteti formula pe baza valorilor obtinute ?
) = 1,7 · 107 si considerand ca volumul nu se
modifica la dizolvarea substantelor, sa se calculeze concentratia ionului I−
si concentratia ionului Ag+ din solutia finala.
Ce concluzie puteti formula pe baza valorilor obtinute ?
Rezolvare:
Ag+ + NH3 Ag(NH3) Ag(NH3) + NH3 Ag(NH3)2
Ag+ + Cl− AgCl(s) si Ag+ + I− AgI(s).
Concentratia amoniacului fiind mult mai mare decat a Ag+, se formeaza ionul complex al Ag+ cu NH3 cu numarul maxim de complexare :
Ag++ 2NH3
Ag(NH3)2 A =![]() = 1,7 · 107.
= 1,7 · 107.
Se poate considera :
Ag(NH3)2+ s 10−3 ion-g /l si NH3 = 0,998 m.
Din, A =![]() = 1,7 · 107 se obtine : Ag+ = 5,906 · 10−11 ion-g / lcare
justifica aproximatiile facute.
= 1,7 · 107 se obtine : Ag+ = 5,906 · 10−11 ion-g / lcare
justifica aproximatiile facute.
Valoarea concentratiei ionilor Ag+ de 5,906 · 10−11 ion-g /l a fost calculata fara a tine seama de posibilitatea formarii de precipitat AgI si AgCl ( in ipoteza ca nu se formeaza nici un fel de precipitat) si deci reprezinta valoarea concentratiei maxime a ionilor Ag+ din solutie.
Deoarece, Ag+ · [I− > Ps(AgI) = 8 · 10−17
Ag+ · [Cl− < Ps(AgCl) = 1,8 · 10−10, rezulta ca se formeaza precipitat AgI si deci valoarea concentratiei ionilor Ag+ din solutie va scadea si va fi mai mica decat 5,906 · 10− 11 ion-g /l.
Din : Ps(AgI)·
A Ag+ ·[I− ·![]()
[I = 1,35·10−6 ion-g /l
Din : Ps(AgI) · A Ag+ · [I− [Ag+ = 5,906 · 10−11 ion-g /l.
Valoarea concentratiei ionilor I din solutia finala de 1,35 ·10−6 ion-g/ l este foarte mica in raport cu cea initiala de10−2 ion-g /l (sub 1,36·10 %), si arata ca practic ionul iodura este practic total precipitat, in timp ce ionul Cl− nici nu incep sa precipite.
Ce concentratie au ionii Ag+
dintr-o solutie K![]() 0,05 m si K3
0,05 m si K3![]() 0,4m, daca valoarea constantelor totale de instabilitate ale ionilor complecsi
sunt, 2,7 · 10−8
si respectiv 9,3 ·10−11.
0,4m, daca valoarea constantelor totale de instabilitate ale ionilor complecsi
sunt, 2,7 · 10−8
si respectiv 9,3 ·10−11.
Rezolvare:
In solutie exista un echilibru intre ionii complecsi [Ag(SCN)2]− si [Ag(SCN)4]3− si solutia saturata fata de ei :
[Ag(SCN)4]3− Ag+ + 4SCN− si [Ag(SCN)2]− Ag+ + 2SCN−
Fie x concentratia ionilor Ag+, in ion-g /l , ce rezulta din disocierea ionului complex [Ag(SCN)2]− si y concentratia ionilor Ag+ ce rezulta din disocierea ionului complex [Ag(SCN)4]3−.
In solutie trebuie sa fie indeplinite conditiile :
![]() =
=![]()
![]() =
=![]()
Deoarece x si y au valori mici, se poate considera :
0,05 - x = 0,05 si 0,4 -y = 0,4.
Deci : ![]() = 2,76 · 10−2.
= 2,76 · 10−2.
Inlocuind in ![]() se obtine :
se obtine :
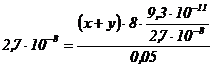 (x + y) =
[Ag+] = 4,9 · 10−8 ion-g / l.
(x + y) =
[Ag+] = 4,9 · 10−8 ion-g / l.
Mascarea unor ioni sub forma de cianuri complexe este larg utilizata la separarea si identificarea unor cationi sub forma de sulfuri. Identificarea ionului Cd2+, ca sulfura de cadmiu galbena intensa, nu poate fi facuta in prezenta Cu2+, deoarece acesta precipita ca sulfura de culoare neagra. Cum se poate identifica totusi ionului Cd2+, ca sulfura de cadmiu, in prezenta Cu2+ ? Explicati aceasta posibilitate de identificare.
Rezolvare:
Daca ionii Cu2+ sunt mascati cu un exces de KCN sub forma de cianura cuproasa [Cu(CN)4]3 , cand are loc si o reducere a Cu2+ la Cu+, atunci ionii Cd2+ pot fi usor pusi in evidenta sub forma de sulfura de cadmiu de culoare galbena.
La adaugarea excesului de KCN, se formeaza [Cu(CN)4]3− (A = 2 · 1030) si [Cd(CN)4]2−(A
Datorita stabilitatii foarte mari a [Cu(CN)4]3−, concentratia ionilor Cu2+ este foarte mica si nu permite formarea de precipitat in mediu puternic acid, nici atunci cand solutia este saturata cu H2S ( [Cu2+] · [S2− < Ps(CuS)).
Stabilitatea mai mica a ionului complex [Cd(CN)4]2− face ca valoarea concentratiei Cd2+ sa fie mai mare decat cea corespunzatoare solutiei saturate de CdS si deci sa se formeze precipitat de CdS de culoare galbena la saturarea solutiei cu H2S.
Ionii Ag+
formeaza cu amoniacul ionii complecsi ![]() si
si ![]() ce au constantele
succesive de formare, K1= 2·103 si K2= 8·103. Sa se
calculeze concentratia ionilor Ag+,
ce au constantele
succesive de formare, K1= 2·103 si K2= 8·103. Sa se
calculeze concentratia ionilor Ag+, ![]() ,
, ![]() si a moleculelor de amoniac in solutia
obtinuta prin amestecarea in volume egale a solutiilor de AgNO3
10−2 mol · l−1 si NH3 10−2
m.
si a moleculelor de amoniac in solutia
obtinuta prin amestecarea in volume egale a solutiilor de AgNO3
10−2 mol · l−1 si NH3 10−2
m.
Rezolvare:
In amestec, ![]() =
= ![]() = 5 ·10−3 m si se stabilesc echilibrele :
= 5 ·10−3 m si se stabilesc echilibrele :
Ag+ + NH3 Ag(NH3)+ A
= K1 = ![]() = 2 · 103
= 2 · 103
Ag+ + 2NH3 Ag(NH3)+ A =
K1 · K2 = ![]() = 1,6 · 107
= 1,6 · 107
Legea conservarii masei pentru argint si pentru amoniac :
![]() = 5 · 10−3
mol /l = [Ag+] + [Ag(NH3)+] + [Ag(NH3)2+]
= 5 · 10−3
mol /l = [Ag+] + [Ag(NH3)+] + [Ag(NH3)2+] ![]() = 5 · 10−3 mol /l = [NH3] + [Ag(NH3)+] + 2[Ag(NH3)2+]
= 5 · 10−3 mol /l = [NH3] + [Ag(NH3)+] + 2[Ag(NH3)2+]
Tinand seama de expresiile constantelor totale de stabilitate A si A , dupa inlocuirea concentratiilor ionilor complecsi se obtine
5 · 10−3 = [Ag+] · ( 1 + A · [NH3] + A · [NH3]2 )
5 · 10−3 = [NH3] + A · [Ag+] · [NH3] + A · [Ag+] · [NH3]2 )
de unde : ![]() =
= ![]()
Dupa inlocuirea valorilor constantelor totale de stabilitate A si A se obtine ecuatia :
1,6 · 107 · [NH3]3 + 8,2 · 104 · [NH3]2 + [NH3] = 5 · 10−3.
Rezolvand ecuatia si tinand seama expresiile A si A se obtine :
[NH3] = 2,357 · 10−4 mol /l , Ag+ = 2,118 · 10−3 ion-g /l ,
Ag(NH3)+ = 0,9986 · 10−3 m si Ag(NH3)2+ = 1,8826 · 10−3 m.
Concentratiile totale ale Pb2+
si Cl− dintr-o solutie sunt : ![]() =5·10−4m si
=5·10−4m si ![]() = 4·10−2 m, iar constantele de formare
succesive ale primilor doi clorocomplecsi au valorile, K1=12,5 si K2=14,5. Sa se calculeze continutul procentual la
echilibru al speciilor : Pb2+, PbCl+ si PbCl2.
= 4·10−2 m, iar constantele de formare
succesive ale primilor doi clorocomplecsi au valorile, K1=12,5 si K2=14,5. Sa se calculeze continutul procentual la
echilibru al speciilor : Pb2+, PbCl+ si PbCl2.
Rezolvare:
Pb2+
+ Cl− PbCl+ K1 = ![]() = 12,5
= 12,5
PbCl+
+ Cl− PbCl2 K2 =![]() = 14,5
= 14,5
Daca se noteaza : [PbCl+] = x si [PbCl2] = y , atunci : [Pb2+] = 0,0005 - x - y si [Cl−] = 0,04 - x - 2y
Inlocuind in expresiile constantelor K1 si K2, si rezolvand sistemul, se obtine :
x = [PbCl+] = 0,000168 mol /l ;
y = [PbCl2] = 0,0000965 mol /l ;
[Pb2+] = 0,04 - x - 2y = 0,000235 mol /l.
La echilibru in solutie exista :
47,1% Pb2+ ; 33,6% PbCl+ ; 19,3% PbCl2
Tinand seama de competitivitatea dintre echilibrul de precipitare al cloruri
de argint si echilibrul de complexare al ionilor de argint cu amoniac,
sa se calculeze care este cantitatea de amoniac ce trebuie
adaugata la o solutie care contine, cAg+ = 4 ·10−3 m,
c![]() = 2 ·10−3 m astfel incat sa nu fie
precipitat de clorura de argint.
= 2 ·10−3 m astfel incat sa nu fie
precipitat de clorura de argint.
Se da Ps(AgCl) = 1,8 · 10 b ([Ag(NH3)2]+) = 1,7 · 107.
Rezolvare:
Concentratia maxima a ionilor de Ag+ liberi care pot exista in solutie, fara a avea loc precipitarea sa ca AgCl, se calculeaza din produsul de solubilitate:
Ps(AgCl)=[Ag+]·[Cl−]=1,8·10−10 [Ag+]liber = 9 · 10−8 ion-g //l.
Pentru a nu se forma precipitat AgCl (sa nu aiba loc precipitarea Ag+) este necesar ca, [Ag+] < 9 · 10−8 ion-g //l.
Aceasta valoare a concentratiei ionilor de Ag+ poate fi asigurata prin complexare, adaugand o cantitate minima de NH3, ce este dictata de stabilitatea ionului complex al Ag+ cu NH3.
Reactia de complexare a Ag+ cu NH3 :
Ag+ + 2NH3 Ag(NH3)2+, b = ![]()
Tinand seama de datele problemei si de cele discutate mai sus :
[Ag(NH3)2+] = 4 · 10−3 - 9 · 10−8 4 · 10−3 mol /l si
[NH3] = 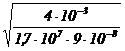 = 5,11 · 10−3
mol/l.
= 5,11 · 10−3
mol/l.
Concentratia totala de amoniac necesara a fi adaugata este egala cu suma concentratiei libere de amoniac si a concentratiei de amoniac folosita la formarea complexului.
c![]() = [NH3] + 2[Ag(NH3)2+]
= 5,11·10−3 + 2·4·10−3 = 1,311 · 10−2
m.
= [NH3] + 2[Ag(NH3)2+]
= 5,11·10−3 + 2·4·10−3 = 1,311 · 10−2
m.
Sa se calculeze constanta echilibrului de dizolvare a bromurii de argint in amoniac si sa se calculeze concentratia minima in NH3 necesara dizolvarii totale a 5 ·10−3 moli AgBr dintr-un litru de solutie.
Se da: Ps(AgBr) = 2 · 10−13; b ([Ag(NH3)2]+) =1,7 · 107.
Rezolvare:
AgBr(s) Ag+ + Br− Ps(AgBr) = [Ag+] · [Br−] =2 · 10−13
Ag++ 2NH3 [Ag(NH3)2]+ b = ![]() = 1,7 · 107
= 1,7 · 107
AgBr(s) + 2NH3 Ag(NH3)2+
+ Br− K = ![]()
Daca se inmulteste si se imparte cu [Ag+] se obtine :
K =![]() ·
·![]() = b · Ps = 1,7·107·2·10
= b · Ps = 1,7·107·2·10
La dizolvarea totala a 5 · 10−3 moli de AgBr rezulta :
cAg+
=5 · 10−3 mol / l si c![]() =5 · 10−3 mol / l.
=5 · 10−3 mol / l.
[Ag+] pentru a nu se forma precipitat este :
[Ag+] = Ps / [Br ] =2 · 10−13 / 5 · 10−3 = 4 ·10−11 mol / l.
In aceste conditii : cAg+ = 5 · 10−2 = [Ag+] + [Ag(NH3)2+], deci Ag(NH3)2+] s 5 · 10-2 ion-g / l.
Din, b = ![]() = 1,7 · 107 rezulta NH3] = 2,71 m
= 1,7 · 107 rezulta NH3] = 2,71 m
si c![]() = [NH3] + 2[Ag(NH3)2+]
=2,71 + 2 ·5 · 10−3 = 2,72 mol / l.
= [NH3] + 2[Ag(NH3)2+]
=2,71 + 2 ·5 · 10−3 = 2,72 mol / l.
Sa se calculeze solubilitatea molara a halogenurilor de argint in solutii de amoniac de concentratii :
1 mol · l−1, 10−1 mol · l−1, 10−2 mol · l−1 si 10−3 mol · l−1.
Sa se reprezinte grafic variatia solubilitati molare a halogenurilor de argint in functie de pNH3 si sa se comenteze graficul.
Se da : Ps(AgCl) = 10−10 ; Ps(AgBr) = 4 · 10−13 ; Ps(AgI) = 10−16 ; ![]() = 1,6 · 103 ;
= 1,6 · 103 ; ![]() = 1,1 · 107.
= 1,1 · 107.
Rezolvare:
Fie AgX halogenura de argint. In solutie se stabilesc echilibrele :
AgX(s) AgX(aq) Ag+ + X− Ps(AgX) = Ag+ · [X−]
Ag+ + NH3 Ag(NH3)+ ![]() =
= ![]()
Ag+ + 2NH3 Ag(NH3)![]()
![]() =
= ![]()
In prezenta ligandului NH3, pot fi fixati o parte din ionii Ag+, determinand o solubilizare a precipitatului.
Daca se noteaza concentratia totala a Ag+ cu ,[Ag+]t = S (solubilitatea molara a AgX), se poate scrie :
S = [Ag+]t
= [Ag+] + [Ag(NH3)+] + [Ag(NH3)![]() ]
]
sau : [Ag+]t =[Ag+]·(1 +![]() ·[NH3] +
·[NH3] + ![]() · [NH3]2 ) = [Ag+] · φ([NH3])
· [NH3]2 ) = [Ag+] · φ([NH3])
[Ag+] = 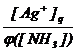 .
.
Tinand seama de relatia produsului de solubilitate al halogenurii de argint, se obtine
S = ![]()
unde φ([NH3]) = ( 1 + ![]() · [NH3] +
· [NH3] + ![]() · [NH3]2
)
· [NH3]2
)
ce depinde numai de valoarea concentratiei amoniacului din solutie si este independenta de halogenura de argint. Dupa cum se vede din relatia ce exprima solubilitatea molara a halogenurilor de argint in solutii amoniacale, solubilitatea molara depinde de natura halogenurii(Ps(AgX)) si de concentratia amoniacului.
Valorile solubilitatilor molare a celor trei halogenuri de argint in solutii de amoniac de 1 mol · l−1, 10−1 mol · l−1, 10−2 mol · l−1 si 10−3 mol · l−1 sunt prezentate in tabelul 2.7.
Tabelul 2.7. Solubilitatea halogenurilor de argint la diferite concentratii de amoniac.
|
S(mol · l−1) |
pNH3 solutie |
|||
AgCl(Ps=1·10−10) | ||||
|
AgBr(Ps = 4 ·10−13) | ||||
|
AgI(Ps = 1 · 10−16) | ||||
La o solutie de acetat de cadmiu 2 ·10−2 mol · l−1 s-a adaugat HCN pana ce concentratia acestuia a fost 2 ·10−2 mol · l−1, iar pH -ul solutiei este 3. Sa se determine daca in ceste conditii, Cd2+ este complexat practic total in ionul complex [Cd(CN)4]2 . Se considera ca nu se modifica volumul solutiei.
Se da : A (Cd(CN)![]() ) = 1017
; Ka(HCN) = 7,2 ·10−10.
) = 1017
; Ka(HCN) = 7,2 ·10−10.
Rezolvare:
Cd2++
4CN− Cd(CN)![]() , A (Cd(CN)
, A (Cd(CN)![]() =
= ![]() = 1017
= 1017
CN−
+ H3O+ HCN + H2O, Ka(HCN)=![]() = 7,2·10−10 CN− = 1,44 · 10−8 ion - g/l.
= 7,2·10−10 CN− = 1,44 · 10−8 ion - g/l.
La stabilirea echilibrului de complexare si complexarea practic totala a Cd2+ sub forma de [Cd(CN)4]2−
Cd2+ = ![]() si Cd(CN)
si Cd(CN)![]()
Inlocuind in A (Cd(CN)![]() CN− = 2,4 ·10−4 ion - g/l.
CN− = 2,4 ·10−4 ion - g/l.
Pentru a se forma complexul [Cd(CN)4]2− este necesar ca valoarea concentratiei ionilor CN− sa fie mai mare decat = 2,4 ·10−4 ion - g/l. Se deduce ca la pH = 3, concentratiei ionilor CN− fiind de numai 1,44 · 10−8 ion - g/l, nu se formeaza complexul [Cd(CN)4]2−.
Complecsii ionului Zn2+ cu
amoniacul au constantele succesive de stabilitate : K1 = 1,51 ·102, K2 = 1,78 ·102, K3 = 2,04 ·102
si K4 = 9,12 ·101.
Sa se calculeze ![]() in solutii de amoniac de concentratie 10−1
mol/l , 10−2 mol/l si 10−3 mol/l. Calculati de asemenea constanta
aparenta de stabilitate a complexonatului Zn2+ cu complexonul
III in solutiile de amoniac mai sus mentionate si la valoarea pH
-lui corespunzator solutiei de amoniac. Trasati graficul
stabilitatii complexonatului ZnY2 in functie de pNH3.
in solutii de amoniac de concentratie 10−1
mol/l , 10−2 mol/l si 10−3 mol/l. Calculati de asemenea constanta
aparenta de stabilitate a complexonatului Zn2+ cu complexonul
III in solutiile de amoniac mai sus mentionate si la valoarea pH
-lui corespunzator solutiei de amoniac. Trasati graficul
stabilitatii complexonatului ZnY2 in functie de pNH3.
Se da : ![]() = 3,16·1016 ;
= 3,16·1016 ; ![]() = 1,82 ·1010,
= 1,82 ·1010, ![]() =1,45·106,
=1,45·106, ![]() = 4,68·102 ,
= 4,68·102 , ![]() = 102 ; Kb(NH3)
= 2·10
= 102 ; Kb(NH3)
= 2·10
Rezolvare:
![]() = 1 + K1·[NH3] + K1· K2·
[NH3]2 + K1· K2· K3· [NH3]3
+ K1· K2· K3· K4 ·[NH3]4.
= 1 + K1·[NH3] + K1· K2·
[NH3]2 + K1· K2· K3· [NH3]3
+ K1· K2· K3· K4 ·[NH3]4.
Inlocuind valorile concentratiei amoniacului se obtine :
![]() (10−1mol/l)
= 5,58 · 104 ;
(10−1mol/l)
= 5,58 · 104 ; ![]() (10−2mol/l) = 15,7;
(10−2mol/l) = 15,7; ![]() (10 mol/l)=1,19.
(10 mol/l)=1,19.
pH -ul solutiilor de amoniac sunt : 11,15( sol. NH3 10−1 mol/l), 10,65( sol. NH3 10−2 mol/l) si 10,12( sol. NH3 10−3 mol/l).
![]() = 1 +
= 1 +![]() ·[H3O+]+
·[H3O+]+![]() ·
·![]() · [H3O+]2 +
· [H3O+]2 + ![]() ·
· ![]() ·
· ![]() · [H3O+]3 +
· [H3O+]3 + ![]() ·
· ![]() ·
· ![]() ·
· ![]() · [H3O+]4.
· [H3O+]4.
Inlocuind valorile constantelor si valoarea concentratiei ionului H3O+ se obtine :
![]() ( pH = 11,15, sol. NH3 10−1 mol/l)
= 1,13 ;
( pH = 11,15, sol. NH3 10−1 mol/l)
= 1,13 ;
![]() ( pH = 10,65, sol. NH3 10−2 mol/l)
= 1,41 ;
( pH = 10,65, sol. NH3 10−2 mol/l)
= 1,41 ;
![]() ( pH = 10,12, sol. NH3 10−3 mol/l)
= 2,38.
( pH = 10,12, sol. NH3 10−3 mol/l)
= 2,38.
Tinand seama de valorile ![]() ,
, ![]() si
si ![]() = 3,16 ·1016 se calculeaza valoarea
constantei aparente de stabilitate a complexonatului Zn2+ cu
complexonul III in solutiile NH3 de concentratiile date cu
relatia :
= 3,16 ·1016 se calculeaza valoarea
constantei aparente de stabilitate a complexonatului Zn2+ cu
complexonul III in solutiile NH3 de concentratiile date cu
relatia :
![]() =
= 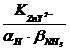
obtinand valorile :
![]() = 5 · 1011(sol. NH3 10−1 mol/l)
;
= 5 · 1011(sol. NH3 10−1 mol/l)
;
![]() = 1,4 · 1015(sol. NH3 10−2 mol/l) ;
= 1,4 · 1015(sol. NH3 10−2 mol/l) ;
![]() = 1,1 · 1016(sol. NH3 10−3 mol/l).
= 1,1 · 1016(sol. NH3 10−3 mol/l).
Cu valorile constantei aparente de stabilitate a complexonatului Zn2+ cu complexonul III in solutiile NH3 calculate, se traseaza graficul cerut.
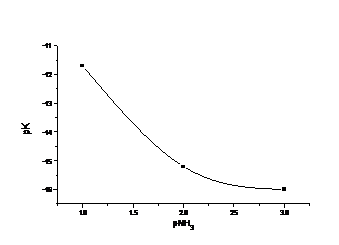
Fig. Solubilitatea complexonatului ZnY2- in functie de pNH3
Ionul Hg2+ formeaza cu ligandul SCN− un complex neutru usor solubil ce are constanta de formare 1,8 · 1017. Concentratia ionilor Hg2+ si a ionilor SCN− in solutia preparata prin amestecarea a 50 cm3 solutie 2 · 10−2 m Hg(NO3)2 cu 50 cm3 solutie KSCN 2 · 10−2 m au valoarea :
a) Hg2+ s 5 ·10−2 ion - g /l si SCN− = 2,36 ·10−8 ion - g /l.
b) Hg2+ s 1 ·10−2 ion - g /l si SCN− = 2,36 ·10−7 ion - g /l.
c) Hg2+ s 5 ·10−3 ion - g /l si SCN− = 2,36 ·10−7 ion - g /l.
d) Hg2+ s 5 ·10−3 ion - g /l si SCN− = 2,36 ·10−9 ion - g /l.
e) Hg2+ s 5 ·10−2 ion - g /l si SCN− = 2,36 ·10−6 ion - g /l.
Constanta echilibrului de dizolvare a clorurii de argint in amoniac, considerand ca se formeaza numai ionul complex Ag(NH3)2 , are valoarea :
a) 2,06 · 101 ; b) 3,06 · 10−1 ; c) 3,06 · 10−3 ; d) 3,06 · 10−4 ;
e) 5,06 · 10−4.
Se da : Ps(AgCl) = 1.8 · 10 A
Concentratia totala de amoniac din solutie necesara dizolvarii totale a 5 · 10−2 moli de clorura de argint intr-un litru de solutie este :
a) 1 mol /l ; b) 1,5 mol /l ; c) 2 mol /l ; d) 2,5 mol /l ; e) 3 mol /l .
Se da : Ps(AgCl) = 1,8 · 10−10 ; A
Ionul Hg2+ formeaza cu ligandul SCN− un complex neutru usor solubil ce are constanta de formare 1,8 · 1017. Valoarea concentratiei ionilor Hg2+ si a ionilor SCN− in solutia preparata prin amestecarea a 50 cm3 solutie Hg(NO3)2 2·10−2 m cu 50 cm3 solutie KSCN 6 ·10 m este
a) Hg2+ s 5,6 ·10−16 ion - g /l si SCN− = 1 ·10−2 ion - g /l;
b) Hg2+ s 5,6 ·10−12 ion - g /l si SCN− = 2,36 ·10−3 ion - g /l;
c) Hg2+ s 5,5 ·10−11 ion - g /l si SCN− = 2,36 ·10−4 ion - g /l;
d) Hg2+ s 5,6 ·10−9 ion - g /l si SCN− = 2,36 ·10−4 ion - g /l;
e) Hg2+ s 5,6 ·10−8 ion - g /l si SCN− = 2,36 ·10−6 ion - g /l.
Fie solutiile de K AgCl2 si de K Ag(CN)2 ce au aceeasi concentratie molara. In care din solutii concentratia ionilor Ag+ este mai mare si de cate ori ?
a) In solutia de K AgCl2 ; 1,3 · 103 ori ;
b) In solutia de K AgCl2 ; 1,3 · 104 ori ;
c) In solutia de K AgCl2 ; 1,3 · 105 ori ;
d) In solutia de K Ag(S2O3) ; 1,3 · 104 ori;
e) In solutia de K Ag(S2O3) ; 1,3 · 103 ori .
Concentratiile ionilor Ag+ si Cl− din solutia K AgCl2 0,1 m sunt :
a) Ag+ = 8,3 ·10−3 ion -g / l si Cl− = 2,7 ·10−1 ion -g / l ;
b) Ag+ = 6,3 ·10−2 ion -g / l si Cl− = 2,7 ·10−1 ion -g / l ;
c) Ag+ = 8,3 ·10−2 ion -g / l si Cl− = 2,7 ·10−2 ion -g / l ;
d) Ag+ = 8,3 ·10−2 ion -g / l si Cl− = 4,7 ·10−1 ion -g / l ;
e) Ag+ = 8,3 ·10−3 ion -g / l si Cl− = 1,7 ·10−2 ion -g / l .
Produsul de solubilitate al PbI2 este 1,1 · 10−9, iar constantele totale de stabilitate ale ionilor complecsi a ionului Pb2+ cu anionul tiosulfat sunt, lg A = 5,13 si lg A = 6,35. Solubilitatea molara Sm a iodurii de plumb in solutie tiosulfat de sodiu 10−1 m este :
a) 7,9 · 10−4 mol / l ; b) 7,9 · 10−3 mol / l ; c) 7,9 · 10−4 mol / l ;
d) 7,9 · 10−5 mol / l ; b) 7,9 · 10−6 mol / l .
Sa se completeze tabelul urmator
|
Nr. crt. |
Ion central |
Ligand |
Ion complex |
Numar de coordinare |
|
Ag+ |
CN | |||
|
Cd2+ |
Cd(NH3)4 | |||
|
Al3+ |
HO | |||
|
I |
HgI4 | |||
|
Fe(CN)6 | ||||
|
Sn4+ |
Sn(C2O4)3 | |||
|
Fe2+ |
CN | |||
|
Cu2+ |
(CH2-NH2)2 |
Constanta totala de stabilitate a ionului complex HgI4 are valoarea 2 · 1030. Se amesteca 50 cm3 solutie KI 0,4 m cu 5 cm3 solutie Hg(NO3)2 0,1 m. Concentratia ionilor I−, Hg2+ si HgI4 din solutia finala are valoarea :
a) [I− = 3,3 ·10−2 m , [Hg2+] = 4 ·10−30
m si [HgI![]() ] = 9,1 ·10−3 m;
] = 9,1 ·10−3 m;
b) [I− = 3,3 ·10−1 m , [Hg2+] = 4 ·10−31
m si [HgI![]() ] = 9,1 ·10−3 m;
] = 9,1 ·10−3 m;
c) [I− = 3,3 ·10−3 m , [Hg2+] = 4 ·10−25
m si [HgI![]() ] = 9,1 ·10−2 m;
] = 9,1 ·10−2 m;
d) [I− = 3,3 ·10−4 m , [Hg2+] = 4 ·10−31
m si [HgI![]() ] = 9,1 ·10−4 m;
] = 9,1 ·10−4 m;
e) [I− = 3,3 ·10−3 m , [Hg2+] = 4 ·10−28
m si [HgI![]() ] = 9,1 ·10−3 m.
] = 9,1 ·10−3 m.
Se da, Ps(Ag Ag(CN)2 A ([Ag(CN)2]−) = 1 · 1021 si
echilibrul : Ag Ag(CN)2 + 2CN− Ag(CN)2
Constanta echilibrul de mai sus are valoarea :
a) 4 · 107 ; b) 4 · 108 ; c) 4 · 109 ; d) 4 · 1011 ; e) 4 · 1012.
Constanta echilibrului, Pb(OH)2(s) + HO−
![]() , este 5·10−2.
, este 5·10−2.
Concentratiile molare
ale ionului ![]() in solutii
saturate cu Pb(OH)2(s) ce au pH - ul solutiei 10, 11, 12
si 13 sunt :
in solutii
saturate cu Pb(OH)2(s) ce au pH - ul solutiei 10, 11, 12
si 13 sunt :
a) 5 · 10−9 ion - g /l (pH = 10), 5 · 10−8 ion - g /l (pH = 11),
5 · 10−7 ion - g /l (pH = 12) si 5 · 10−6 ion - g /l (pH = 13).
b) 8 · 10−8 ion - g /l (pH = 10), 5 · 10−6 ion - g /l (pH = 11),
8 · 10−5 ion - g /l (pH = 12) si 5 · 10−4 ion - g /l (pH = 13).
c) 5 · 10−7 ion - g /l (pH = 10), 5 · 10−6 ion - g /l (pH = 11),
5 · 10−5 ion - g /l (pH = 12) si 5 · 10−4 ion - g /l (pH = 13).
d) 9 · 10−6 ion - g /l (pH = 10), 9 · 10−5 ion - g /l (pH = 11),
9 · 10−4 ion - g /l (pH = 12) si 9 · 10−3 ion - g /l (pH = 13).
e) 5 · 10−6 ion - g /l (pH = 10), 5 · 10−5 ion - g /l (pH = 11),
5 · 10−4 ion - g /l (pH = 12) si 5 · 10−3 ion - g /l (pH = 13).
Constanta
echilibrului, Pb(OH)2(s) + HO−
![]() , este 5·10−2. Stiind ca valoarea produsului de
solubilitate a Pb(OH)2 este 1,1·10−20, valoarea
constantei de formare a ionului
, este 5·10−2. Stiind ca valoarea produsului de
solubilitate a Pb(OH)2 este 1,1·10−20, valoarea
constantei de formare a ionului ![]() din Pb2+
si HO− este :
din Pb2+
si HO− este :
a) 1,82 · 1018 ; b) 1,82 · 1016 ; c) 1,82 · 1015 ;
d) 1,82 · 1014 ; e) 1,82 · 1012.
Se dau constantele totale de
instabilitate ![]() = 2,7 · 10−8 si
= 2,7 · 10−8 si ![]() = 9,3 · 10−11.
Concentratiile ionului Ag+ din solutia K
= 9,3 · 10−11.
Concentratiile ionului Ag+ din solutia K![]() 0,5m si din
solutia K3
0,5m si din
solutia K3![]() 0,4m au
valoarea :
0,4m au
valoarea :
a) 1,8· 0−2 ion-g /l in ambele solutii ;
b)
1,8·10−2
ion-g /l(K![]() ) si 8,8·10−3 ion-g /l(K3
) si 8,8·10−3 ion-g /l(K3![]() );
);
c)
1,8·10−3
ion-g /l(K![]() ) si 2,7·10−3 ion-g /l(K3
) si 2,7·10−3 ion-g /l(K3![]() );
);
d)
1,8·10−4
ion-g /l(K![]() ) si 2,7·10−3 ion-g /l(K3
) si 2,7·10−3 ion-g /l(K3![]() );
);
e)
1,8·10−3
ion-g /l(K![]() ) si 2,7·10−4 ion-g /l(K3
) si 2,7·10−4 ion-g /l(K3![]() ).
).
Valoarea concentratiei minime de KCN la care nu se mai poate identifica Cu2+ dintr-o solutie 10−2 ion - g /l cu hidrogen sulfurat la pH = 0 este :
a) 1,33 · 10−2 m ; b) 1,33 · 10−3 m ; c) 1,33 · 10−4 m ;
d) 1,33 · 10−5 m ; e) 1,33 · 10−6 m.
Se da : A ([Cu(CN)4]3−) = 2 · 1030 ; S2− = 10−22 ion - g /l ; Ps(Cu2S) = 2,5 · 10−48.
Zincul formeaza cu amoniacul ionul
complex ![]() , ce are constanta totala de stabilitate 5 · 108
la 25 0C. Concentratia
ionului Zn2+ in solutie 10−3 m in ioni Zn2+
total dizolvat si 2,5 m in amoniac total dizolvat este :
, ce are constanta totala de stabilitate 5 · 108
la 25 0C. Concentratia
ionului Zn2+ in solutie 10−3 m in ioni Zn2+
total dizolvat si 2,5 m in amoniac total dizolvat este :
b) ion-g /l ; b) 5,1·10 ion-g /l ; c) 5,1·10 ion-g /l ;
d) 5,1 · 10 ion-g /l ; e) 5,1 · 10 ion-g /l.
Concentratia la echilibru a ionilor Cu2+ liberi in solutia preparata prin dizolvarea a 0,05 moli CuSO4 intr-un litru de solutie NH3 4 m are valoarea :
a) 6,2·10−19 ion-g / l ; b) 6,2·10−18 ion-g / l ; c) 6,2· 0−17 ion-g / l ;
d) 6,2·10−16 ion-g / l ; e) 6,2·10−15 ion-g / l.
Se da : ![]() ([Cu(NH3)4]2+) = 2,6 · 10−13.
([Cu(NH3)4]2+) = 2,6 · 10−13.
Concentratia ionilor Cu2+ necomplexati la echilibru in solutia preparata prin dizolvarea a 2 · 10−3 moli CuSO4 intr-un litru de solutie NH3 1 m are valoarea :
a) 5,4·10−16 ion-g / l ; b) 5,4·10−15 ion-g / l ; c) 5,4· 0−14 ion-g / l ;
d) 5,4·10−13 ion-g / l ; e) 5,4·10−12 ion-g / l.
Se da : b ([Cu(NH3)4]2+) = 3,85 · 1012.
Sa se completeze urmatorul tabel :
|
Nr. crt. |
Echilibru de complexare |
Expresia constantei totale de stabilitate |
|
Hg2+ + HgI4 | ||
|
Ni2+ + 6NH3 |
A |
|
|
Ag(S2O3)2 + | ||
|
A = |
||
|
Cu(OH)4 + | ||
|
+ AlF6 | ||
|
+ |
A = |
Ionii de argint formeaza cu cianurile
alcaline, ionul complex [Ag(CN)2]− ce are constanta
totala de instabilitate, ![]() = 1,8·10 .
Cantitatea de cianura de potasiu (mol / l) care trebui adaugata la un
litru de solutie care contine 10−3 moli AgNO3,
astfel incat concentratia la echilibru a ionilor de argint sa
fie mai mica decat 10−20 ion-g /l are valoarea :
= 1,8·10 .
Cantitatea de cianura de potasiu (mol / l) care trebui adaugata la un
litru de solutie care contine 10−3 moli AgNO3,
astfel incat concentratia la echilibru a ionilor de argint sa
fie mai mica decat 10−20 ion-g /l are valoarea :
b) 1,36 · 10−5 mol /l ; b) 1,36 · 10−4 mol /l ; c) 1,36 · 10−3 mol /l ;
d) 1,36 · 10−2 mol /l ; e) 1,36 · 10−1 mol /l.
![]() intr-o solutie in
care concentratia ionilor H3O+ este 10 n pentru
complexonati derivati de la complexonul III are valoarea :
intr-o solutie in
care concentratia ionilor H3O+ este 10 n pentru
complexonati derivati de la complexonul III are valoarea :
a) 1,78 · 109 ; b) 2,78 · 108 ; c) 3,78 · 107 ;
d) 4,78 · 107 ; e) 5,78 · 106.
Valoarea concentratiei ionilor Ca2+, la pH = 4, dintr-o solutie a complexului CaY2− de concentratie 10−2 mol · l−1 este :
a) 7,4 · 10−3 mol · l−1 ; b) 9,4 · 10−3 mol · l−1 ; c) 1,2 · 10−2 mol · l−1 ;
d) 1,6 · 10−2 mol · l−1 ; e) 2,2 · 10−2 mol · l−1.
Se da: ![]() =5,01·1010;
=5,01·1010; ![]() =1,82·1010;
=1,82·1010; ![]() =1,45·106;
=1,45·106; ![]() =4,68·102;
=4,68·102; ![]() =102.
=102.
5. Raspunsuri la intrebari si probleme propuse
Raspunsuri la intrebari
|
Intrebarea |
Raspunsul corect |
||||
|
a |
b |
c |
d |
e |
|
|
a | |||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a |
a | ||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a |
|||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a |
a | ||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a |
a | ||||
|
a |
a |
||||
|
a | |||||
Raspunsuri la probleme propuse
|
Problema |
Raspunsul corect |
||||
|
a |
b |
c |
d |
e |
|
|
a | |||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a |
|||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a |
|||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a | |||||
|
a |
|||||
|
a | |||||
|
a | |||||
Copyright © 2025 - Toate drepturile rezervate