 | Aeronautica | Comunicatii | Constructii | Electronica | Navigatie | Pompieri |
| Tehnica mecanica |
Elemente de termodinamica
1. Sisteme, marimi si procese termodinamice. Temperatura, energia interna, caldura
2. Principiul zero al termodinamicii si echilibrul termic
3. Ecuatiile de stare pentru gazul ideal
4. Ecuatiile de stare pentru gazul real
5. Principiul I al termodinamicii
6. Entropia si principiul al II-lea al termodinamicii
7. Principiul al III-lea al termodinamicii
8. Procese izotrope ale gazului ideal
Procese ciclice. Ciclul Carnot
10. Masinile termice si randamentul lor
1. Sisteme, marimi si procese termodinamice
Definitie: Termodinamica este acea parte a fizicii care studiaza miscarea termica a materiei in particular procesele de schimb de caldura dintre obiectul studiat si mediul inconjurator fara a apela insa la reprezentarea moleculara.
Deci, putem spune ca termodinamica se ocupa de studiul acelorasi fenomene ca si teoria cinetico moleculara dar nu din punctual de vedere al mecanismelor, ci al schimburilor de energie, care au loc in decursul acestor fenomene. La baza deducerilor termodinamice stau cele mai generale legi ale naturii, denumite principii. Aceste principii reprezinta o generalizare a rezultatelor activitatii umane.
Obiectul de studio al termodinamicii il constituie sistemele.
Definitie: Un corp (sau un ansamblu de corpuri) de dimensiuni macroscopice, cu volum determinat reprezinta un sistem termodinamic.
Sistemul termodinamic este un sistem fizic compus dintr-un numar mare dar finit de componenti de exemplu molecule si atomi care se gasesc intr-o continua miscare. Spatiul ocupat de sistem poate fi delimitat fie de o granita (sau frontiera) materiala (reala) cu pereti rigizi sau elastici, fie de o granita imaginara. Aceasta delimitare a spatiului se face astfel incat sistemul termodinamic sa se comporte ca un tot unitar iar interactiunile interioare sa se poata deosebi de cele exterioare.
Clasificarea sistemelor termodinamice:
Izolate: nu schimba cu exteriorul nici energie si nici materie.
Inchise: poate schimba cu exteriorul energie dar nu schimba materie.
Deschise: schimba cu exteriorul atat energie cat si materie.
Un sistem termodinamic se poate caracteriza prin definirea starii sistemului termodinamic.
Definitie: Prin starea unui sistem termodinamic intelegem totalitatea proprietatilor lui fizice la un moment in situatia de echilibru si este determinata de numarul parametrilor macroscopici independenti.
Pentru a caracteriza in mod univoc starea sistemului termodinamic trebuie stabilit acest numar minim de marimi fizice ce poarta numele de parametrii de stare.
Definitie:
Parametrii de stare ai unui sistem
termodinamic exprima proprietati mecanice, termice
electrice, magnetice, chimice etc. ale sistemului stu-
diat.
Definitie: Starea unui sistem termodinamic
este statica sau de echilibru daca parametrii sistemu-
lui nu variaza in timp.
Definitie: Orice schimbare a starii sistemului
termodinamic se numeste transformare de stare sau
proces de stare.
Fig. 1 Sisteme termodinamice
cu volum fix sau frontiera elastica.
Definitie: O transformare se numeste cvasistatica daca sistemul temodinamic evolueaza dintr-o stare de echilibru in alta stare de echilibru prin stari intermediare de echilibru, astfel ca parametrii termodinamici evolueaza foarte lent in timp.
 Definitie: O transformare
se numeste reversibi-
Definitie: O transformare
se numeste reversibi-
la daca sistemul revine la starea initiala exact prin
aceleasi stari ca si la transformarea directa.
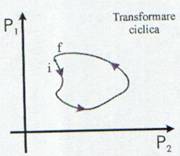
Definitie: O transformare se numeste ciclica da-
ca starea finala coincide cu starea initiala.
Fig. 2 Transformare ciclica.
Proprietatile termodinamice
Se pot masura direct (presiune p, volumul V, temperatura T, numarul de kilomoli, v);
Sunt determinate indirect (energia interna U, entropia S);
Proprietatile termodinamice pot fi
Extensive (depind de dimensiunea sistemului): volumul V, energia interna U, entropia S.
Intensive (nu depind de dimensiunea sistemului): presiunea p, temperatura T.
Marimile termodinamice pot fi:
De stare: presiune p, volumul V, energia interna U, entropia S.
De proces: caldura Q, lucrul mecanic L.
Temperatura
Definitie: Temperatura este acea proprietate a sistemului termodinamic care determina daca acesta este in echilibru termodinamic sau nu.
Conceptul de temperatura are la baza ideea de masurare relativa a incalzirii sau racirii unui corp legata de observatia experimentala ca daca
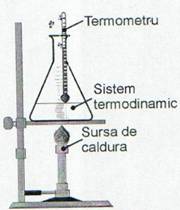 acesta primeste o cantitate de caldura atunci tem-
acesta primeste o cantitate de caldura atunci tem-
peratura acestuia creste. Cateva dintre cele mai cu-
noscute, si cel mai des folosite scari de temperatura
sunt: Celsius, Kelvin, Fahrenheit si Rankine.Trans-
formarile dintre ele sunt date de relatiile:
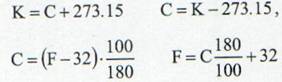 (1)
(1)
Fig. 3 Transferul de caldura
poate duce la cresterea tempe-
raturii unui sistem termodinamic.
Energia interna
Particulele componente ale corpurilor executa o miscare continua si deci poseda o anumita cantitate de energie cinetica dar in acelasi timp interactioneaza si intre ele si o anumita cantitate de energie potentiala.
Definitie: Suma tuturor energiilor cinetice (de oscilatie, rotatie sau translatie) datorate miscarilor dezordonate ale particulelor constituente ale unui sistem termodinamic si ale energiilor potentiale de interactiune reprezinta energia interna, U.
![]() (3)
(3)
Moleculele sau atomi se pot gasi in diferite microstari energetice, iar energia medie a unei microstari se poate scrie ca:
![]()
(4)
unde Pi reprezinta probabilitatea ca molecula sa posede energia εi. Daca sistemul are N molecule atunci energia interna va fi data de:
![]() (5)
(5)
Caldura
Definitie: Energia cedata sau primita de un corp care duce la variatia energiei sale interne se numeste cantitate de caldura sau simplu caldura.
Definitie: Procesul de variatie al energiei interne, care are loc fara a se efectua un lucru mecanic se numeste schimb de caldura.
Cantitatea de caldura primita (sau cedata) de un corp poate fi folosita pentru:
 ● Ridicarea sau coborarea
temperaturii cor-
● Ridicarea sau coborarea
temperaturii cor-
pului - caldura sensibila;
● Trecerea corpului dintr-o stare de agregare
in alta - caldura latenta;
● Efectuarea unui lucru mecanic de catre
corp;
Fig. 4 Pompa de caldura
Caldura specifica
Definitie: Cantitatea de caldura necesara pentru a incalzi o unitate de masa dintr-o substanta astfel incat temperatura ei sa varieze cu 1 K (1sC) se numeste caldura specifica.
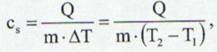
(6)
astfel caldura schimbata de un corp cu mediul inconjurator este:
![]()
(7)
Caldura specifica depinde de felul procesului:
cv - caldura specifica la volum constant;
cp - caldura specifica la presiune constanta;
Caldura latenta
Definitie: Cantitatea de caldura ce revine unitatii de masa a undei substante pentru a trece dintr-o stare in alta stare la temperatura constanta, se numeste caldura latenta.
![]()
(8)
de unde cantitatea de caldura este:
![]()
(9)
Unitatea de masura este:
![]()
(10)
2. Principiul zero al termodinamicii si echilibrul termic
Un sistem in echilibru termodinamic isi poate modifica stare prin interactiune cu mediul inconjurator. Interactiunile pot fi: mecanice (comprimarea unui gaz), electrice (polarizarea unui dielectric), magnetice (magnetizarea unei substante), schimb de substanta (prin modificarea numarului de kilomoli).
 Postulat: Un sistem izolat ajunge intotdea-
Postulat: Un sistem izolat ajunge intotdea-
una dupa un interval de timp in starea de echi-
libru termodinamic si nu poate iesi niciodata
de la sine din aceasta stare.
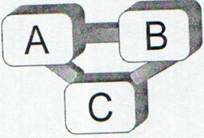
Astfel daca avem doua sisteme termodina-
mice A si B puse in contact termic si daca un al
treilea sistem termodinamic C este si el pus in
Fig. 5 Sistemele termodinami- contact termic si ajunge la echilibru termodina-
ce, A, B si C aflate in contact mic cu A si separat cu B atunci inseamna ca si
termic sunt caracterizate de sistemele termodinamice A si B sunt in echilibru
aceeasi temperatura. termodinamic.
Enuntul principiului zero al termodinamicii: Intr-un sistem izolat, format din n corpuri aflate in contact termic, conditia necesara si suficienta de echilibru termodinamic este ca toate cele n corpuri sa aiba aceeasi temperatura.
3. Ecuatiile de stare pentru gazul ideal
Ipotezele care ne permit sa consideram un gaz ca fiind un gaz ideal:
Moleculele gazului sunt sferice;
Dimensiunile sunt neglijabil de mici in raport cu distanta dintre ele;
Ciocnirea dintre ele este elastica si intr-un timp infinit scurt;
Cu exceptia ciocnirilor nu interactioneaza intre ele;
Pentru un astfel de ansamblu de molecule care se gasesc in continua miscare dezordonata se poate stabili experimental urmatoarea ecuatie de stare care leaga parametrii de stare intre ei:
![]()
(11)
unde V este volumul gazului, p - presiunea acestuia, T - temperatura, R - constanta universala a gazelor si v - numarul de kilomoli:
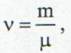
(12)
unde μ este masa molara. Valoarea constantei universale a gazelor este data de:
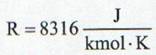
(13)
Pentru un amestec de gaze ecuatia de stare are aceeasi expresie.
Definitie: Presiunea pe care ar exercita-o un gaz perfect care ar ocupa singur tot volumul gazului in care se afla se numeste presiune partiala.
Legea lui Dalton
Definitie: Presiunea exercitata de mai multe gaze ideale care ocupa acelasi volum este suma presiunilor partiale.
![]() (14)
(14)
Numarul de kilomoli al unui amestec este suma numarului de kilomoli al fiecarui component:
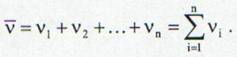
(15)
Fractia molara a componentelor se poate defini ca:
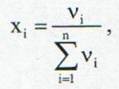
(16)
astfel incat:
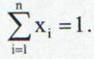
(17)
Daca μi este masa molara a fiecarui component al amestecului atunci masa molara a amestecului este:
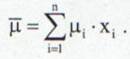
(18)
Ecuatia de stare pentru un amestec de gaze ideale se scrie:
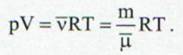
(19)
Copyright © 2025 - Toate drepturile rezervate