 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Clasificarea cationilor pe grupe analitice
Cationii se clasifica in 5 grupe analitice conform tabelului de mai jos :
|
Grupa analitica |
I |
II |
III |
IV |
V |
|
Reactivul de grupa |
HCl |
H2S |
(NH4)2S |
(NH4)2CO3 |
fara reactiv de grupa |
|
Cationii mai importanti ai grupelor |
Ag+ Hg22+Pb2+ |
Hg2+ ; Pb2+ Cu2+ ; Cd2+ As(III,V) Sb(III,V) Sn(II,IV) Bi3+ |
Co2+ ; Ni2+ Zn2+ ; Mn2+ Fe2+ ; Fe3+ Al3+ ; Cr3+ |
Ca2+ Sr2+ Ba2+ |
Na+ K+ NH4+ Mg2+ |
Pentru a realiza o separare riguroasa a cationilor pe grupe analitice, trebuie respectate urmatoarele conditii :
sa se lucreze in limitele de concentratie impuse de metoda adoptata ;
sa se creeze conditiile optime de precipitare (pH, temperatura, concentratia reactivilor, etc.) ;
sa se efectueze precipitarea completa cu reactivul grupei in mic exces, care sa micsoreze concentratia ionului de determinat sub limita de recunoastere (la adaugarea primei picaturi de reactiv care nu mai produce precipitare, aceasta se considera completa);
se evita un exces mare de reactiv precipitant care mareste solubilitatea precipitatului, prin complexare sau datorita tariei ionice ;
spalarea precipitatului cu o solutie diluata (1:10) a reactivului precipitant in conditiile de precipitare (pH, temperatura), prima apa de spalare adaugandu-se solutiei ce contine grupele urmatoare;
Analiza chimica calitativa se efectueaza in mai multe etape, fiecare dintre ele trebuind sa se integreze perfect in ansamblu, realizandu-se astfel posibilitatea unor concluzii riguroase, sigure.
Astfel, analiza chimica calitativa de cationi cuprinde urmatoarele etape :
1.Analiza orientativa sau preliminara, cuprinde urmatoarele faze :
a). Analiza orientativa asupra substantei in stare solida :
aspectul substantei ,
reactii de orientare pentru cationi ,
comportarea la dizolvare in apa a probei ,
b). Analiza orientativa asupra substantei aflate in solutie, cu urmatoarele faze :
identificarea unor cationi din solutia initiala.
2.Analiza propriu-zisa :
- separarea si identificarea cationilor.
3.Rezultate si concluzii.
a). Analiza orientativa asupra substantei in stare solida
Aspectul substantei - este cel dintai indiciu asupra compozitiei probei. Culoarea, forma cristalelor, higroscopicitatea pot oferii indicatii utile asupra desfasurarii in continuare a analizei, permitand uneori, ocolirea unor etape si deci, simplificarea mersului analizei.
În tabelul de mai jos este redata culoarea unor ioni mai uzuali care, de obicei, imprima sarurilor lor culoarea. În unele cazuri si ionii incolori se prezinta sub forma de saruri slab colorate Hg2(NO3)2 AgCl3-saruri de culoare galbui).
|
Ion |
Cu(H2O)42+ |
Cr(H2O)X3+ |
Fe(H2O)63+ |
|
Culoare |
albastru |
verde inchis sau violet |
galben |
|
Ion |
Fe(CN)63- |
Fe(CN)64- |
CrO42- |
|
Culoare |
portocaliu |
galbui |
galben |
|
Ion |
Fe(H2O)62+ |
Co(H2O)62+ |
Mn2+ |
|
Culoare |
verzui |
roz intens |
rosu slab |
|
Ion |
Cr2O72- |
MnO4- |
Ni(H2O)62+ |
|
Culoare |
portocaliu |
violet |
verde |
x - in functie de numarul de molecule de apa legate direct de atomul de crom, culoarea se modifica de la verde inchis la violet ametist.
Se va tine seama de interferentele culorilor ionilor prezenti si de anumite transformari care pot avea loc chiar in amestec, mai ales la contact indelungat al acestuia cu mediul de laborator.
Saruri higroscopice formeaza ionii : Zn2+, Ca2+, Mg2+, mai ales clorurile acestora, apoi azotatii.
* Reactii de orientare pentru cationi
Aceste reactii au la baza transformarea cationilor in compusi volatili, usor identificabili sau in compusi colorati specific.
Dintre reactiile de orientare pentru cationi, mai des intalnite sunt :
- incalzirea in tub inchis : prin aceasta operatie se urmareste stabilitatea compusului, volatilitatea si reziduul obtinut, incalzindu-se progresiv substantele de analizat intr-un tub inchis la capat, deci in prezenta unei cantitati foarte mici de aer. Reziduul obtinut poate indica prezenta unor substante organice cu mai mult de doi atomi de carbon in molecula, sau transformarea unor saruri, in oxizi de alta culoare (de exemplu azotatii de Cr3+, Mn2+, Co2+, Ni2+, Cu2+, etc.). De asemeni, informatii deosebit de importante despre cationii formati in amestec ne pot da culoarea sublimatelor obtinute (de exemplu sublimatul alb indica prezenta sarurilor de amoniu, a clorurii si bromurii mercurice, a trioxidului de arsen si de stibiu; sublimatul cenusiu indica prezenta mercurului; sublimatul galben indica prezenta sulfurii de arsen si a iodurii mercurice; sublimatul negru indica prezenta sulfurii mercurice, a arsenului si a iodului, etc.).
- incalzirea pe carbune : aceasta operatie consta in aducerea flacarii oxidante sau reducatoare, cu ajutorul unui suflator de gura, deasupra unei cantitati foarte mici de substanta, aflata intr-o scobitura efectuata pe o bucata de carbune obisnuit (mangal). În functie de culoarea reziduului obtinut, prezenta sau absenta aureolei de diferite culori poate da de asemeni indicatii pretioase asupra prezentei unor anumite elemente.
- formarea perlelor : aceasta operatie consta in topirea unor elemente cu borax sau cu fosfat, obtinandu-se sticle diferit colorate in functie de elementul prezent in amestec. De asemeni culoarea perlelor obtinute este in functie de caracterul oxidant sau reducator al flacarii in care este obtinuta perla (de exemplu Co2+ formeaza perle de culoare albastra atat in flacara oxidanta cat si reducatoare, atat la cald cat si la rec ; Cu2+ formeaza perle de culoare verde in flacara reducatoare, atat la cald cat si la rece, iar in flacara oxidanta se obtine o perla de culoare albastra la rece si verde la cald).
- coloratia flacarii : in aceasta reactie se observa culoarea pe care o imprima unei flacari incolore de gaz, sarurile volatile aduse la incandescenta. Coloratia flacarii este foarte pretioasa mai ales in analiza substantelor simple, deoarece in analiza de amestecuri, culorile suprapunandu-se, pot fi greu observate cu ochiul liber. În aceste cazuri este de preferat sa se utilizeze un spectroscop, cu ajutorul caruia se poate observa cu mare precizie prezenta elementelor in amestec. Coloratia flacarii data de cationii mai des intalniti in practica analitica este redata in tabelul de mai jos :
|
Ionul |
Ca2+ |
Sr2+ |
Ba2+ |
Na+ |
K+ |
Cu2+ |
|
Coloratia flacarii |
rosu deschis |
rosu intens |
galben verzui |
galben intens |
violet |
verde inchis |
Sodiul coloreaza flacara chiar cand se afla in cantitati de 10 mg, interferand potasiul. Pentru determinarea potasiului se absoarbe culoarea datorata ionului de sodiu printr-o sticla de cobalt, albastru inchis.
b). Analiza orientativa asupra substantei aflate in solutie.
Aceasta analiza ofera de asemeni indicatii asupra prezentei sau absentei unor ioni in proba. Aceasta analiza se realizeaza urmarind comportamentul substantei de analizat fata de apa si acizi.
- comportamentul fata de apa : in cazul in care substanta este solubila in apa, din amestecul de analizat lipsesc cationii cu caracter bazic, care cu apa formeaza saruri bazice, asa cum sunt cationii de Bi3+, Sn2+, Sb3+ si intr-o masura mai mica cationii de Fe3+, Hg22+, Al3+ etc. De asemeni din amestecul de analizat lipsesc sarurile greu solubile cum ar fi : carbonati, fosfati, cromati ai cationilor grupelor analitice I-IV si Mg2+. Solubilitatea in apa se verifica si la cald. La incalzire gradul de hidroliza creste, fapt observabil printr-o precipitare mai abundenta; in consecinta se poate deosebi o hidroliza de o insolubilizare a substantei. Masurand pH-ul probei in apa (indiferent daca e solutie sau nu), se pot primi indicatii pretioase privind comportarea hidrolitica a cationilor si anionilor astfel: un pH mic indica predominanta unor cationi cu caracter slab bazic cum ar fi Fe3+, Al3+, iar un pH > 7 indica predominanta unor anioni cu caracter bazic mai pronuntat. Coexistenta celor doua tipuri de ioni in solutie, nu duce la valori semnificative ale pH-ului.
- comportarea fata de acizi : daca substanta nu e solubila in apa, se aciduleaza cu acid azotic 2N; hidroliza este regresata si sarurile greu solubile amintite anterior se vor dizolva daca nu sunt prea vechi. În aceasta solutie se verifica pe o portiune mica, prezenta grupei I-a de cationi. Daca nu este prezenta, se reia dizolvarea substantei in HCl 2N.
Analiza propriu-zisa consta in separarea si identificarea ionilor prezenti in amestec. Separarea si identificarea cationilor precum si identificarea anionilor se face pe baza proprietatilor chimice a fiecarui ion in parte, asa cum vor fi ele studiate, in capitolele ce urmeaza, pe grupe analitice.
Activitatea practica
În cadrul analizei preliminare, se va urmarii identificarea orientativa a unor cationi prin coloratia flacarii si formarea perlelor; se vor face de asemeni, tot in cadrul analizei preliminare, teste de solubilitate a substantelor anorganice studiate, fata de apa si diferiti acizi organici.
Observatiile referitoare la toate modificarile si fenomenele observate, vor fi notate, in asa fel incat pe baza lor sa se poata trage concluzii concludente asupra comportamentului substantelor anorganice solide studiate, precum si a speciilor existente in acestea.
Generalitati
Grupa I-a analitica, are drept reactiv de grupa acidul clorhidric, fiind grupa urmatorilor cationi : Hg22+, Ag+, Pb2+, care se separa sub forma de cloruri insolubile:
Hg2Cl2 , AgCl , PbCl2.
Conditii de precipitare :
- pH-ul este pH-ul reactivului de grupa ( HCl ), in exces mai mic de 10 M.
- temperatura : la rece sau temperatura camerei.
Greutatea atomica 107,880 ; Valenta +1 , +2 ; Numar de ordine 47
1. Reactia cu HCl
- precipita, in solutii neutre si acide, clorura de argint, un precipitat alb branzos, care se depune in solutiile concentrate sau care formeaza solutii coloidale, in cele diluate.
( Ag+ + NO3 + ( H+ + Cl = AgCl + ( H+ + NO3
- clorura de argint este insolubila in apa, la incalzire. Sub actiunea luminii (a razelor solare), se descompune partial in clor si argint, cu formarea unui produs de absorbtie intre argintul in stare coloidala si clorura de argint ramasa nedescompusa (precipitatul se innegreste).
- clorura de argint este solubila in diferiti reactivi cum ar fi : ( NH4 )2CO3, NH4OH, cu care formeaza combinatii complexe solubile :
AgCl + [2(NH4+)+CO32 ] = [Ag(NH3)2]+Cl + CO2 + H2O
AgCl + 2(NH4++OH ) = [Ag(NH3)2]+Cl + 2H2O
- adaugand la solutia complexului (clorura diamino argentica), acidul azotic diluat, pana la reactia acida, are loc reprecipitarea clorurii de argint :
( Ag(NH3)2+ + Cl- ) + 2( H+ + NO3- ) = AgCl + 2( NH4+ + NO3- )
2. Reactia cu (NH4)I
- iodura de argint este insolubila in carbonat si hidroxid de amoniu, si este solubila in tiosulfat de sodiu si cianura de potasiu, cu formarea urmatorilor complecsi : Na3[Ag(S2O3)2] si K[Ag(CN)2].
3. Reactia cu K2CrO4
Cromatul de potasiu precipita din solutiile sarurilor de argint, cromatul de argint, de culoare rosu-brun :
2Ag+ + (2K+ + CrO42-) = Ag2CrO4 + 2K+
4. Reactia cu NaOH
Hidroxidul de sodiu precipita din solutiile sarurilor de argint, oxidul de argint Ag2O, si nu hidroxidul :
2Ag+ + 2OH- = Ag2O + H2O
5. Reactia cu H2S
Atat in mediu acid, cat si in mediu bazic, solutiile sarurilor de argint, precipita sulfura de argint, un precipitat negru-brun :
2Ag+ + H2S = Ag2S + 2H+
Greutatea atomica 200 ; Valenta +2, +1 ; Numarul de ordine 80
Mercurul formeaza saruri mercuroase, in care aparent este monovalent (format din molecule duble), si saruri mercurice in care este bivalent :
Hg2(NO3)2 Hg(NO3)2
Se observa ca in azotatul mercuros, mercurul este de asemenea bivalent, dar are o legatura intre atomii de mercur, astfel incat el apare monovalent, de aceea scrierea corecta a azotatului mercuros este : Hg2(NO3)2.
1. Reactia cu HCl
Acidul clorhidric diluat precipita din solutiile sarurilor mercuroase, clorura mercuroasa (calomelul) Hg2Cl2, un precipitat alb care se innegreste in timp datorita descompunerii sale:
(Hg2 2+ + 2NO3-) + 2 (H+ + Cl- ) = Hg2Cl2 + 2(H+ + NO3-)
![]() Hg2Cl2 HgCl2 +
Hg
Hg2Cl2 HgCl2 +
Hg
clorura mercuroasa este insolubila in apa, la cald, este de asemeni insolubila in NH4OH cu care reactioneaza formand clorura amino-mercurica de culoare alba, si mercur metalic, negru, intregul precipitat avand culoare cenusie:
Hg2Cl2 + 2(NH4+ + OH-) = Cl-Hg-NH2 + Hg + 2H2O + (NH4+ + Cl-)
clorura mercuroasa este solubila in HNO3 concentrat sau diluat, la cald:
3Hg2Cl2 + 8HNO3 = 3HgCl2 + 3Hg(NO3)2 + 2NO + 4H2O.
2. Reactia cu NH4I
Iodura de amoniu precipita din solutiile sarurilor mercuroase, iodura mercuroasa, de culoare verde inchis, solubila in exces de reactiv:
Hg2 2+ + 2I- = Hg2I2
Hg2I2 + 2 (NH4+ + I-) = [HgI4](NH4)2 + Hg.
la adaugarea in exces a iodurii de amoniu, se observa modificarea culorii precipitatului, din verde inchis in gri datorita solubilizarii iodurii mercuroase si formarii in acelasi timp de mercur metalic.
3. Reactia cuK2 CrO4
Cromatul de potasiu precipita din solutiile sarurilor mercuroase, cromatul mercuros, de culoare rosu-aprins:
Hg2 2+ + (2K+ + CrO4 -2) = Hg2CrO4 + 2K+.
4. Reactia cu NaOH
Hidroxidul de sodiu precipita din solutiile sarurilor mercuroase, oxidul mercuros, de culoare neagra, solubila in HNO3 concentrat si CH3COOH concentrat:
Hg2 2+ + 2HO- = Hg2O + H2O
5. Reactia cu H2S.
Hidrogenul sulfurat precipita din solutiile sarurilor mercuroase, sulfura mercurica si mercur metalic, obtinandu-se un precipitat de culoare neagra:
Hg22+ + H2S = HgS + Hg+ 2H+
Greutatea atomica 207,21; Valenta 2+, 4+; Nr. de ordine 82.
1. Reactia cu HCl
Ionul clorura din acid clorhidric sau din alte cloruri, precipita la rece, clorura de plumb, un precipitat alb format din cristale aciculare; acesta se dizolva in apa, la fierbere, recristalizand la racire tot sub forma de ace stralucitoare sau in foite:
(Pb2+ + 2NO3-) + 2 (H+ + Cl-) = PbCl2 + 2(H++NO3-)
2. Reactia cu NH4I
Iodura de amoniu precipita din solutiile sarurilor de plumb iodura de plumb, precipitat de culoare galbena, solubil in apa fierbinte si in exces de reactiv:
Pb2+ + 2(NH4+ + I-) =PbI2 + NH4+
PbI2 + 2(NH4+ + I-) = [PbI4 ] (NH4)2
3. Reactia cu K2CrO4
Cromatul de potasiu precipita din solutiile sarurilor de plumb cromatul de plumb, de culoare galbena:
Pb2++ (2K+ + CrO42-) = PbCrO4+ 2K+
4. Reactia cu NaOH.
Hidroxidul de sodiu precipita din solutiile sarurilor de plumb, hidroxidul de plumb de culoare alba, solubil in exces de reactiv:
Pb2++ 2(Na++OH-) = Pb (OH)2 + 2Na+
Pb (OH)2 + 2(Na++OH-) = Na2[Pb(OH)4]
5. Reactia cu H2S.
Hidrogenul sulfurat precipita din solutiile acidulate, neutre sau alcaline ale sarurilor de plumb, sulfura de plumb un precipitat de culoare neagra:
Pb2+ + H2S = PbS + 2H+.
Proprietatile chimice ale cationilor grupei I-a analitice au fost sistematizate in urmatorul tabel:
|
Cation Reactiv |
Ag+ |
Hg22+ |
Pb2+ |
|
HCl |
AgCl - precipitat alb branzos, solubil in NH4OH, (NH4)2CO3 |
Hg2Cl2-pp. alb insolubil in apa la cald si NH3, solubil in HNO3 dil. , la cald. |
PbCl2-pp. alb cristalin, solubil in apa la cald. |
|
NH4I |
AgI - pp. alb-galbui, solubil in Na2S2O3 si KCN |
Hg2I2-precipitat verde solubil in exces de reactiv : Hg+ [HgI4](NH4)2. |
PbI2 - pp. galben, solubil in exces de reactiv: [PbI4](NH4)2 |
|
K2Cr2O4 |
Ag2CrO4--precipitat rosu-brun |
Hg2CrO4 - precipitat rosu-aprins. |
PbCrO4 - pp. galben. |
|
NaOH |
Ag2O - pp. negru |
Hg2O - pp. negru |
Pb(OH)2-pp. alb solu- bil in exces de reactiv : [Pb(OH)4]Na2 |
|
H2S |
Ag2S-pp. negru |
HgS + Hg - pp. negru |
PbS - pp. negru |
III.2.4. SEPARAREA SI IDENTIFICAREA PROPRIU-ZISA A GRUPEI I-A ANALITICE
Pe baza proprietatilor chimice ale cationilor s-a elaborat o schema, cu ajutorul careia, cationii, in cadrul unei grupe analitice, pot fi separati si identificati.
În cazul unui amestec necunoscut analiza calitativa incepe prin incercarea prezentei cationilor din grupa I-a, adaugand, la o cantitate mica din proba de analizat (solutie), reactivul de grupa - HCl - al acestei grupe analitice. Daca se observa formarea de precipitat, se adauga HCl 2N la intreaga cantitate de proba, pana la precipitarea completa a grupei, care se verifica adaugand o picatura de reactiv in exces la proba de analizat. În cazul in care nu se mai observa aparitie de precipitat, reactia se considera terminata. Se separa solutia de precipitat, prin centrifugare si aspirarea solutiei limpezi, de deasupra precipitatului. Se spala precipitatul cu o solutie diluata de acid clorhidric; prima solutie de spalare se adauga solutiei separate. Precipitatul se prelucreaza conform urmatoarei scheme de separare
Schema de separare si identificare a cationilor din grupa I-a analitica
|
Solutie: Ag+ , Hg22+ , Pb2+ , + alti cationi |
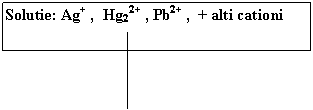 |
+ HCl
|
Pp. : AgCl , Hg2Cl2 , PbCl2 |
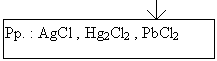 |
|||
|
+
![]()
+ 1 ml apa
fierbinte
![]()
Solutie
: Pb2+ , 2Cl- Pp.
: AgCl , Hg2Cl2
+
![]()
![]() + K2CrO4
+ K2CrO4
Pp.: PbCrO4 galben![]()
![]()
+
NH3
concentrat
|
Pp.: Cl-Hg-NH2 + Hg negru |
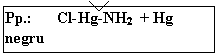 |
|||||
|
|||||
+
![]()
![]()
![]()
Hg22+ Ag+ Pb2+
Activitate practica
În vederea efectuarii practice a reactiilor chimice, pentru fiecare cation in parte, al acestei grupe analitice, se va trasa urmatorul tabel, in care se va completa, in paralel cu efectuarea reactiei chimice in eprubeta, ecuatia reactiei chimice, alaturi de observatiile care se refera la : solubilitatea precipitatelor respective, aspectul lor, culoare, forma, etc. precum si alte observati
|
Cation |
Reactii chimice, solubilitate |
Observatii |
Generalitati
Din aceasta grupa analitica fac parte acei cationi ale caror saruri solubile, precipita din solutiile acide, sub actiunea H2S, la pH 0,5 sub forma de sulfuri. Acesti cationi sunt :
Hg2+, Pb2+, Cu2+, Cd2+, Bi3+, As(III,V), Sb(III,V), Sn(II,IV).
Posibilitatea de a se forma o sulfura in mediu acid se datoreaza produsului de solubilitate mic al sulfurilor din aceasta grupa, spre deosebire de cationii grupei sulfurii de amoniu, ale caror sulfuri nu se pot precipita in prezenta ionilor de hidrogen (mediu acid), pentru ca produsul de solubilitate al acestor are o valoare mai mare; ionii de hidrogen prezenti scad puternic gradul de disociere al hidrogenului sulfurat, astfel incat ionii S2 raman in concentratie prea mica si nu mai pot determina o formare de sulfura (nu ajung la valoarea ceruta de produsul de solubilitate al sulfurilor respective).
În prezenta alcaliilor, a sulfurilor si polisulfurilor alcaline, o parte din sulfurile acestei grupe analitice functioneaza ca sulfoacizi respectiv oxisulfoacizi, formand sulfosaruri respectiv oxisulfosaruri, care sunt combinatii solubile. Aceasta proprietate subdivide grupa hidrogenului sulfurat in doua subgrupe :
a) Subgrupa sulfobazelor - care cuprinde cationii a caror sulfuri au caracter bazic, fiind insolubile in alcalii, respectiv sulfura si polisulfura de amoniu. Din aceasta subgrupa fac parte urmatorii cationi :
Hg2+, Pb2+, Cd2+, Cu2+, Bi3+.
b) Subgrupa sulfoacizilor - care cuprinde cationii a caror sulfuri au un caracter acid, dizolvandu-se in sulfuri alcaline, alcalii, sulfura si polisulfura de amoniu, formand sulfosaruri solubile. Din aceasta subgrupa fac parte urmatorii cationi :
As (III,V), Sb (III,V), Sn (II, IV).
Cationii grupei I-a analitice datorita faptului ca formeaza de asemeni sulfuri insolubile cu sulfura si polisulfura de amoniu, si datorita precipitarii incomplete a acestora cu reactivul de grupa - HCl, o parte ramanand in solutie, sunt de asemenea inclusi in subgrupa sulfobazelor (Pb).
Deci reactivul de grupa al cationilor grupei a II-a analitice este hidrogenul sulfurat, precipitarea lor realizandu-se in urmatoarele conditii :
- pH = 0,5 (concentratia HCl = 0,33 N), verificabil cu metil-violet, pana la virajul acestuia la culoarea galben-verde ;
- temperatura : 80 - 100 C;
- concentratia reactivului : 0,1M H2S.
III.3.1.MERCURUL - Hg2+
1. Reactia cu H2S
Cu cationul grupei sarurile solubile ale cationului mercuric formeaza o sulfoclorura de culoare alba : 2HgS.HgCl2 care prin adaugare in continuare de H2S trece in galben, apoi brun pana la negru, obtinandu-se sulfura mercurica :
3(Hg2++2Cl-) + 2(2H++S-) = 2HgS.HgCl2 + 4(H++Cl-)
HgS.HgCl2 + H2S = 2HgS + 2(H++Cl-)
- sulfura mercurica este solubila in apa regala (HCl : HNO3 = 3:1), HNO3 concentrat la fierbere, si este insolubila in (NH4)2S2 :
3HgS + 6HCl + 2HNO3 = 3HgCl2 + 3S + 2NO + 4H2O
2. Reactie cu NH4I
Cu iodura de amoniu, sarurile solubile ale cationului mercuric, precipita iodura mercurica, de culoare rosie, solubila in exces de reactiv, cu formarea unui complex de tetraiodomercuriat de amoniu, incolor.
Hg2+ + 2I- = HgI2
HgI2 + 2I- = [HgI4]2-
3. Reactia cu NH4OH
Sarurile solubile ale cationului mercuric formeaza cu hidroxidul de amoniu, un precipitat alb, format din clorura amino-mercurica Cl - Hg - NH2 :
(Hg2++2Cl-) + 2(NH4++OH-) = Cl-Hg-NH2 + (NH4++Cl-) + 2H2O
4. Reactia cu KOH
Cationul mercuros formeaza cu hidroxidul de potasiu un precipitat de oxid mercuric, de culoare galbena:
(Hg2++2Cl-) + 2(K++OH-) = HgO + 2(K++Cl-) + H2O
5. Reactia cu SnCl2
Clorura stanoasa formeaza cu cationul mercuric, un precipitat alb de clorura mercuroasa, care reactioneaza mai departe cu excesul de clorura stanoasa, formand mercur metalic, negru.
2(Hg2++ 2Cl-) + (Sn2++2Cl-) = Hg2Cl2 + (Sn4++4Cl-)
(2Hg2++2Cl-) + (Sn2++ 2Cl-) = 2Hg + (Sn4++4Cl-)
III.3.2. CUPRUL - Cu
Greutatea atomica 63,54 ; Valenta 1+, 2+ ; Numar de ordine 29
1. Reactia cu H2S
Cu reactivul grupei, sarurile solubile ale cationului de cupru (II) formeaza un precipitat negru coloidal, de sulfura cuprica, solubila in acid azotic diluat, la cald, in cianura de potasiu, cu formarea unui complex solubil : [Cu(CN)4]2-, si este insolubil in acid sulfuric la cald, HCl concentrat si partial insolubil in disulfura de amoniu.
(Cu2++SO42-) + H2S = CuS + (2H++SO42-)
2. Reactia cu KOH
Cu hidroxidul de potasiu, sarurile solubile ale cationului de cupru (II), precipita hidroxidul de cupru de culoare albastra, care se descompune la incalzire, cu formarea oxidului de cupru , negru.
(Cu2++SO42-) + 2(K++OH-) = Cu(OH)2 + (2K++SO42-)
Cu(OH)2 CuO + H2O
3. Reactia cu NH4OH
Cationul de cupru (II), cu o cantitate mica de hidroxid de amoniu, formeaza o sare bazica verde, care in exces de reactiv se dizolva cu formarea unui complex cuproamoniacal de culoare albastru-azuriu.
2(Cu2++SO42-) + 2(NH4++OH-) = CuSO4 Cu(OH)2 + (2NH4++SO4-)
CuSO4 Cu(OH)2 + 6(NH4++OH-) + 2(2NH4++SO42-) = 2[Cu(NH3)4]SO4 + 8H2O
4. Reactia cu K4[Fe(CN)6]
Ferocianura de potasiu, precipita din solutiile solubile ale cationului de cupru, ferocianura de cupru, de culoare rosu-bruna, solubila in amoniac si insolubila in acizi diluati.
2(Cu2++SO42-) + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2(2K++SO42-)
5. Reactia cu NH4I
Cationul de cupru formeaza cu iodura de amoniu, iodura de cupru (II), care se descompune cu formare de iodura cuproasa (I) si iod molecular, intregul precipitat fiind de culoare maroniu-galbui :
2Cu2+ + 4(NH4++I-) = 2CuI + I2 + 4NH4+
6. Coloratia flacarii
Sarurile volatile de cupru coloreaza flacara incolora a unui bec de gaz, in albastru sau in verde. Aceasta reactie se executa cu ajutorul unui varf de grafit (creion), care se introduce succesiv in HCl si apoi in flacara, pana cand flacara ramane incolora, dupa care varful de creion se introduce in HCl si apoi in sarea de cupru utilizata pentru analiza, apoi in flacara cand se observa culoarea imprimata flacarii de sarea de cupru.
7. Reactia cu acidul rubeanic - (NH=C-SH2)2
Solutia alcoolica de acid rubeanic, precipita din solutiile amoniacale sau slab acide ale sarurilor de cupru, sarea complexa de cupru, greu solubila (rubeanatul de cupru) de culoare neagra, insolubila in amoniac si in acizi minerali diluati.
Structura posibila a rubeanatului de cupru este :
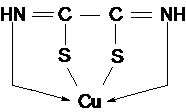
8. Reactia cu ditizona ( C6H5-NH-NH-CS-N=N-C6H5 )
La solutia de ditizona in CCl4 se adauga solutia acidulata a sarii de cupru, se agita puternic si se lasa apoi in repaus. În prezenta ionilor de cupru culoarea verde a solutiei de reactiv trece in violet.
III.3.3. PLUMBUL - PB
1. Reactia cu H2S
Cu reactivul grupei, in mediu acid, cationul de plumb precipita sulfura de plumb de culoare neagra, solubil in HNO3 2N.
Pb2+ + H2S = PbS + 2H+
3PbS + 8(H++NO3-) = 3(Pb2++ 2NO3-) + 3S + 2NO + 4H2O
2. Reactia cu KOH
Cu hidroxidul de potasiu, cationul de plumb precipita sub forma de hidroxid de plumb, de culoare alba, solubil in exces de reactiv.
Pb2+ + 2OH = Pb(OH)2
Pb(OH)2 + 2OH = PbO2 + 2H2O
3. Reactia cu NH4OH
Hidroxidul de amoniu precipita din solutiile sarurilor solubile de plumb, hidroxidul de plumb de culoare alba, insolubil in exces de reactiv.
(Pb2++2NO3 ) + 2(NH4++OH ) = Pb(OH)2 + 2(NH4++NO3
4. Reactia cu H2SO4
Acidul sulfuric, precipita din solutiile cationului de plumb, sulfatul de plumb, de culoare alba, solubil in HCl concentrat si H2SO4 concentrat.
Pb2+ + SO42- = PbSO4
PbSO4 + (2H++SO42-) = (Pb2++2HSO4-)
PbSO4 + (2H++Cl-) = (PbCl42-+2H+) + (2H++ SO42-)
5. Reactia cu K4[Fe(CN)6]
Cu ferocianura de potasiu, precipita ferocianura de plumb de culoare alba, insolubila in acizi diluati.
2Pb2+ + [Fe(CN)6]4- = Pb2[Fe(CN)6]
6. Reactia cu K2CrO4
Cationul de plumb formeaza cu cromatul de potasiu, cromatul de plumb, un precipitat de culoare galbena.
Pb2+ + CrO42- = PbCrO4
7. Reactia cu ditizona (difeniltiocarbazona)
C6H5-N=N-SC-NH-NH-C6H5
Ditizona produce cu sarurile de plumb un complex intern, de culoare rosu-caramiziu.
III.3.4.CADMIUL - Cd
Greutatea atomica 112,41 ; Valenta 2+ ; Numarul de ordine 48
1. Reactia cu H2S
Cu reactivul grupei sarurile solubile ale cationului de cadmiu, precipita (din solutii acide), sulfura de cadmiu, un precipitat de culoare galben intens, solubil in HCl, H2SO4 diluati, HNO3 2N, la cald, precum si in solutie saturata de NaCl cu care formeaza o sare complexa solubila.
Cd2+ + H2S = CdS + 2H+
CdS + 2(H++ Cl-) = (Cd2++2Cl-) + H2S
CdS + (2H++ SO4) = (Cd2++ SO42-) + H2S
3CdS + (2H++ SO42-) = 3(Cd2++ 2NO3-) + 3S + 2NO + H2O
CdS + 4(Na++ Cl-) = Na2[CdCl4] + (2Na++S2-)
2. Reactia cu KOH
Hidroxidul de potasiu, precipita din solutiile sulfurilor solubile de cadmiu, hidroxidul de cadmiu, un precipitat alb gelatinos, insolubil in exces de reactiv, dar solubil in HCl.
Cd2+ + 2OH- = Cd(OH)2
Cd(OH)2 + 2H+ = Cd2+ + H2O
3. Reactia cu NH4OH
Hidroxidul de amoniu adaugat in cantitate mica la solutia unei sari solubile de cadmiu, duce la formarea hidroxidului de cadmiu, solubil in exces de reactiv, cu formarea unui complex incolor, care este distrus sub actiunea hidrogenului sulfurat cu reprecipitarea sulfurii de cadmiu de culoare galben intens.
Cd2+ + 2(NH4++OH-) = Cd(OH)2 + 2NH4+
Cd(OH)2 + 4(NH4++OH-) = [Cd(NH3)4](OH)2 + 4H2O
[Cd(NH3)4](OH)2 + H2S = CdS + 2NH3 + 2(NH4++OH-)
4. Reactia cu K4[Fe(CN)6]
Ferocianura de potasiu formeaza cu cationul de cadmiu, ferocianura de cadmiu, un precipitat alb amorf, solubil in acizi minerali.
Cd2+ + [Fe(CN)6]4- = Cd2[Fe(CN)6]
Cd2[Fe(CN)6] + 4H+ = 2Cd2+ + H4[Fe(CN)6]
5. Reactia de reducere a Cd2+ cu Zn (Al, Mg) metalic
Zincul, magneziul si aluminiul precipita cadmiul metalic din solutiile sarurilor sale.
Cd2+ + Zn (Al, Mg) = Cd + Zn2+
6. Reactia cu ditizona
La solutia de ditizona se adauga o picatura din solutia neutra sau acida a sarii de cadmiu. Se formeaza o sare complexa interna, ditizonatul de cadmiu, si culoarea verde a solutiei trece in rosu-fraga.
7. Reactia cu difenil-carbazida (C6H5-NH-NH)2CO
Difenil-carbazida formeaza cu sarurile de cadmiu un complex albastru-violet.
III.3.5. BISMUTUL - Bi
Greutatea atomica 209 ; Valenta 3+, 5+ ; Numarul de ordine 83
Hidroliza sarurilor de bismut
Ionii de bismut (Bi3+) exista in solutie apoasa numai in mediu puternic acid. În mediu slab acid sau neutru, ionul de bismut hidrolizeaza si formeaza cationul complex BiO+ (ion de bismutil).
Bi3+ + HOH = BiO+ + 2H+
1. Reactia cu H2S
Cu reactivul grupei, precipita din solutiile acidulate ale sarurilor de bismut, sulfura de bismut, de culoare brun-inchis.
2Bi3+ + 3H2S = Bi2S3 + 6H+
- sulfura de bismut este solubila in HNO3 2N si insolubila in acizi diluati si sulfuri alcaline.
Bi2S3 + 8(H++NO3-) = 2(Bi3++3NO3-) + 2NO + 3S + 4H2O
2. Reactia cu KOH
Cationul de bismut (III), precipita cu hidroxidul de potasiu, hidroxidul de bismut, alb, care se ingalbeneste usor prin incalzire, datorita formarii hidroxidului de bismutil BiO(OH).
Bi3+ + 3OH- = Bi(OH)3
to
Bi(OH)3 BiO(OH) + HOH
3. Reactia cu NH4OH
Cu hidroxidul de amoniu, sarurile solubile ale cationului de bismut, precipita sub forma de hidroxid de culoare alba, care se ingalbeneste la incalzire, si care este solubil in acizi minerali diluati si insolubil in exces de reactiv sau KCN (spre deosebire de Cd si Cu).
Bi3+ + 3(NH4++OH-) = Bi(OH)3 + 3NH4+
4. Reactia cu NH4I
Iodura de potasiu, precipita din solutiile acidulate si concentrate ale cationului de bismut, iodura de bismut, de culoare neagra, care se dizolva in exces de reactiv cu formarea unui complex de culoare portocaliu inchis, si care, prin diluare nu prea puternica cu apa reprecipita iodura de bismut, de culoare neagra.
Bi3+ + 3I- = BiI3
BiI3 + I- = BiI4-
5. Reactia cu KCN
Cu cianura de potasiu, cationul de bismut, precipita hidroxidul de bismut si nu cianura, conform reactiilor :
3CN- + 3HOH = HCN + 3OH-
Bi 3+ + 3OH- Bi(OH)3
6. Reactia de reducere a Bi3+
O reactie foarte sensibila, e reactia de reducere cu Sn2+care se realizeaza in modul urmator : la solutia de SnCl2 se adauga KOH pana la dizolvarea hidroxidului si apoi se adauga o cantitate foarte mica din solutia analizata. În felul acesta sub actiunea KOH in exces, se obtine hidroxidul de bismut, de culoare alba, care sub actiunea SnO22-se innegreste, datorita bismutului metalic fin divizat care se formeaza.
(Sn2+ 2Cl-) + 2OH- = Sn(OH)2 + 2Cl-
Sn(OH)2 + 2OH- = SnO22- + 2HOH
Bi3+ + 3OH- = Bi(OH)3
Bi(OH)3 + SnO22- = Bi + 3SnO32- + 2HOH
III.3.6. ARSENIUL - As (V, III)
Greutatea atomica 74,91 ; Valenta 3+, 5+ ; Numarul de ordine 33
Arsenul (V)
1. Reactia cu H2S
Prin barbotarea la rece a unui curent de hidrogen sulfurat, intr-o solutie acidulata de H3AsO4, nu se separa imediat precipitat de sulfura si solutia nu se coloreaza. Abia dupa o perioada mai lunga de timp, se obtine un precipitat galben de sulfura de arsen. Precipitarea are loc mai rapid, daca solutia de acid arsenic este adusa la fierbere si mediul este suficient de acid.
H2AsO4 + 5HCl = AsCl5 + 4HOH
2AsCl5 + 5H2S = As2S5 + 10HCl
2. Reactia cu AgNO3
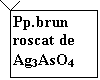
Cationul de arsen formeaza cu azotatul de argint, un precipitat de arseniat de argint, de culoare brun-roscata.
3Ag+ + AsO43- = Ag3AsO4
3. Reactia cu NH4I
Ionul de iodura reduce cationul de As (V) la As (III), in mediu acid.
AsO43- + 2I- + 2H+ = AsO33- + I2 + HOH
4. Reactia comuna ionului arsenios si ionului arsenic - Proba Marsh-Liebing (oglinda de arsen)
Intr-o eprubeta se introduce putin trioxid de arsen si se trateaza cu cativa ml de HCl concentrat si cateva granule de zinc metalic.
Se astupa gura eprubetei cu un dop de pluta prin care trece un tub de sticla efilat. Se asteapta cateva minute, lasand eprubeta sub nisa. Se aprinde gazul care se degaja prin tubul de sticla, si se introduce in flacara o capsula cu apa rece. Se constata formarea pe peretele capsulei a unei oglinzi.
Reactiile care au loc in decursul acestui experiment sunt :
Zn + 2HCl = ZnCl2 + 2H - hidrogen in stare nascanda
As2O3 + 12H = 2AsH3 + 3H2O
- aprinzand hidrogenul in exces, se degaja o caldura care descompune AsH3.
2AsH3 2As + 3H2
Arsenul (III)
1. Reactia cu H2S
Pentru precipitare, se aciduleaza puternic cu HCl, dupa care se barboteaza cu hidrogen sulfurat, pana cand precipita sulfura arsenoasa, sub forma de fulgi de culoare galben intens, solubila in sulfura de amoniu, hidroxizi alcalini, hidroxid de amoniu si carbonat de amoniu.
2(3H++AsO43-) + 6(H++ Cl-) = 2AsCl3 + 6HOH
2AsCl3 + 3H2S = As2S3 + 6HCl
2. Reactia cu AgNO3
Azotatul de argint precipita arsenul trivalent sub forma de arseniat de argint, de culoare galbena, solubil in amoniac.
AsO33- + 3Ag+ = Ag3AsO3
3. Reactia cu SnCl2 (reactia Bettendorf)
Clorura stanoasa, dizolvata in HCl fumans, reduce la cald combinatiile arsenului trivalent la arsen metalic, care se separa sub forma unui precipitat amorf de culoare brun inchis.
2As3+ + 3Sn2+ = 2As + 3Sn4+
III.3.7. STIBIUL (III) - Sb
Greutatea atomica 121,76 ; Valenta 3+, 5+ ; Numarul de ordine 51
1. Reactia cu H2S
Cu hidrogenul sulfurat, solutiile acidulate ale stibiului trivalent, precipita sub forma de sulfura de culoare portocalie, fiind un precipitat coloidal.
2Sb3+ + 3H2S = Sb2S3 + 6H+
2. Reactia cu hidroxizii alcalini
Sarurile solubile ale stibiului trivalent formeaza cu hidroxizii alcalini, hidroxidul de stibiu, solubil in exces de reactiv.
Sb3+ + 3OH- = Sb(OH)3
Sb(OH)3 + (Na++OH-) = NaSbO2 + 2HOH
3. Reactia cu KI
Iodura de potasiu precipita din solutiile acidulate ale cationului de stibiu trivalent, iodura de stibiu de culoare galbena.
Sb3+ + 3I- = SbI3
4. Reducerea Sb (III)
Zn, Fe sau Al precipita din solutiile sarurilor de stibiu un precipitat fin, de stibiu metalic redus, negru.
2Sb3+ + 2Zn = 2Sb + 3Zn2+
III.3.8. STANIUL (II) - Sn
Greutatea atomica 118,7 , Valenta 2+, 4+ ; Numarul de ordine 50
1. Reactia cu H2S
Sarurile solubile ale staniului bivalent, precipita din solutiile acidulate, un precipitat de culoarea ciocolatei, de sulfura stanoasa, solubila in polisulfura de amoniu, HCl concentrat la cald si insolubil in HNO3 concentrat.
Sn2+ + H2S = SnS + 2H+
2. Reactia cu hidroxizii alcalini
Cu hidroxizii alcalini, cationul de staniu (II) formeaza hidroxidul stanos de culoare alba, solubil in acizi si alcalii.
Sn2+ + OH- = Sn(OH)2
Sn(OH)2 + OH- = SnO22- + 2HOH
Sn(OH)2 + 2H+ = Sn2+ + 2HOH
3. Reactia cu K4[Fe(CN)6]
Ferocianura de potasiu formeaza cu cationul de staniu (II) un precipitat, de ferocianura stanoasa, de culoare alba, solubil in HCl concentrat si fierbinte.
4. Reactia cu HgCl2
La o solutie saturata de clorura mercurica, se adauga cu grija clorura stanoasa, pana se obtine un precipitat alb matasos de clorura mercuroasa. La adaugar7ea unui exces de clorura stanoasa, se obtine un precipitat negru de mercur metalic, redus.
2(Hg2+ + 2Cl-) + (Sn2++2Ci-) = Hg2Cl2 + (Sn4++4Cl-)
Hg2Cl2 + (Sn2++2Cl-) = (Sn4++4Cl-) + 2Hg
III.3.9. TABELE RECAPITULATIVE
Proprietatile chimice ale cationilor grupei a II-a analitice au fost sistematizate, pe subgrupe, in urmatoarele tabele :
Subgrupa sulfobazelor
|
Cation Reactiv |
Hg2+ |
Pb2+ |
Cu2+ |
Cd2+ |
Bi3+ |
|
H2S |
HgS - pp. negru |
PbS - pp. negru |
CuS - pp. negru |
CdS - pp. galben |
Bi2S3 - pp. brun |
|
NaOH |
HgO - pp. galben |
Pb(OH)2 - pp. alb sol. in exces de NaOH |
- la rece : Cu(OH)2 - pp. albastru - la cald : CuO - pp. negru |
Cd(OH)2 - pp. alb |
sare bazica , alba. În exces de NaOH, Bi(OH)3 - pp. alb |
|
NH4OH |
ClHgNH2 - pp. alb |
Pb(OH)2 - pp. alb insolubil in exces de reactiv |
CuSO4Cu(OH)2 pp. verde, sol. in exces de reactiv ; [Cu(NH3)4]2+ |
Cd(OH)2 - pp. alb | |
|
HCl |
Hg2+ |
PbCl2 - pp. alb |
Cu2+ |
Cd2+ |
Bi3+ |
|
KI (NH4I) |
HgI2 - pp. rosu sol. in exces de reactiv |
PbI2 - pp. galben, sol. in exces de reactiv |
CuI2+I2 - pp. alb-maroniu |
[CdI4]2- - incolor |
BiI3 - pp. negru, sol. in exces de reactiv |
|
K4[Fe(CN)6] |
pp. galbui de comp. necunoscu-ta |
Ferocianu- ra de Pb - pp. alb |
Cu2[Fe(CN)6] - pp. rosu-brun |
Ferocianura de Cd - pp.alb amorf |
pp. galbui de saruri de Bi3+ |
Subgrupa sulfoacizilor
|
Cation Reactiv |
As5+ |
Sb3+ |
Sn2+ |
|
H2S |
As2S5 - pp. galben |
Sb2S3 - pp. rosu portocaliu, solubil in HCl |
SnS - pp. brun-murdar |
|
AgNO3 |
Ag3AsO4 - pp. rosu - caramiziu | ||
|
KI |
- separa I2 , in mediu acid |
- nu pune I2 in libertate | |
|
HgCl2 |
Hg2Cl2 Hg pp. alb pp. negru |
În vederea separarii si identificarii cationilor acestei grupe analitice se va proceda in modul urmator:
Daca portiunea din filtratul de la grupa acidului clorhidric, sau din solutia initiala, nu a format nici un precipitat cu HCl, ea este tratata in continuare cu hidrogen sulfurat (fie solutie apoasa, obtinuta prin barbotarea hidrogenului sulfurat in apa, fie hidrogen sulfurat gazos), si se observa schimbarile care au loc. In cazul in care se produce o reactie vizibila, se procedeaza la precipitarea cu hidrogen sulfurat a intregii solutii.
Deoarece elementele din aceasta grupa analitica, nu toate precipita instantaneu, mai ales cand sunt in urme, o simpla trecere la rece de H2S in solutie nu este in toate cazurile suficienta. Pentru se va proceda in modul urmator : solutia obtinuta la separarea grupei I-a analitice, se incalzeste la 60-70 ¤C, dar nu se fierbe. Încalzirea favorizeaza aglomerarea precipitatelor. Dupa ce solutia a fost incalzita, se barboteaza hidrogen sulfurat sau se adauga o solutie saturata de H2S. Barbotarea, respectiv cantitatea de solutie de H2S adaugata, se face pana la precipitarea completa a elementelor din aceasta grupa. Trecerea H2S timp mai indelungat este necesara pentru precipitarea unor sulfuri care nu precipita instantaneu, asa cum sunt sulfurile de Pb, Hg, Cd si Sn, mai ales cand acestea se gasesc in urme; de asemeni este nevoie de un timp mai indelungat pentru a se separa As2S5.
În precipitarea acestor sulfuri trebuie tinut seama si de cantitatea de acid clorhidric adaugat pentru crearea pH-ului necesar precipitarii. O cantitate prea mare de acid determina trecerea in solutie a sulfurilor din aceasta grupa, care sunt mai solubile, cum sunt: PbS, CdS, SnS si care, din aceasta cauza, ar putea fi regasite in grupa urmatoare. Daca se adauga o cantitate prea mica de acid, ar putea precipita sulfurile din grupa urmatoare, in special sulfura de zinc.
Pentru a evita aceste erori, se recomanda ca pentru fiecare 10 ml de solutie de analizat, sa se adauge 2 ml HCl 2N.
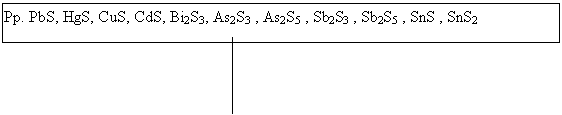
În urma precipitarii cu hidrogen sulfurat, formarea unui precipitat, dovedeste prezenta a cel putin unui element din aceasta grupa. Cand se gasesc toate elementele din grupa, precipitatul este format din urmatoarele sulfuri :
|
HgS negru |
PbS negru |
CuS negru |
CdS galben |
Bi2S3 brun |
|
As2S3 galben |
As2S5 galben |
Sb2S3 portocaliu |
Sb2S5 portocaliu |
SnS brun-murdar |
SnS2 galben |
Dupa precipitarea tuturor cationilor din aceasta grupa si separarea lor de solutia supernatanta, in vederea identificarii, precipitatul obtinut se prelucreaza conform urmatoarei scheme de separare si identificare :
Schema de separare si identificare a cationilor din grupa a II-a analitica ( grupa H2S).
|
Pb2+, Hg2+, Cu2+, Cd2+, Bi3+, As3+, As5+, Sb3+, Sb5+, Sn 2+, Sn4+ |
 |
![]()
![]() + H2S /HCl
+ H2S /HCl
|
Pp. PbS, HgS, CuS, CdS, Bi2S3, As2S3 , As2S5 , Sb2S3 , Sb2S5 , SnS , SnS2 |
 |
+ (NH4)2S2 la cald
|
Pp. PbS , HgS, CuS, CdS, Bi2S3 |
![]() + AsS43- ,
SbS43- , SnS33-
+ AsS43- ,
SbS43- , SnS33-
![]() + HNO3 la cald
+ HNO3 la cald
Pp.HgS negru![]()
![]()

+ H2SO4 pana la reactie acida
Pp. As2S5 , Sb2S5 , SnS2
Bi3+ , H+
[Cu(NH3)4]2+ albastru [Cd(NH3)4]2+ incolor![]()
![]()
![]() + apa regala + NH3 conc. + HCl concentrat
+ apa regala + NH3 conc. + HCl concentrat
Pp.Pb(OH)2
, Bi(OH)3
Sb3+ , Sn4+
|
|
![]()
![]() +
+
![]()
![]()
![]()
![]() + SnCl2 + NaOH30%
+ SnCl2 + NaOH30%
[Pb(OH)4]2- Pp.Bi(OH)3 Hg2Cl2
pp. alb
+NaClO3 + H2S
H3AsO4
![]() + (NH4)2HPO4
+ (NH4)2HPO4
![]()
![]()
![]() +SnCl2 +SnCl2 + K2CrO4
+SnCl2 +SnCl2 + K2CrO4
exces KOH CH3COOH + AgNO3
|
Pp.brun roscat de Ag3AsO4 |
|
Pp.portocaliu de Sb2S3 |
 |  |
||||||
Pp.galben PbCrO4 Bi metalic Hg cenusiu
+ KCN
[Cu(CN)4]2-
incolori
![]()
![]() + Zn
metalic
+ Zn
metalic
SnCl2 + ZnCl2
+ H2S
Pp.galben de CdS![]()
+ HgCl2
Pp.cenusiu-negru de SnCl2 + Hg2Cl2
+ Hg
![]()
![]()
Activitate practica
În vederea efectuarii practice a reactiilor chimice, pentru fiecare cation in parte, al acestei grupe analitice, se va trasa urmatorul tabel, in care se va completa, in paralel cu efectuarea reactiei chimice in eprubeta, ecuatia reactiei chimice, alaturi de observatii care se refera la: solubilitatea precipitatelor respective, aspectul lor culoare, forma, etc. precum si alte observatii.
|
Cation |
Reactii chimice , solubilitate |
Observatii |
Generalitati
Elementele din aceasta grupa, precipita, cu ionul sulfura, in mediu neutru sau alcalin.
Reactivul de grupa este sulfura de amoniu, (NH4)2S, iar precipitarea se face in prezenta de hidroxid de amoniu. Sulfura de amoniu, nu precipita in mediu acid nici unul din elementele acestei grupe, dar in mediu bazic si la fierbere o parte din elementele acestei grupe precipita sub forma de sulfuri, iar altele sub forma de hidroxizi, datorita hidrolizei acestor sulfuri in mediu apos.
Cationii care fac parte din aceasta grupa sunt :
Fe3+, Al3+, Cr3+, Fe3+, Ni2+, Zn2+, Mn2+, Co2+.
În functie de modul cum precipita, cationii acestei grupe analitice se impart in doua subgrupe, si anume :
a) Subgrupa cationilor trivalenti : Fe3+, Al3+, Cr3+
Acesti cationi formeaza cu reactivul grupei, in conditiile mai sus mentionate, hidroxizi conform ecuatiei generale :
2Me3+ + 3(NH4)2S + 6HOH = 2Me(OH)3 + 6NH4+ + 3H2S
in care Me3+ reprezinta unul din cei trei cationi trivalenti ai acestei subgrupe.
b) Subgrupa cationilor bivalenti : Fe2+, Co2+, Ni2+, Mn2+, Zn2+
Acesti cationi formeaza cu reactivul grupei, sulfuri, conform ecuatiei generale
Me2+ + (NH4)2S = MeS + 2NH4+
in care Me2+ reprezinta unul din cei cinci cationi ai acestei subgrupe.
Deci reactivul de grupa al acestor cationi este sulfura de amoniu, precipitarea realizandu-se in urmatoarele conditii :
- pH 9, creat prin adaugare de NH4Cl si NH4OH pana la reactie alcalina (turnesol albastru).
- temperatura : 80 - 100¤C (la fierbere).
- concentratia reactivului : CNH3 = 1M, CS2- = 10-9g / l
III.4.1. ALUMINIUL - Al
Greutatea atomica 26,97 ; Valenta 3+ ; Numarul de ordine 13
1. Reactia cu (NH4)2S
Cu sulfura de amoniu, in mediu de clorura de amoniu si hidroxid de amoniu, cationul de aluminiu, precipita sub forma de hidroxid, de culoare alba, gelatinoasa. El are un caracter amfoter, fiind solubil atat in acizi cat si in baze.
Al3+ + 3(NH4)2S = Al2S3 + 6NH4+
Al2S3 + 6HOH = 2Al(OH)3 + 3H2S
- caracterul amfoter al aluminiului se observa mai usor daca hidroxidul de aluminiu este scris sub urmatoarea forma :
Al(OH)3 H3AlO3 AlO2- + HOH
Al(OH)3 + 3H+ = Al3+ + 3HOH
AlO2- + (Na+ + OH-) = NaAlO2 + OH-
2. Reactia cu KOH
Cu hidroxidul de potasiu, cationul de aluminiu, formeaza hidroxidul de aluminiu, un precipitat alb gelatinos, solubil in exces de reactiv, cu formarea hidroxoaluminatului, care cu clorura de amoniu reprecipita hidroxidul de aluminiu.
Al3+ + OH- = Al(OH)3
Al(OH)3 + KOH = K[Al(OH)4]
K[Al(OH)4] + NH4Cl = NH4[Al(OH)4] + KCl
NH4[Al(OH)4] Al(OH)3 + NH4OH
3. Reactia cu NH4OH
Hidroxidul de amoniu formeaza cu cationul de aluminiu, hidroxidul de aluminiu, care in exces mare de reactiv formeaza un hidroxoaluminat de amoniu, partial solubil.
Al3+ + 3(NH4++OH-) = Al(OH)3 + NH4+
Al(OH)3 + (NH4++OH-) = NH4[Al(OH)4]
4. Reactia cu Na2CO3 si K2CO3
Cu carbonatii alcalini, cationul de aluminiu formeaza nu carbonati, ci hidroxidul corespunzator, datorita hidrolizei, hidroxid solubil in exces de reactiv.
2Al3+ + 3HOH + 3CO32- = 2Al(OH)3 + 3CO2
5. Reactia cu alizarina S (SC14H5O2(OH)2SO3Na)
Alizarina S formeaza cu sarurile de aluminiu, un lac de culoare rosie. Aceasta se obtine astfel : precipitatul de Al(OH)3 se dizolva in 1-2 ml solutie alcoolica 0,1 % de alizarina S. Se adauga NH4OH pana la reactie alcalina. Se fierbe, se raceste si se aciduleaza cu CH3COOH pana la aparitia unui precipitat de culoare rosu inchis.
III.4.2. CROMUL - Cr (III)
Greutatea atomica 52,01 ; Valenta 2+, 3+, 6+ ; Numarul de ordine 24
1. Reactia cu (NH4)2S
Reactia decurge in mediu de clorura de amoniu si amoniac, la fierbere, cand se obtine un precipitat verde-cenusiu gelatinos de hidroxid de crom (III).
2Cr3+ + 3(NH4)2S = Cr2S3 + 6NH4+
Cr2S3 + 6HOH = 2Cr(OH)3 + 3H2S
2. Reactia cu hidroxizi alcalini
Hidroxizii alcalini, precipita din solutiile sarurilor solubile de crom (III), hidroxidul de crom, solubil in acizi si baze (caracter amfoter).
Cr(OH)3 + 3H+ = Cr3+ + 3HOH
Cr(OH)3 + NaOH = NaCrO2 + HOH
3. Reactia cu NH4OH
Hidroxidul de amoniu, formeaza cu cationul de crom (III), hidroxidul de crom, de culoare verde-cenusiu gelatinos, care in exces de amoniac si in prezenta de clorura de amoniu, formeaza clorura hexaaminocromica, violeta. Prin diluare si fierbere se reprecipita hidroxidul de crom.
Cr(OH)3 + 3(NH4++OH-) + 3(NH4++Cl-) = [Cr(NH3)6]Cl3 + 6HOH
4. Reactia cu Na2CO3
Carbonatul de sodiu formeaza cu cationul de crom (III), hidroxidul de crom, verde-cenusiu.
2Cr3+ 3HOH + 3CO32- = 2Cr(OH)3 + 3CO2
5. Reactia cu arseniatul de sodiu - N3AsO4
Arseniatul de sodiu formeaza cu cationul de crom (III), arseniatul de crom, greu solubil.
Cr3+ + Na3AsO4 = CrAsO4 + 3Na+
6. Reactia de oxidare a Cr3+ cu KMnO4, in mediu neutru
Permanganatul de potasiu, oxideaza cromul trivalent la crom hexavalent, la fierbere, conform reactiei :
CrCl3 + KMnO4 + 2HOH = H2CrO4 + MnO2 + KCl + 2HCl
7. Reactia de reducere a Cr6+ la Cr3+
Reducerea se face cu H2S, KI, FeSO4 sau H2O2, in mediu acid, culoarea portocalie a bicromatului trecand in verde.
Cr2O72- + 3H2S + 8H+ = 2Cr3+ + 3S + 7HOH
Cr2O72- + 6I- + 14 H+ = 2Cr3+ + 3I2 + 7HOH
Cr2O72- + 6Fe2+ + 14 H+ = 2Cr3+ + 6Fe3+ + 7HOH
8. Reactia specifica Cr6+
La o solutie de cromat de potasiu, se adauga H2SO4 2M, pana la reactie acida (solutia devine portocalie), se adauga apa oxigenata (H2O2) 30 % ; in prezenta de acetat de etil, se formeaza un inel albastru intens.
Na2CrO4 + 2H2O2 + H2SO4 CrO5 + Na2SO4 + 3HOH
- cromatul are proprietatea de a trece cu usurinta, in mediu acid, in prezenta apei oxigenate, in combinatii intens colorate, datorita formarii acizilor percromici, mai stabili in eteri decat in mediu apos.
III.4.3. FIERUL - Fe (III)
Greutatea atomica 55,85 ; Valenta 2+, 3+, 6+ ; Numarul de ordine 26
1. Reactia cu (NH4)2S
Cu reactivul grupei, cationul de fier (III), reactioneaza in mediu de hidroxid de amoniu si clorura de amoniu, la fierbere, cu formare de hidroxid feric, de culoare bruna. Cand precipitarea se face la rece, se formeaza sulfura ferica de culoare neagra, solubila in HCl.
2Fe3+ + 3(NH4)2S = Fe2S3 + 6NH4+
Fe2S3 + 6HOH = 2Fe(OH)3 + 3H2S
Fe2S3 + 4HCl = 2FeCl2 + S + 2H2S
2. Reactia cu KOH
Sarurile solubile ale cationului de fier (III), formeaza cu hidroxidul de potasiu, hidroxidul feric, de culoare brun-roscata.
Fe3+ + 3OH- = Fe(OH)3
3. Reactia cu NH4OH
Cationul de fier (III), formeaza cu hidroxidul de amoniu, hidroxidul de fier, un precipitat amorf, brun-roscat.
Fe3+ + 3(NH4++OH-) = Fe(OH)3 + 3NH4+
4. Reactia cu K4[Fe(CN)6]
Ferocianura de potasiu, formeaza cu cationul de fier (III), un precipitat albastru amorf, cunoscut sub denumirea de 'albastru de Berlin'.
4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3
5. Reactia cu KSCN
Sulfocianura de potasiu (rodanura de potasiu), formeaza cu cationul de fier (III), o solutie rosu sange, de sulfocianura ferica, a carei coloratie se intensifica prin adaugarea de KSCN in exces, datorita formarii unui amestec de combinatii complexe, astfel :
[Fe(SCN)2]+; [Fe(SCN)3] ; [Fe(SCN)4]-; [Fe(SCN)5]2-; [Fe(SCN)6]3-.
Fe3+ + SCN- = [Fe(SCN)]2+
6. Reactia cu NH4I
Iodura de amoniu formeaza cu cationul de fier (III),o solutie de culoare bruna, datorita punerii in libertate a iodului molecular.
2Fe3+ + 2I- = 2Fe2+ + I2
7. Reactia cu CH3COOH
Cationul de fier (III), formeaza cu acetatul de sodiu, saruri complexe, solubile in mediul de reactie, de culoare rosu-rubiniu.
3Fe3+ + 9CH3COOH + 2HOH = Fe3(OH)2(CH3COO)6OOCH3C + 2CH3COOH
8. Reactia cu Na2S2O3
Tiosulfatul de sodiu formeaza cu sarurile solubile ale cationului feric, o sare complexa, solubila, care coloreaza solutia in violet ; culoarea dispare treptat din cauza reducerii fierului la starea bivalenta.
Fe3+ + 2Na2S2O3 = Na[Fe(S2O3)2] + Na3[Fe(S2O3)2]
III.4.4. FIERUL - Fe (II)
1. Reactia cu (NH4)2S
Cu reactivul grupei, cationul de fier (II), formeaza din solutii neutre sau amoniacale, sulfura feroasa, de culoare neagra.
Fe2+ + (NH4)2S = FeS + 2NH4+
- sulfura feroasa este solubila in acizi minerali si acid acetic.
2. Reactia cu hidroxizii alcalini
Hidroxidul de potasiu, precipita, in atmosfera de hidrogen, hidroxidul feros, de culoare alba, care la aer isi schimba repede culoarea de la verde pana la rosu-brun.
3. Reactia cu NH4OH
O solutie apoasa de amoniac, precipita hidroxidul feros, de culoare alba.
Fe2+ + 2(NH4++OH-) = Fe(OH)2 + 2NH4+
4. Reactia cu Na2CO3
Carbonatul de sodiu, formeaza cu cationul feros, carbonatul feros, de culoare alba, care se brunifica prin sedere in timp datorita oxidarii si formarii hidroxidului feric.
Fe2+ + CO32- = FeCO3
4FeCO3 + 6HOH + O2 = 4Fe(OH)3 + 4CO2
5. Reactia cu K3[Fe(CN)6]
Cationul de fier (II), formeaza cu fericianura de potasiu, fericianura feroasa, de culoare albastra, insolubila, cunoscuta si sub denumirea de 'albastru de Turnbull'.
3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2
6. Reactia cu AgNO3
Azotatul de argint formeaza cu cationul de fier (II), argint metalic de culoare gri, care la incalzire se depune pe peretele eprubetei sub forma unei oglinzi.
Fe2+ + Ag+ = Fe3+ + Ag
7. Reactia de oxidare a Fe (II) la Fe (III)
Oxidarea fierului bivalent la fier trivalent, se face in mediu de acid sulfuric, cu KMnO4.
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4HOH
III.4.5. COBALTUL - Co
Greutatea atomica 58,94 ; Valenta 2+ , 3+ ; Numarul de ordine 27
1. Reactia cu reactivul grupei
Sulfura de amoniu, precipita din solutiile sarurilor cobaltoase, sulfura de cobalt (II), de culoare neagra.
Co2+ + (NH4)2S = CoS + 2NH4+
2. Reactia cu hidroxizii alcalini
Hidroxizii alcalini, adaugati cu atentie, formeaza cu solutiile sarurilor cobaltoase, un precipitat albastru de sare bazica, care se transforma la adaugarea in exces a acestora in hidroxid cobaltos, si culoarea albastra a precipitatului trece in roz. Prin sedere la aer, precipitatul se brunifica, din cauza oxidarii partiale in hidroxid cobaltic.
(Co2+ + Cl2-) + (K+ + OH-) = CoOHCl + (K+ + Cl-)
CoOHCl + (K+ + OH-) = Co(OH)2 + (K+ + Cl-)
2Co(OH)2 + 1/2O2 + HOH = 2Co(OH)3
3. Reactia cu NH4OH
Prin adaugarea unei cantitati mici de hidroxid de amoniu, la o sare cobaltoasa, se obtine sarea bazica de culoare albastra, care se dizolva in exces de reactiv, cu formarea unui complex de clorura hexaaminocobaltoasa, de culoare galben murdar.
Co2+ + (NH4++OH-)
= CoOHCl + (NH4++Cl-)
![]()
4. Reactia cu carbonatii alcalini
Prin actiunea carbonatilor alcalini asupra sarurilor solubile de cobalt (II), se obtine un albastru constituit dintr-un amestec de carbonati si saruri bazice de cobalt, de compozitie variabila.
5. Reactia cu K4[Fe(CN)6]
Ferocianura de potasiu formeaza cu cationul de cobalt, ferocianura cobaltoasa de culoare verde.
Co2+ + [Fe(CN)6]4- = Co2[Fe(CN)6]
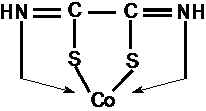
6. Reactia cu acidul rubeanic
Acidul rubeanic, formeaza cu sarurile cobaltoase, rubeanatul de cobalt, de culoare galben bruna, solubil in NH3, cu urmatoarea structura :
III.4.6. NICHELUL - Ni
Greutatea atomica 58,69 ; Valenta 2+, 3+ ; Numarul de ordine 28
1. Reactia cu (NH4)2S
Sulfura de amoniu, precipita din solutiile neutre ale sarurilor de nichel (II), sulfura de nichel, de culoare neagra.
Ni2+ + (NH4)2S = NiS + 2NH4+
2. Reactia du H2S
Hidrogenul sulfurat nu precipita sulfura de nichel, din solutiile acide ale sarurilor acestuia. Sulfura de nichel se separa insa, din solutiile usor acidulate cu acid acetic, in prezenta acetatului de sodiu, la un pH > 3,7, sub forma unui precipitat floconos.
Ni2+ + H2S = NiS + 2H+
3. Reactia cu hidroxizii alcalini
Cu hidroxidul de potasiu, cationul de nichel formeaza hidroxidul de culoare verde deschis, solubil in HCl si in NH4Cl + NH4OH, si insolubil in exces de reactiv.
Ni2+ + OH- = Ni(OH)2
Ni(OH)2 + 2(H++Cl-) = (Ni2++2Cl-) + 2HOH
Ni(OH)2 + 4(NH4++Cl-) = [Ni(NH3)6]Cl2 + 6HOH
4. Reactia cu NH4OH
O solutie diluata de amoniac, separa din solutii concentrate ale sarurilor de nichel, un precipitat de saruri bazice de culoare verde, solubile in exces de reactiv, cu formarea unui complex solubil, de culoare albastru deschis.
2NiSO4 + 2NH4OH = (NiOH)2SO4 + (NH4)2SO4
(NiOH)2SO4 + NH4OH = [Ni(NH3)6]SO4 + 2HOH
5. Reactia cu carbonatii alcalini
Carbonatul de sodiu sau de potasiu, formeaza cu cationul de nichel un precipitat verde deschis, format dintr-un amestec de carbonat si saruri bazice de compozitie variabila.
6. Reactia cu K4[Fe(CN)6]
Cationul de nichel formeaza cu ferocianura de potasiu, un precipitat verde-galbui, de ferocianura de nichel : Ni2[Fe(CN)6]
7. Reactia cu dimetil-glioxima
Cea mai sensibila reactie pentru cationul de nichel, este reactia cu dimetil-glioxima, in solutie amoniacala sau acetica. În prezenta amoniacului sau a acetatului de sodiu, se separa un precipitat cristalin al unei sari complexe interne, Ni-dimetil-glioxima, de culoare rosie, insolubila in amoniac, dar solubila in acizi minerali.
Ni2+ + 2DMG = (DMG)2Ni
8. Reactia cu acidul rubeanic
Cu acidul rubeanic, cationul de nichel formeaza un precipitat albastru-violet de rubeanat de nichel.
III.4.7. ZINCUL - Zn
Greutatea atomica 65,37 ; Valenta 2+ ; Numarul de ordine 30
1. Reactia cu (NH4)2S
Sulfura de amoniu, precipita din solutii neutre sau slab amoniacale, sulfura de zinc, un precipitat alb, solubil in acizi minerali, si insolubil in acid acetic si hidroxizi alcalini.
Zn2+ + (NH4)2S = ZnS + 2NH4+
2. Reactia cu hidroxizii alcalini
Hidroxizii alcalini adaugati in cantitate mica, la o solutie de zinc, precipita hidroxidul de zinc, un precipitat alb gelatinos, solubil in exces de reactiv, cu formare de zincati.
Zn2+ + 2OH- = Zn(OH)2
Zn(OH)2 + 2OH- = ZnO2- + 2HOH
3. Reactia cu NH4OH
Hidroxidul de amoniu formeaza cu cationul de zinc, hidroxidul de zinc, solubil in exces de reactiv , in prezenta sarurilor de amoniu, cu formarea unui complex solubil.
Zn2+ + 2(NH4++OH-) = Zn(OH)2 + 2NH4+
Zn(OH)2 + 2NH3 + 2NH4+
![]()
4. Reactia cu Na2CO3
Reactia decurge in prezenta hidroxidului de sodiu, cand se formeaza un precipitat alb de carbonat bazic de zinc, solubil in carbonat de amoniu si hidroxizi alcalini, cu urmatoarea structura : 5ZnO 2CO2 4H2O.
5. Reactia cu K4[Fe(CN)6]
Ferocianura de potasiu, formeaza cu cationul de zinc, o sare dubla de zinc si potasiu, alb cristalin, solubila in alcalii si insolubila in acizi diluati.
3ZnSO4 + 2K4[Zn(CN)6] = K2Zn3[Fe(CN)6]2
6. Reactia cu K2CrO4
Cromatul de potasiu formeaza cu cationul de zinc, cromatul de zinc, de culoare galbena.
III.4.8. MANGANUL - Mn (II)
Greutatea atomica 54,93; Valenta 2+, 3+, 4+, 6+, 7+; Numarul de ordine 25
1. Reactia cu (NH4)2S
Sulfura de amoniu, precipita in mediu amoniacal, sulfura de mangan (II), un precipitat de culoare roz, coloidal. Pentru ca precipitarea sa fie completa, se lucreaza cu solutii fierbinti de saruri solubile de mangan, in prezenta de clorura de amoniu. Prin sedere in aer, precipitatul se brunifica, datorita oxidarii.
Mn2+ + (NH4)2S = MnS + 2NH4+
2MnS + 3/2O2 + 3HOH = 2Mn(OH)3 + 2S
- prin fierberea sulfurii de mangan cu exces de sulfura de amoniu, se obtine o variatie verde a sulfurii, cu urmatoarea structura : 3MnS H2O
2. Reactia cu NH4OH
Cu hidroxidul de amoniu, cationul de mangan (II), formeaza hidroxidul manganos, de culoare alba.
Mn2+ + 2NH4OH = Mn(OH)2 + 2NH4+
3. Reactia cu hidroxizii alcalini
Cu hidroxizii alcalini, cationul de mangan (II), formeaza hidroxidul manganos, solubil in acizi diluati si saruri de amoniu, si insolubil in exces de reactiv. Hidroxidul manganos se oxideaza in aer, cu formarea unui amestec de Mn(OH)3, H2MnO3 si MnMnO3, de culoare brun-inchis.
Mn2+ + 2OH- = Mn(OH)2
2Mn(OH)2 + 1/2O2 + HOH = 2Mn(OH)3
2Mn(OH)3 + 1/2O2 = 2H2MnO3 + HOH
4. Reactia cu carbonatii alcalini
Carbonatii alcalini formeaza cu sarurile solubile ale cationului manganos, un precipitat alb, format dintr-un amestec de carbonati si saruri bazice de mangan, de compozitie variabila.
5. Reactia cu K4[Fe(CN)6]
Ferocianura de potasiu, formeaza cu cationul de mangan (II), un precipitat alb de ferocianura manganoasa.
Mn2+ + [Fe(CN)6]4- = Mn2[Fe(CN)6]
6. Reactia cu K3[Fe(CN)6]
Fericianura de potasiu formeaza cu cationul manganos, un precipitat brun, de fericianura manganoasa : Mn3[Fe(CN)6]2
7. Reactia de reducere a Mn6+
Prin trecerea unui curent de hidrogen sulfurat printr-o solutie acidulata de permanganat de potasiu, se observa decolorarea solutiei si punerea in libertate a sulfului.
2MnO4- + 5H2S + 6H+ = 2Mn2+ + 5S + 8HOH
Iodura de potasiu reduce permanganatul de potasiu la sare manganoasa. În acest caz solutia se coloreaza in brun din cauza punerii in libertate a iodului molecular.
2MnO4- + 10I- + 16H+ = 2Mn2+ + 5I2 + 8HOH
III.4.9. TABEL RECAPITULATIV
Proprietatile chimice ale cationilor grupei a III-a analitice au fost sistematizate in urmatorul tabel :
|
Cation Reactiv |
Fe3+ |
Cr3+ |
Al3+ |
Ni2+ |
Co2+ |
Zn2+ |
Mn2+ |
||
|
(NH4)2S |
Fe(OH)2 pp. brun- roscat |
Cr(OH)3 pp. verde-cenusiu |
Al(OH)3 pp. alb gelatinos |
NiS pp. negru |
CoS pp. negru |
ZnS pp. alb |
MnS pp. roz coloidal |
||
|
NH4OH |
Fe(OH)3 |
Cr(OH)3 |
Al(OH)3 |
Ni(OH)2SO4 verde |
CoOHCl albastru |
Zn(OH)2 pp. alb |
Mn(OH)2 alb |
||
|
exces |
[Ni(NH3)6]2+ albastru |
[Co(NH3)6]2+ |
[Zn(NH3)6]2+ incolor | ||||||
|
NaOH |
Fe(OH)3 |
Cr(OH)3 |
Al(OH)3 |
Ni(OH)2 verde |
CoOHCl albastru |
Zn(OH)2 alb |
Mn(OH)2 alb |
||
|
exces |
Co(OH)2 roz Co(OH)3 brun |
[Zn(OH)4]2- | |||||||
|
Na2CO3 |
Fe(OH)3 |
Cr(OH)3 |
Al(OH)3 |
pp. verde de carbonati si saruri bazice |
pp. albastru |
5ZnO 2CO2 4H2O |
pp. alb carbonati si saruri bazice |
||
|
|
albastru de Berlin |
pp. verde-galbui |
verde |
alb cristalin |
pp. cenu-siu |
||||
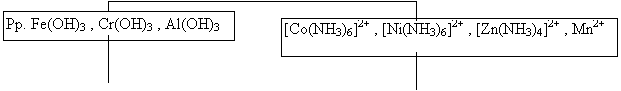
În vederea separarii si identificarii cationilor grupei a III- a analitice se va proceda in felul urmator: se incalzeste solutia ramasa dupa separarea cationilor grupei a II-a analitice si se adauga amoniac pana la reactie alcalina (turnesol albastru), apoi se adauga sub agitare, sulfura de amoniu proaspat preparata, pana ce o noua adaugare de reactiv nu mai produce precipitare. De obicei se incearca daca precipitarea este completa, adaugandu-se la primele portiuni de filtrat, cateva picaturi de sulfura de amoniu. Numai dupa ce s-a constatat ca precipitarea este completa, se filtreaza la cald si se spala cu apa care contine sulfura de amoniu si clorura de amoniu. Cand precipitarea se face in solutie initiala, (in acest caz nu s-au gasit cationi din grupele I-a si a II-a analitica), se adauga de la inceput clorura de amoniu si amoniac pana la reactie alcalina si se precipita la fierbere cu sulfura de amoniu. În cazul prezentei tuturor cationilor acestei grupe analitice, precipitatul obtinut este format din:
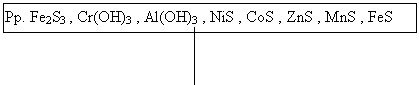
CoS, NiS, FeS, Fe2S3, MnS, ZnS, Al(OH)3, Cr(OH)3,
negru negru negru negru roz alb alb verde.
Culoarea precipitatelor ofera oarecare indicatii asupra elementelor prezente. O culoare deschisa indica absenta sulfurilor de Co, Ni, si Fe. Uu precipitat de culoare inchisa indica prezenta a cel putin unuia din elementele de mai sus.
Dupa precipitarea tuturor cationilor din aceasta grupa, sub forma de sulfuri respectiv hidroxizi, in vederea identificarii, precipitatul obtinut se prelucreaza conform urmatoarei scheme de separare si identificare:
|
Fe3+ , Cr3+ , Al3+ , Ni2+ , Co2+ , Zn2+ , Mn2+ , Fe2+ |
![]()
![]() + NH4Cl
+ NH4OH + (NH4)2S
+ NH4Cl
+ NH4OH + (NH4)2S
|
Pp. Fe2S3 , Cr(OH)3 , Al(OH)3 , NiS , CoS , ZnS , MnS , FeS |
 |
+ NH3 concentrat + NH4Cl solid
|
Pp. Fe(OH)3 , Cr(OH)3 , Al(OH)3 |
|
[Co(NH3)6]2+ , [Ni(NH3)6]2+ , [Zn(NH3)4]2+ , Mn2+ |
+ NaOH 30% + H2O230% + H2S la cald
|
Pp. Fe(OH)3 |
|
[Al(OH)4]- CrO42- |
|
Pp.
CoS , |
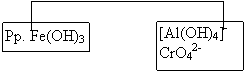 |
|||
 |
|||
![]() + HCl 2N
la cald
+ HCl 2N
la cald
|
Fe3+ |
|
Pp. NiS,CoS |
|
Mn2+ , Zn2+ |
|
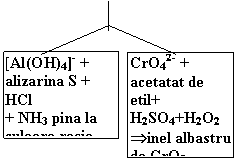
[Al(OH)4]- + alizarina S + HCl + NH3 pina la culoare rosie |
|
CrO42- + acetatat de etil+ H2SO4+H2O2 Þinel albastru de CrO5 |
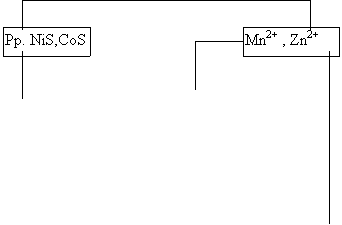 |
|||||
 |
|||||
 |
|||||
se imparte in doua
Zn2+ + (NH4)2Hg(SCN)2 ¯ ZnHg(SCN)4 cristale albe
+ NaClO3+HCl
Co2+
, Ni2+ Fe(SCN)3 culoare rosie
![]() se fierbe ptr.indepartarea
se fierbe ptr.indepartarea
Cl2 si se imparte in doua
|
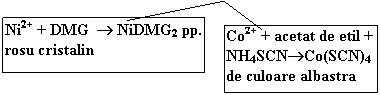
Ni2+ + DMG NiDMG2 pp. rosu cristalin |
|
Co2+ + acetat de etil + NH4SCN Co(SCN)4 de culoare albastra |
 |
|||
|
|||
Generalitati.
Precipitarea cationilor din aceasta grupa se bazeaza pe formarea de carbonati, in mediu amoniacal si in prezenta de clorura de amoniu. Reactivul de grupa este carbonatul de amoniu (NH4)2CO3.
Cationii care fac parte din aceasta grupa sunt:
Ca2+, Sr2+, Ba2+.
iar conditiile generale de precipitare :
pH < 9, creat prin adaugare de clorura de amoniu si amoniac;
temperatura: 60-70 C;
concentratia reactivilor: [NH4+] = 2N, NH3 = 2N, (NH4)2CO3 = 0,1M.
III.5.1. Bariul - Ba
1. Reactia cu (NH4)2CO3.
Din solutia sarurilor solubile de bariu, carbonatul de amoniu, precipita, la cald, carbonatul de bariu, un precipitat alb solubil in acizi minerali si acid acetic:
Ba2+ + (NH4)2CO3 = BaCO3 + 2NH4+.
2. Reactia cu K2CrO4
Cromatul de potasiu formeaza cationul bariu, cromatul de bariu, un precipitat de culoare galbena, solubil in acid clorhidric si insolubil in acid acetic:
Ba2+ + K2CrO4 = BaCrO4 + 2K+
3. Reactia cu H2SO4 si (NH4)2SO4
Acidul sulfuric diluat si sulfatii solubili, precipita, din solutiile sarurilor de bariu, sulfat de bariu, un precipitat alb cristalin. Precipitatul de sulfat de bariu, poate fi obtinut prin actiunea unei solutii saturate de sulfat de calciu, in acest caz se formeaza imediat o tulbureala fina, alba (deosebire de Sr2+).
Ba2+ + CaSO4 = BaSO4 + Ca2+.
4. Reactia cu K4[Fe(CN)6]
Ferocianura de potasiu precipita din solutii foarte concentrate ale sarurilor de bariu, in prezenta clorurii de amoniu, obtinandu-se un precipitat alb de ferocianura dubla de bariu si amoniu.
Ba2+ + [Fe(CN)6]4- = Ba(NH4)2[Fe(CN)6]
5. Reactia cu rodizonatul de sodiu - Na2C6O6.
Rodizonatul de sodiu precipita din solutiile neutre ale sarurilor de bariu, rodizonatul de bariu de culoare rosie bruna.
![]() CO CO CO Na CO CO CO
CO CO CO Na CO CO CO
![]() BaCl2 + ½ ½ Ba + 2NaCl.
BaCl2 + ½ ½ Ba + 2NaCl.
CO CO CO Na CO CO CO
6. Coloratia flacarii.
Sarurile de bariu coloreaza flacara incolora a unui bec de gaz, in galbui - verzui. (Vezi cationul de cupru).
III.5.2. Strontiul - Sr
Greutatea atomica 87,63; Valenta 2+; Numar de ordine 38
1. Reactia cu (NH4)2CO3
Cu carbonatul de amoniu, la cald cationul de strontiu, formeaza un precipitat alb de carbonat de strontiu, solubil in acizi minerali si acid acetic.
Sr2+ + (NH4)2CO3 = SrCO3 + 2NH4+
2. Reactia cu (NH4)2SO4
Sulfatul de amoniu formeaza cu cationul de strontiu, un precipitat alb cristalin.
Sr2+ + (NH4)2SO4 = SrSO4 + 2NH4+
3. Reactia cu K2CrO4
Prin actiunea cromatului de potasiu asupra solutiilor concentrate de saruri de strontiu, se obtine cromatul de strontiu, un precipitat de culoare galbena, solubil in acid acetic (spre deosebire de cationul de bariu) si acizi minerali.
Sr2+ +CrO4 = SrCrO4
- cromatul de strontiu precipita numai in mediu neutru pH = 7.
4. Reactia cu K4[Fe(CN)6]
Ferocianura de potasiu, reactioneaza numai cu solutiile foarte concentrate de strontiu, in prezenta clorurii de amoniu, cand se formeaza o sare dubla.
5. Coloratia flacarii.
Sarurile volatile de strontiu coloreaza flacara incolora a unui bec de gaz, in rosu carmin.
Greutatea atomica 40,08 ; Valenta 2+; Numar de ordine 20.
1. Reactia cu (NH4)2CO3
Carbonatul de amoniu, precipita din solutiile neutre ale cationului de calciu, carbonatul de calciu, un precipitat alb cristalin, solubil in acizi minerali.
Ca2+ + (NH4)2CO3 = CaCO3 + 2NH4+
2. Reactia cu (NH4)2C2O4
Oxalatul de amoniu formeaza cu cationul de calciu, oxalatul de calciu, un precipitat de culoare alba, cristalin, solubil in acizi minerali, si insolubil in acid acetic.
Ca 2+ + C2O42- = CaC2O4
3. Reactia cu K4[Fe(CN)6]
La solutia analizata se adauga, clorura de amoniu, pana la saturare, apoi solutia proaspata de ferocianura de potasiu 2N, se incalzeste si se lasa o perioada de timp in repaus. Se observa obtinerea unui precipitat galben verzui de ferocianura dubla de calciu si amoniu. Cationii de bariu precipita doar din solutii foarte concentrate.
Ca2++ Fe(CN)64- + 2NH4+ = Ca(NH4)2Fe(CN)6
4. Reactia cu H2SO4
Acidul sulfuric, precum si sulfatii metalelor alcaline, precipita din solutii foarte concentrate ale sarurilor de calciu, sulfatul de calciu, un precipitat alb cristalin.
Ca2+ + H2SO4 = CaSO4 + 2H+
5. Coloratia flacarii
Sarurile volatile ale cationului de calciu, coloreaza flacara incolora a unui bec de gaz, in rosu caramiziu.
III.5.4. Tabel recapitulativ
Proprietatile chimice ale cationilor grupei a IV-a au fost sistematizate in urmatorul tabel:
|
Cation Reactiv |
Ca2+ |
Sr2+ |
Ba2+ |
|
(NH4)2CO3 |
CaCO3-pp. alb solubil in acid acetic |
SrCO3 -pp. alb solubil in acid acetic |
BaCO3 -pp. alb solubil in acid acetic |
|
(NH4)2C2O4 |
CaC2O4 - pp. alb solubil in acid acetic |
SrC2O4 - pp. alb solubil in acid acetic. |
BaC2O4 - pp.alb solubil in acid acetic la cald. |
|
K2CrO4 |
SrCrO4 - pp. galben, precipita numai din solutii conc. de Sr. |
BaCrO4 - pp. galben |
|
|
(NH4)2SO4 |
CaSO4 - pp. alb, precipita numai din solutii conc. de Ca |
SrSO4 -pp. alb |
BaSO4 - pp.alb |
|
K4Fe(CN)6 |
Ca(NH4)2Fe(CN)6 pp. numai in prezenta sarurilor de amoniu. |
- pp. Numai din solutii foarte concentrate. |
-pp. numai din solutii foarte concentrate. |
În vederea separarii si identificarii cationilor grupei a IV-a analitice, se va proceda in felul urmator:
Solutia colectata, in urma separarii celorlalte grupe analitice (I; II; III), in vederea precipitarii cu carbonat de amoniu, se concentreaza, prin fierbere si se neutralizeaza. Se adauga apoi amoniac in exces (pH<¨9), putina clorura de amoniu se incalzeste la fierbere, si se precipita cu o solutie de carbonat de amoniu 0,1M. Precipitarea efectuata la cald, are avantajul de a determina obtinerea carbonatilor sub forma cristalina.
Pentru a obtine o separare cat mai completa, se lasa balonasul sau eprubeta in care s-a efectuat precipitarea, pe flacara mica si se agita din cand in cand. Dupa 10-15 minute se poate filtra.
Trebuie sa se evite fierberea indelungata a carbonatilor, deoarece sarurile de amoniu, favorizeaza solubilizarea carbonatilor conform reactiei:
CaCO3 + 2(Cl-+NH4+) = (2Cl- + Ca2+) + CO2 + 2NH3 + HOH.
Dupa precipitarea cationilor din aceasta grupa, sub forma de carbonati, in vederea identificarii acestora, precipitatul obtinut se prelucreaza conform urmatoarei scheme de identificare .
Activitate practica.
În vederea efectuarii practice a reactiilor chimice, pentru fiecare cation in parte, al acestei grupe analitice, se va trasa urmatorul tabel, in care se va completa, in paralel cu efectuarea reactiilor chimice in eprubeta, ecuatia reactiei chimice, alaturi de observatii care se refera la solubilitatea precipitatelor respective, aspectul lor, culoare, forma, etc., precum si alte observatii.
|
Cation |
Reactii chimice, solubilitate |
Observatii |
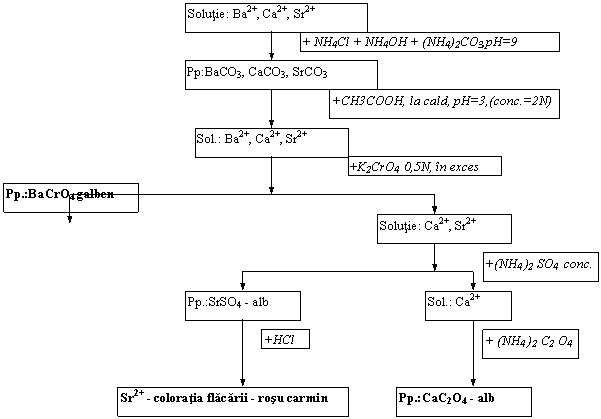
Schema de separare si identificare a cationilor din grupa a IV- a analitica
|
Solutie: Ba2+, Ca2+, Sr2+ |
|
Pp:BaCO3, CaCO3, SrCO3 |
|
+CH3COOH, la cald, pH=3,(conc.=2N) |
|
+ NH4Cl + NH4OH + (NH4)2CO3,pH=9 |
|
Sol.: Ba2+, Ca2+, Sr2+ |
|
Pp.:BaCrO4 galben |
|
+K2CrO4 0,5N, in exces |
|
Solutie: Ca2+, Sr2+ |
|
Pp.:SrSO4 - alb |
|
Sol.: Ca2+ |
|
+(NH4 )2 SO4 conc. |
|
Sr2+ - coloratia flacarii - rosu carmin |
|
+HCl |
|
Pp.:CaC2O4 - alb |
|
+ (NH4 )2 C2 O4 |
 |
Generalitati
Aceasta grupa analitica cuprinde urmatorii cationi: Li+, Na+, K+, Rb+, Cs+, Mg+, NH4+. Ionul amoniu NH4+ este studiat tot aici, deoarece din toate punctele de vedere se comporta ca un ion metalic alcalin. Tot din aceasta grupa se considera si ionul de magneziu, fiindca nu precipita cu reactivii celorlalte grupe analitice, in analiza identificandu-se dupa grupa metalelor alcalino-pamantoase si inainte de metalele alcaline. Aceasta grupa nu are reactivi de grupa.
Identificarea cationilor din grupa a V-a se realizeaza folosind reactivi specifici pentru fiecare cation in parte.
Solutia supusa analizei, nu trebuie sa contina cationi din grupele analitice precedente, deci ionii grupei a V-a analitice sunt ionii care raman in solutie dupa separarea celorlalti ioni din solutie.
Dintre ionii acestei grupe analitice, in cele ce urmeaza vor fi studiati doar urmatorii: , K+,Na+ Mg+, NH4+.
III.6.1. POTASIU - K
Greutate anatomica 39,096 ; Valenta 1+ ; Numar de ordine 19.
1. Reactia cu Na3[Co(NO2)6]
Reactivul cel mai sensibil pentru cationul de potasiu este hexanitrocobaltiatul de sodiu. Prin actiunea acestui reactiv asupra solutiei unei sari de potasiu, acidulata cu acid acetic, se formeaza imediat un precipitat galben cristalin de hexanitrocobaltiat de sodiu si potasiu:
2K + (3Na3 + + [Co(NO2)6]3-) = K2Na3[Co(NO2)6]
- solutia analizata nu trebuie sa contina hidroxid alcalin liber, acizi minerali liberi, alcooli, deoarece conduc la produsi ce ar putea duce in eroare analiza.
2. Reactia cu HClO4
Acidul percloric, precipita din solutia sarurilor solubile de potasiu, percloratul de potasiu, un precipitat alb cristalin.
K+ + ClO4 - = KClO4.
3. Reactia cu H2C4H4O4
Acidul tartric precipita din solutiile neutre ale sarurilor de potasiu, tartratul de potasiu, un precipitat alb cristalin, solubil in acizi minerali si hidroxizii alcalini.
K+ + H2C4H4O6 = KHC4H4O6 + H+
4. Coloratia flacarii
Cationul de potasiu, coloreaza flacara incolora a unui bec de gaz, in violet. În prezenta sarurilor de sodiu, care coloreaza flacara in galben, flacara trebuie observata printr-o prisma indigo. Pentru reactie se utilizeaza cloruri care sunt volatile. Înaintea experientei, mina de creion se umecteaza in HCl si se calcineaza. Aceasta operatie se repeta pana cand flacara ramane incolora.
III.6.2. SODIU - Na
Greutatea anatomica 22,997 ; Valenta 1+ ; Numar de ordine 11.
1. Reactia cu Mg(UO2)3(CH3COO)8
Prin actiunea acetatului de uranil si magneziu asupra unei sari de sodiu, acidulata cu acid acetic, se obtine un precipitat cristalin, galben verzui, de acetat de uranil, magneziu si sodiu.
Na+ + Mg(UO2)3(CH3COO)8 + CH3COO- = NaMg(UO2)3(CH3COO)9
- cristalele de culoare galbena, se formeaza si in prezenta acetatului de uranil si zinc sau cobalt.
2. Coloratia flacarii
Ionul de sodiu coloreaza flacara incolora a unui bec de gaz, in galben intens. Proba nu e concludenta; culoarea galbena a flacarii apare si in absenta sodiului din solutia de analizat, deoarece praful din aer contine saruri de sodiu in cantitate mare.
III.6.3. MAGNEZIU - Mg
Greutatea atomica 24,32 ; Valenta 2+ ; Numar de ordine 12.
1.Reactia cu KOH si NaOH
Solutiile cu hidroxizi alcalini precum si solutiile saturate de bariu si de calciu, precipita din solutiile sarurilor de magneziu, hidroxidul de magneziu, un precipitat alb gelatinos.
Mg2+ + 2OH- = Mg(OH)2
2. Reactia cu NH4OH
O solutie apoasa de amoniac, precipita din solutiile sarurilor de magneziu, hidroxidul de magneziu. Precipitarea nu este completa din cauza formarii sarurilor de amoniu care dizolva precipitatul.
Mg2+ + 2(NH4+ + OH-) = Mg(OH)2 + 2NH4+
3. Reactia cu K2CO3 si Na2CO3
Carbonatul de sodiu sau de potasiu, precipita din solutiile neutre ale sarurilor de magneziu, sarea bazica de compozitie variabila, de culoare alba:
n MgCO3 · Mg(OH)2 ·HOH.
4. Reactia cu (NH4)2S
Sulfura de amoniu precipita din solutiile sarurilor de magneziu, la pH = 9,3, hidroxidul de magneziu.
5. Reactia cu Na2S.
O solutie apoasa de sulfura de sodiu, precipita complet ionul de magneziu, sub forma de hidroxid.
Mg2+ + Na2S + HOH = Mg(OH)2 + 2Na+ + H2S
6. Reactia cu Na2HPO4
Pentru obtinerea unui precipitat caracteristic, solutia analizata se aciduleaza cu HCl diluat, se adauga o solutie de fosfat disodic, si se incalzeste, dupa care se adauga cu grija hidroxidul de amoniu, pana la precipitarea completa a ionului de magneziu sub forma de sare dubla de magneziu si amoniu, un precipitat alb cristalin.
Mg2+ + HPO42- + NH4OH = MgNH4PO4 + HOH
7. Reactia cu chinalizarina - 1,2,5,,8, Tetraoxi-antrachinona.
Solutia alcoolica a reactivului se coloreaza in albastru violet, prin adaugare de alcalii. În prezenta cationului de magneziu, culoarea trece in albastru azuriu. Pentru aceasta se va proceda in felul urmator: la solutia de analizat, se adauga cateva picaturi din solutia alcoolica de chinalizarina, si apoi, o jumatate din acest volum, dintr-o solutie 2N de NaOH. Chinalizarina formeaza o sare complexa interna, cu ionul de magneziu.
8. Reactia cu difenil carbazida.
O solutie alcoolica 5% de difenil-carbazida, in prezenta de exces de alcalii, coloreaza solutiile diluate ale sarurilor de magneziu, in rosu violet din cauza unei sari complexe interne.
III.6.4. IONUL AMONIU - NH4+
1. Reactia cu NaOH sau KOH
La solutia unei sari de amoniu, se adauga exces de hidroxid alcalin, se incalzeste cu grija, si se introduce in vaporii sai o hartie rosie de turnesol umezita. Amoniacul care se degaja, este absorbit de umiditate, se formeaza hidroxid de amoniu, si hartia de turnesol se inalbastreste (pH = 8).
Daca in vaporii probei mai sus preparate, se tine o hartie de filtru muiata intr-o solutie de azotat mercuros, se observa ca in prezenta ionilor de amoniu se formeaza o pata de culoare negru cenusiu, datorita formarii de mercur metalic, conform reactiei:
![]()
![]() Hg
Hg
![]()
![]() 4NH3 + 2Hg2(NO3)2
+ HOH = O NH2NO3
+ 2Hg + 3NH4NO3
4NH3 + 2Hg2(NO3)2
+ HOH = O NH2NO3
+ 2Hg + 3NH4NO3
Hg
azotat de dimercur amoniu
2. Reactia cu reactivul Nessler
Reactivul Nessler este o solutie alcalina de tetraiodo-mercuriat de potasiu - K2[HgI4]. Prin actiunea acestuia asupra sarurilor de amoniu, se obtine un precipitat brun-roscat, de iodura de dimercur amoniu.
![]()
![]() Hg
Hg
![]()
![]() NH3 + 2HgI42- + 3OH- = O NH2I + 7I-
+ 2HOH
NH3 + 2HgI42- + 3OH- = O NH2I + 7I-
+ 2HOH
Hg
3. Reactia cu Na3[Co(NO2)6]
Hexanitrocobaltiatul de sodiu, formeaza cu sarurile de amoniu, un precipitat galben cristalin de sare dubla de hexanitrocobaltiat de sodiu si amoniu.
2NH4+ + (3Na+ + [Co(NO2)6]3-) = (NH4)2NaCo(NO2)6
III.6.5. IDENTIFICAREA PROPRIU-ZISA A CATIONILOR GRUPEI A V - A ANALITICE
În vederea identificarii cationilor grupei a V - analitice se va proceda in modul urmator: ionul de amoniu se cauta direct in solutia initiala, deoarece pe parcursul analizei se introduc saruri de amoniu. În acest scop se ia fie o portiune din substanta solida, fie o cantitate mica din solutia initiala si se incalzeste cu hidroxid alcalin. Degajarea de amoniac, gaz incolor cu miros caracteristic, indica prezenta sarurilor de amoniu. Pentru identificarea urmelor de amoniac, se intrebuinteaza hartia indicator cu azotat mercuros sau cu reactiv Nessler.
Pentru identificarea magneziului si a alcalinelor, se evapora la uscare solutia ramasa dupa separare. Un reziduu obtinut, chiar dupa o slaba calcinare prin care s-au indepartat sarurile de amoniu, indica prezenta sarurilor de magneziu si a metalelor alcaline. Se dizolva reziduul in apa sau acid clorhidric daca este necesar, si eventual se filtreaza pentru indepartarea sulfului. Într-o portiune a acestei solutii se cauta ionul de magneziu prin adaugare de fosfat disodic si amoniac, in mic exces. Formarea la fierbere a unui precipitat alb cristalin, de fosfat dublu de magneziu si amoniu, indica prezenta magneziului in amestec. Daca precipitatul nu apare imediat, datorita prezentei in cantitati mici a magneziului, se va astepta 2-3 ore. Pentru a indeparta ionul de magneziu din solutie, acesta se trateaza cu hidroxid de bariu in exces si apoi se filtreaza hidroxidul de magneziu precipitat. Mai departe la solutia obtinuta, se adauga carbonat de amoniu pentru a indeparta excesul de ioni de bariu, sub forma de carbonat, dupa care se filtreaza din nou. Filtratul obtinut se evapora la sec, si se calcineaza slab, pentru indepartarea sarurilor de amoniu. Reziduul obtinut se dizolva in putina apa (1-2 ml), si se imparte in 2 parti: intr-o parte se identifica potasiul si in cealalta sodiul.
Pentru identificarea ionului de potasiu, alaturi de cel de sodiu se va proceda astfel: la solutia acidulata cu acid acetic se adauga hexanitrocobaltiat de sodiu. Formarea unui precipitat galben cristalin indica prezenta ionului de potasiu. Pentru identificarea ionului de sodiu alaturi de cel de potasiu, se adauga la solutia de analizat, acetat dublu de magneziu si uranil in prezenta de acid acetic. Aparitia unui precipitat galben cristalin indica prezenta ionului de sodiu.
Activitate practica.
În vederea efectuarii practice a reactiilor chimice, pentru fiecare cation al acestei grupe analitice, se va trasa urmatorul tabel, in care se va completa, in paralel cu efectuarea reactiei chimice in eprubeta, ecuatia reactiei chimice, alaturi de observatii care se refera la: solubilitatea precipitatelor respective, aspectul lor, culoare, forma, etc., precum si alte observatii.
|
Cation |
Reactii chimice, solubilitate |
Observatii |
III.7. MERSUL SISTEMATIC AL ANALIZEI UNUI AMESTEC DE CATIONI
În cazul analizei unei solutii, se va proceda mai intai la identificarea cationului, si numai dupa aceea se va trece la identificarea anionului. Solutia primita spre analiza se imparte in doua parti si anume: 2/3 din volumul solutiei se rezerva pentru cautarea cationului, iar 1/3 pentru identificarea anionului. Se va incepe cu separarea pe grupe analitice, iar o data stabilita grupa, se va trece la efectuarea reactiilor specifice, cu ajutorul carora se va identifica cationul din grupa respectiva. Deci se va proceda astfel: 1 ml din solutia de analizat, se aciduleaza cu acid clorhidric diluat. Formarea unui precipitat alb, indica prezenta a cel putin unui cation din grupa I-a analitica. Precipitatul obtinut se imparte in doua eprubete. Continutul primei eprubete se incalzeste la flacara unui bec de gaz; daca precipitatul se solubilizeaza si apoi prin racire recristalizeaza, inseamna ca in solutie se gaseste cationul de plumb, Pb2+. Pentru a verifica prezenta acestui cation, solutia obtinuta dupa incalzirea precipitatului, se trateaza cu cromat de potasiu. Obtinerea unui precipitat galben, confirma prezenta cationului de plumb in solutia de analizat.
Daca precipitatul nu s-a dizolvat la incalzire, inseamna ca in solutie pot fi prezenti cationul de argint sau cationul mercuros. Daca prin tratare cu amoniac precipitatul se dizolva si prin acidulare precipitatul reapare, inseamna ca in solutie exista cationul de argint. În cazul in care prin tratare cu amoniac apare un precipitat negru (Hg metalic), acesta dovedeste existenta cationului de mercur (I).
Daca la tratarea solutiei initiale cu acid clorhidric nu s-a obtinut un precipitat solutia se va trata mai departe cu hidrogen sulfurat. Formarea unui precipitat indica prezenta a cel putin unui cation din grupa a II - analitica. Pentru precipitarea completa a cationului de arsen (V), se adauga la solutia de analizat, 1ml HCl concentrat, se fierbe si se adauga in exces hidrogen sulfurat. Formarea unui precipitat galben intens confirma prezenta acestui cation in solutia de analizat. Reactia de identificare se face adaugand, la precipitatul de sulfura arsenica solubilizat, conform schemei de separare si identificare a cationilor acestei grupe analitice, a azotatului de argint, cand se obtine un precipitat brun-roscat.
Daca se obtine precipitat la tratarea la rece a solutiei, acidulate cu HCl cu hidrogen sulfurat, acest precipitat se separa cantitativ de solutia supernatanta si se incalzeste cu polisulfura de amoniu. Sulfobazele nu se dizolva, iar sulfoacizii se solubilizeaza, ramanand in solutie.
Daca avem sulfobaze (Hg2+, Pb2+, Cu2+, Cd2+, Bi3+), se va incerca solubilitatea precipitatului in acid azotic diluat la cald. În cazul in care nu se dizolva, cationul precipitat ca sulfura este mercurul (II). Pentru a executa reactia de recunoastere a acestui cation, precipitatul (sulfura) se dizolva in apa regala, dupa care se face reactia de recunoastere cu clorura stanoasa, cand trebuie sa se obtina un precipitat cenusiu de mercur metalic. Daca sulfurile obtinute se dizolva in HNO3 diluat, al cald, la aceasta solutie se adauga amoniac concentrat. În cazul in care in solutie mai exista Pb2+ ramas in urma separarii grupei I-a analitice, acesta va precipita sub forma de hidroxid insolubil (ca si Bi3+) de culoare alba. Pentru verificare, se trateaza precipitatul obtinut cu hidroxid de sodiu 30 %, cand cationul de plumb se va dizolva sub forma de plumbit. El se va pune apoi in evidenta prin acidulare cu acid acetic si tratare cu cromat, cand precipita cromatul de plumb, galben. Cationul de bismut (III), la tratarea cu NH3 concentrat precipita sub forma de hidroxid care nu se dizolva in NaOH 30 %. Verificarea se realizeaza cu clorura stanoasa, in mediu bazic, cand precipita Bi metalic.
Daca la adaugare de amoniac concentrat nu se obtine precipitat, in solutie ar putea exista cationul de cupru (II) sau cadmiu (II). Prezenta Cu2+ este indicata de formarea unui complex (cu hidroxidul de amoniu) de culoare albastru inchis. În cazul in care solutia ramane mai departe incolora, se va incerca prezenta ionului de cadmiu prin retratarea solutiei cu ferocianura de potasiu, cu care cationul de cadmiu formeaza un precipitat alb amorf, solubil in acizi minerali.
Sulfoacizii As (III), Sb (II,V), Sn (II,V) se reprecipita prin acidulare cu acid sulfuric diluat, sub forma de sulfuri. La tratarea cu HCl concentrat, sulfura de arsen (V) nu se dizolva fata de sulfurile de stibiu (III) si staniu (IV) care se solubilizeaza. Acesti cationi se pun in evidenta prin reactiile lor specifice prezentate la grupa a II-a analitica.
Pentru a precipita cationii grupei a III-a, solutia de analizat (cea initiala, daca nu contine cationi din primele doua grupe analitice, sau solutia obtinuta dupa filtrarea cationilor primelor doua grupe analitice) se trateaza cu sulfura de amoniu in prezenta de clorura si hidroxid de amoniu. Precipitatul obtinut se trateaza cu amoniac concentrat si clorura de amoniu solida. În aceste conditii cationul de aluminiu precipita sub forma de hidroxid, un precipitat alb gelatinos, solubil in hidroxizi alcalini (KOH sau NaOH). Pentru a se confirma prezenta acestui cation se va efectua o reactie de identificare si anume : reactia cu alizarina S. Pentru aceasta se va trata 1 ml din solutia de analizat cu NH4OH pana la reactie alcalina, dupa care se fierbe, se raceste si se aciduleaza cu acid acetic, pana la aparitia unui precipitat rosu inchis.
În cazul in care precipitatul obtinut, dupa tratarea cu amoniac concentrat si clorura de amoniu solida, este de culoare bruna, aceasta indica prezenta cationului de fier (III). Verificarea se realizeaza efectuand urmatoarea reactie specifica: la 1 ml din solutia de analizat se adauga sulfocianura de potasiu. Obtinerea unei solutii colorate in rosu - sange confirma prezenta cationului de fier (III).
Daca sulfurile obtinute sunt negre si solubile in NH4OH concentrat, se incearca prezenta cationului de cobalt (II) si a celui de nichel (II). Pentru verificarea cationului de cobalt, solutia de analizat se trateaza cu sulfocianura de amoniu, cu care in mediu de acetat de etil formeaza un complex albastru. Prezenta cationului de nichel se verifica efectuand reactia cu dimetil-glioxima in mediu de amoniac, cu care formeaza un precipitat de culoare rosie.
Daca sulfura obtinuta e alba, solubila in amoniac, se incearca identificarea zincului (II) prin tratarea solutiei cu ferocianura de potasiu, cu care cationul de zinc precipita, obtinandu-se un precipitat alb de ferocianura de zinc, sau prin tratarea solutiei cu cromat de potasiu cu care formeaza cromatul de zinc, un precipitat galben - gelatinos.
Daca sulfura obtinuta e de culoare roz-galbuie, solubila in amoniac, si care se brunifica in timp, indica prezenta cationului de mangan (II).
Dupa separarea prin filtrare, a cationilor grupei a III - analitice, in solutia supernatanta, se incearca prezenta cationilor grupei a IV - a prin tratarea solutiei de analizat cu carbonat de amoniu. Formarea unui precipitat alb, indica prezenta cationilor acestei grupe. Carbonatii formati se dizolva in acid acetic diluat la cald.
Prezenta cationului de bariu poate fi pusa in evidenta prin tratarea unei portiuni din solutia obtinuta dupa dizolvarea precipitatului in acid acetic, cu cromat de sodiu cand rezulta cromat de bariu de culoare galbena.
Prezenta cationului de strontiu este pusa in evidenta prin tratarea unei portiuni din solutia obtinuta anterior, cu sulfat de amoniu, cand cationul de strontiu precipita sub forma de sulfat, un precipitat alb cristalin. Acest cation mai poate fi pus in evidenta prin coloratia flacarii, el colorand flacara incolora a unui bec de gaz in rosu - carmin.
Prezenta cationului de calciu este pusa in evidenta prin tratarea solutiei obtinute dupa dizolvarea carbonatilor in acid acetic diluat, cu tartrat de amoniu, cu care formeaza tartratul de calciu de culoare alba.
Evidentierea cationilor grupei a V-a analitice se face pe portiuni din solutia de analizat, astfel:
Cationul de amoniu, se pune in evidenta la inceputul analizei, inaintea tuturor grupelor analitice, cu reactivul Nessler cand prezenta lui este confirmata de formarea unui precipitat de culoare brun-roscat.
Ceilalti cationi se identifica in solutia ramasa dupa separarea cationilor grupei a IV-a analitice.
Cationul de sodiu poate fi pus in evidenta prin reactia specifica cu acetatul de uranil si magneziu (sau zinc), in prezenta acidului acetic, cu care formeaza acetatul triplu de uranil, magneziu si sodiu, un precipitat cristalin, galben-verzui.
Cationul de potasiu, poate fi pus in evidenta prin reactia acestuia cu acidul percloric cu care formeaza percloratul de potasiu, un precipitat alb-cristalin.
Cationul de magneziu poate fi pus in evidenta prin reactia specifica a acestuia cu chinalizarina, in prezenta hidroxidului de sodiu, cu care formeaza un complex de culoare albastru-azuriu.
Activitate practica.
În paralel cu efectuarea reactiei chimice in eprubeta, in vederea identificarii cationilor prezenti in amestecul de analizat, se vor scrie in caiet ecuatiile reactiilor chimice, iar in final, dupa ce concluziile au fost trase (cationii au fost identificati) se va trasa o schema de separare efectiva a acestor cationi.
De exemplu, in cazul in care in amestecul de analizat s-au gasit urmatorii cationi: Ag+, Al3+, Ca2+, NH4+ schema de separare si identificare va arata astfel:
|
¯ |
|
+ HCl |
|
Solutie: Ag+, Al3+, Ca2+, NH4+ |
|
¯ |
|
¯ |
|
+ NH3 |
|
¯ |
|
Pp. : AgCl - alb |
|
Sol. : [Ag(NH3)2]Cl incolor |
|
¯ |
|
+ (NH4)2S + NH4Cl |
|
Solutie: Al3+, Ca2+, NH4+ |
|
¯ |
|
¯ |
|
¯ |
|
+ NaOH 30% |
|
Pp. : Al(OH)3 alb gelatinos |
|
¯ |
|
+Alizarina+acid acetic |
|
Sol. : [Al(OH)4]- |
|
Ca2+ |
|
CaC2O4 pp. alb |
|
Oxalat de amoniu |
|
pp.rosu inchis |
|
Se identifica ionul de amoniu cu R. Nessler |
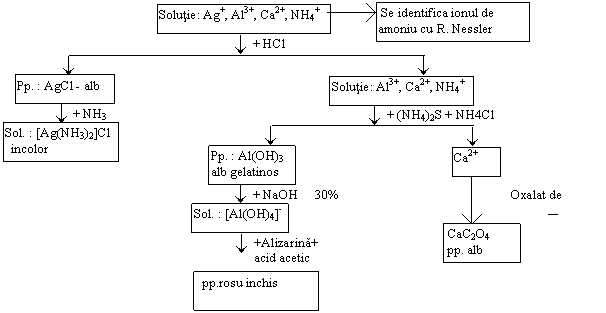 |
Copyright © 2025 - Toate drepturile rezervate