 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Influenta substituentilor asupra vitezei de reactie. Relatii liniare ale entalpiei libere. Aplicarea relatiilor de corelare la calculul constantelor de viteza.
Calculul constantelor de viteza pentru reactiile elementare nu s-a realizat pana in prezent decat pentru cazurile cele mai simple, in primul rand din cauza dificulatilor matematice enorme legate de determinarea suprafetei de energie potentiala a reactiei. De aceea sunt foarte necesare relatiile de corelare dintre constantele de viteza intr-o serie omoloaga de reactii si caracteristicile reactantului sau ale reactiei care se pot masura usor, ca de exemplu caracteristicile termodinamice. Intr-un numar mare de cazuri s-au stabilit dependente liniare intre logaritmii constantelor de viteza ki si logaritmii constantelor de echilibru Ki corespunzatoare de tipul :
lg ki = A + ρ lg Ki (1)
unde A si ρ sunt constante pentru seria de reactii considerate.
![]()
![]()
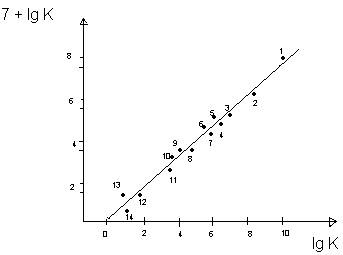 Zr4+ 1
Zr4+ 1
Th4+
Sc3+
Al3+
Fe3+
Be2+
Ga3+
Y3+
In3+
H+
La3+
Mg3+
En3+
Cd2+ 14
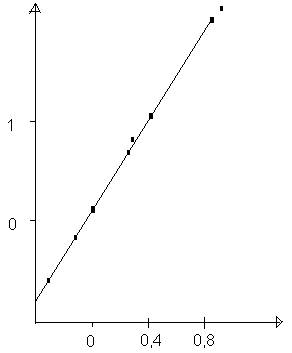
Fig. 40/145
Dependenta constantei de viteza a hidrolizei fluorurii de t-Bu sub efectul ionilor metalici de constanta de echilibru la formarea complecsilor metalici
k i
![]() (CH3)3CF
+Hen+ (CH3)3
COH + Men+F-
(CH3)3CF
+Hen+ (CH3)3
COH + Men+F-
Ki
![]() Men+ + F- [Men+F-]
Men+ + F- [Men+F-]
Ki= constanta de stabilitate a complecsilor formati de ionul F- cu aceleasi metale, adica constanta de echilibru a reactiei de mai sus
Relatia (1) poate fi scrisa si sub forma: (2)
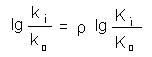
k0= constanta de viteza pentru un anumit component ales ca standard, iar K0= constanta de echilibru e reactiei standard
Deoarece :
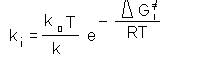
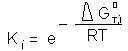
relatia (2) poate fi scrisa si
ΔGi≠−ΔG0≠=ρ(ΔGT,i0− GT,00) (3)
Adica Gi≠ depinde liniar de GT,i0. Aceste corelari au primit numele de relatii liniare de entalpie libera.
Printre cele mai cunoscute corelari de tipul (3) se afla ecuatia lui Hammett. Ea serveste la calculul constantelor de viteza ale reactiilor care au loc la catena laterala a nucleului benzenic si s-a stabilit la hidroliza esterilor acizilor benzoici substituiti in m- sau p- in raport cu centrul de reactie:
![]()
![]()
![]()

![]()
![]()
![]()
 O O
O O
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() C + HO-
C + HO- ![]() C + ROH
C + ROH
![]() O R O-
O R O-
R R
Drept caracteristica termodinamica a substituentului s-a ales constanta de ionizare a acidului benzoic substituit corespunzator ,K:
![]()
![]()
![]()

![]()
![]()
![]()
 O O
O O
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() C + HO-
C + HO- ![]() C + H3O+
C + H3O+
OH O−
R R
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() COO - H3O+
COO - H3O+
![]()
![]() X
X
![]()
![]()
![]()
![]()
![]()
![]()
![]() X COOH
X COOH
De aceea termenul lg(K/K0) notat cu in relatia Hammett este o caracteristica a substituentului. H este considerat ca standard, iar K0 este constanta de ionizare a acidului benzoic
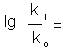
ρσi (4)
 p-NO2
p-NO2
m-NO2
![]()
m-Cl
p-Br
p-Cl
m-CH3
p-CH3
p-OCH3
![]()
In
conformitate cu conventia adoptata, substituentii care maresc densitatea de
electroni la centrul de reactie si deci micsoreaza
Substiutenti care micsoreaza densitatea de electroni la centru de reactie au σ>0.
este constanta in seria de rectii de acelasi tip si are alta valoare pentru alte serii de reactie.
ρ caracterizeaza sensibilitatea recatiei date fata de variatia densitati electronice la centrul de reactie . De exemplu pentru hidroliza alcalina a etilbenzoatilor substituiti in etanol 85% ρ=2,6 => reactia este considerabil accelerata de cresterea densitatii electronice la centrul de reactie. Acest fapt este perfect explicabil dat fiind faptul ca centrul reactional este un centru electrofil atacat de nucleofilul HO -. Spre deosebire de acest caz, la benzoilarea aminelor aromatice, in care gruparea amino este un centru nucleofil atacat de un agent de benzoilare electrofil, cresterea densitatii electronice are ca efect cresterea constantei de viteza si prin urmare reactia are ρ = - 2,8.

![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]() NH2 + C2H5CO+
NH2 + C2H5CO+ ![]() NHCOC6H5 + H+
NHCOC6H5 + H+
X X
Reactia
ArCOOH → ArCOO− + H+ 1
ArBr + R′OH → ArOR′ + HBr 4,981 ( R′ = C5H9 )
ArCOOC2H5 + HO− → ArCOOH + C2H5O− 2,768
ArCH3 + Br2 → ArCH2Br + HBr −1,085
ArNH2 + C6H5CO+ → ArNHCOC6H5 + H+ −2,8
Valori σ pentru diferiti substituenti
|
X |
σp |
σn |
|
OH OCH3 CH3 Cl NO2 |
−0,37 −0,268 −0,17 +0.227 +),778 |
+0,121 +0,115 −0,069 +0,373 +0,710 |
pentru un numar mic (minimum 2) de derivati substituiti (numar indispensabil pentru calculu lui ρ) sa se obtina prin calcul constantele de viteza pentru toti ceilalti derivati pentru . care sunt cunoscute constantele σ.
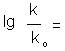 Relatia (4) nu poate fi aplicata in cazul
derivatilor benzenului substituiti in o, caci ea nu tine seama de influenta
sterica exercitata de substituenti. O relatie mai generala, valabila si pentru
reactiile compusilor alifatici la care impiedicarile sterice joaca un rol important, este relatia Taft.
Relatia (4) nu poate fi aplicata in cazul
derivatilor benzenului substituiti in o, caci ea nu tine seama de influenta
sterica exercitata de substituenti. O relatie mai generala, valabila si pentru
reactiile compusilor alifatici la care impiedicarile sterice joaca un rol important, este relatia Taft.
ρ* σ* + δES (5)
2 parametri: σ* caracterizeaza influenta pe care o exercita substituentul asupra densitatii electronice a centrului de reactie.
ES caracterizeaza influenta sterica a substituentului .
Constantele ρ* si δ caracterizeaza respectiv sensibilitatea reactantilor de tipul considerat la variatia densitatii electronice si la impiedicari sterice.
Deoarece factorii preexponentiali pot fi evaluati in cazul reactiilor elementere cu ajutorul teoriei vitezelor absolute de reactie, se acorda un mare interes posibilitatii de estimare, prin mijloace corelative a valorilor energiilor de activare. Exemplu: relatia Polanye-Semensv (?)leaga energia de activare E* de efectul termic al reactiei,Q
E*= 11,5 - 0,25 | Q | (6)
Valorile pentru reactiile homolitice:
![]()
Eex = 11,5 - 0,25 |Q|
Eend = 11,5 + 0,75 |Q|
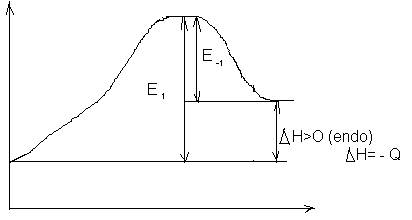 E-1=11,5
- 0,25 |Q| (exo)
E-1=11,5
- 0,25 |Q| (exo)
E-1=E1 - |Q|
E1=11.5 - 0,25 |Q| + |Q| =11,5 + 0,75 |Q| (endo
Ex. 1
r.necat.
![]() C2O4-4 +
ClO- + 2H+ → 2CO2 + Cl-+H2O
C2O4-4 +
ClO- + 2H+ → 2CO2 + Cl-+H2O
cat.
![]() Cl O-+2H ++2Fe2+→
2 Fe3++ H2O+Cl -
Cl O-+2H ++2Fe2+→
2 Fe3++ H2O+Cl -
![]() 2Fe3++C2O42-→2CO2+2Fe2+
2Fe3++C2O42-→2CO2+2Fe2+
ClO2+2H++C2O42-→2CO2+Cl-+H2O
Ex.2
Oxidarea acidului oxalic: reactia de manganometrie
7+
2MnO4- + 5C2O42- + 16H+→ 2Mn2+ + 10CO2 + 8H2O
-1 = r-8 =>r=7
reactia autocatalizata de Mn2+
Ex.3
Oxidarea iodurilor cu disulfat de K:
2I - + S2O82- → I 2+2SO42-
este catalizate de Fe2+
Cu2+ foarte putin active, dar Cu2++Fe2+ foarte activi
Cu2+ promoter al catalizei cu Fe2+
Copyright © 2026 - Toate drepturile rezervate