 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Generalitati
Definirea pigmentilor
Pigmentul este o molecula sau macromolecula insolubila, ce are proprietatea sa absoarba unde cu lungimi specifice. Pigmentul deci are o anumita culoare specifica, pe care o transmite celulelor, tesuturilor, materialelor, ce contin pigmentul dat.
Pigmentii anorganici sunt substante albe sau colorate, fin dispersate, insolubile in apa si solventi, care poseda proprietati fizice si chimice corespunzatoare scopului urmarit la utilizare si din care, cu ajutorul liantilor, se pot pregati vopsele adecvate acoperirii suprafetelor, cerneluri poligrafice etc. Folosirea pigmentilor in vopsele urmareste scopuri decorative, protejarea suprafetelor, marirea rezistentei peliculelor aplicate si alte scopuri speciale.
Pigmentii ceramici fac parte din categoria pigmentilor anorganici. Ei se definesc ca fiind silicati, silico-aluminati sau alte combinatii anorganice ale metalelor tranzitionale cu proprietati colorante, care introdusi in mase ceramice sau glazuri le confera acestora culori a caror intensitate este influentata de proportia de adaugare, de conditiile de ardere si de compozitia fondantilor insotitori. Un rol important in categoria pigmentilor il ocupa cei cu rezistenta la temperaturi ridicate si la agresivitatea topiturii generatoare de pelicule acoperite
Clasificarea pigmentilor
Pigmentii
pot fi anorganici sau organici. Pigmentii
anorganici se deosebesc de cei organici prin
greutatea specifica mai mare, particule elementare mai mari, putere de colorare
in general mai mica, rezistenta mare la lumina si intemperii, nuante mai putin
vii, indicele de absorbtie de ulei mai scazut.
Clasifcarea pigmentilor anorganici
si organici este posibila pe baza mai multor criterii:
compozitia,culoarea,provenienta si domeniul de utilizare.
Pigmentii din punct de
vedere al provenientei si compozitiei:
. Pamanturi colorate, care sunt produse naturale provenite din diferite
zacaminte si roci. Cele mai importante sunt ocru,
. Materiale de umplutura, care sunt substante naturale obtinute din zacaminte
si roci ca de exemplu : barita, mica, talcul, diatomita, creta, azbestul si
dolomita ;
. Pigmenti anorganici
sintetici ca :ZnO, TiO , ultramarin,
galben de crom;
Pigmenti
organici sintetici :se prepara cu ajutorul colorantilor organici.
. Pigmenti metalici, constituiti din particule fine
de metal ca : pulbere de Al, bronzuri.
Pigmentiitii anorganici dupa modul de fabricare :
. Pigmenti naturali - obtinuti prin operatii fizice
(macinare, sitare, flotatie etc) ;
. Pigmenti sintetici - obtinuti prin precipitare sau
prin (precipitare urmata de) calcinare.
Pigmentii clasificati dupa forma de prezentare :
pigmenti micronizati,
pigmenti liofilizati,
paste flusate,
chipsuri
Pigmentii sunt constituenti esentiali ai lumii vii, iar contributia lor la evolutia si mentinerea vietii este evidenta.Exista o serie de documente ce atesta folosirea pigmentilor in diverse domenii inca din antichitate.
La inceput, in calitate de pigmenti s-au folosit materiale naturale, aflate la indemana omului primitiv, ca de exemplu: pamanturi bogate in oxizi de fier, carbune de lemn, creta,etc.Cu timpul, in urma evolutiei vietii, din nevoia gasirii unor noi materiale colorate, s-a ajuns la folosirea focului in obtinerea de pigmenti, respectiv pentru arderea ocrului. Pigmentii "arsi" s-au impus de la sine, arderea culorilor de pamant putandu-se pune probabil in legatura directa cu olaritul, care a aparut in neolitic, deci cu 2000 de ani i.e.n
Pigmentii minerali pe baza de cupru, fier, mangan,au fost cunoscuti si utilizati in Babilon, Egipt si China cu mii de ani i.e.n.Cobaltul a fost introdus in portelanul chinezesc in timpul dinastiei T`ang (618-906 i.e n.), iar in Europa, din secolul XV.In evul mediu, tehnicile de pictare si colorare s-au dezvoltat; s-au adaugat:galbenul de Neapole si lazurit-silicat natural de aluminiu si sodiu, asociat cu sulfura de sodiu-culoare albastru intens.
Inceputul industriei culorilor minerale se situeaza insa de abia in secolul al XVIII-lea. Dupa descoperirea intamplatoare a albastrului de Berlin (Fe [Fe(CN) ] ),de catre Diesbach in 1704, a trecut inca o vreme pana cand a inceput epoca descoperirilor in domeniul pigmentilor:verdele de Rinmann, albastru de cobalt, cinabru,etc.
In anul 1777, C.F.Wenzel descrie culoarea albastra obtinuta prin incalzirea aluminei cu compusi ai cobaltului pentru ca, in anul 1805 L.J.Thenard sa obtina acelasi pigment albastru, aluminat de cobalt, prin incalzirea celor doi oxizi sau hidroxizi. Utilizarea compusilor cromului ca si pigmenti este mai recenta, ei fiind folositi pentru prima data la Sevres in anul 1802. In anul 1931, Holgerson si Herlin au preparat pentru prima data ortotitanatul de cobalt prin topirea unui amestec de oxid de cobalt si oxid de titan. C.A.Seabright a descoperit noi pigmenti albastri si verzi prin introducerea vanadiului in reteaua silicatului de zirconiu, punand astfel bazele unei noi clase de pigmenti in anul 1948.
Studiul pigmentilor anorganici a cunoscut in ultimii ani o dezvoltare considerabila, datorita necesitatii utilizarii in industrie a unor materiale de decorare cu proprietati artistice superioare, de lunga durata.
Spre deosebire de colorantii
organici, colorantii ceramici au o rezistenta ridicata, o claritate a
nuantelor, precum si o durata lunga de viata. cu proprietati superioare. Depunerea unor coloranti ceramici pe
suprafata obiectelor, permite sa se obtina figuri artistice superioare, de
lunga durata. In functie de domeniile de utilizare, limitele minime impuse
termorezistentei pigmentilor sunt cu aproximatie
urmatoarele:
- 200-250 °C pentru colorarea maselor plastice tip PVC,polistiren;
-400 °C pentru colorarea teflonului;
-900 °C pentru colorarea emailului;
-1250 °C pentru colorarea ceramicii fine.
Pigmenti termorezistenti
Pigmentii termorezistenti se apreciaza pe baza proprietatilor care pot fi valorificate in cursul utilizarii. Deoarece pigmentii au utilizari multiple, respectiv in grunduri, vopsele de ulei, emailuri, cerneluri, vopsele emulsionate, vopsele praf, materiale plastice, cauciuc, cimenturi, pretentiile privind proprietatile lor sunt la fel de multiple.
Un pigment nu poate face fata la toate utilizarile (care sunt foarte diverse), de aceea pentru fiecare scop se alege pigmentul cel mai potrivit.
Astfel,in grunduri se utilizeaza pigmentii anticorozivi (de exemplu miniu de plumb, fosfati sau tetraoxicromat de zinc), care insa in pelicule de acoperire nu pot fi utilizati din cauza puterii de acoperire mai redusa.Pentru acestea se utilizeaza pigmenti cu putere de acoperire mai mare, ca de exemplu albastru de fier, galben de crom, rosu molibden, pigmenti organici.
Negrul de fum utilizat ca pigment in industria cauciucului, pe langa efectul de colorare, are si un rol de intarire a structurii cauciucului.
Pigmentii
anticorozivi, antivegetativi, termoindicatori sau luminescenti au proprietati
specifice definite prin denumirea lor.
Pigmentii sunt practic insolubili, spre deosebire de
coloranti care sunt solubli in apa, lianti si solventi
Un pigment termorezistent prezinta urmatoarele caracteristice:
Culori:clare, luminoase;
Granulatie: cat mai fina ;
Rezistenta si stabilitate la temperaturi ridicate;la actiunea razelor UV;la agenti corozivi externi ;
Indicele de refractie a luminii cat mai ridicat;
Solubilitate cat mai redusa in matricea vitroasa a straturilor care se coloreaza.
Domeniu de utilizare
Pigmentii termorezistenti se utilizeaza la obtinerea unor produse din urmatoarele domenii:
Ceramica, email, sticlarie;
Glazuri ceramice colorate;
Emailuri colorate pentru tabla de otel, fonta, cupru si aluminiu;
Coloranti de uscare la rece;
Mase plastice;
Lacuri si vopsele;
Zugraveli, freasca, finisari interioare si exterioare a constructiilor.
Importanta economica a pigmentilor anorganici:
Consideand intregul domeniu al pigmentilor, sub raport cantitativ, vom constata ca
productia mondiala de pigmenti organici reprezinta
numai o zecime din productia mondiala de pigmenti anorganici.
Nici din punct de vedere al valorii sale, productia de pigmenti organici nu o intrec pe aceea a pigmentilor anorganici.Acest rezultat devine explicabil daca examinam mai de aproape domeniile de intrebuintare ale celor doua clase de pgmenti.
Pigmentii derivati din gudron au ca scop exclusiv acela de a colora. Cantitatea de pigment organic este redusa, in raport cu cantitatea de material care se coloreaza.
In schimb, pigmentul mineral are un rol mai variat. El nu serveste numai la colorat, ci constituie, in majoritatea cazurilor o parte componenta insemnata a materialului care urmeaza sa fie colorat, avand o importanta deosebita atata din punct de vedere mecanic cat si chimic.
Domeniul pigmentilor organici este industria fibrelor, in sensul cel mai larg, pe cand pigmentii anorganici intra in compozitia vopselelor si lacurilor, cu care se acopera suprafete cum ar fi de exemplu cele din interiorul si exteriorul cladirilor.Sunt substante colorate insolubile.
Cu lianti si dizolvanti ei formeaza dispersii a caror finete depinde de gradul de macinare a pigmentului.
Metode generale de fabricare a
pigmentilor anorganici
A.Procedee de fabricare
Pigmentii anorganici se fabrica in general prin trei metode :
Metoda uscata prin calcinare;
Metoda umeda, prin precipitare;
Metoda mixta, prin precipitare, urmata de calcinare.
In continuare vom aminti cei mai importanti pigmentii din cele trei metode:
Pigmentii de calcinare:
Oxidul de zinc;
Oxidul verde de crom;
Galbenul si rosul de cadmiu;
Oxidul rosu de fier;
Ultramarinul;
Albastrul de cobalt.
Pigmentii de precipitare :
Galbenul de crom;
Verdele de crom;
Albastrul de fier;
Oxidul galben si negru de fier;
Fosfatii;
Rosu molibden.
Pigmentii obtinuti prin metoda mixta:
Bioxidul de titan;
Litoponul;
Oxidul rosu de fier.
Schema procesului tehnologic este urmatoarea
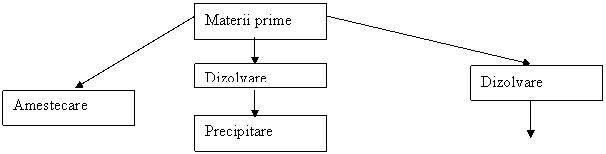
Precipitare![]()
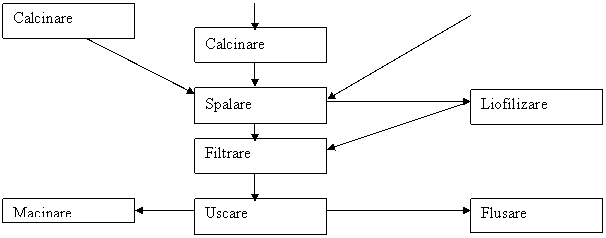
Fazele de finisare sunt identice pentru toate cele trei metode.Nu este obligatoriu ca fiecare pigment sa treaca prin toate fazele tehnologice.Unii pigmenti de calcinare, la care continutul in saruri solubile este minim, nu se spala, ci se trec direct la macinare.Liofilizarea se efectueaza numai la unele sortimente.O mare parte a materialelor de umplutura trec numai prin fazele de sortare si macinare, fara spalare, filtrare si uscare.Ca urmare, fiecare pigment are procesul lui tehnologic caracteristic si in acest capitol se indica numai notiunile fundamentale ale acestor metode.
Pregatirea materiilor prime, ca prima faza a fabricatiei, are un rol hotarator asupra calitatii produselor.Impuritatile si duritatea apei utilizate influenteaza in mod vizibil nuanta pigmentilor obtinuti.Printre criteriile primordiale care concureaza la obtinerea produselor cu calitati constante, este constanta materiilor prime utilizate si absenta impuritatiilor daunatoare.
Procedeul prin calcinare.
La fabricarea pigmentilor, calcinarea poate sa aiba diferite scopuri:
Deshidratarea, ca in cazul fabricarii oxidului rosu de fier;
Oxidarea, la fabricarea miniului de plumb;
Reducerea, la obtinerea oxidului verde de crom;
Transformarea formei de cristalizare intr-o forma dorita, ca in cazul galbenului si rosului de cadmiu, oxidului de zinc sau litoponului;
Formarea combinatiilor dorite prin contopire,ca la albastrul de cobalt;
Cresterea dimensiunilor particulelor prin sinterizare la produsele coloidale, pentru a ajunge la particule de marime optima, care ofera cele mai bune efecte de pigmentare.Particulele primare de litopon cu diametrul de 0,03-0,07 µm.
Nu este de dorit ca durata si temperatura calcinarii sa depaseasca valorile optime, fiindca prin sinterizarea exagerata a particulelor de pigmenti, proprietatile lor de pigmentare scad.In unele cazuri, pentru oprirea sinterizarii la momentul optim se aplica scufundarea in apa a pigmentului incins, aburul format avand un efect favorabil asupra texturii pigmentului si asupra eliminarii mai rapide a substantelor solubile in apa prin spalare.
Procesul de calcinare poate fi exprimat termodinamic prin ecuatia lui Helmholtz, in modul urmator:
![]() sau
sau ![]()
Unde:
R-constanta universala a gazelor;
T-temperatura, in grade absolute, K;
M-greutatea moleculara;
d -densitatea lichidului;
P -presiunea de vapori a particulei avand raza r ;
P -presiunea de vapori a particulei avand raza r .
Din aceste ecuatii reiese ca presiunea de vapori a particulelor, cu raza mai mare, este mai mica, deci pigmentul tinde spre sinterizare in cursul calcinarii.
Procedeele industriale de calcinare se realizeaza in cuptoare cu vatra, in cuptoare cu mufa, in cuptoare rotative sau in cuptoare cu strat fluidizat.Pigmentii pot fi in contact direct cu flacara desi exista pericolul de impurificare a produselor, sau indirect in mufe sau tuburi rotative cu pereti dubli.Incalzirea in flacara directa este mai eficace in unele cazuri, dar la obtinerea sortimentelor cu calitati superioare se utilizeaza incalzirea indirecta a amestecului de reactie.
La procesele care au la baza topirea masei de ractie, ca de exemplu la albastrul de cobalt, se utilizeaza adaosuri de substante (1-2%) care coboara temperatura de fuziune a masei de reactie.Aceste adaosuri de substante se elimina ulterior, la spalarea pigmentului.
Obtinerea sortimentelor de pigmenti din amestecuri de componenti este posibila, numai atunci cand, omogenizarea reactantilor s-a efectuat perfect, astfel pigmentul rezultat va fi omogen si de calitate inferioara.
Procedeul prin precipitare.
La procedeele de fabricare a pigmentilor pe cale umeda prima faza tehnologica este dizolvarea reactantilor.Aceasta dizolvare se efectueaza in vase cilindrice verticale, prevazute cu agitatoare, cu racorduri la apa, abur, canalizare, protejate la nevoie contra coroziunii.Concentratia solutiilor se regleaza la valorile indicate si la nevoie se realizeaza purificarea lor prin sedimentizare sau filtrare.Solutiile pot fi preparate pentru fiecare sarja in parte sau pot fi stocate in vase mai mari.
Precipitarea pigmentilor din solutiile preparate se efectueaza de asemenea in vase cilindrice verticale de 5-50cm³, prevazute cu: agitator, incalzitor cu abur, conducta cu apa, de golire si termometru.Vasele de dizolvare, precipitare si spalare se confectioneaza de preferinta din lemn de brad fara noduri, care prin continutul natural de rasini, rezista mai bine la apa si solutii de substante chimice, decat celelalte materiale lemnoase.In unele cazuri cazile se confectioneaza din otel inoxidabil V A sau din beton protejat cu caramizi antiacide.Agitatoarele cu palete se confectioneaza tot din lemn de brad, iar turboagitatoarele din otel inoxidabil V A.Racordarile la apa , abur, pompe de transvazare si tijele de termometre se confectioneaza din material antiacid.
Gradul de dispersie a pigmentilor precipitate depinde in prima faza de concentratia solutiilor utilizate, de temperatura precipitarii, durata precipitarii si durata agitarii dupa precipitare, precum si de durata fazei de spalare, respective durata stationarii pigmentului in fazele de precipitare si uscare.
Spalarea pigmentilor este necesara in vederea eliminarii substantelor solubile in apa din pigmenti, atat la sortimentele obtinute prin calcinare, cat si la cele rezultate in urma precipitarii.Deosebirea consta in faptul ca la pigmentii obtinuti prin calcinare, inaintea spalarii este necesara o premacinare uscata sau umeda a pigmentului.
Spalarea pigmentilor necesita in general 80-120m³ apa la o tona de pigment, in functie de modul de spalare.Daca spalarea se efectueaza prin decantari repetate, se urmareste o depunere cat mai rapida si cat mai completa a pigmentului in vedere decantarii unei cantitatii cat mai mari de apa.Eliminarea substantelor solubile nu depinde numai de numarul apelor schimbate, ci si de volumul suspensiei ramase in cuva de spalare dupa decantare, de raportul pigment-apa, de temperatura si de duritatea apei utilizate.
Viteza de sedimentare a pigmentilor in faza de spalare influenteaza sensibil capacitatea intregii instalatii.Pentru marirea vitezei de sedimentare a pigmentilor se utilizeaza floculanti in proportie de 0,05-0,1% fata de pigment.
Tot pentru marirea vitezei de spalare se utilizeaza metoda de lucru prin care suspensia pigmentului format, impreuna cu apa-mama se introduce in filtre prese, iar turtele de pigment se suspenda din nou in apa de spalare.Operatia se repeta de 2-3 ori, reducand timpul de spalare cu 50-60%.Nu este indicate spalarea pigmentilor in filtre-prese, fiindca nu se poate realize o spalare uniforma si de buna calitate.Spalarea se continua pana la reducerea continutului in substante solubile in apa sub valoarea prescrisa.
Filtrarea suspensiilor de pigmenti se efectueaza in modul cel mai adecvat cu ajutorul filtrelor prese de diferite constructii, la o presiune de filtrare de 3-6 atm.Viteza de filtrare este mult ameliorata prin utilizarea floculantilor in faza de spalare.Totodata pigmentii formeaza aglomerati mai putin compacte, obtinand o textura mai moale.
B.Procedee de finisare a pigmentilor.
Procedeele de finisare a pigmentilor, prin care li se confera forma fizica necesara asigurarii unei bune pigmentarii, sunt:
Procedeul de uscare si macinare a pigmentului obtinut dupa sinteza propriu-zis prin care se obtin pigmentii sub forma de pulberi;
Procedeul de flusare prin care pastele apoase de pigment rezultate din sinteza sunt transformate direct in paste uleioase;
Liofilizarea pigmentilor.
Toate procedeele de finisare pornesc de la paste apoase de pigment.Sinteza pigmentilor poate fi realizata in astfel de conditii, incat acestia se obtin in final intr-o forma in care sa corespunda procedeului de finisare. In cazul procedeelor amintite se poate actiona in cadrul sintezei la faza de precipitare a pigmentului.De obicei in cazul pigmentilor utilizati ca pulberi uscate, precipitarea trebuie condusa astfel incat sa nu se ajunga la particule prea fine, coloidale, deoarece dupa uscare produsele vor avea o textura dura.
In cazul cand pigmentii sunt finisati prin procedeul de flusare, se urmareste ca la precipitare sa se obtina particule cat mai fine, deoarece cu cat particulele vor fi mai fine, cu atat vor fi imbunatatite caracteristicile produsului, ca: puterea de colorare, puterea de acoperire,finetea.
Procedeul prin uscare si macinare.
Pastele de pigment asa cum se obtin in final dupa spalare si filtrare, contin 30-50% pigment, independent de dimensiunile particulelor, de natura agregatelor formate si de gradul de hidratare.
Din aceste paste pigmentii pot fi prelucratii in doua feluri:
Eliminarea apei prin uscare in aparate uzuale ca uscatoare cu tavi, uscatoare cu benzi, uscatoare rotative, urmata de macinare;
Eliminarea apei prin uscare in dispozitive speciale-atomizare, cu sau fara macinare ulterioara.
Uscatoarele cu tavi tip dulap contin de obicei 10-15 randuri de tavi, asezate la distante de 10-15 cm, cu cate 1 m² suprafata pe care pasta de pigment se aseaza in straturi de 2-5 cm grosime.Incalzirea aerului se asigura prin calorifere, iar schimbul de aer prin ventilatoare.Durata uscarii la 75-80 °C, este de 2-4 zile.
Uscatoarele cu benzi sunt uscatoare continue, incarcarea pastelor si desfacerea pigmentului uscat facandu-se mecanizat.
Suprafata expusa uscarii este mai mare decat in cazul precedent, reducandu-se timpul de uscare, deci si stationarea pigmentului in mediu umed la temperatura ridicata si se evita astfel alterarile pigmentilor in aceasta faza.
In cursul procesului de uscare se produce o agregare hidrofila si anume, la indepartarea apei particulele sunt supuse unor forte de compresie care provoaca agregarea.Aceste forte de compresie se datoresc lucrului mecanic pozitiv de adeziune dintre toate componentele solide si lichide, la care se adauga valoarea ridicata a lucrului mecanic de coeziune a apei.
Pentru evitarea unei texturi dure se recomanda ca pigmentul sa nu se precipite la finite prea mare, daca se poate la temperatura mai ridicate, micsorand gradul de hidratare si marind dimensiunile particulelor.
Macinarea si micsorarea pigmentilor si a materialelor de umplutura se efectueaza cu diferite sisteme de mori cu bile, dezintegratoare, mori cu jet si separatoare pneumatice. Acestea din urma sunt de obicei cuplate cu unul din sistemele de macinare amintite si sorteaza materialul macinat in fractia fina, care se ambaleaza, si in fractia grosiera, care se recircula la sistemul de macinare.
Procedeul de flusare
Flusarea este procedeul prin care un pigment este transferat direct dintr-un mediu apos intr-un mediu uleios, astfel incat pigmentul si uleiul sa formeze o masa coerenta din care sa fie eliminate cea mai mare parte a apei.
In procedeul de flusare se elimina faza de uscare, ca urmare se evita agregarea hidrofila si macinarea ulterioara a masei uscate, totodata particulele de pigmenti isi mentin gradul de dispersie initial din faza de precipitare sub forma de aglomerate usor legate.
Drept medii de dispersii uleioase se folosesc liantii de vopsele, liantii de cernelurii tipografice, sau lichide speciale care se adauga ulterior in vopsele.
In procesul de flusare pigmentii sunt transferati din faza apoasa in faza uleioasa prin amestecarea turtelor apoase in malaxoare basculante de tip Werner-Pfleiderer a caror actiune mecanica favorizeaza inglobarea particulelor de pigment in liant. Separarea apei are loc cu atat mai repede cu cat malaxarea se face mai energic si cu cat continutul in apa al pastei este mai mic.
Deoarece procesul de flusare se desfasoara in doua trepte (decantarea si incalzirea sub vid), aceste operatii se pot efectua in doua dispozitive independente, sau pentru a folosi intreaga capacitate a masinii, incarcarea se face treptat, adica dupa eliminarea in prima treapta a apei se adauga noi cantitatii de pasta si liant si se separa din nou in apa.
PIGMENTI CU STRUCTURA SPINELICA
Spinelii sunt compusi oxidici cu formula generala AB O cristalizati in sistemul cubic.Denumirea deriva de la mineralul spinel, MgAl O cu aceeasi structura.
In formula Am+ Bn + O , A si B sunt cationic metalici care trebuie sa respecte conditia: 1*m+2*n=8.Aceasta inseamna ca m=2, n=3 sau m=4, n=2 si mai rar m=6,n=1.
Celula elementara a retelei spinelice contine opt unitati AB O si are ocupate opt goluri tetraedrice si 16 goluri octaedrice.In functie de modul de ocupare a acestor goluri spineli pot fi:
Normali- in care cationii A sunt plasati in golurile tetraedrice, iar B ocupa golurile octaedrice.Pentru a scoate in evidenta acest aranjament al cationilor, se foloseste paranteza dreapta pentru cationii coordinate octaedric: (A 2+)[B3+] O .
Un exemplu tipic de spinel normal este Mg[Al ]O
Inversi- in care cationii B se afla 50% in goluri tetraedrice si 50% in goluri octaedrice, iar cationii A se afla in cealalta jumatate din golurile octaedrice ocupate: (B3+)[A2+B3+] O
Ex: Fe3+ [Fe2+Fe3+] O , Fe3+ [Co2+Fe3+]O
Micsti- in care ocuparea golurilor tetraedrice si octaedrice de catre cationii A si B este statica.Atat cationii A cat si B se afla in ambele tipuri de goluri. Ex:Ni 2+ Al 3+ [ Ni 2+Al 3+] O
Pentru desemnarea tipului structural al unui spinel, se utilizeaza factorul de ocupare, notat cu . Acesta prezinta fractiunea de atomi B aflati in pozitii tetraedrice.Pentru spinelul normal: =0, iar pentru un spinel invers =0,5.
|
B |
Mg2+ D0 |
Mn2+ D5 |
Fe2+ D6 |
Co2+ D7 |
Ni2+ D8 |
Cu2+ D9 |
Zn2+ D10 |
|
Al3+ d0 |
0 |
0 |
0 |
0 |
0.38 |
0 | |
|
Cr3+d3 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Fe3+d5 |
0.45 |
0.1 |
0.5 |
0.5 |
0.5 |
0.5 |
0 |
|
Mn3+d4 |
0 |
0 |
|||||
|
Co3+d6 |
0 |
0 |
Se poate remarca faptul ca ionii A si B cu configuratii electronice d0 favorizeaza structura spinel normal.Atunci cand A2+este un ion d6,d7,d8 sau d9, iar B3+ este Fe3+este favorizata structura spinel invers.Aceasta preferinta este legata de stabilizarea ionilor d6-d9 in campul octaedric al liganzilor, concomitant cu absenta stabilizarii in acelasi camp pentru ionii Fe3+ (d5).
Structura spinelica sta la baza unei game largi de pigmenti termorezistenti bazati pe substitutiile multiple atat intre cationii divalenti cat si intre cei trivalenti.Asocierea unor ioni necromofori (Zn2+, Mg2+,Al3+) in proportii variabile, cu unul sau mai multi cationic cromofori (Co2+,Ni2+,Cr3+,Fe3+) conduce la o gama foarte variata de culori si nuante.
Compozitia si culoarea unor pigmenti cu structura spinelica
|
Nr. |
Compozitia |
Culoarea |
|
1 |
CoAl O |
Albastru intens(albastrul lui Thenard) |
|
2 |
Co1-xZnxAl O |
Albastru a carui intensitate scade odatat cu cresterea lui x |
|
3 |
ZnAl2-xCrxO |
Roz (pentru x<0.16) |
|
4 |
CoCr O |
Verde albastrui intens |
|
5 |
Co1-xZnxAl2-yCry O |
Nuante de albastru verzui |
|
6 |
ZnAl2-x-yFex3+CryO |
Nunate de maro (brun-galbui,brun-oranj,brun scortisoara,brun rosiatic) |
|
7 |
ZnCr2-x-yFex3+NiyO |
Brun (Cuba) |
|
8 |
Co1-xFex2+Fe 3+O |
Negru |
|
9 |
Co1-xFex2+Fe2-y3+CryO |
Negru |
|
10 |
Fe1-xMnx2+Fe2-y3+Mny3+O |
Negru |
|
11 |
CuCr O |
Negru |
|
12 |
Co1-x-yNixCuy2+Fe2-z-vCrzMnv3+O |
Negru |
|
13 |
Co TiO4 (spinel invers) |
Verde-inchis |
|
14 |
Co xZnxTiO4 (spinel invers) |
Verde |
|
15 |
Fe TiO4 |
Maro |
Interes practic pentru pigmentii termorezistenti prezinta in special spinelii cu formula AB O in care A reprezinta cationic divanti, iar B cationic trivalenti.Acesti pigmenti prezinta o buna stabilitate la agresivitatea topiturilor generatoare de glazuri sau emailuri.
Compozitia rationala a acestor pigmenti presupune un raport molar:
Σ oxizi metale divalente Σ oxizi metale trivalente = 1/1
Daca in pigment sunt prezenti cationic de exemplu Co3+ sau chiar Mn3+, riscul reducerii lor la Co2+ respective Mn2+ in timpul arderii glazurii este relative mare.In timpul reducerii se elibereaza surplusul de oxigen, ceea ce genereaza defecte ale stratului de glazura.
Culoarea pigmentului depinde de :
Natura cationilor cromofori
Numarul si proportia cationilor cromofori prezenti in compozitia spinelului
In cazul multor cationi divalenti si trivalenti cu respectarea stoichiometriei AB O si in conditii de sinteza corespunzatoare rezulta o solutie solida spinelica.
Structura spinelica in cauza, putand face ca de la un singur ion metalic cum ar fi Fe2+ sau Co2+, in cazul CoO*SnO sau CoO*TiO sa avem de-a face cu doi cromofori ca urmare a prezentei cationului respective in doua stari de oxidare.
ZnO
Zincul este un metal cenusiu albastrui, care isi pierde luciul in aer, acoperindu-se cu un strat protector de oxid. Cristalizeaza in sistemul hexagonal. Are duritate mica - 2,5 in scara Mohs. Este destul de casant la temperatura obisnuita, dar devine maleabil la 100 - 150ºC, cand poate fi tras in foi. Peste 200ºC devine din nou casant, incat poate fi maruntit (pulverizat) in mojar. La temperaturi foarte joase (0,79K) devine supraconductor. Zincul formeaza multe aliaje de mare importanta tehnica, intre care cel mai utilizat este aliajul Cu - Zn, alama.
Zincul are in general comportare chimica asemanatoare, reactioneaza usor cu acizi neoxidanti, cu eliminare de hidrogen si formare de ioni pozitivi M2+:
. De exemplu: Zn + H SO4 = ZnSO4 + H
Zincul se dizolva si in alcalini cu formare de tetra-hidroxo-zincati, deci are un caracter slab amfoter:
. De exemplu: Zn + 2NaOH + 2H O = [Zn(OH) 4] 2- + 2Na2+ + H
Acest compus este similar cu aluminatii si mai poate fi formulat:
. Na[Zn(OH) 3.H O] sau Ma[Zn(OH) 3.(H O)3].
Zincul se dizolva in baze si reactioneaza direct la cald cu oxigenul cu formare de oxizi, MO.
Oxidul de zinc este utilizat in principal ca pigment alb, in industria cauciucului, in industriile materialelor plastice, hartiei si celulozei, dar si in industria farmaceutica si cosmetica. In procesul de zincare termica, la suprafata bailor de zincare se formeaza cenusa de zinc, ce reprezinta o valoroasa sursa secundara de zinc datorita continutului de zinc total de aproximativ 80%
Zincul este cel de al 25-lea dintre cele mai comune elemente naturale ale scoartei terestre si o inerenta parte a mediului nostru inconjurator. Zincul nu este prezent doar in roci si sol; el este, de asemenea, prezent in aer, apa si biosfera . Zincul este un element esential pentru toate vietuitoarele de la om pana la cele mai mici microorganisme.
Zincul este al 4-lea dintre cele mai des utilizate elemente, dupa fier, aluminiu si cupru, si are multiple utilizari comerciale si industriale. Albul de zinc folosit in prezent ca pigment a fost cunoscut inca din antichitate, de catre greci, care l-au folosit si ca medicament. Culoarea albului de zinc, in lipsa impuritatilor de cadmiu si plumb, este alba, la incalzire trece in galben, iar la racire devine din nou alba.
Caracterul bazic al albului de zinc se dovedeste prin formarea sapunurilor cu acizi grasi. Acest caracter se valorifica si in compozitia nitroemailurilor. In general, in peliculele aplicate la exterior, albul de zinc prezinta un efect protector impotriva razelor ultraviolete si prelungeste durata de viata a peliculelor deoarece absoarbe si transforma razele ultraviolete in lumina vizibila. Sarurile de zinc influenteaza uscarea si duritatea peliculelor in sens pozitiv. La sicativarea vopselelor pigmentate cu alb de zinc se utilizeaza saruri de cobalt si se evita utilizarea sicativilor de mangan, care accentueaza ingalbenirea peliculelor albe. In cazul vopselelor anticorozive, albul de zinc se utilizeaza impreuna cu pigmenti de plumb si oxid rosu de fier. Albul de zinc se utilizeaza in cantitati mari in industria cauciucului, in industriile materialelor plastice, hartiei si celulozei, textila, in ceruri, chituri, pudre si produse cosmetice, precum si la fabricarea pigmentilor (cromati de zinc).
Fe2O3
Se gaseste in natura sub forma de 'hematit'.
Poate fi obtinut prin calcinarea hidroxidului feric sau prin arderea piritelor:
2Fe(OH)3 = Fe2O3 + 3H2O
2FeS2 + 11/2O2 = Fe2O3 + 4SO2
Are culoarea rosie si este intrebuintat ca vopsea rosie.
Oxidul feric (Fe2O3) este cel mai comun oxid al fierului si se gaseste in natura sub forma de minereu de fier numit hematina.El se formeaza si prin actiunea lenta a agentilor atmosferici asupra fierului metalic.
Chimic pur se prepara prin calcinare precipitatului de hidroxid feric Fe(OH) 3,iar industrial prin calcinarea sarurilor de fier cu usoara tendinta de descompunere. Oxidul feric este opac pentru radiatii ultraviolete si infrarosii, proprietate ce isi gaseste aplicatii la fabricarea geamurilor termoabsorbante.
Oxidul de fier se gaseste sub doua forme polimorfe:
. a-Fe2O3,care este forma cristalina pentru temperaturi inalte, cristalizeaza romboedric. La temperaturi inalte (650 °C) se descompune in oxid feroferic (magnetic) Fe3O4 si oxigen, cu mare degajare de caldura:
3Fe2O3 = 2Fe3O4+1/2O2+45 000 cal
La temperaturi inalte (1100-1200 °C) reactioneaza cu CaO si Al2O3,din feriti si feritialuminati de calciu, compusi intalniti in ciment si materiale refractare.
. g-Fe2O3,care reprezinta modificatia cubica a oxidului feric,se obtine prin
dehidratarea lenta a Fe(OH) 3.
Pastrat mai mult timp la temperatura ordinara, forma g Fe2O3 trece in forma a-Fe2O3.Aceasta trecere se face mult mai usor la 500 °C.De mentionat ca forma g prezinta propeietatea magnetice ca si Fe4O3.
Fierul este un metal de culoare cenusie,se afla in grupa a-VII-a,relativ greu (7860 kg/m3),moale (duritate 60..70 HB),cu rezistenta mecanica medie (Rm=200..250 N/mm2) plasticitate buna(As=50%) si rezilienta buna (KCU=200..250 J/cm2).
Temperatura de topire a fierului este de 1539 °C si cea de fierbere de 2880 °C, electronegativitatea este de 1,64 si are o raspandire de 4,7%.
La temperatura ambianta, fierul are reteaua cristalina de tipul cub cu volum centrat si este feromagnetic. Prin incalzire la 910 °C, fierul isi modifica reteaua cristalina din cub cu volum centrat in cub cu fete centrate, iar la 1400 °C reteaua fierului devine iarasi cubica cu volum centrat.
Acest fenomen de modificare a tipului de retea cristalina la acelasi metal poarta numele de polimorfism (mai multe forme cristaline), iar fiecare dintre starile cristaline prezentate se numeste modificatie polimorfica.
Fierul are trei modificatii polimorfice, existente in trei domenii de temperatura
diferite si care se trasnforma una in cealalta, atat la racire cit si la incalzire.
Temperaturile de transformare dintr-o stare in alta sunt notate cu litere si anume A3=910°C si A4=1400 °C.
Fierul isi pierde feromagnetismul cand este incalzit la 770 °C (punctul Curie), devenind paramagnetic.
Elaborarea aliajelor feroase:
Aliajele feroase se obtin din minereuri de fier, care contin fierul sub forma de oxizi sau carbonati: hematitul si limonitul (Fe2O3), magnetitul (Fe3O4) si (FeCO3).Continutul de fier din aceste minereuri este de 30-60%, iar sterilul lor este silicios (SiO2) sau silicoaluminos (SiO2,Al2O3).
Procesul de baza in obtinerea aliajelor il reprezinta reducerea oxizilor de fier din minereu cu ajutorul cocsului si al oxidului de carbon, la temperaturi foarte inalte, intr-un cuptor inalt de tip special numit furn.
In furnal se introduc: minereu (care contine fier); cocs (care indeplineste mai multe roluri: este combustibillul necesar obtinerii temperaturilor inalte, contribuie la formarea oxidului de carbon care este agentul reducator de baza al oxizilor de fier, reduce direct la o parte din oxizi si carbureaza fierul topit transformandu-l in fonta topita); fondanti (materiale auxiliare necesare pentru a usura topirea sterilului si a-l indeparta sub forma de zgura; pentru sterilul silicios se foloseste calcarul, iar pentru cel silicoaluminos calcarul si dolomita): aer incalzit in instalatii speciale numite caupere (necesar arderi cocsului combustibil).
La temperatura din furnal CaCO3 se descompune cu formare de oxid de calciu, CaO, care reactioneaza cu impuritatile de silicati prezente in minereu (nisip sau argila), formand zgura. Aceasta este formata din alumino-silicati usor fuzibili si se aduna deasupra fontei topite, protejand-o astfel de oxidare. Fonta si zgura se elimina prin orificiile corespunzatoare pe la partea inferioara a furnalului. O parte din oxidul de carbon rezultat prin arderea cocsului se elimina, pe la partea superioara a furnalului, si este valorificat ca gaz combustibil.
Fonta mai contine in afara de carbon si alte impuritati ca Si, P, S, si Mn, are rezistenta ridicata dar este casanta (fragila) - de aceea este dificil de prelucrat. Elementele nemetalice trebuiesc eliminate pentru a reduce fragilitatea.
Reactiile chimice care au loc in furnal sunt:
3Fe2O3 (l) + CO(g) = 2Fe3O4(l) + CO2 (g)
Fe3O4 (l) + CO(g) = 3FeO(l) + CO2g
CaCO3 (s) = CaO(s) + CO2 (g)
FeO(l) + CO(g) = Fe(s) + CO2 (g)
C + CO2 = 2CO
In urma reactilor care au loc in furnal intre materialele incarcate rezulta urmatoarele produse:
. Fonta topita (numita si fonta bruta sau fonta de prima fuziune, care este produsul principal al furnalului);
. Zgura topita;
. Gaze de furnal (care se folosesc partial pentru preincalzirea aerului in caupere, partial in alte scopuri in cadrul combinatului siderurgic).
Cr2O3
CROMUL (Z=24 ; A=51,996)
Valenta : II ; III ; VI;
Sarcina : 2+ ; 3+ ; 6+;
Structura electronica :1s2 2s2 2p6 3s2 3p6 4s1 3d5;
Observatie: in cadrul Cr se observa o surpare de straturi ce face ca a lui configuratie sa fie o exceptie avand stratul d semicompletat prin sarirea unui electron din 4s in 3d.
Este un metal alb, cu nuanta albastruie-deschis.Acoperirile de crom au un aspect foarte frumos, un luciu durabil, stabilitate si inoxidabilitate termica.
Principalele atribute ale cromului depus electrochimic ca duritatea, rezistenta la uzura, frecare, abraziune,coroziune, aspectul decorativ etc, au determinat o larga utilizare a acestuia in cele mai diverse domenii industriale.
Istoric:
In 1765 geologul rus Pallas a descoperit in mina de la Berezovo din Urali un mineral rosu-portocaliu ,pe care l-a denumit crocoit.Prin descompunerea crocoitului cu acizi minerali,in 1797 Vauqelin obtine acidul de plumb (numit mai tarziu cromic),care prin topire cu borax da o culoare verde.Prin incalzirea puternica a acidului cromic cu carbune,Vauqelin a obtinut un nou metal pe care l-a denumit crom dupa cuvantul grecesc "chorma"ce inseamna culoare, deoarece combinatiile acestui element sunt multicolore.
Stare naturala:
Cromul este un metal foarte raspandit in natura sub forma de minerale. Cele mai importante minerale ale cromului sunt:
. Cromitul FeCr2O4: contine 46,46%Cr;se gaseste in cristale octaedrice brune-negre,cu densitatea 4,5g/cm3;se topeste la 1545-1850 grade Celsius si are duritatea 5,5-7,5 in scara Mosh ;
. Crocoitul PbCrO4: este mai putin raspandit, se prezinta in prisme mono-cline galbene-portocali, de densitate 6 g/cm3 si duritate 2,5-3 in scara Mosh si se formeaza in zonele de oxidare a zacamintelor de plumb;
. Cociubeitul : e o varietate a clinoclorului (ce este silicat de aluminiu , crom , fier si magneziu),care se gaseste in prisme verzi de densitate 2,61-2,78 g/cm3 si de duritate 2-2,5 in scara Mosh;
. Uwarowitul Ca3Cr2[SiO4]3: se gaseste sub forma de cristale cubice verzi ca smaragdul, de densitate 3,52g/cm3 si de duritate 6,5-7,5 in scara lui Mosh;
Alte minerale ale cromului sunt: stichitul 2MgCO3.5Mg(OH)2.2Cr(OH)2 ; vauquelinitul ( fosfat si cromat de plumb si cupru ) , lopezitul K2Cr2O7 , daubrelitul FeS.Cr2S3 ,kameritul (silicat de aluminiu,crom ,fier si magneziu), wolchonskoitu(silicat hidratat de aluminiu crom si fier).
Obtinere:
Cromul metalic se obtine prin reducerea la cald a Cr O3 cu aluminiu, siliciu, calciu, hidrogen, zinc, etc. sau prin reducerea catodica a solutiilor sau topiturilor sarurilor lui , cel mai intalnit procedeu fiind reducerea aluminotermica a oxidului de crom trivalent conform reactie:
Cr O + 2Al = 2Cr + Al O + 120,30kcal
Cromul metalic obtinut prin procedeul aluminotermic industrial are puritatea 97,99%Cr si contine ca impuritati in special fier.
Alte procedee ar fi reducerea Cr O cu hidrogen pur la 1500 grade Celsius, prin disociere termica a diiodurii de crom,prin reducerea la cald a tricloruri anhidre de crom cu hidrogen ,cu metale alcaline sau alcalino-pamantoase, si prin reducerea cromatilor cu vapori de potasiu:
Cr O + 3H = 2Cr + 3H O
CrI = Cr + I
CrCl + 3/2H = Cr + 3HCl
CrCl + 3Na = Cr + 3NaCl
2CrCl + 3Zn = 2Cr + 3ZnCl
Prin reducerea aluminotermica a oxidului de crom trivalent cu Fe O se obtine fercrom ce este un aliaj ce contine 60-72%crom.
Aceste procese au loc numai in prezenta unor anioni (SO 2-, SiF 2-, F - etc.) care au rol de catalizatori si a caror concentratie trebuie sa aiba o valoare bine definita in raport cu concentratia anhidridei cromice din solutie.
Mecanismul de actionare al acestor ioni nu este pe deplin elucidat, fiind cunoscut numai efectul catodic pe care il exercita in timpul procesului de electrodepunere.
Incalzind hidroxidul cromic sau CrO se obtine:
2CrO = Cr O + 3/2O
2Cr(OH) = Cr O + 3H O
Industrial se prepara prin urmatoarele metode:
(NH ) Cr O = Cr O + 4H O + N
S + Na Cr O = Na SO + Cr O
Este o pulbere de culoare verde, insolubila in apa, acizi si alcali si cu punct de topire ridicat. Se utilizeaza ca pigment de catre zugravi in fabricarea portelanului si sticlei.
Structura:
Depunerile de crom sunt constituite din cristale de forma cubica cu fete centrate si in proportie variabila din cristale de forma hexagonala.
Structura acestor depuneri este caracterizata prin prezenta fisurilor al caror numar si profunzime este variabil.Cel mai frecvent aceste fisuri se prezinta sub forma de canale inchise cilindrice mai mult sau mai putin aplatisate.
Studiile efectuate asupra structurii depunerilor de crom, au condus la concluzia ca pana la o anumita grosime depunerile de crom se efectueaza continuu, fara fisuri; grosimea depunerilor fara fisuri este determinata de tensiunile interne care se produc in interiorul depunerii.
Cand aceste tensiuni depasesc limita de rezistenta a cromului se formeaza o retea de fisuri, care elibereaza stratul de tensiuni.Depunerea de crom continua, se formeaza un al doilea strat cu tensiuni interne care vor provoca repetarea fenomenului de fisurare, astfel incat in final diversele straturi fisurate se suprapun dar nu coincid intre ele.
Variatia structurii fisurate a depunerii de crom este in relatie directa cu parametrii de electroliza(densitate de curent, temperatura, natura anionilor din solutie etc.)
Experimental s-a stabilit de asemenea relatia existenta intre procesul fisurarii acoperirii si cel al degajarii hidrogenului la catod: formarea fisurilor este insotita simultan de degajarea hidrogenului astfel incat aceasta are loc discontinuu si numai odata cu aparitia fisurilor.
De asemenea, s-a constatat ca depunerile lucioase se caracterizeaza printr-o structura cu un numar foarte mare de fisuri in comparatie cu cel al depunerilor mate.Depunerile lucioase poseda cristale foarte fine, cu o orientare a cristalelor preferentiala corespunzand la o grupare de planuri paralele cu suprafata depunerii.
Structura depunerii de crom nu este omogena, astfel incat fisurile, porii, discontinuitatile etc, sunt repartizate neregulat in depunere.
Modul de lucru
Materiile prime utilizate la obtinerea pigmentiilor de culoare maro cu structura spinelica in sistemul ZnO-Fe O -Cr O sunt:
Oxid de zinc - ZnO;
Oxid de fier - Fe O ;
Oxid de crom - Cr O
In continuare se vor calcula cantitatiile de materii prime necesare, pentru a putea fi cantarite si omogenizate.Materiile prime se omogenizeaza folosind apa distilata calda.Dupa terminarea procesului de omogenizare acestea se vor introduce in etuva pentru uscare.
Reteta
Sistemul spinelic ZnO-Fe O -Cr O contine:
|
Materii prime |
Masa moleculara |
Raport molar |
M*Raport molar |
|
a)ZnO |
81 |
1 |
81 |
|
b)Fe O |
160 |
0,6 |
96 |
|
c)Cr O |
152 |
0,4 |
61 |
Masa moleculara a sistemului ZnO-Fe O -Cr O = 238 g
238g ..... 81g ZnO ...... 96g Fe2O3 ...... 61g Cr2O3
5g pigment ... x g ...... y g ...... z g
x = 5*81/238=1,7g ZnO
y = 5*96/238=2g Fe2O3
z = 5*61/238=1,3g Cr2O3
In cele 5g de pigment se introduce 1,7g ZnO, 2g Fe2O3, 1,3g Cr2O3.
ZnO x'=1,7g
252 152
Cr2O3 provine din reactia (NH4)2 Cr2O 7 = Cr2O3 + 4 H2O +N2
y ' 1,3
y' = 252*1,3/152=2,15g (NH4)2 Cr2O 7 rezulta x = 1,3g Cr2O3
Fe2O3 provine din trei surse :
Fe(NH4)2(SO4) 2.6H2O (5) ;
Oxid rosu de fier (7) ;
3. Oxalat de fier (9) .
Calcularea fierului din fiecare sursa:
1) Sulfat dublu de fier si amoniu :
2*392 160
Fe(NH4)2(SO4) 2.6H2O = Fe2O3 +
z' 2
z' = 2*2*392/160=9,8g Fe(NH4)2(SO4) 2.6H2O (5)
2) Oxid rosu de fier: este chiar Fe2O3 z''' = 2g (7)
3) Oxalat de fier :
2*180 160
2(COO)2Fe*2H2O = Fe2O3 +CO 2+2H2O
z' 2
z' = 2*180*2/160=4,5g 2(COO)2Fe*2H2O.(9)
|
Nr. proba |
ZnO(g) |
Fe2O3(g) |
(NH4)2 Cr2O 7(g) |
|
5 |
1,7 |
9,8 |
2,15 |
|
7 |
1,7 |
2 |
2,15 |
|
9 |
1,7 |
4,5 |
2,15 |
Arderea I:
Probe:
-(5): brun-roscat deschis, granular
-(7): brun-roscat caramiziu
-(9): brun-roscat caramiziu inchis, granular fin divizat

Dupa ce probele au fost arse, produsele obtinute au fost dezaglomerate, au fost spalate cu apa distilata calda de trei ori, astfel s-a indepartat tot cromoforul solubil. Culoarea apei dupa ultima spalare a fost o nuanta foarte deschisa de vernil pentru proba (5), iar pentru probele (7) si (9) o nuanta foarte deschisa de maro. Produsele astfel obtinute au fost reintroduse in cuptor.
Arderea II:
Probe:
-(5): maro inchis, pulbere fina
-(7): maro deschis, pulbere fina
-(9): maro foarte deschis, pulbere fina
Dupa ce probele au fost arse, au fost dezaglomerate minutios. Apoi s-a cantarit glazura pentru fiecare proba in parte conform proportiilor urmatoare, adaugandu-se si 5g pigment pentru 95g glazura:
(5) Capsula + glazura: 26,245*0,54=14,17g
Masa Pigment: 14,17*0,05=0,7 g pigment
(6) Capsula + glazura: 31,9*0,54=17,22g
Masa Pigment: 17,22*0,05=0,86 g pigment
(7) Capsula + glazura: 41,4*0,54=22,35g
Masa Pigment: 22,35*0,05=1,12g pigment
Glazura a fost obtinuta din barbotina cu urmatoarele caracteristici: u=46%, m=54%; unde: u-umiditate; m-masa produs uscat.
Din fiecare amestec obtinut s-a aplicat cate un strat pe un suport ceramic, iar suporturile ceramice au fost introduse la cuptor dupa care s-a obtinut produsul final glazurat.

Bibliografie
C. Savii - Teza de doctorat, Institutul Politehnic Timisoara, 1989
N. Orban - "Pigmenti anorganici pentru lacuri, vopsele si cerneluri", Ed. Tehnica Bucuresti, 1974
C. D. Nenitescu - "Chimie Generala", Ed. Didactica si Pedagogica, Bucuresti, 1972
C. Dragulescu si E. Petrovici - "Introducere in chimia anorganica moderna", Ed. Facla, Timisoara, 1973
L. Gogea - Teza de doctorat, Institutul Politehnic Timisoara, 1981
S. Ifrim si I. Rosca - "Chimie Generala", Ed. Tehnica Bucuresti, 1989
L. Pauling - "Chimie Generala", Ed. Stiintifica Bucuresti, 1972
Copyright © 2025 - Toate drepturile rezervate