 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Respingerea Perechilor de Electroni din Stratul de Valenta (RPESV)
Teoria (sau modelul) RPESV reprezinta un mijloc simplu pentru prezicerea structurilor geometrice ale combinatiilor elementelor din grupele principale. Rezultatele sale sunt similar cu cele obtinute prin metoda hibridizarii orbitalilor atomici dar este mai simpla si mai directa. Teoria RPESV se bazeaza pe idea ca perechile sau grupurile de electroni din stratul de valenta (fie de legatura, fie electroni neparticipanti) se vor respinge asezandu-se la o distanta maxim posibila. Consecinta va fi aceea ca moleculele adopta o geometrie care sa le permita perechilor de electroni sa se aseze cat mai departe unele de altele - geometrie care este foarte apropiata de geometria observata experimental.
Prezentam in continuare cateva cazuri de geometrii intalnite frcvent in chimie.
In rezumat, ori de cate ori intalnim in jurul unui atom central un numar de perechi de electroni (de legatura sau neparticipanti) acestia vor tinde sa se aranjeze dupa aceeasi geometrie (v. Fig.3.18) anume:
2 perechi la atomul central – geometrie liniara,
3 perechi la atomul central – geometrie trigonala,
4 perechi la atomul central – geometrie tetraedrica,
5 perechi la atomul central – geometrie bipiramidal-trigonala,
6 perechi la atomul central – geometrie octaedrica,
7 perechi la atomul central – un numar de geometrii mai putin uzuale.
Numararea electronilor se face astfel:
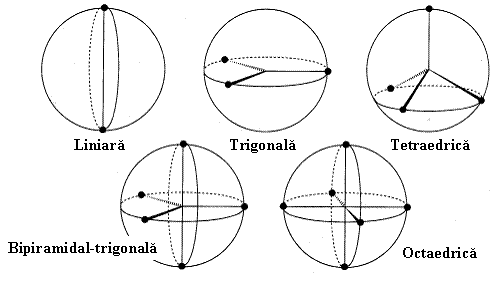

Fig. 3.18. Geometrii explicabile prin modelul RPESV frecvent utilizate
Pentru moleculele covalente cu legaturi simple, se numara mai intai toti electronii de valenta ai atomului central la care se mai adauga cate un electron pentru fiecare atom legat (ligand). De ex. in cazul BCl3: exista trei electroni pe ultimul strat la atomul de bor la care se adauga trei electroni pentru fiecare atom de clor. Rezulta 3 perechi de electroni.
Cand sunt prezente si legaturi duble se numara mai intai cei patru electroni din legatura dubla care formeaza toti un singur grup.
Cateva exemple de geometrii sunt prezentate in cele ce urmeaza.
Geometria liniara Moleculele cu doua perechi (sau doua grupuri) de electroni in jurul atomului central prezinta un unghi de 180o intre valente molecula avand in consecinta forma liniara. Exemplele prezentate in Fig. 3.19 sunt pentru moleculele BeCl2, CO2 respectiv pentru ionul NO2+.
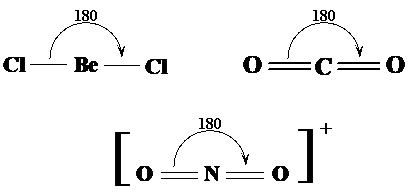

Fig. 3.19. Exemple de molecule cu forma liniara
Geometria trigonala Este prezenta in molecule ca BF3, NO2 si in ionul NO2-. In cazul azotului (cu 5 electroni pe utimul strat) exista aici si electroni neparticipanti (Fig. 3.20).
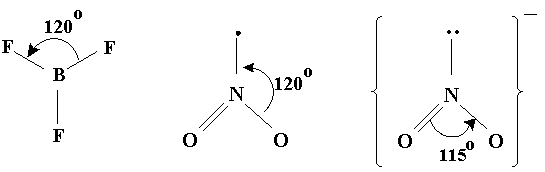
Fig. 3.20. Exemple de molecule cu forma trigonala.
Observatie: Repulsia dintre perechile (grupele) de electroni nu este independenta de numarul electronilor din grup sau de faptul ca electronii sunt neparticipanti sau nu. Perechile de electroni neparticipanti, nefiind atrase de un nucleu ocupa un spatiu mai extins de cat o pereche de electroni de legatura. Consecinta este usor de anticipat: perechea de electroni neparticipanti provoaca o micsorare a unghiului dintre electronii de legatura. Acest lucru va ramane valabil si in cazul celorlalte geometrii. In plus, repulsia dintre perechile (grupele) de electroni nu este independenta de numarul de electroni din grup. O preche de electroni neparticipanti va respinge ceva mai puternic perechile de electroni de legatura decat un singur electron.
Geometria tetraedrica Are la baza orientarea tetraedrica a electronilor dar geometria molecule este influentata de electronii neparticipanti in sensul amintit anterior. Exemplele de molecule din aceasta categorie sunt: CH4, NH3, H2O (Fig.3.21).
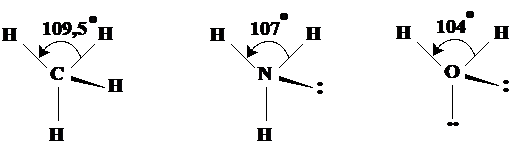
Fig. 3.21. Exemple de molecule cu forma tetraedrica. Se observa
micsorarea unghiurilor dintre electronii legaturilor.
Geometria bipiramidal-trigonala PCl5 are o geometrie din aceasta categorie deoarece cele 5 perechi de electroni se resping la distanta maxima fromand o bipiramida trigonala (Fig.3.22).
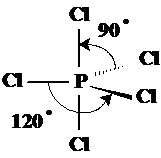
Fig. 3.22. Geometria bipiramidal-trigonala a PCl5
SF4 respectiv XeF2 prezinta geometrii modificate de existenta electronilor neparticipanti. Acestia vor prefer orientarea ecuatoriala pentru a minimize repulsia deorece distanta dintre atomii situati la 120o este mai mare decat intre atomii situati la 90o. Astfel SF4 ar putea in principiu exista in doua structure (a) si (b) redate in fig. 3.23. Este preferata forma (b) fata de (a) intotdeauna.
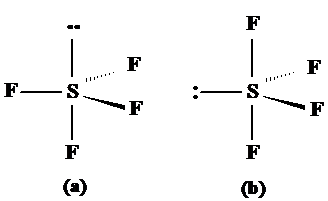
Fig. 3.23. Exemple de molecule ce au electroni neparticipanti
cu forma bipiramidal-trigonala.
Din acelasi motiv BF3 are forma apropiata de T iar XeF2 forma liniara pe cand SF4 adopta o forma deosebita (de sea) dupǎ cum se observǎ in fig. 3.24.
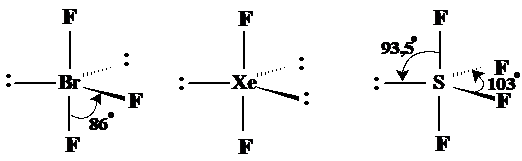
Fig. 3.24. Exemple de molecule cu forma bipiramidal-trigonala.
Geometria octaedrica Duce de asemenea la situatii in care respingerea plaseaza atomii legati la atomul central la distanta maxima posibila. Un exemplu din aceasta geometrie este SF6. Unde exista electroni neparticipanti apar geometrii particulare, de exemplu JF5 sau XeF4 (v. Fig. 3.25).


Fig. 3.25. Exemple de molecule cu forma octaedrica.
In aceste cazuri electronii prefera orientarea axiala a perechilor de electroni neparticipanti.
Webografie:
Liaison Chimique,Xavier Assfeld, Laboratoire de Chimie théorique, Entrée 2A, 7ème niveau
Copyright © 2024 - Toate drepturile rezervate