 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Tensiunea de disociere a MeO dizolvat in zgura sau aflat sub forma de combinatii complexe de forma MeO.RO
Disocierea oxidului MeO sub forma de combinatii complexe sau dizolvat in zgura se realizeaza foarte greu, in conditii speciale. Acest lucru poate fi explicat prin faptul ca intotdeauna tensiunea de disociere si entalpia libera de formare a unui oxid depinde de concentratiile componentilor prezenti in solutia respectiva. Valorile entalpiei libere de formare devin mai negative cu cat concentratia oxidului in solutie se va micsora.
Deseori Me se gaseste sub forma complexa (MeO.RO).
Tensiunea de disociere a MeO din MeO.RO va fi intotdeauna mai mica decat tensiunea de disociere a MeO in stare libera.
In domeniul temperaturilor ridicate combinatia chimica se poate descompune conform relatiei:
![]()
In conformitate cu principiul Le Chatelier tinand seama de caracterul endoterm al reactiei de disociere, odata cu cresterea temperaturii valorile lui k devin mai mari.
Pentru un asemenea sistem tensiunea de disociere a unui oxid dintr-o combinatie chimica este mai redusa deoarece acest oxid in combinatia respectiva este mult mai stabil.
Nu este exclus ca disocierea oxidului MeO sa poata avea loc si conform reactiei:
(2MeO.zgura)=2Me+O2+zgura
![]()
In expresia lui k s-a neglijat concentratia metalului Me deoarece de regula Me se dizolva in cantitati reduse in topituri oxidice.
Din relatia de mai sus se poate stabili urmatoarea ecuatie.
![]()
In realitate nu se poate determina concentratia MeO in stare libera. Din aceasta cauza daca se tine seama de faptul ca la temperaturile foarte ridicate la care se gasesc zgurile metalurgice, gradul de disociere a combinatiilor chimice este foarte mare, in calculul tensiunii de disociere va trebui sa se ia in considerare concentratia totala MeO aflat in zgura, nu numai concentratia MeO in stare libera.
Exemplu: Disocierea fayalitei 2FeO SiO2
(Fe)2SiO2→2FeO+SiO2+![]()
2FeO→2Fe+ +![]()
(Fe)2SiO2→2Fe+SiO2+ +![]()
![]() =
=![]() +
+![]()
Rezulta ca pentru disocierea FeO din 2FeO.SiO2
este necesara ![]() (entalpia pentru
disocierea FeO scos din combinatia chimica.
(entalpia pentru
disocierea FeO scos din combinatia chimica.
Surplusul de entalpie libera este tocmai entalpia pentru formarea compusului.
Tensiunea de disociere ![]() este mai mare decat
este mai mare decat ![]() .
.
Rezulta ca pentru a reduce oxidul aflat in combinatie chimica se va consuma o cantitate >> de reducator decat daca oxidul este in stare libera.
a) Disociarea carbonatului de calciu (CaCO3)
Carbonatul de calciu se prezinta sub forma starii alotropice: aragonita si calcita.
Aragonita cristalizeaza in sistemul cubic si nu prezinta importanta pentru procesul metalurgic deoarele din punct de vedere termodinamic este stabila numai la temperaturi joase (pana la 214K).
Pentru procesele metalice prezinta importanta calcita care are la baza o retea hexagonala.
Nu este exclus ca in aceste conditii de temperatura CaO format in urma disocierii sa se combine cu carbonatul formand o serie de solutii solide.
De regula aparitia solutiei solide complica procesul de disociere deoarece mentine aceeasi tensiune de disociere intr-un interval mai mare de temperatura.
Disocierea carbonatului de calciu are loc conform reactiei:
CaCO3![]() CaO+CO2
CaO+CO2
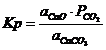
![]() este tensiunea de disociere a carbonatului sau presiunea
partiala a CO2 desprins din reteaua cristalina a
CaCO3 la o anumita temperatura de lucru.
este tensiunea de disociere a carbonatului sau presiunea
partiala a CO2 desprins din reteaua cristalina a
CaCO3 la o anumita temperatura de lucru.
Stabilitatea sau instabilitatea CaCO3 poate fi apreciata pe baza relatiilor:
![]()
![]()
![]() - reprezinta variatia entalpiei libere a
reactiei de disociere a CaCO3;
- reprezinta variatia entalpiei libere a
reactiei de disociere a CaCO3;
![]() - reprezinta caldura de formare a carbonatului;
- reprezinta caldura de formare a carbonatului;
T - temperatura la care se realizeaza disocierea;
![]() - variatia de entropie a sistemului.
- variatia de entropie a sistemului.
Pe baza relatiilor de mai sus se pot determina temperaturile de inceput de disociere, in fucntie de continutul de CO2 din atmosfera gazoasa si de presiunea partiala a acestuia. Pentru un sistem monovariat si cand disocierea are loc in aer (0,03% CO2) temperatura la care incepe disocierea este 805K (532oC).
Impuritatile care insotesc de obicei CaCO3 influenteaza in oarecare masura temperatura la care incepe disocierea.
In prezenta SiO2 oxidul de carbon rezultat in urma disocierii carbonatului de calciu, intra in reactie cu acesta formandu-se o serie de silicati de calciu care au entalpii libere de formare in valori absolute mult mai mari decat a CaCO3.
b) Disocierea carbonatului de magneziu (MgCO3)
In conditii industriale, deseori in diverse incarcaturi, este prezent si MgCO3 care poate sa disocieze conform reactiei:
MgCO3 ![]() MgO+CO2
MgO+CO2
![]() =120 000-132,2 T
=120 000-132,2 T
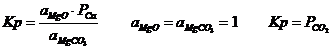
![]()
Temperatura de inceput de disociere intense a MgCO3 este 647oC iar la 589K incepe disocierea. Disocierea MgCO3 se realizeaza mai usor decat disocierea CaCO3 aparitia solutiilor solide intre MgO si MgCO3 avand acelasi efect ca si in cazul procesului de disociere a CaCO3 (ingreuneaza procesul de disociere).
c) Disocierea dolomitei CaMg(CO3)2
Cercetarile experimentale privind disocierea dolomitei au stabilit doua etape ale procesului de disociere.
I.
CaMg(CO3)2![]() CaCO3+MgO+CO2
CaCO3+MgO+CO2
II.
CaCO3![]() CaO+CO2
CaO+CO2
Prima etapa se realizeaza la
temperaturi mai joase ![]() 760oC deoarece in aceasta etapa
dosociaza MgCO3.
760oC deoarece in aceasta etapa
dosociaza MgCO3.
Ulterior in etapa a doua are loc disocierea CaCO3, cand temperatura trebuie sa fie mai mare de 910oC.
d) Disocierea carbonatului de fier (FeCO3)
Reactia chimica principala care caracterizeaza disocierea FeCO3 este:
FeCO3![]() FeO+CO2
FeO+CO2
Simultan cu disocierea FeCO3 are loc si reactia de oxidare a FeO cu CO2.
De aceea pentru disocierea la un moment dat a FeCO3 este valabila reactia:
M FeCO = nFeO + pFe3O4 + qCO2 + r CO
Temperatura energica de disociere a FeCO calculata atunci
cand ![]() are valoarea de
669K(396).
are valoarea de
669K(396).
g) Disocierea oxizilor de plumb
Diagrama de echilibru PbO2 si Pb3O4 se caracterizeaza prin tensiuni de disociere foarte mari, descompun la temperaturi ridicate in oxizi inferiori PbO.
Din aceasta cauza in procesele reducatoare in mai mica masura participa Pb3O4 sau PbO2. De obicei in practica participa PbO.
Copyright © 2026 - Toate drepturile rezervate