 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Acidul sulfuric.
Obtinere.1.
Fabricarea acidului sulfuric comporta trei etape:a.obtinerea dioxidului de sulf, sau mai correct a unui gaz continand dioxid de sulf; b. oxidarea dioxidului de sulf la trioxid de sulf si c. combinarea trioxidului de sulf cu apa.
a.Dioxidul de sulf se obtine, in cele mai multe fabrici, prin arderea piritei in aer. Gazul de ardere este un amestec de 7-10% S02, cu mult azot si putin oxigen nereactionat. Daca pirita contine sulfura de arsen, cum se intampla de obicei, se formeaza si trioxid de arsen, As4O6, care este volatil la temperatura ridicata, dar se depune la racirea gazului de ardere, in camere de desprafuire. Pentru a servi la fabricarea acidului sulfuric, gazele trebuie bine purificate, caci trioxidui de arsen inactiveaza ("otraveste') catalizatorul folosit in etapa urmatoare.
b. Oxidarea dioxidului de sulf la trioxid. Cel mai bun procedeu, si unicul folosit in prezent, este oxidarea catalitica cu aer, asa-numitul procedeu prin contact:
![]()
Reactia fiind exoterma, echilibrul este (conform principiului lui Le Chatelier ) cu atat mai deplasat spre dreapta, cu cat temperatura este mai joasa. Dioxidul de sulf nu arde, nici chiar in oxigen pur. La temperatura flacarii de sulf, care trece de 1000°, echilibrul este practic complet deplasat spre stanga si nu se formeaza decat urme de SO3. La temperatura joasa, favorabila reactiei, viteza de reactie este insa mica. De aceea este necesar un catalizator.
Primul catalizator
utilizat a fost platina fin divizata, depusa pe un suport de azbest
sau de masa ceramica . Cu
acest catalizator se realizeaza, la 425°, o transformare ![]() de 98%. Mai
ieftin este catalizatorul de pentoxid de vanadiu, V2O5,
pe un suport inert. Acesta necesita o temperatura mai ridicata
(500°) si, in consecinta, continutul in S03 la
echilibru este mai mic.
de 98%. Mai
ieftin este catalizatorul de pentoxid de vanadiu, V2O5,
pe un suport inert. Acesta necesita o temperatura mai ridicata
(500°) si, in consecinta, continutul in S03 la
echilibru este mai mic.
c. Trioxidul de sulf este continut in concentratie mica in gazul obtinut prin procedeul de contact. De aceea el nu poate fi absorbit direct in apa, spre a da acid sulfuric. Din cauza caldurii mari de reactie si a excesului de gaze inerte (N2 si 02) se formeaza un aerosol, foarte greu de condensat, compus din picaturi foarte mici de acid sulfuric. De aceea gazele provenite din reactorul de cataliza se spala cu acid sulfuric concentrat, in care SO3 se dizolva, dand o solutie numita acid sulfuric fumans sau oleum. Acesta poate fi apoi diluat cu cantitatea necesara de apa spre a da acid sulfuric de concentratia dorita.
Acidul sulfuric. Proprieti fizice. 1. Acidul sulfuric pur este un lichid vascos, incolor si inodor. Punctul de topire al acidului sulfuric 100 % (asa-numitul "monohidrat') este 10 °.
2. Punctele de topire ale amestecurilor de acid sulfuric cu apa. In curba punctelor de topire ale amestecurilor de acid sulfuric cu apa, intre 0-100 procente de masa acid sulfuric in apa, se observa patru eutectice (primul la -75° si cca. 35% H2S04) si patru maxime (in afara maximului reprezentat pentru p.t al ghetii;fig. 24.4).Dintre cele patru maxime, unul corespunde acidului sulfuric pur, iar celelalte trei unor hidrati cu compozitie molara definita:
H2SO4 H2SO4·H2O H2SO4·2H2O H2SO4·4H2O
p.t +10,36o +8o cca. -38o -27o
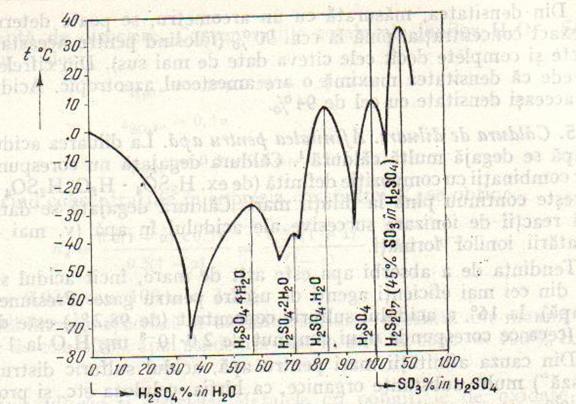
Fig. 24.4. Curba punctelor de topire ale amestecurilor de acid sulfuric si apa. In partea dreapa a figurii: o portiune din diagrama punctelor de topire ale amestecurilor de acid sulfuric si trioxid de sulf (oleum).
Acesti hidrati sunt compusi stabili numai in stare solida. Nu sunt indicii ca a exista compusi cu asemenea compozitii in faza lichida.
3. Puncle de fierbere. Amestecul azeotropic. Daca se incalzeste acid sulfuric concentrat (de ex. de 80%) distila apa si concentratia acidului rezidual creste pana la punctul de fierbere, 338° (la 760 torr). Acest punct de fierbere corespunde unui amestec azeotropic cu maxim de concentratie 98 % H2S04 . Daca se incalzeste in mod similar acid sulfuric de 100% (obtinut din acid mai diluat si oleum) distila intai S03, pana se ating concentratia si punctul de fierbere ale azeotropului.
Vaporii azeotropului, peste punctul de fierbere, sunt in mare parte disociati in S03 si H20; la 450° disocierea este completa, dupa cum se constata din determinarea densitatii vaporilor. La racire si condensare produsii de disociere se recombina dand H2SO4 de 98 %.
4.Densitatea amestestecurilor cu apa.Densitatea solutiilor apoase de acid sulfuric creste cu concentratia astfel:
Conc. %: 10 20 30 40 50 60 70 80 90 98 100
d la 20o: 1,07 1,14 1,22 1,30 1,40 1,50 1,62 1,73 1,82 1,841 1,836
Din densitatea, masurata cu un areometru, se poate determina destul de exact concentratia, pana la cca. 90% (folosind pentru aceasta tabele mai exacte si complete decat cele cateva date de mai sus). Din cifrele de mai sus se vede ca densitatea maxima o are amestecul azeotropic. Acidul de 100% are acceasi densitate cu cel de 94%.
5. Caldura de diluare. Afinitatea pentru apa. La diluarea acidului sulfuric cu apa. se degaja multa caldura. Caldura degajata nu corespunde formarii unor combinatii cu compozitie definita (de ex. H2SO4 · H2O, H2SO4 · 2 H2O etc.) ci create continuu pana la dilutii mari. Caldura degajata se datoreste celor doua reactii de ionizare succesive ale acidului in apa si hidratarii ionilor formati.
Tendinta de a absorbi apa este atat de mare, incat acidul sulfuric este unul din cei mai eficienti agenti de uscare pentru gaze. Presiunea de vapori (de apa), la 16°, a acidului sulfuric concentrat (de 98 %) este de 2,1· 10-3 torr (ceea ce corespunde unui continut de 2,0-·10-3 mg H2O la 1 litru aer).
Din cauza afinitatii mari pentru apa, acidul sulfuric distruge ("carbonizeaza') multe substante organice, ca hartia, celuloza etc. si produce arsuri pe piele.
Acidul sulfuric. Proprietati chimice. 1. Ionizarea in solutie apoasa. Acidul sulfuric este un acid diprotic, care ionizeaza in doua etape:
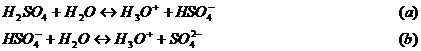
Prima ionizare decurge ca la electrolitii tari; ea este totala chiar la concentratii relativ mari (de ex. in solutie 1 normala). Cea de-a doua ionizare decurge dupa legea maselor:
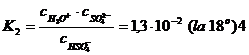
In solutie 1 normala (49
g/1 H2S04), ca urmare a primei ionizari (care este
totala) se obtin, conform ecuatiei (a), 0,5 ioni-gram H3O+ si 0,5
ioni-gram ![]() intr-un litru de solutie.
Daca gradul de ionizare in cea de-a doua treapta de disociere este
α, atunci rezulta, conform ecuatiei (b), 0,5 α ioni-gram
H30+ si 0,5 α ioni-gram
intr-un litru de solutie.
Daca gradul de ionizare in cea de-a doua treapta de disociere este
α, atunci rezulta, conform ecuatiei (b), 0,5 α ioni-gram
H30+ si 0,5 α ioni-gram ![]() intr-un litru de
solutie, ce provin din aceasta treapta de disociere.
Concentratiile totale ale ionilor H3O+,
intr-un litru de
solutie, ce provin din aceasta treapta de disociere.
Concentratiile totale ale ionilor H3O+, ![]() si
si ![]() vor fi deci:
vor fi deci:
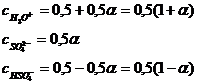
Introducand concentratiile in
expresia constantei
![]()
de unde α = 0,025 sau 100 α = 2,5%.
Conductibilitatea specifica, a acidului sulfuric prezinta un maxim la o concentratie de cca. 30%, apoi scade aproape la zero la concentratie. = 100% H2S04.
2.Acidul sulfuric si metalele. Metalele cu potentiale de oxidare mai pozitive decat hidrogenul reactioneaza cu acid sulfuric diluat, formand sulfatii respectivi (dupa cele de mai sus, concentratia de masa optima pentru aceasta reactie este de cca. 30% H2S04):
![]()
Acidul sulfuric concentrat nu contine practic ioni de hidrogen si deci nu poate reactiona in modul acesta. El reactioneaza totusi cu metale cu potentiale de oxidare negative, cum sunt cuprul, argintul si mercurul, pe care le oxideaza, el reducandu-se pana la dioxid de sulf:
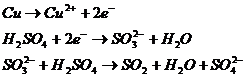
__________ ______ ____ ______
![]()
In industrie se sufla aer, in turnurile care contin cuprul si acidul sulfuric. Oxigenul oxideaza ionul de sulfit la ionul de sulfat. Se evita astfel degajarea de S02, care ar reprezenta o pierdere.
Acidul sulfuric concentrat se conserva si se transporta in rezervoare de otel obisnuit, pe care nu-1 ataca, datorita unui fenomen de pasivitate. Acidul sulfuric mai diluat decat 80% ataca ferul, dar poate fi conservat in vase de plumb sau captusite cu o foaie de plumb. Rezistenta plumbului fata de acidul sulfuric diluat se datoreste formarii unui strat protector subtire de sulfat de plumb, PbSO4, insolubil in apa si acid sulfuric diluat, dar solubil in acid concentrat.
3. Acidul sulfuric si nemetalele. Acidul sulfuric, incalzit cu sulf, este redus la dioxid de sulf, in timp ce sulful este oxidat tot la dioxid de sulf:
![]()
Carbonul (carbunele de lemn) reactioneaza la fel:
![]()
Acidul sulfuric se comporta ca agent oxidant slab si fata de alti compusi, de ex. fata de ionii Br- si I- .
4. Acidul sulfuric si compusii organici. Acidul sulfuric este un reactiv mult utilizat in chimia organica, pentru reactia de sulfonare, nitrare, aditii la alchene, catalizator etc.
Acidul sulfuros
1. In solutie apoasa, dioxidul de sulf este combinat, in mica proportie, cu apa, dand nastere acidului sulfuros:
![]()
Dioxidul de sulf este deci anhidrida acidului sulfuros. Majoritatea dioxidului de sulf din solutia apoasa este dizolvat fizic, ca SO2. Acidul sulfuros nu poate fi izolat din solutia sa apoasa, caci la incalzirea sau evaporarea acesteia, echilibrul de mai sus se deplaseaza cantitativ spre stanga si se degaja S02.
2. Acidul sulfuros este un acid slab. Fiind un acid diprotic, in apa se stabilesc doua echilibre de ionizare (al doilea insa. numai la dilutie foarte mare si cu grad de ionizare foarte mic):
![]()
Ion de
Bisulfit
![]()
Ion de
sulfit
3. Acidul sulfuros (solutia de S02 in H20) este un agent reducator puternic. El reduce permanganatul la Mn2+, dizolva dioxidul de mangan:
![]()
si reduce dicromatul de potasiu, la sulfat de crom (III):
![]()
4. Halogenii oxideaza acidul sulfuros la acid sulfuric, reducandu-se la hidracizi:
![]()
Reactia este practic ireversibila in cazul clorului, dar este reversibila in cazul bromului si, mai mult inca, al iodului:
![]()
Daca se adauga carbonat acid de sodiu, NaHC03, care consuma ionii de hidrogen, echilibrul se deplaseaza cantitativ spre dreapta. In conditiile acestea, reactia serveste pentru dozarea dioxidului de sulf (transformat in ion de sulfit de catre NaHC03) prin titrare cu o solutie de iod (iodometrie).
Hidrurile halogenilor(Hidracizii)
Tabelul 23.3
|
Formula |
Punct de topire, oC |
Punct de fierbere,oC |
Densitatea gazului, g/l |
Energia de legatura, H-X, In kcal/mol |
|
|
Acid fluorhidric Acid clorhidric Acid bromhidric Acid iodhidric |
HF HCl HBr HF |
|
Obtinere. l.Sinteza directa din elemente.Cei patru halogeni se combina direct cu hidrogenul, dupa ecuatia stoechiometrica:
ΔH(HF)=-64,8 kcal/ 1 mol HF
ΔH(HCl)=-22,1 kcal/ 1 mol HCl
![]() ΔH(HBr)=-8,7 kcal/ 1 mol HBr
ΔH(HBr)=-8,7 kcal/ 1 mol HBr
ΔH(HI)=-6,3 kcal/ 1 mol HI
Fluorul reactioneaza extrem de violent , ireversibil, cu hidrogenul, dupa cum s-a mai spus.
Clorul reactioneaza de asemenea energic cu hidrogenul.Aproape singura metoda utilizata, in prezent, pentru fabricarea acidului clorhidric in industrie consta in arderea hidrogenului intr-o atmosfera de clor, ambii obtinuti intr-o instalatie pentru electroliza clorurii de sodiu._Se arde clor intr-o atmosfera de hidrogen intr-un azator compus din tuburi concentrice de cuart sau fonta.
Combinarea bromului cu hidrogenul decurge mult mai putin energic, caldura de reactie fiind mult mai mica. Un amestec echimolecular de H2 si Br2, trecut printr-un tub de sticla, incalzit pana la pornirea reactiei cu un arzator, arde cu flacara verzuie. In aceste conditii are loc o reactie omogena in faza gazoasa. Pentru a prepara HBr in laborator este mai comod a trece un curent de H2, incarcat cu vapori de Br2(prin barbotare prin brom lichid) peste carbune activ, incalzit intr-un tub de sticla la cca. 180o(cataliza heterogena nespecificata). Se obtine astfel HBr liber de brom.
Combinatia iodului cu hidrogenul poate fi efectuata, in faza omogena gazoasa. Reactia, incompleta, duce la stabilirea unui echilibru .
La 300o, reactia are loc cu viteza mica si se duce, daca se porneste de la un amestec echimolecular de H2 si I2, la un amestec care contine 19% HI. La temperatura ridicata, viteza de reactie este mai mare, dar echilibrul este deplasat mai spre stanga. In prezenta de catalizatori viteza de reactie este mai mare. In consecinta se poate lucra la temperatura mai joasa (200o) si, cu H2 in exces, se obtine HI liber de_iod.
2. Hidracizi prin reactii de deslocuire. Sarurile halogenilor cu metalele (halogenurile metalice) pun in libertate hidracizi cand sunt tratate cu acizi nevolatili .Din fluorura de calciu si acid sulfuric in retorte de fonta sau de otel plumbuit, se obtine acid fluorhidric:
![]()
Acidul fluorhidric astfel format se.poate lichefia prin racire sub 0° sau se dizolva in apa pentru a obtine solutii apoase de HF.
Metoda aceasta a fost utilizata in trecut pentru obtinerea industriala a acidului clorhidric (Glauber, in sec. al 17-lca). Reactia decurge in doua etape:
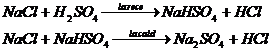
Metoda deslocuirii nu poate fi utilizata pentru prepararea acidului bromhidric si mai putin inca a acidului iodhidric. Acidul sulfuric reactioneaza fata de acesti hidracizi ca un agent oxidant, asa ca acidul bromidric sau acidul iodhidric, care se formeaza initial :
![]()
reactioneaza mai departe, oxidandu-se pana la halogen molecular:
![]()
Acidul clorhidric nu este oxidat de acidul sulfuric ci numai de agentii oxidanti tari. Acidul fluorhidric nu este oxidat de nici un oxidant.
![]()
3. Hidracizi prin hidroliza unor halogenuri. Halogenurile multor nemetale si metale hidrolizeaza la tratarea cu apa, punand in libertate hidracizi. Metoda aceasta se utilizeaza uneori pentru a prepara acidul iodhidric. Peste un amestec de fosfor rosu si iod se toarna apa. Se formeaza intermediar triiodura de fosfor:
![]()
Acidul clorhidric ca produs secundar la clorurarea compusilor organici. Se obtin cantitati mari de acid clorhidric la clorurarea unor compusi organici, ca:
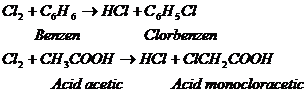
Proprietati fizice si chimice. 1. In moleculele hidracizilor, atomii sunt legati covalent, dupa cum rezulta din punctele lor de topire si de fierbere joase, din spectrele in infrarosu si Raman si din momentele electrice.
Hidracizii in stare gazoasa disociaza in elemente, la temperaturi inalte:
HCl HBr HI
Gradul de disociere 300o 3·10-7% 0,003% 19%
la 1 atm si la 1000o 0,014% 0,5% 33%
2. Solutiile hidracizilor in apa. a. Hidracizii sunt,foarte usor solubili in apa. Din cauza aceasta, hidracizii uscati fumega in aer.Prin combinarea cu vapori de apa din atmosfera se formeaza mici picaturi de solutii de hidracizi care au o presiune de vapori mult mai mica decat apa.
Un volum de apa dizolva cca. 450 volume HCl gazos. O sticla cu HCl gazos destupata, cu gura in jos sub nivelul apei dintr-o cuva se umple imediat cu apa din cauza dizolvarii rapide a gazului.
b. Aciditate. La dizolvare are loc o reactie exoterma intre acid si apa (ΔH = -17,4 kcal/mol de HCl, in apa multa):
![]()
Din cauza acestei reactii cu apa, dizolvarea hidracizilor in apa nu decurge dupa legea lui Henry. Din solutia fizica a unui gaz in apa (sau chiar din solutia unui gaz legat chimic de apa prin legaturi slabe), gazul poate fi gonit cantitativ prin barbotarea unui gaz greu solubil, de exemplu aer. Din solutiile apoase de NH3 sau CO2, aceste substante sunt complet indepartate prin barbotare cu aer. Hidracizii nu pot fi scosi din solutie in modul acesta.
Cu exceptia acidului fluorhidric, care este un acid slab, ceilalti hidracizi sunt acizi tari. In apa, cei trei hidracizi apar egal de tari din cauza efectului de nivelare al apei; in solventi acizi se observa o crestere considerabila_a aciditatii in ordinea :
HF ≤ HCl < HBr < HI
c. Densitatea solutiilor apoase ale hidracizilor este mai mare decat a apei. Solutiile de HCl au la 15o, densitatile:
d= 1,060 1,124 1 1,19 1,212
conc. greutate 12,2 24,8 31,5 37,2 42,9
S-au intocmit tabele cu ajutorul carora se poate aprecia concentratia aproximativa a hidracizilor din densitatile solutiilor.
d. Solutii azeotropice ale hidracizilor. Solutiile hidracizilor in apa sunt amestecuri azeotropice cu maxim. Pentru diferiti hidracizi, solutiile azeotropice au urmatoarele constante:
HF HCl HBr HI
P.f la 700 torr) 122,2o 108,6o 124,30 127oC
Conc. greutate 38,2 20,2 47,6 56,9
Densitate(20o) 1,14 1,10 1,49 1,70
Daca se distila (la
presiunea normala) solutii mai diluate decat cele azeotropice,
distilatul contine mai multa apa decat acid; daca se
incalzesc solutii mai concentrate, se degaja acid, pana se
atinge concentratia amestecului azeotropic, la presiunea respectiva.
Amestecurile azeotropice au puncte de fierbere constante (la presiune
Punctul de fierbere si concentratia amestecurilor azeotropice variaza cu presiunea. La 50 torr compozitia solutiei de acid clorhidric-apa cu p.f. constant (48 °) este 23,4% ; la 1220 torr (1.6 atm), solutia cu p.f. constant (123°) este de 19,4%.
La temperaturi sub punctul de fierbere al azeotropului, se pot obtine solutii de hidracizi mai concentrate decat cele corespunzand compozitiei amestecurilor azeotropice, de exemplu la 0° se pot obtine solutii de HF de 70% si solutii de HCl de peste 40 %. Prin incalzire sau distilare pe coloane de distilare se obtin industrial, din asemenea solutii, HF sau HCl puri.La fundul coloanei se aduna solutiile azeotropice respective, care pot fi din nou saturate, la temperatura joasa, cu hidracid.
e. Desorbtia hidracizilor din solutiile lor apoase Dintr-o solutie de HCl de concentratie obisnuita (37%:d=1,19) se poate degaja HCl uscat prin picurare de acid sulfuric concentrat. HCl este mai putin solubil intr-o solutie de H2SO4 decat in apa. Metoda serveste_ pentru a prepara HCl gazos, in laborator .Urmele de apa antrenate se retin prin barbotarea gazului degajat prin H2SO4 concentrat.
Saturand o solutie apoasa de HF cu HCl gazos, la rece, se obtine o solutie apoasa concentrata de HCl si HF anhidru ca faza separata nemiscibila (d = 0 g/cm3).
3. Proprietati speciale ale acidului fluorhidric. a. Punctul
de fierbere, anormal de inalt, al acidului fluorhidric comparativ cu al
celorlalti hidracizi, indica_asociatie moleculara.
Spre deosebire de apa care este asociata
numai in stare solida si lichida acidul fluorhidric este asociat
si in stare de vapori; masa moleculara aparenta,
determinata, din densitatea gazului este de 87 la 20°, dar scade la
valoarea normala (M = 20) la 80°.
b. Asociatia moleculelor HF, in acidul fluorhidric anhidru, are loc prin legaturi de hidrogen, comparabile cu cele din apa .Din calcule bazate pe entropia reziduala la 0K , hidrogenul nu este legat exact la mijlocul distantei intre cei doi atomi F pe care ii leaga. In asociatiile (HF)n , n poate avea valori intre 2 si 5. Distanta F-F este 2,55Ć, iar energia legaturii de hidrogen este de 6 kcal/mol. Intr-un polimer de acid fluorhidric, moleculele HF au o aranjare in zig-zag.

c. Acidul fluorhidric este un acid slab. Acidul fluorhidric se deosebeste de ceilalti hidracizi in doua privinte: energia de legatura HF este, exceptional de mare; energia de solvatare a ionului F- este de asemenea, foarte mare. Prima defavorizeaza, cea de-a doua favorizeaza ionizarea. La HF primul dintre aceste efecte predomina, in mod evident, asupra celui de-al doilea.
4. Proprietati chimice ale hidracizilor. a. Hidracizii anhidri nu reactio-neaza decat cu metalele cu potentiale de oxidare mari, si cu unele dintre acestea numai la cald. De aceea acizii fluorhidric si clorhidric, bine uscati,pot fi conservati si transportati in cilindri de otel.
In solutie apoasa hidracizii reactioneaza cu aproape toate metalele (numai Pt rezista la HF; iar la HCl sunt rezistente si Pb, Au si Ta).
Reactivitatea aceasta mare a hidracizilor produce dificultati serioase in industria chimica, din cauza coroziunii pe care o produce aparaturii metalice, in special otelului obisnuit. Unul din produsii cei mai corosivi (afara de HF),ce apare curent in tehnica, este acidul clorhidric. Rezistenti la acid clorhidric (in afara de metalele amintite mai sus) sunt grafitul, sticla, materialele ceramice (asa-numita gresie artificiala) si unele substante organice macromoleculare ca teflonul, polietilena, cauciucul vulcanizat si bachelita. Nemetalele nu reactioneaza cu hidracizii.
b.Hidracizii reactioneaza cu oxizii si hidroxizii elementelor din grupele A si B si chiar cu unii oxizi din grupa C, de exemplu As2O3 si Sb2O3, dand halogenurile elementelor respective.
c. Spre deosebire de ceilalti hidracizi, acidul fluorhidric se combina cu dioxidul de siliciu:
![]()
dand tetrafluorura de siliciu si alti compusi. Sticla este de asemenea atacata de solutiile apoase de HF. De aceea solutiile de acid fluorhidric (de 40% sau mai mult) se conserva in flacoane de polietilena sau de bachelita.
d.Acizii bromhidric si iodhidric ca agenti reducatori. In timp ce ionul F- nu cedeaza electroni nici unei alte substante, iar ionii Cl- si Br- cedeaza electroni numai unor agenti oxidanti tari, ionul I- cedeaza usor un electron si este deci agent reducator puternic.
e.Proprietatile fiziologice.Acidul clorhidric este singurul acid anorganic care apare liber, cu o functie importanta in oganismul animalelor si anume in sucul gastric al mai tuturor vertebratelor. Concetratia de HCl din sucul stomacal al omului este de cca. 0 % (solutie aproximativ decinormala). Acidul clorhidric este secretat de mucoasa stomacului si are rolul de a activa una dintre enzimele digestiei, pepsina.
Copyright © 2025 - Toate drepturile rezervate