 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Procesele chimice la electroliza:
Electroliza este procesul de descompunere permanenta a unei substante sub actiunea curentului electric. Transformarile chimice care se produc in timpul electrolizei, pot fi foarte fregvente, in functie de natura si starea electrolitului, de natura solventului, de natura materialului din care se confectioneaza electrodele si de prezenta altor substante in solutia sau topitura electrolitului.
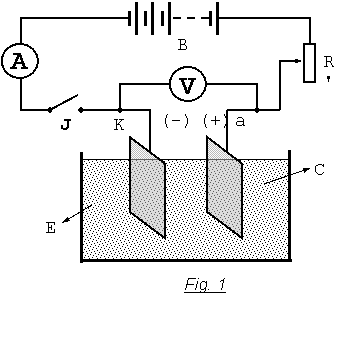
Electroliza se efectueaza intr-un sistem numit celula de elctroliza, care se prezinta in figura 1 si se compune din urmatoarele:
O cuva de sticla, sau din alt material adecvat C1 de dimensiuni potrivite, in care se pune solutia sau topitura electrolitului E;
Doua bucati metalice a si k, legate la o sursa exterioara de curent continuu B;
Un ampermetru A;
Un voltmetru V;
Un interupator I;
Un reostat R;
 La baza oricarei electrolize se afla un proces de oxidoreducere
care incepe odata cu inchiderea circuitului si consta din orientarea si
deplasarea ionilor spre cele doua bucati metalice, in functie de sarcina lor,
de polaritatea placilor de metal. Prin placa cu potentialul pozitiv a care se
numeste anoda, se vor deplasa ionii cu sarcina negativa, iar anionii spre placa
cu potential negativ k, numita catoda. Pe catoda exista un exces de electroni
care determina descarcarea ionilor pozitivi, fiind in acest fel reducatoare.
La baza oricarei electrolize se afla un proces de oxidoreducere
care incepe odata cu inchiderea circuitului si consta din orientarea si
deplasarea ionilor spre cele doua bucati metalice, in functie de sarcina lor,
de polaritatea placilor de metal. Prin placa cu potentialul pozitiv a care se
numeste anoda, se vor deplasa ionii cu sarcina negativa, iar anionii spre placa
cu potential negativ k, numita catoda. Pe catoda exista un exces de electroni
care determina descarcarea ionilor pozitivi, fiind in acest fel reducatoare.
Aceste procese, care se petrec cu schimb de electroni, se numesc procese primare si sunt procese de oxidoreducere. In general electroliza nu ramane la forma sa primara. Ea este insotita de cele mai multe ori de procese secundare, ca rezultat al diferitelor reactii ce au loc in jurul electrodelor intre produsele de elctroliza, electrolit si solvent, etc.
Exemplificand pentru cazul electrolitului unei solutii concentrate de acid clorhidric folosind electroda de platina, care nu reactioneaza cu produsii electrolizei, la electrode vor avea loc urmatoarele procese:
![]()
La catoda (-): ![]() ( proces primar );
( proces primar );
![]() ( proces secundar );
( proces secundar );
La anoda (+): ![]() ( proces primar );
( proces primar );
![]() ( proces secundar );
( proces secundar );
Daca
se pune electrolizei o solutie de sulfat de cupru ![]() folosind electroda de
cupru, reactiile care au loc la acestea sunt urmatoarele in cazul cuprarii:
folosind electroda de
cupru, reactiile care au loc la acestea sunt urmatoarele in cazul cuprarii:
La catoda (-): ![]() ( se depune ).
( se depune ).
La anoda (+): ![]() ( anoda se dizolva ).
( anoda se dizolva ).
Legile cantitative ale electrolizei:
Studiind relatia dintre cantitatea de electricitate care pleaca printr-un electrolit si cantitatea de substanta transformata intr-un interval de timp bine precizat, M. Faraday, descopera intre anii 1882 - 1933, "Legile fundamentale ale electrolizei", care se enunta astfel:
Cantitatile de substanta transformate la electrode in timpul electrolizei sunt proportionale cu cantitatea de electricitate trecuta prin solutia sau topitura de electrolit.
La trecerea aceleiasi cantitati de electricitate prin solutiile sau topiturile diversilor electroliti, cantitatile fiecaruia dintre substantele transformate la electrode sunt proportionale cu echivalentii lor chimici, pentru depunerea unui echivalent-gram de substanta fiind nevoie de 96,496 coulombi.
Prin urmare, pentru transformarea unui echivalent-gram de substanta la electrode, prin electrolit trebuie sa treaca un curent de 1 amper timp de 26,8 ore, un curent de 2 amperi timp de 13,4 ore, un curent de 26,8 amperi timp de o ora, etc.
![]()
![]()
In care:
m = masa de substanta rezultata la electroliza;
A = masa atomica a elementului care se separa;
Z = valenta elementului separat;
I = intensitatea curentului electric;
t = timpul cat dureaza electroliza (secunde);
F = numarul lui Faraday
Modul de lucru:
Pentru
verificarea experimentala a legilor lui Faraday se supune electrolizei
(montajul prezent in figura 1), o solutie de ![]() cu ambele electrode de
cupru.
cu ambele electrode de
cupru.
Se calculeaza masa teoretica de cupru depusa la catoda pentru I=0,1A si 0,2A; t=15min si se determina randamentul de curent.

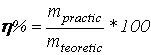
Se
detasaza catoda de pe suportul ei si se curata cu hartie de smirghel, se spala
cu apa distilata si cu alcool, dupa care se usuca etuva la 80o C.
Dupa uscare si racire ea este cantarita la balanta analitica. Se asaza usor
catoda pe suportul ei, se umple celula de sticla cu solutie avand compozitia: ![]() ,
, 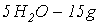 ,
, ![]() .
.
Dupa trecerea timpului de 15 minute, se intrerupe functionarea celulei electrolitice. Se scot electrodele din celula de sticla, se desprinde catoda de pe suportul ei, se spala cu apa distilata si alcool, se usuca si se cantareste din nou la balanta analitica. Diferenta dintre aceasta cantarire si cea initiala reprezinta masa de cupru depusa in urma electrolizei, constituind si stratul protector impotriva coroziunii, in cazul in care catodul este confectionat din fier.
Rezultatele experimentale obtinute in urma determinarilor se trec intr-un tabel.
|
Nr. determ. |
I (A) |
T (secunde) |
mt *g mcalculat teoretic |
mt *g mcalculat practic |
|
![]()
E=2
![]()
![]()
![]()
I1=0 A
I2=0 A
![]()
m1
m2=30,1315
m2-m1=
![]()
Copyright © 2025 - Toate drepturile rezervate