 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Proprietatile chimice ale solurilor
Insusirile chimice, alaturi de celelalte insusiri ale solului (fizice, hidrofizice, biologice s.a.) au o importanta deosebita mai ales cele legate de solutia solului si coloizii solului.
.1. solutia solului
Solutia solului se poate defini (determina) ca faza lichida a solului, care include apa din sol ce contine saruri minerale dizolvate, compusi organo - minerali si organici, gaze si particule fine coloidale.
Precipitatiile atmosferice, apa din scurgeri de suprafata, apele freatice etc. patrund in sol, iar in urma interactiunii cu faza solida si gazoasa a solului, cu sistemul radicular al plantelor si cu organismele vii care populeaza solul - isi schimba compozitia chimica.
Solutia solului joaca un rol important in dinamica solurilor, in hrana plantelor si microorganismelor; participa activ la transformarea compusilor minerali si organici din sol, la transportul acestora pe profil. Continutul in umiditate din sol, deci cantitatea solutiei solului, poate oscila in limite foarte largi, de la zeci de procente (cand apa ocupa practic, toti porii solului) pana la unitati sau parti de procent, cand in sol se gaseste numai apa adsorbita.
1.1. Compozitia chimica a solutiei solului
Compozitia solutiei solului depinde de cantitatea si calitatea precipitatiilor atmosferice, de compozitia fazei solide a solului, de alcatuirea cantitativa si calitativa a materialului stratului vegetal viu si neviu al biocenozelor, de activitatea vitala a mezofaunei si a microorganismelor.
Compozitia solutiei solului sufera permanent modificari datorita activitatii plantelor superioare, prin "absorbtia" de catre radacinile acestora a unor compusi si invers, prin "patrunderea" (intrarea) unor substante, prin secretii eliberate de radacinile plantelor etc. Substantele minerale, organice si organominerale care intra in compozitia fazei lichide a solului se pot prezenta sub forma de combinatii solubile (dizolvate) sau combinatii coloidale. Substantele coloidale sunt reprezentate prin merale argiloase, prin hidrati ai oxizilor de fier si de aluminiu, prin combinatii organice si organominerale. Se apreciaza ca in general coloizii reprezinta de la 1/10 pana la ¼ din cantitatea totala de substante care se gasesc in solutia solului. Cei mai importanti cationi care se pun in evidenta in solutia solului sunt: Ca2+, Mg2+, Na+, K+, NH4+, H+, Al3+, Fe2+, iar dintre anionii mai raspanditi sunt: HCO-3, CO23-, NO2-, Cl-, SO42-, H2PO4-, HPO42-. Fierul, aluminiul si multe microelemente (Cu, Ni, V, Cr etc.), se gasesc in solutia solului mai ales sub forma de combinatii complexe organominerale, in care partea organica a complexelor este reprezentata de catre acizii humici si acizii organici cu molecule mici, de catre polifenoli si alte substante organice.
In general, concentratia solutiei solului este mica si pentru diferite tipuri de soluri oscileaza de la zeci de miligrame pana la cateva grame de substanta la litru de solutie de sol, cu exceptia solurilor saline unde concentratia solutiei de sol poate ajunge la zeci si chiar sute de grame la litru.
Datorita prezentei in solutia solului a acizilor liberi si a bazelor, a sarurilor acide si bazice, acestea determina aciditatea actuala (reactia) solutiei solului - una din insusirile esentiale pentru activitatea plantelor si in acelasi timp, pentru procesele de solificare.
Valorile pH-ului solutiei diferitelor tipuri de soluri variaza de la 2,5 la solurile acide, sulfatice, pana la 8 - 9 la solurile carbonatice si salinizate, ajungand la valori maxime de 10 - 11 la solurile alcaline (soloneturi) si solonceacuri sodice.
Cea mai mica concentratie a solutiei solului si valorile cele mai scazute ale reactiei acide se intalnesc la solurile podzolice la care concentratia lor reprezinta cateva zeci de miligrame la l solutie, la valori ale pH-ului de 5 si mai mici.
Continutul de carbon organic in solutia solului difera, de asemenea, cu tipul de sol si natura vegetatiei; sub paduri de conifere, substanta organica solubilizata este reprezentata mai ales prin acizii fulvici, pe cand la solurile formate sub vegetatie ierboasa predomina acizii huminici.
Cantitatea de substanta organica din faza lichida a solului se micsoreaza pe adancimea profilului de sol, datorita intensificarii migrariii substantelor solubile. Impreuna cu substantele organice migreaza si fierul (in forme bi- si trivalente). In solutia solului, pana la 80 - 95 % din fier este puternic legat in complexe organominerale.
, la solurile de stepa (cernoziomuri), concentratia solutiei solului este mai mare decat in solurile podzolice. Avand in vedere activitatea biologica mai intensa a acestor soluri si ca in cele de stepa creste continutul in ioni bicarbonati, reactia lor devine neutra sau slab alcalina. Sub actiunea vegetatiei de stepa se constata cresterea concentratiei si a altor cationi si anioni (Ca2+, Mg2+, Cl-, SO42-); in soloneturi creste brusc cantitatea ionilor de Na+, a ionilor CO32- determinand alcalinizarea solutiei solului.
Concentratia maxima a solutiei solului se observa la solonceacuri, la care poate ajunge la zeci si sute de grame la litru, cu predominarea clorurilor si sulfatilor de magneziu si natriu.
Compozitia solutiei solului este influentata de temperatura si umiditatea din sol, de intensitatea activitatii microflorei si microfaunei solurilor, de metabolismul plantelor superioare, de procesele de descompunere a resturilor organice din sol,
Cresterea concentratiei solutiei solului are loc in urma pierderilor de apa prin evapotranspiratie.
In orizonturile de bioacumulare, in care continutul de microorganisme este mai mare si, deci, intensitatea proceselor biochimice este cea mai ridicata, se inregistreaza si cele mai puternice contraste de temperatura si respectiv de umiditate si ca atare, compozitia solutiei solului va fi cea mai dinamica.
S-a constatat, de asemenea, ca concentratia solutiei solului poate sa creasca si in perioada primavara - vara timpurie, cand are loc cresterea masiva a plantelor, iar in solutie intra secretii abundente ale radacinilor si diferiti produsi de descompunere ai resturilor organice.
In perioada toamna - iarna precipitatiile atmosferice dilueaza solutia solului si dizolva o parte din saruri care au precipitat vara.
Rolul solutiei solului
Solutia solului constituie sursa directa de elemente nutritive pentru plante. Prin aplicarea diferitelor masuri agrochimice, agrotehnice, hidroameliorative (irigatii, desecari) omul modifica compozitia solutiei solului, aducand-o la valori optime in raport cu cerintele cresterii si dezvoltarii plantelor.
Pentru folosirea elementelor nutritive din solutia solului de catre plante, un rol important il are presiunea osmotica a solutiei solului. Daca aceasta este egala cu presiunea osmotica a sucului celular al plantelor sau mai mare, atunci patrunderea apei in plante nu mai are loc. Se considera ca suctiunea (forta de sugere a radacinilor majoritatii plantelor de cultura) nu depaseste 100 - 120 MPa.
Presiunea osmotica depinde de concentratia solutiei solului si de gradul de disociere a substantelor solubilizate. Astfel, in soluri nesalinizate presiunea osmotica nu depaseste 10 MPa. Prin scaderea umiditatii de la capacitatea de camp la coeficientul de ofilire, concentratia solutiei solului se modifica corespunzator (creste) de 5 - 6 ori si ca atare, creste si presiunea osmotica.
In solutia solului, la solurile mediu salinizate presiunea osmotica este de 30 - 40 MPa, iar la cele puternic salinizate 50 - 60 MPa; la concentratii ale solutiei solului de 20 - 50 g/l, presiunea osmotica poate sa creasca pana la 150 - 260 MPa.
COLOIZII SOLULUI
In sol se gasesc atat coloizi minerali, precum si organici si organo-minerali, a caror compozitie depinde de caracterul rocilor de formare si de tipul de solificare (tab. 1.).
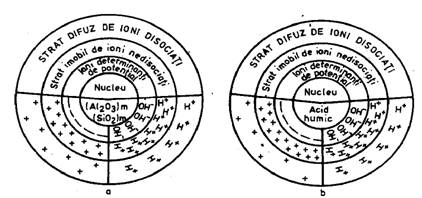
Fig. 1 Alcatuirea micelei coloidale
La baza alcatuirii coloizilor, stau "micelele coloidale"(V i n g h e r). O micela coloidala este alcatuita din nucleu, reprezentat prin combinatii complexe amorfe sau cristaline, cu compozitie chimica diferita (fig. 1).
La suprafata nucleului se gaseste un strat de ioni retinuti stabil, denumit "strat determinant de potential"; in continuare, urmeaza un dublu strat de ioni compensatori - un "strat imobil" cu ioni retinuti puternic de catre ionii din stratul determinant de potential, iar in continuare urmeaza un strat de ioni mai dispersati, numit "strat difuz".
Nucleul micelei, impreuna cu stratul determinant de potential, alcatuiesc granula coloidala; intre granula si solutia care inconjoara coloidul apare un potential termodinamic, sub influenta caruia sunt atrasi din solutie ioni de semn contrar (ioni compensatori).
Granula coloidala, impreuna cu stratul imobil de ioni compensatori, constituie particula coloidala; intre aceasta si solutia inconjuratoare apare un potential electrocinetic (zeta), sub influenta caruia se gaseste al doilea strat de ioni compensatori (cel difuz), posedand posibilitatea de schimb cu ionii de acelasi semn din solutia inconjuratoare.
Coloizii care au in stratul determinant de potential ioni cu sarcina negativa si care elibereaza in solutie ioni de H+ se numesc "acidoizi" (de exemplu, acizii humici, acidul silicic). Coloizii care au in stratul determinant de potential sarcina pozitiva si elibereaza in solutie ionii de OH- se numesc "bazoizi". Coloizii de hidroxizi de fier, hidroxizi de aluminiu, proteinele in functie de reactia mediului se comporta cand ca acidoizi (acizi), cand ca bazoizi (baze) si se numesc amfoteri sau amfolitoizi.
Astfel, hidroxidul de aluminiu, in conditii de reactie acida, datorita concentratiei ridicate a ionilor de hidrogen in solutie, impiedica disocierea hidroxidului de aluminiu ca acid si acesta va disocia ca baza, cu eliberarea in solutie a ionilor de OH-:
Al(OH)3 D Al(OH)2+ + OH-
La reactie alcalina, hidroxidul de aluminiu se comporta ca acid, coloidul avand predominant sarcina negativa:
Al(OH)3 D AlO(OH)2- + H+
La reactie acida a mediului se intensifica disocierea bazica a coloizilor amfoteri, iar la reactie alcalina, cea de acidoid.
La anumite valori pH, numite "punct izoelectric" (sau pH izoelectric), coloidul trece in solutia inconjuratoare o cantitate identica de cationi si anioni si devine electric, neutru.
Starea fizica a coloizilor din sol. Coloizii din sol se gasesc indeosebi sub forma de gel, in care particulele se unesc intre ele, alcatuind o retea cu structura spatiala, in celulele careia se retine apa.
Particulele coloidale cu sarcini de acelasi fel se resping, ramanand in stare de dispersie, fara a forma precipitat, deoarece au un anumit potential cinetic. Pe masura scaderii potentialului electrocinetic si micsorarea sarcinii particulelor de acelasi semn a coloizilor, acestea se reunesc, se grupeaza prin miscari haotice, se lipesc unele de altele, se maresc in diametru si trec sub forma de precipitat.
Procesul de unire a particulelor coloidale si de trecere din stare de sol in cea de gel se numeste "coagulare", iar trecerea din stare de gel in stare dispersa de sol, se numeste" peptizare". (Aici termenul de sol are semnificatie fizico - chimica de coloid in stare dispersata).
Coagularea poate fi reversibila, cand coloizii trec usor din starea de sol in cea de gel si invers, ireversibila, pentru coloizii care trec greu in starea de sol.
Coloizii "hidrofili" (puternic hidratati) coaguleaza mai greu: unele substante organice, mineralele din grupa montmorillonitului. Coloizii hidrofobi (care retin o cantitate mai mica de apa) coaguleaza mai usor: hidroxizii de fier, mineralele argiloase din grupa caolinitului etc.
Procesul de coagulare a coloizilor depinde de natura ionilor adsorbiti, de valenta acestora, de energia ionilor, cationii insiruindu-se in urmatoarea ordine dupa posibilitatea lor de coagulare (K. K. G h e d r o i t).
Li+ < Na+ < NH4 < K+ < Mg2+ < H+ < Ca2+< Ba2+ < Al3+ < Fe3+
Cand coloizii sunt saturati cu ioni monovalenti (Na+, H+) se gasesc mai ales in stare de sol; in urma inlocuirii cationilor monovalenti cu cationi bivalenti (mai ales de Ca) si trivalenti, ei trec in stare de gel, contribuind la formarea unei structuri hidrostabile.
Procesele de sorbtie in soluri
Mecanismul de baza al capacitatii de retinere fizico - chimica a solului se poate explica prin procesele de sorbtie.
Sorbtia nespecifica sau schimbul de cationi
Acest proces se refera la capacitatea cationilor din stratul difuz al coloizilor din sol de a putea fi schimbati in conditii de echivalenta de catre cationii din solutia solului.
La acest schimb pot participa, in mod obisnuit, urmatorii cationi: Ca2+, Mg2+, K+, NH4, Na+, Mn2+, Fe2+, Fe3+, H+, Al3+, iar in proportii mai reduse si alti cationi: Li+, Sr2+ etc.
Schimbul de cationi se face dupa urmatoarele legi:
1. intre cationii adsorbiti din sol si cei din solutie, cu care interactioneaza, schimbul se face in "proportii echivalente",
![]()
2. pentru ionii cu valenta diferita, energia de retinere creste cu cresterea valentei ionilor:
Li+ < Na+ < K+ < NH4+ < Cs+ < Mg2+ < Ca2+ < Al3+ < Fe3+;
3. energia de adsorbtie depinde si de raza ionilor nehidratati (cu cat este mai mica raza ionilor, cu atat acestia sunt mai slab legati), aceasta datorandu-se densitatii sarcinilor de suprafata si ca atare, capacitatii mai mari de hidratare a ionilor (tab. 2.).
4. pentru ionii cu aceeasi valenta, energia de sorbtie creste odata cu cresterea masei atomice a numarului atomic, stabilindu-se urmatoarea serie de sorbtie a ionilor: monovalenti: 7Li < 23Na < 18NH4 < 39 K < 89Pb; bivalenti: 24Mg < 40Ca < 59Co < 112Cd; trivalenti: 27Al < 56Fe.
Ionul de hidrogen, care se prezinta sub forma de H3O+ (hidroniu) se retine foarte stabil, datorita diametrului sau mai mic si capacitatii de a da cu multi anioni combinatii slab disociabile, insa retinerea hidrogenului depinde si de compozitia fazei solide (sorbantului).
Cantitatea totala a cationilor adsorbiti (schimbabili) care pot fi scosi din sol se numeste "capacitate de retinere" (sau capacitate de schimb cationic - T) si se exprima in me la 100 g sol.
Valorile capacitatii de schimb depinde de continutul in sol a fractiilor coloidale (mai ales de humus si minerale argiloase), de natura complexului adsorbtiv al solului, de reactia mediului.
Astfel, capacitatea de retinere a cationilor creste odata cu cresterea gradului de dispersie a coloizilor din alcatuirea complexului adsorbtiv: partea organica a complexului adsorbtiv (acizii humici) poseda o capacitate mai mare de retinere decat cea minerala; la mineralele argiloase din grupa montmorillonitului, capacitatea de retinere este influentata de marirea suprafetei dintre foite prin umezire si de schimbul dintre cationii dispusi intre foite cu cei din solutia solului.
De asemenea, cu cresterea pH - ului, creste ionizarea grupelor functionale ale acizilor humici, ale mineralelor argiloase, se micsoreaza energia pozitiva a oxizilor si creste capacitatea de retinere cationica.
Cand in complexul coloidal al solului se gasesc numai cationi bazici (Ca2+, Mg2+, K+, Na+), suma acestora constituie "suma bazelor de schimb" (sau capacitatea de schimb pentru baze), care se noteaza cu SB si se exprima in me la 100 g sol uscat la 1050 C.
In complexul adsorbtiv al solului se pot gasi adsorbiti numai cationi bazici, in zonele mai uscate (la kastanoziom, cernoziom), dar si in zone mai umede, la soluri formate pe roci bogate in elemente bazice (calcare, marne) sau la unele soluri halomorfe (solonceacuri, soloneturi). O saturatie completa cu cationi bazici (mai ales de Ca) se gaseste in orizontul Cca al diferitelor soluri.
are valori cuprinse intre 1 si peste 50 me la 100 g sol uscat la 1050 C; cele mai mici valori se pun in evidenta la solurile puternic levigate si debazificate, chiar daca au humus si argila in cantitati relativ ridicate, dar si la solurile nisipoase, sarace in coloizi.
Cand in complexul adsorbtiv intalnim si ioni de hidrogen, suma acestora constituie "capacitatea de schimb pentru hidrogen" (sau suma hidrogenilor schimbabili) ce se noteaza cu SH si se exprima in me la 100 g sol uscat.
Proportia ionilor de H+ adsorbit in complexul coloidal al solului creste cu intensificarea levigarii, respectiv a debazificarii: in zona de stepa, in arealele mai umede, alaturi de ionii bazici, in complexul adsorbtiv, se intalnesc si ioni de hidrogen, iar proportia acestora creste mergand spre zone mai umede: silvostepa, padure, montana - unde si rocile sunt mai sarace in elemente bazice. In conditiile tarii noastre nu exista soluri saturate numai cu ioni de hidrogen (chiar la podzoluri - solurile cele mai debazificate - intalnim circa 5 % ioni bazici). Trebuie subliniata influenta negativa pe care o exercita ionii de H+ asupra fertilitatii solului, cu atat mai puternica cu cat proportia ionilor de H+ este mai mare in complexul adsorbtiv.
Deci, "capacitatea totala de schimb cationic" (T) este data de suma cationilor bazici (SB) si a cationilor de hidrogen (SH) adica T = SB + SH
Proportia in care complexul adsorbtiv al solului este saturat cu ioni bazici se exprima prin "gradul de saturatie in baze", care se noteaza cu V si este dat de relatia:
![]()
La solurile care au complexul adsorbtiv saturat numai cu baze (T = SB) gradul de saturatie in baze este egal cu 100 % (kastanoziomuri, unele rendzine, unele cernoziomuri, soluri aluviale carbonatice, lacovisti etc.).
Cand in complexul adsorbtiv se gasesc si ioni de hidrogen, gradul de saturatie in baze (V%) va avea valori mai mici de 100 si cu atat mai mici, cu cat proportia ionilor de H+ este mai mare (80 % la preluvosoluri; 50 % la unele luvosoluri; 10 - 20 % la luvosol albic; 5 % la podzol).
3.2. Sorbtia anionilor din sol
Dupa cum s-a aratat la alcatuirea coloizilor, acestia, pe langa cationi (ioni cu semn +) pot retine si anioni (ioni cu sarcina negativa); sorbtia acestora din urma in sol depinde de alcatuirea si insusirile chimice ale complexului adsorbtiv al solului.
Anionii se dispun in urmatoarea ordine, dupa posibilitatea de a fi adsorbiti de particulele de sol:
Cl- ![]() NO3-
< SO42- < PO43- < SiO44-
< OH-
NO3-
< SO42- < PO43- < SiO44-
< OH-
Sorbtia anionilor creste pe masura cresterii continutului de Fe si Al in complexul adsorbtiv al solului si in acelasi sens, este influentata sorbtia anionilor de scaderea pH-ului mediului.
1. formarea fosfatilor putin solubili, ca rezultat al interactiunii fosfatilor solubili introdusi in sol cu sarurile din solutia solului (retinere chimica): o asemenea forma de adsorbtie este posibila la multe soluri in prezenta ionilor de Ca, Al, Fe, la reactia neutra sau alcalina a mediului.;
2. formarea fosfatilor slab solubili cu cationii complexului adsorbtiv, dupa scoaterea lor de catre cationii din solutie;
3. retinerea ionilor-fosfati prin interactiunea lor cu sarurile minerale: gips, calcit, dolomit. O parte din ionii fosfati sunt legati de calciu care trece in solutie, dar este posibila retinerea ionului fosfat la suprafata mineralelor, fara deplasarea calciului, in parte prin includerea fosfatului in mineral;
7. silicea amorfa retine fosfati pe calea retinerii mecanice (a includerii).
Substantele organice saturate cu baze, de asemenea, retin fosfatii, dar mai putin in raport cu oxizii de fier si mineralele argiloase (tab. 3.)
Micsorarea retinerii fosfatilor se poate realiza pe seama formarii de combinatii complexe alumo- si ferohumice.
O importanta deosebita pentru regimul fosforului din sol o reprezinta trecerea lui, sub forma de ion fosfat, in compusi greu solubili sau insolubili.
Fosfatii de Na si K, care sunt solubili, nu se retin si nu se intalnesc in masa solului. Mult mai raspanditi in sol sunt fosfatii de calciu care se pot prezenta sub forma de fosfati monocalcic: Ca(H2PO4)2 si dicalcic: CaHPO4 care sunt solubili si sub forma de fosfat tricalcic: Ca3(PO4)2 ca fosfat greu solubil.
In solurile acide se pot forma fosfati de fier (FePO4) si de aluminiu (AlPO4), care sunt practic insolubili. Trecerea anionilor fosforici in fosfati insolubili sau greu solubili duce la inaccesibilitatea fosforului pentru plante si respectiv la scaderea productiilor agricole. Ca atare, pe solurile cu reactie neutra sau alcalina (bogate mai ales in Ca) trebuie aplicate ingrasaminte fosfatice usor solubile (fosfat mono- si dicalcic) in doze mai reduse si mai dese (puterea de solubilizare a fosfatilor este foarte mica la reactie bazica).
Pe solurile acide al caror complex coloidal este bogat in Fe si Al, fosforul poate fi blocat sub forma de fosfati de fier si aluminiu care sunt practic, insolubili. Prin urmare, pe solurile acide nu se recomanda aplicarea ingrasamintelor fosfatice usor solubile (fosfat mono- si dicalcic), deoarece ionul de fosfor este blocat sub forma de fosfati de fier si aluminiu insolubili.
Prin aplicarea ingrasamintelor fosfatice greu solubile (fosfat tricalcic), acestea trec treptat in fosfati mono- si dicalcici (solubili), plantele pot folosi ionul de fosfor, iar cationii de calciu eliberati din fosfatul tricalcic, imbunatatesc calitatea complexului adsorbtiv si contribuie la ameliorarea reactiei acide a solurilor respective.
ACIDITATEA SI ALCALINITATEA SOLURILOR
Solutia solului contine in stare de dispersie ioni, molecule, substante coloidale, care se gasesc in proportii foarte diferite in functie de diferiti factori care actioneaza in formarea si evolutia solurilor.
Reactia solului este determinata de raportul dintre concentratia ionilor de H+ si OH- si anume cand proportia ionilor de H+ este mai mare reactia este acida, iar cand predomina ionii de OH- , reactia este alcalina.
Daca ionii de H+ si ionii de OH- sunt in proportii egale, reactia este neutra. Reactia solului este influentata de o serie de factori: compozitia chimica si mineralogica a partii minerale a solului; prezenta sarurilor solubile; continutul si natura substantelor organice care se gasesc in sol; umiditatea solului; activitatea organismelor din sol etc.
Un rol deosebit de important asupra reactiei solului il au sarurile care trecand din faza solida a solului in solutie exercita o influenta importanta asupra caracterului reactiei solului si in ultima instanta, asupra fertilitatii acestuia.
In sol, cel mai raspandit acid (dintre acizii minerali) este acidul carbonic, care poate determina un pH al solului intre valori de 3,9 - 4,7 in functie de conditii le termice, de activitatea biologica din sol etc.
Daca in soluri si in rocile de formare sunt prezente sulfuri, prin oxidarea acestora se poate forma acid sulfuric, ceea ce poate duce la o puternica acidifiere a solurilor; de exemplu la mangrove sau marse, prin uscarea acestora, valorile pH pot scadea de la 7 - 8 (neutru-slab alcalin) la 2 - 3 (extrem acid).
Acidifiere puternica a solurilor produc si acizii humici nesaturati cu cationi si respectiv, acizii fulvici pot determina pH cu valori de 3 - 3,5 (extrem acid); prin descompunerea resturilor organice din zona de padure (litiera), pH-ul poate deveni foarte puternic acid (3,5 - 5) iar muschii pot acidifia solul ajungand la valori de pH de 2,5 - 3.
Reactia solului este influentata si de activitatea ciupercilor si bacteriilor, de gradul de descompunere a resturilor organice, de secretiile radacinilor plantelor sau de catre insectele din sol, putand aparea acizi liberi, organici (oxalic, citric si altii).
Plantele consuma din sol diferiti ioni, eliberand cantitati echivalente de ioni de H+, OH-, HCO3-, CO32- si prin aceasta, se poate modifica reactia solutiei solului spre acida sau spre alcalina.
In mod diferit influenteaza reactia solutiei solului si microorganismele: cele nitrificatoare conduc la aparitia in solutia solului a acidului azotos sau azotic, contribuind la scaderea pH-ului cu 0,5 - 2,0; prin actiunea microorganismelor asupra substantelor proteice, in solutia solului pot aparea mici cantitati de acid sulfuric.
Aciditatea solurilor
Se deosebeste, in general, la soluri o aciditate actuala (activa) si o aciditate potentiala.
Aciditatea actuala (sau pH-ul solului) este data de concentratia ionilor de H+ prezenti la un moment dat in solutia solului. Apa distilata, in raport cu care se stabileste aciditatea, are o reactie neutra, raportul ionilor de H+ si OH- fiind egal:
Ca atare, pH-ul (logaritmul cu semn schimbat al concentratiei ionilor de H+ din solutia solului) poate avea teoretic, valori cuprinse intre 1 si 14. Cand valoarea pH este egala cu 7, reactia este neutra; cand este < 7, reactia este acida si respectiv alcalina, cand pH-ul este > 7.
Pentru solurile din tara noastra valorile pH sunt cuprinse intre 3,5 si 9,5 sau 10 - 11 in cazul unor soloneturi sau solonceacuri sodice.
Reactia solurilor lipsite de saruri. In zonele cu precipitatii abundente, sarurile usor solubile si in mare masura si cele greu solubile (ex: CaCO3) sunt indepartate, solurile avand valori de pH cuprinse intre 3,5-7,0 in functie de gradul de saturatie cu baze a solului, respectiv de raportul dintre cationii bazici (Ca2+, Mg2+, K+, Na+) si cei de hidrogen (H+) din complexul adsorbtiv.
Aciditatea coloizilor organici din sol (acizi humici) este conditionata de hidrogenul schimbabil, acizii organici fiind sursa directa de hidrogen schimbabil.
Aciditatea coloizilor minerali este determinata de prezenta in complexul coloidal a ionilor schimbabili de hidrogen, aluminiu sau fier, ultimii rezultand din reteaua cristalina a mineralelor argiloase si a hidroxizilor.
Deci, reactia acida a extractului de saruri din sol se explica prin aparitia in solutie a ionilor de hidrogen (hidroniu H3O3+).
Reactia acida este influentata si de folosirea substantelor fertilizante (fiziologic acide), care determina imbogatirea solutiei solului in ioni de hidrogen si uneori de aluminiu.
Reactia solurilor care contin saruri. Cand in sol se gasesc saruri, reactia acestuia este determinata de natura sarurilor, care pot hidroliza acid, neutru sau alcalin.
Sarurile neutre (NaCl, CaCl2, CaSO4 etc.), formate din acizi si baze puternice, nu hidrolizeaza si deci nu influenteaza direct reactia solului, valorile pH fiind cuprinse intre 7 si 8,5 (solonceac), in functie si de concentratia solutiei solului si a aerului in CO2. Totusi, prezenta sarurilor neutre in solutia solului determina o scadere a pH - ului cunoscuta sub denumirea de "efect salin".
In cazul in care predomina sarurile cu hidroliza alcalina (carbonati), reactia va fi cu atat mai alcalina, cu cat carbonatul va fi mai solubil. Astfel, CaCO3 se dizolva 0,0131 g/l (la 160C); MgCO3 - 0,960 g/l; Na2CO3 - 140 g/l, iar pH-ul solutie, in ordinea amintita, este de 10,23; 11,46 si 12,00.
Deci, se formeaza bazele respective si acidul carbonic (acid slab), in mod practic, nu influenteaza reactia.
Datorita prezentei CO2 in solutia solului, CaCO3 trece insa in bicarbonat de calciu, care are caracter bazic mai slab decat hidroxidul si determina un pH mai scazut al solutiei solului:
CaCO3 + CO2 + H2O→Ca(HCO3)2
In conditii naturale, reactia solurilor care contin carbonati depinde de raportul dintre carbonat si bicarbonat, care este in functie de continutul de CO2 din sol.
Astfel, la solurile care au CaCO3, pH-ul este in jur de 8,3-8,5; la cele cu MgCO3 pH-ul poate ajunge la 9 iar la solurile cu Na2CO3 pH-ul are valori mai mari de 9,0.
Alcalinitatea solurilor
Reactia alcalina a solutiei solului este determinata de compozitia diferitilor compusi din sol: carbonatii din bicarbonatii alcalini si ai elementelor si metalelor alcalinoteroase, ai silicatilor de natriu si humatilor de natriu etc.
Clase de reactie a solului
(pH-ul in suspensie apoasa la raport sol/solutie de 1: 2,5)
|
Denumire |
Limite de pH |
|
Extrem de acida Foarte puternic acida Puternic acida |
< 3,50 |
|
Moderat acida | |
|
Slab acida | |
|
Neutra Slab alcalina | |
|
Moderat alcalina Puternic alcalina Foarte puternic alcalina Extrem de alcalina |
>10,1 |
Rol determinant in aparitia reactiei alcaline il au sarurile ce hidrolizeaza alcalin (carbonati de Na si K, bicarbonati de Na si K, carbonati de Ca si Mg etc.).
Deoarece cu acidul poate reactiona o anumita substanta capabila sa se uneasca cu protonul acestuia, alcalinitatea globala poate fi considerata ca masura (marime) a deficitului de protoni in raport cu conditia luata ca nivel zero (nul).
In general, se deosebeste o alcalinitate actuala (activa) si o alcalinitate potentiala a solului.
Alcalinitatea actuala, este determinata de existenta in solutia solului a sarurilor care hidrolizeaza alcalin (au fost enumerate anterior) prin a caror disociere se formeaza cantitati importante de ioni hidroxili. Alcalinitatea solurilor se determina prin titrarea extractului apos sau a solutiei solului cu un acid, in prezenta diferitilor indicatori si se exprima in miliechivalenti la 100 g sol.
Pe langa sarurile care hidrolizeaza alcalin, asupra alcalinitatii globale a solului o influenta importanta exercita si anionii bazelor. De exemplu alcalinitatea data de carbonatii solubili este determinata de reactia de schimb a solurilor care contin Na adsorbit; ea poate fi si rezultatul activitatii bacteriilor sulfat reducatoare, in conditii de anaerobioza, si in prezenta substantei organice, a sarurilor sub forma de sulfati de Na cu formarea sodei.
Alcalinitatea potentiala, este data de totalitatea ionilor de CO32- si HCO3- evidentiata in urma titrarii cu solutie de NaOH 0,1 n in prezenta fenoftaleinei si a metilorange ca indicatori.
In scopul ameliorarii solurilor alcaline, se pot folosi gips, nitrat de calciu sau materiale ce contin gips, acid sulfuric, sulfat de fier, cenusa de pirita sau sulf.
Importanta reactiei solului
Cunoasterea reactiei (pH-ului) solurilor prezinta o deosebita importanta pentru studiile pedologice si pentru caracterizarea solurilor.
Solurile din tara noastra se clasifica, in functie de reactie, de la extrem acide, cu valori pH < 3,5 pana la alcaline si puternic alcaline, cu valori pH mai mari de 9,0 (v. tab. 4).
In general, plantele de cultura se comporta optim la valori de pH neutre, slab acide sau slab alcaline (cuprinse intre 6,3 - 7,5) (tab. 5), dar sunt plante care se dezvolta mai bine pe soluri acide (cartof, secara, ovaz) iar altele pe soluri alcaline.
Prin cunoasterea insusirilor solului in ceea ce priveste reactia (pH-ul), putem stabili cele mai corespunzatoare culturi in functie de cerintele acestora fata de reactie.
Solurile cu reactie acida (cu valori de pH sub 6), sau cele cu reactie alcalina (pH> 8) trebuie ameliorate, folosind in acest scop amendamente pe baza de calcar, la cele acide, sau sub forma de gips, fosfogips, la solurile alcaline.
Comportamentul plantelor de cultura este foarte diferit fata de reactia solurilor (v. tab. 6). De asemenea si organismele din sol au cerinte diferite fata de pH: bacteriile prefera mediul neutru, slab acid (valori 6 - 8 ale pH-ului); ciupercile reactie acida (pH = 4 - 5) etc.
Asimilarea elementelor nutritive de catre plante si microorganisme este de asemenea influentata de reactia solului. Astfel, oligoelementele sunt asimilate mai usor in mediul acid si mai greu in mediul alcalin; Ca, Mg in domenii de pH =7 - 8,5 (neutru-slab alcalin), N in intervalul de pH = 6,0 - 6,8 (slab acid) etc.
Intervalul optim al pH-ului solului pentru vita de vie, pomi si arbusti fructiferi, legume, plante ornamentale s.a.
|
pH-ul |
Planta |
|
|
Vita - de - vie Mar (soiuri criofile) Piersic Cires Prun Par Cais Visin, gutui, migdal Mar (soiuri termofile) Agris Zmeur Coacaz, frag Tomate, hrean Morcov Castravete, pepene verde, dovlecel, telina, spanac Salata Sparanghel Varza Sfecla rosie, praz, fasole, mazare Araucaria, Azalea, Coleus, Rhododendron, Camelia, Dahlia Magnolia, Lilium, Gloxinia, Opuntia Calla, Gladiolus, Weigelia Asparagus Dianthus, Freesia, Cineraria, Rosa Buxus, Gentiana, Forsythia, Peonia, Tamarix, Tulipa Anemone, Calendula, Chrysantemum Ovaz, orez, secara Grau, porumb, sorg Floarea - soarelui Sfecla pentru zahar Agrostis Dactylis. Lolium, Trifolium Bromus Cartof |
Aciditatea potentiala a solului
Aciditatea potentiala este determinata de ionii de hidrogen, adsorbiti in complexul coloidal; solul prin interactiunea cu sarurile din solutie, se manifesta ca un acid slab.
In functie de caracterul interactiunii cu solutia solului, se deosebesc doua forme de aciditate potentiala a solurilor: de schimb si hidrolitica. Ele reprezinta etape succesive de separare in solutie a cantitatilor complementare de protoni din faza solida.
Aciditatea de schimb (As), se pune in evidenta prin tratarea probei de sol cu o solutie normala a unei sari neutre (KCl, NaCl, CaCl2); prin aceasta se produce schimbul echivalent dintre cationii sarii neutre si ionii de hidrogen, aluminiu etc. adsorbiti in complexul coloidal.
Aciditatea hidrolitica (Ah), se pune in evidenta la tratarea solului cu o sare care hidrolizeaza alcalin (formata dintr-o baza puternica si un acid slab), prin care se produce o scoatere mai deplina a hidrogenului adsorbit sau a altor ioni acizi.
In mod obisnuit, pentru determinarea aciditatii hidrolitice se foloseste acetat de natriu, 1n (pH = 8,2);
[CAS-]H+ + CH3COONa → [CAS-]Na+ + CH3COOH
In acest caz se formeaza acid acetic care, fiind un acid mai slab, disociaza mai putin in solutia solului si se va scoate din complex o cantitate mai mare de ioni de hidrogen, deci aciditatea hidrolitica are valori mai mari decat aciditatea de schimb. Aceasta se pune in evidenta pana la un pH al solurilor de 8,2 - 8,3 (pH-ul solutiei de acetat).
Acidul acetic care se formeaza se titreaza, de asemenea, cu o baza (NaOH, 0,1n).
Daca in sol este aluminiu schimbabil, se va forma acetat de aluminiu, care trece apoi in hidroxid de aluminiu si acid acetic.
Aciditatea hidrolitica (me/100 g sol uscat la 1050C) se foloseste la calculul capacitatii totale de schimb cationic: T = SB + Ah . 2,17, precum si la calculul dozelor de amendamente calcaroase pentru ameliorarea solurilor acide:
CaCO3 t/ha = Ah 1,5; CaO t/ha = Ah . 0,84.
Capacitatea de tamponare a solului
Prin capacitatea de tamponare se intelege insusirea solului de a se opune tendintei de modificare a concentratiei unor ioni (H+, OH-, K+, Ca2+) din solutia solului, prin actiunea reciproca dintre faza solida si faza lichida.
Capacitatea de tamponare a solului este determinata de insusirile fazei solide, mai ales ale coloizilor din sol.
Capacitatea de tamponare a solurilor depinde de o serie de factori
cantitatea coloizilor din sol: capacitatea de tamponare este cu atat mai mare cu cat in sol se gasesc mai multi coloizi (organici, minerali, organo-minerali). Astfel, solurile nisipoase care practic nu contin coloizi sunt lipsite de tamponare;
compozitia coloizilor din sol: capacitatea de tamponare in mediu acid sau bazic va creste odata cu cresterea continutului de humus, a argilei montmorillonitice;
natura cationilor de schimb: o proportie mai mare a cationilor de Ca2+, Mg2+, Na+ determina o capacitate de tamponare considerabila in intervalul acid, pe cand prezenta in complexul coloidal al ionilor de H+ sau de Al3+ schimbabili, influenteaza pozitiv capacitatea de tamponare in domeniul alcalin.
Solurile la care in complexul adsorbtiv sunt retinuti ionii de H+ in cea mai mare parte (podzol) au capacitate de tamponare numai pentru baze, pe cand solurile saturate in intregime cu cationi bazici (unele rendzine) au capacitate de tamponare numai pentru acizi.
De capacitatea de tamponare a solurilor se tine cont la aplicarea ingrasamintelor si amendamentelor, astfel:
▪ pentru corectarea reactiei acide a solurilor se folosesc amendamente pe baza de carbonat de calciu sau oxizi de calciu, iar pentru corectarea reactiei puternic alcaline, gips sau fosfogips; folosirea inversa a CaSO4 2H2O si CaCO3 poate contribui mai mult la acidifierea solului (prin formarea de H2SO4) sau la alcalinizarea sa (formarea Na2CO3);
▪ la solurile care nu au capacitate de tamponare pentru acizi nu se recomanda folosirea ingrasamintelor cu reactie fiziologic acida: (NH4)2SO4;
▪ la solurile care nu au capacitate de tamponare pentru baze nu se recomanda aplicarea ingrasamintelor cu reactie alcalina (nitrocalcamoniu);
▪ la solurile cu capacitate de tamponare slaba se recomanda aplicarea ingrasamintelor in doze mici si la intervale scurte;
▪ la solurile cu capacitate de tamponare puternica sunt recomandate doze de ingrasaminte in cantitate mare si la intervale lungi de timp.
Reactia solului nu sufera variatii prea mari datorita capacitatii de tamponare, ceea ce este foarte important pentru activitatea microorganismelor si cresterea plantelor.
Reactii si procese de oxido - reducere
Solul constituie un sistem complex oxido-reducator, datorita alcatuirii sale, diferitilor compusi minerali si organici care sunt capabili sa intre in reactii de oxidare si reducere - procese cu influenta deosebita asupra solificarii.
Reactiile de oxidare influenteaza procesele de humificare a resturilor organice, iar modificarile pe care le sufera compusii de fier, mangan, azot, sulf etc. sunt legate atat de reactiile de oxidare, cat si de cele de reducere.
In mod obisnuit, reactiile de oxidare si reducere se produc concomitent: substanta care castiga O sau pierde electroni se oxideaza, cea care pierde O sau castiga electroni se reduce. Donatorul de electroni se numeste "reducator" (el se oxideaza), iar acceptorul de electroni - oxidant (el se reduce).
Reactia de oxido - reducere se poate prezenta astfel:
Ox + nē D Red,
in care Ox este oxidant; red - reducator; ē - electron; n - numar de electroni care participa la reactie.
Unele reactii de oxido - reducere din sol sunt reversibile (oxidarea si reducerea fierului si manganului), pe cand altele sunt ireversibile (oxidarea materiei organice).
5.2. potentialul oxido - reducator al solului
Pentru caracterizarea cantitativa a reactiilor oxido - reducatoare care au loc in sol, ce determina starea oxido - reducatoare a solurilor, se foloseste notiunea de potential oxido - reducator, care este dat de diferenta de potential, care apare intre solutia solului si electrodul de referinta, care se introduce in sol. Se masoara cu ajutorul potentiometrului. Ca electrod de referinta se foloseste electrodul de calomel. Potentialul se exprima, de regula, in milivolti, se noteaza cu simbol Eh si exprima raportul dintre activitatea oxidantului (Ox) si reducatorului (Red).
Potentialul redox al solului variind foarte mult in functie de gradul de aeratie
Inrautatirea aeratiei solurilor, ca rezultat al cresterii umiditatii lor, sau al tasarii, a formarii crustei la suprafata, care contribuie la dereglarea schimbului normal de gaze al aerului din sol cu cel atmosferic, contribuie, de asemenea, la scaderea potentialului oxido-reducator al solului.
Rolul proceselor de oxido - reducere in formarea solurilor si a fertilitatii acestora
Procesele de oxido - reducere au o influenta importanta asupra proceselor de solificare si asupra fertilitatii solurilor.
De aceste procese sunt legate transformarea substantelor organice, ritmul de bioacumulare si compozitia substantelor organice (mai ales a humusului).
Umiditatea in exces si starea de reducere indelungata contribuie la incetinirea proceselor de descompunere a resturilor organice, la cresterea in compozitia humusului a proportiei acizilor organici mai mobili (acizii fulvici).
Prin reducerea combinatiilor fierului si manganului, creste solubilitatea acestor elemente, favorizand migrarea lor in cadrul profilului de sol.
Schimbarea conditiilor de reducere cu cele de oxidare conduce la segregarea hidroxizilor de fier si mangan si formarea neoformatiilor ferimanganice. In urma reactiilor de reducere a sulfatilor se formeaza hidrogen sulfurat si sulfura de fier, care dau solului culori inchise. Cand in sol predomina starea de aerobioza, , aceasta influenteaza nefavorabil accesibilitatea pentru plante a fierului, manganului si partial, a azotului. Daca valorile acestea determina acumularea combinatiilor reduse de fier, mangan, mercur, in cantitati toxice pentru plante.
Pentru crearea conditiilor optime pentru dezvoltarea plantelor se impun masuri pentru reglarea proceselor de oxido-reducere in soluri, prin imbunatatirea starii de structurare, a regimului hidric si de aer prin folosirea metodelor agrotehnice, prin irigatie si drenarea solurilor.
Copyright © 2026 - Toate drepturile rezervate