 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Electroliza si aplicatiile ei
1. Ce este electroliza?
Inainte de anul 1880, energia electrica avea o utilizare foarte limitata in industria chimica, cu toate ca primele cercetari de laborator in domeniul electrochimiei dateaza inca de la inceputul secolului al XIX-lea. Dezvoltarea larga a electrochimiei industriale a inceput abia dupa inventarea si perfectionarea dinamului. Un rol important in dezvoltarea electrochimiei ii revine lui M. Faraday care a formulat legile fundamentale ale electrolizei.
Producerea diferitelor fenomene chimice sub actiunea curentului electric la suprafata de contact electrolit-electrod metalic constituie fenomenul de electroliza. Acesta poate fi definit dupa Faraday ca o descompunere permanenta a unei substante sub actiunea curentului electric, caz in care ionii solutiei se vor dirija spre electrodul cu incarcarea electrica opusa celei pe care o iau ionii, unde se depun.
Procesele de electroliza se supun legilor lui Faraday:
Legea I a electrolizei:
Masa de substanta separata la electrod prin electroliza este direct proportionala cu cantitatea de electricitate ce trece prin electrolit.
m = K · I · t,
![]() ,
E=96.500·K
,
E=96.500·K
unde
|
m |
masa de substanta depusa la electrod |
|
|
K |
echivalentul electrochimic al electrolitului |
|
|
A |
masa atomica |
|
|
N |
valenta ionului care se depune |
|
|
F |
constanta lui Faraday |
|
|
I |
intensitatea curentului (in amperi) |
|
|
t |
reprezinta timpul cat dureaza electroliza |
|
|
E |
echivalentul chimic |
Pentru verificarea experimentala a acestei legi, se trece un curent electric prin mai multe celule electrolitice care sunt legate in serie si care contin acelasi electrolit. Se poate constata ca in fiecare celula electrolitica cantitatea de electrolit descompus este aceeasi pentru aceeasi durata de electroliza. Daca se dubleaza durata de electroliza (sau intensitatea de curent) cantitatea de electrolit descompusa este dublata.
Legea a II-a a electrolizei:
![]()
![]()
La determinarea cantitatii de curent necesara pentru un echivalent-gram se tine seama de descarcarea unui ion monovalent necesita un electron, a carui sarcina este:
4,8020.10-10 u.e.s.C.G.S.=1,602.1019 As (amperi-secunda)=1C (coulomb), si ca un echivalent-gram reprezinta N (numarul lui Avogadro) ioni monovalenti. Deci sarcina totala a acestor ioni este:
eN =(1,602.10-19 As)(6,023.10-23 val-1)=
=96494 As . val-1=96494 C. val-1
26,8 Ah.val-1
Aceasta cantitate de electricitate se numeste un Faraday si are simbol F. Deci un Faraday reprezinta cantitatea de electricitate necesara pentru a transforma la electroliza un echivalent-gram dintr-o substanta(F=96.500 C).
De exemplu, pentru ca la electroliza acidului clorhidric sa se puna in libertate un atom-gram de hidrogen este necesar 1F, pentru 2 atomi-gram de hidrogen sunt necesari 2F, pentru 3 atomi-gram sunt necesari 3F etc. Tot asa, pentru ca la electroliza unei solutii de clorura de cupru(II) sa se puna in libertate 1 atom-gram de cupru sunt necesari 2F, pentru 2atomi-gram de cupru sunt necesari 4F etc.
Fenomenul de electroliza este complicat si depinde de o serie de factori fizici si chimici, a caror actiune a impus clarificarea a insasi modului prin care se face disocierea unui electrolit sub actiunea curentului electric. Fenomenul consta in migratia ionilor pozitivi catre catod si a ionilor negativi spre anod, cat si in neutralizarea acestora. Astfel, la electrozi, ionii capteaza, respectiv cedeaza electroni, transformandu-se in atomi neutri sau grupe de atomi. Acestia se pot depune ca atare pe electrod sau pot reactiona; cu moleculele dizolvantului, cu electrodul, sau intre ei. Se formeaza astfel produsi secundari ai electrolizei. De fapt, procesele la electrozi, avand loc cu transfer de electroni sunt transformari redox.
Industriile electrochimice reprezinta o ramura cu aplicatii importante pentru economia nationala. Aplicarea electrochimiei permite sa se obtina cantitai mari de produse importante, cum sunt: hidrogenul, oxigenul, clorul, hidroxizii alcalini, peoxizii, oxiclorurile etc.
Prin electroliza substantelor topite se obtin: sodiu, calciu, magneziu, aluminiu si alte metale. Datorita metodelor eletrochimice s-a reusit sa se realizeze pe scara indsutriala obtinerea unor metale ca: bariu, cesiu, litiu etc.
Metalele din grupele I, a II-a si a III-a principala se obtin industrial prin electroliza topiturilor. Beriliul metalic se obtine prin electroliza unui amestec topit de BeF2 si o fluorura alcalina iar strontiul, un alt metal al grupei a II-a se obtine similar cu calciul.
Cu toate ca prin aceste procese electrochimice se consuma mari cantitati de energie electrica, ele sunt utiliate pe scara larga intrucat permit obtinerea metalelor pure necesare in tehnica. Procedeele electrochimice sunt singurele care fac posibila obtinerea metalelor cu potential de oxidare mare.
Obtinerea aluminiului este un proces tehnologic complex care cuprinde doua etape distincte: obtinerea aluminei din bauxita si electroliza oxidului de aluminiu.
Nemetalul care se obtine pe calea electrolizei este fluorul. Pentru electroliza se utilizeaza un amestec de fluorura de potasiu si acid fluorhidric. Temperatura la care se efectueaza electroliza se stabileste in functie de compozitia electrolitului.
Obtinerea aluminiului a fost un dar binevenit. Pana catre sfarsitul secolului al XIX, aluminiul a fost un metal mai rar. Doar cei foarte bogati isi permiteau sa detina obiecte din aluminiu. Charles M. Hall, in varsta de 21 de ani, student la Oberlin, a incercat sa descopere metode ieftine de obtinere ale acestui metal. Greutatile pe care le-a infruntat au fost legate de faptul ca aluminiul este foarte reactiv si era greu sa-l obtina prin reactii chimice obisnuite. Eforturile de a produce aluminiu prin electroliza au fost neroditoare, deoarece sarurile sale anhidre erau greu de preparat, iar oxidul Al2O3, avea un puncte de topire > 2000 , astfel incat, nu exista nici o metoda practica de al topit. In 1886 Hall a descoperit ca Al2O3 dizolva un mineral numir criolit, Na3AlF6, rezultand un amestec, cu un punct de topire relativ mic, din care aluminiul putea fi obtinut prin electroliza.
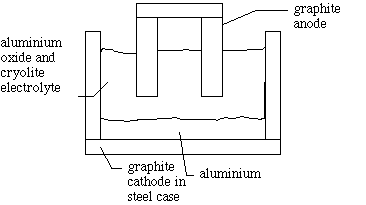 Diagrama de functionare a acestui proces este redata mai jos. Bauxita
contine Al2O3. Bauxita este purificata,
iar Al2O3 este apoi adaugat electrolitului de topitura de criolit, in care se
dizolva si apoi se disociaza. La catod, ionii de aluminiu se reduc si se obtine
metalul care formeaza un strat sub electrolitul mai putin dens. La anodul de
carbon, ionul oxid este oxidat rezultand O2.
Diagrama de functionare a acestui proces este redata mai jos. Bauxita
contine Al2O3. Bauxita este purificata,
iar Al2O3 este apoi adaugat electrolitului de topitura de criolit, in care se
dizolva si apoi se disociaza. La catod, ionii de aluminiu se reduc si se obtine
metalul care formeaza un strat sub electrolitul mai putin dens. La anodul de
carbon, ionul oxid este oxidat rezultand O2.
Al3+ + 3e- ---> Al(l) (catod)
2 O2- ---> O2(g) + 4e- (anod)
4 Al3+ + 6 O2- ---> 4 Al(l) + 3 O2(g)
Oxigenul produs la anod ataca electrodul de carbon, producand CO2, astfel electrodul trebuind schimbat frecvent.
Una din aplicatiile electrolizei cu anozi activi (care se consuma in decursul electrolizei) este electrorafinarea. Aceasta metoda este utilizata in procesul de obtinere a cuprului de mare puritate si pentru recuperarea metalelor pretioase. De fapt, rafinarea electrolitica reprezinta ultima etapa in metalurgia cuprului. Electroliza cuprului are loc astfel:
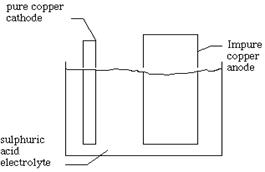 In baia de electroliza ce contine ca electrolit o solutie acidulata de
CuSO4 se introduc o serie de placi groase de cupru impur si se leaga de anodul
sursei de curent. Intre placile anodice se intercaleaza placi subtiri de cupru
pur, legate la polul negativ al sursei de curent. In aceste conditii trec in
solutie din placile anodice numai ionii de cupru si ionii impuritatilor
metalice, care se gasesc in seria tensiunilor electrochimice
inaintea cuprului. La catod se descarca numai ionii de cupru, potentialul de
descarcare al celorlalti fiind mai ridicat, acestia raman in solutie. Celelalte
impuritati cu potentialul mai electropozitiv, aflate in placile anodice de
cupru se acumuleaza prin depunere pe fundul baii de electroliza, formand
asa-numitul namol anodic care constituie la randul sau o sursa pentru
obtinerea acestor elemente.
In baia de electroliza ce contine ca electrolit o solutie acidulata de
CuSO4 se introduc o serie de placi groase de cupru impur si se leaga de anodul
sursei de curent. Intre placile anodice se intercaleaza placi subtiri de cupru
pur, legate la polul negativ al sursei de curent. In aceste conditii trec in
solutie din placile anodice numai ionii de cupru si ionii impuritatilor
metalice, care se gasesc in seria tensiunilor electrochimice
inaintea cuprului. La catod se descarca numai ionii de cupru, potentialul de
descarcare al celorlalti fiind mai ridicat, acestia raman in solutie. Celelalte
impuritati cu potentialul mai electropozitiv, aflate in placile anodice de
cupru se acumuleaza prin depunere pe fundul baii de electroliza, formand
asa-numitul namol anodic care constituie la randul sau o sursa pentru
obtinerea acestor elemente.
La anod : Cu ---> Cu2+ + 2e- La catod: Cu2+ + 2e- ---> Cu Reactia totala: Cu2+ + Cu ---> Cu ---> Cu2+
In prezent cea mai mare cantitate din necesarul mondial de hidroxid de sodiu si de potasiu de obtine prin electroliza solutiilor apoase concentrate de clorura de sodiu, respectiv de potasiu. Exista doua procedee de a obtine substante compuse: unul ce se numeste procedeul cu diafragma, deoarece in industrie spatiul catodic este separat de spatiul anodic printr-un perete poros denumir diafragma, si unul ce se numeste procedeul cu catod de mercur, care se foloseste pentru a avita reactiile secundare. Pe plan mondial se observa utilizarea cu prioritate a celulelor cu diafragma, pentru a evita poluarea mediului inconjurator cu mercur.
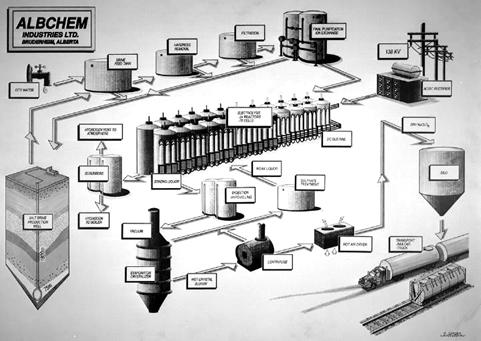
Pentru a obtine NaClO3 Albchem Industries Ltd. foloseste urmatoarea tehnologie:
Din minele de sare ce se afla la 1800 m adancime este pompata o solutie de NaCl. Ajunsa in fabrica aceasta solutie este curatata de impuritati si i se elimina "taria" . Calciul si magneziul sunt eliminati pentru a preveni depunerile la catod, rezultand in pierderi electrice. Solutia astfel pregatita este gata pentru electroliza. Sectia de electroliza consta in 24 de vase si 72 de celule aranjate in serie. Cand sunt conectate la tensiune, se formeaza hidrogen gazos. Hidrogenul misca lichidul formand astfel un circuit intre vas si celula. NaCl este transformat in NaClO3. Hidrogenul este eliminat in atmosfera. Ecuatia reactiei este:
NaCl + 3H2O -> NaClO3 + 3H2
Lichidul concentrat continand NaClO3 la o temperatura de 85 C este turnata intr-un vas unde are loc cristalizarea. Apoi cristalele sunt spalate din nou si NaClO3 este depozitat fiind gata pentru livrare.
Consta in aplicarea unui start fin, ornamental si protector al unui metal pe altul. Este o tehnica comuna utilizata pentru a imbunatati aparenta si durabilitatea unor obiecte metalice. De exemplu aur si platina sunt aplicate pe bijuterii fabricate din materiale ieftine. Grosimea acestor starturi variaza intre 0.03 si 0.05 mm.
Compozitia baii de electrolit variaza, si este des tinuta secret, dar de obicei ea depinde metal ce urmeaza a fi depozitat, si poate afecta durabilitatea si caliatatea suprafetei. De exemplu, argintul depus dintr-o solutie de nitrat de argint nu se lipeste prea bine de o suprafata metalica. Daca este depus dint-o solutie ce contine ioni de Ag(CN)2-, atunci el adera bine si capata si luciu. Alte metale ce sunt electroplacate in asemenea bai sunt aurul si cadmiul. Nichelul, ce poate si el fi folosit ca start protector, este placat dintr-o solutie de sulfat de nichel, iar cromul este placat dint-o solutie de H2CrO4.
Anumiti monomeri (stiren) sunt usor de folosit pentru a crea anioni organici. Acesti anioni pot polimeriza intr-un proces numit polimerizare anionica. Se poate folosi un circuit electric pentru a porni acest proces, polimerul localizandu-se la catod. Daca este gandit bine procesul, se poate utiliza la placarea organica a metalui. Acest proces a fost folosit pentru a vopsi masinile noi, avantajul constand ca el are loc in apa, nemaifiind nevoie de spray-uri cu solventi organici volatili.
Electroliza se mai utilizeaza in instrumente de masurare ale pH-ului. Aceste instrumente compara pH solutiei cu cel al electrodului corespunzator.
O alta aplicatie este utilizarea electrolizei la eliminarea parului nedorit de pe corp. Eliminarea parului are loc prin aplicarea unei tensiuni foarte mici intr-o solutie de NaCl ce se afla la radacina parului. In urma electrolizei rezulta NaOH ce arde radacina parului, distrugand firul. Aceasta tehnica este scumpa si detine critici. Produce durere in functie de zona ce este electrocutata, durerea putand chiar fi uriasa in cazul unor tensiuni prea mari.
Electroliza se mai utilizeaza in industria uleiului comestibil, in instalatiile de intarire a grasimilor atat animale cat si vegetale.
2. Importanta electrolizei.
Prin electroliza se obtin mai multe produse chimice importante: hidroxidul de sodiu rezulta prin electroliza unei soluti apoase de clorura de sodiu odata cu clorul si hidrogenul; tot pe cale electronica se prepara hipocloritii de potasiu si de sodiu (KClO3, NaClO3), permanganatul de potasiu (KMnO4); prin descompunerea electrolitica a apei se obtin cantitati mari de oxigen si hidrogen etc.
In metalurgie se aplica electroliza pentru extragerea unor metale din compusi, de exemplu Na, Al, sau la rafinarea Cu, Zn, Pb etc.
Mark S. Wrighton,
'Electrolysis,' Discovery Channel School, original content provided
by World Book Online, https://www.discoveryschool.com/homeworkhelp/
worldbook/atozscience/e/177180.html
https://www.ucdsb.on.ca/tiss/stretton/chem2/electro9.htm
https://www.madsci.org/posts/archives/may98/893874472.Ch.r.html
https://host2.mbcomms.net.au/tg/gtg/tfb-elect.html
Sanda Fatu, Cornelia Costin, Adina Toescu, Chimie, manual pentru clasa a XII-a, Editura Didactica si Pedagogica, Bucuresti, 1997
Constantin Ionescu, Chimie Fizica, Editura Didactica si Pedagogica, Bucuresti, 1982
Copyright © 2026 - Toate drepturile rezervate