 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
Un Roman Evolutionist, Model Al Planificarii Medicamentelor In
Chimioterapia Cancerului
Abstract- In aceasta lucrare, introducem un control optim modificat, model al planificarii medicamentelor in chimioterapia cancerului si o noua adaptare a elitistilor bazata pe algoritmul genetic ( AEGA) pentru a se rezolva. Lucrand indeaproape cu un oncologist, prima data am modificat modelul existent, pentru ca ecuatia lui pentru toxicitatea cumulativa a medicamentelor este inconsistenta in comparatie cu stiinta medicala si experientele clinice. Pentru a cerceta eficientele multiple ale planificarii medicamentelor, propunem o reprezentare variabila a unui roman, o reprezentare a unui ciclu intelept si modificand cautarea genetica a operatorilor in AEGA. Rezultatele partiale obtinute din modelul modificat se potriveste cu experientele tratamentului clinic si poate da multiple solutii eficiente ce pot fi luate in seama de oncologisti. Mai mult, a fost aratat ca planificarea evolutionista a medicamentelor este simpla si capabila sa rezolve problemele complexe ale chimioterapiei cancerului, adoptand mai multe versiuni ale algoritmului evolutionist.
Cuvinte cheie: modelul planificarii medicamentelor, algoritmi genetici.
I. Introducere
O tinta importanta a chimioterapiei este sa ucida cat mai multe celule ale tumori pe o perioada fixa de tratament. Asadar planificarea medicamentelor este esentiala in chimioterapia cancerului. Martin [1] a propus un model optim al planificarii medicamentelor si a aplicat tehnici de programare nonliniare pentru a se rezolva. Rezultatele au fost imbunatatite de Bojkov et al. [2] care a folosit o apropiere cuplata intuitiva apropiata cu procedura directa de cautare propusa in [3]. Bazata pe numere aleatoare apropiate si cautare de regiuni contractile, o metoda a cautarii optime directe a fost aplicata pentru a rezolva aceasta problema [4]. Carrasco si Banga [5] au propus un algoritm adaptabil de cantitate pentru a gasi controlul optim al resturilor asigurarii pentru problema planificarii medicamentului, mutand trei puncte ce sunt incluse pentru a reduce probabilitatea unei urgente in cazul rezistentei celulelor la medicament.
Pe de alta parte, algoritmele evolutioniste (EAs) sunt foarte capabile sa rezolve problemele optime bazate pe cercetarile populatiei desfasurate in paralel. Tan et al. [6] a propus un "Algoritm evolutionist dispus uniform" apropiindu-se sa rezolve aceasta problema a planificarii medicamentelor si obtinand o optima globala aproximativa.
In opinia noastra, muncind [7], prin analiza planificarii optime al medicamentelor obtinute din modelul lui Martin, s-au descoperit doua motive neeficiente evidente: 1) sincronizarea nereusita pentru primul tratament, 2) cele trei puncte constranse nu pot ameliora eficienta tratamentului cancerului. Noi analizam motivele cauzate de aceste probleme si modificam modelul lui Martin. Cel mai nou model planificat poate descrie corect procesul metabolic al acumularii toxicitatii medicamentului in organism si rezolva problemele nerezonabile in modelul planificarii medicamentelor a lui Martin.
Modelul planificarii medicamentelor sunt probleme ale optimizarii multimodale si solutiile lor posibile in timp consta in cateva subregiuni discontinue. Aici, noi utilizam algoritmul genetic propus (GA) - un algoritm genetic adaptabil pe populatia elitista (AEGA) - care este un algoritm eficient pentru problemele de optimizare multimodale [8], pentru a rezolva modelul modificat al planificarii medicamentelor.Rezultatele partiale arata ca algoritmul de optimizare multimodal AEGA, produce excelente asigurari ale planificarii medicamentelor, in chimioterapia cancerului, care se potriveste cu experienta tratamentului clinic.
Aceasta lucrare este oraganizata dupa cum urmeaza. Sectiunea II descrie modelul planificarii medicamentelor in chimioterapia cancerului a lui Martin si rezultatele lui partiale. Sectiunea III prezinta modelul nou modificat al planificarii medicamentelor in chimioterapia cancerului. Sectiunea IV introduce automatizarea planificarii medicamentelor in chimioterapia cancerului prin AEGA. Adaptarea si modelarea, modelului modificat in AEGA, include detaliat reprezentarea veritabila a cromozomilor si operatoarele genetice. Analizele parametrice si discutiile sunt date in sectiunea V. Concluzii si comentarii despre munca viitoare sunt incluse in Sectiunea VI.
II. Stabilirea problemei
In cateva studii [1], [6], [9] - [13], [14], protocoalele in chimioterapia cancerului sun alese pentru a minimaliza numarul celulelor tumorice dupa tratamentul fixat. Aceasta inseamna ca eficacitatea protocolului este masurata doar in termeni finali a tumori. Oricum, sunt dovezi sugerand ca regimurile cu medicamente mentin o marime inermediara a tumori joase ce poate descreste probabilitatea unei urgente in cazul celulelor rezistente la medicamente [15], [6]. Urgenta celulelor rezistente la medicament pare a fi un factor important in esecul chimioterapeutic [16], [17], [6].
Efectele chimioterapiei cancerului asa cum sunt propuse de Martin [1], sunt date prin ecuatiile diferentiale:
![]()
![]() (1)
(1)
![]()
![]() (2)
(2)
![]() (3)
(3)
cu constanta initiala xt (0)= [ ln(100), 0, 0] si
H( x![]() -
- ![]() daca x
daca x![]()
![]()
2, daca x![]() <
<![]() (4)
(4)
unde x1 este o
variabila care se transforma si este invers legata de cantitatea de tumoare. Cantitatea
de tumoare este data de N= 10![]() x exp (-x
x exp (-x![]() ) celule si populatia celulelor initiale cu tumoare este
aproximata la 10
) celule si populatia celulelor initiale cu tumoare este
aproximata la 10![]() celule [1]. Variabila x
celule [1]. Variabila x![]() este concentratia medicamentului in organism in unitatile de
medicament (D) si x
este concentratia medicamentului in organism in unitatile de
medicament (D) si x![]() este medicamentul toxic acumulat in organism. Ecuatia (1)
descrie transformarea neta in populatia celulelor cu tumoare in unitatea de
timp. Primul termen din partea dreapta a ecuatiei (1) descrie cresterea
celulelor datorata proliferari celulelor,iar al doilea termen descrie scaderea
celulelor cauzate de medicament. Parametrul
este medicamentul toxic acumulat in organism. Ecuatia (1)
descrie transformarea neta in populatia celulelor cu tumoare in unitatea de
timp. Primul termen din partea dreapta a ecuatiei (1) descrie cresterea
celulelor datorata proliferari celulelor,iar al doilea termen descrie scaderea
celulelor cauzate de medicament. Parametrul ![]() este o constanta pozitiva legata de viteza de crestere a
celulelor canceritgene si k este
proportia celulelor cu tumoare distruse pe unitatea de timp si pe unitatea
concentratiei medicamentului care este presupusa a fi o constanta pozitiva.
Implicatia functie descrise in ecuatia (4) arata ca este o limita a
concentratiei medicamentului, cu un nivel
este o constanta pozitiva legata de viteza de crestere a
celulelor canceritgene si k este
proportia celulelor cu tumoare distruse pe unitatea de timp si pe unitatea
concentratiei medicamentului care este presupusa a fi o constanta pozitiva.
Implicatia functie descrise in ecuatia (4) arata ca este o limita a
concentratiei medicamentului, cu un nivel ![]() scazut al caror numar
de celule cu tumoare distruse este mai mic decat numarul de celule cu tumoare reproduce
si astfel medicamentul nu este eficient. Ecuatia (2) descrie cresterea neta a
concentratiei medicamentului in localizarea cancerului. Variabila u, este rata distribuirii medicamentului
si ln(2)/
scazut al caror numar
de celule cu tumoare distruse este mai mic decat numarul de celule cu tumoare reproduce
si astfel medicamentul nu este eficient. Ecuatia (2) descrie cresterea neta a
concentratiei medicamentului in localizarea cancerului. Variabila u, este rata distribuirii medicamentului
si ln(2)/![]() este jumatatea existentei medicamentului, unde
este jumatatea existentei medicamentului, unde ![]() este parametrul
caracterului biochimic al medicamentului. Se asuma ca medicamentul sa fie
trimis prin infuzie si este o mixare instantanee a medicamentului cu plasma,
atata timp cat are loc o expediere imediata a medicamentului la locatia cancerului.
Aceste rezultate reprezinta aproximari bazate pe suma relativa dintre timpul
necesar pentru activitatile de mai sus, ce s-au intamplat cu aceste
consideratii a sumei totale a timpului asupra caruia a fost administrat
tratamentului. Ecuatia (3) releva medicamentele toxice acumulate in
medicamentele concentrate, exemplu: efectul acumulat este integral
medicamentelor concentrate in perioada expunerii.
este parametrul
caracterului biochimic al medicamentului. Se asuma ca medicamentul sa fie
trimis prin infuzie si este o mixare instantanee a medicamentului cu plasma,
atata timp cat are loc o expediere imediata a medicamentului la locatia cancerului.
Aceste rezultate reprezinta aproximari bazate pe suma relativa dintre timpul
necesar pentru activitatile de mai sus, ce s-au intamplat cu aceste
consideratii a sumei totale a timpului asupra caruia a fost administrat
tratamentului. Ecuatia (3) releva medicamentele toxice acumulate in
medicamentele concentrate, exemplu: efectul acumulat este integral
medicamentelor concentrate in perioada expunerii.
Valorile parametrilor deobicei sunt date in tabelul I.
Performanta indexului [1] pentru a fi maxim este:
I=x![]() (t
(t![]() (5)
(5)
unde timpul final este de 84 zile. Controlul este un subiect discutat ca sa contina medicamentele expediate
u![]() (6)
(6)
si conditiile variabile
x![]() (7)
(7)
x![]()
![]() 2,1 x 10
2,1 x 10![]()
![]() (8)
(8)
Chimioterapia cancerului este un tratament
sistematic, deci actiunea agentului chimioterapeutic nu este restrictionat la
locatia tumorii. Orce organ al corpului este predispus la imbolnavire. Aceasta
este constant pentru a localiza tratamente ca chirurgie si radioterapie. De
aceea constrangerile pe concentratrea de medicament x![]() si cumulativ toxicitatea medicamentului x
si cumulativ toxicitatea medicamentului x![]() , in (7) si (8) pot asigura ca pacientul poate tolera
efectele toxice secundare ale medicamentului. Rezistenta medicamentului este
luata in consideratie sa fie un factor semnificativ in esecul chimioterapeutic
[16], [17] si a fost aratat ca celulele rezistente ale medicamentului probabil
vor creste odata cu cresterea greutati tumori [15]. In scopul reduceri
probabilitati, urgentei, in cazul celulelor rezistente ale medicamentelor,
localizarea tumori este constransa pentru a fi redusa la cel putin 50% in
fiecare 3 saptamani [4], deci:
, in (7) si (8) pot asigura ca pacientul poate tolera
efectele toxice secundare ale medicamentului. Rezistenta medicamentului este
luata in consideratie sa fie un factor semnificativ in esecul chimioterapeutic
[16], [17] si a fost aratat ca celulele rezistente ale medicamentului probabil
vor creste odata cu cresterea greutati tumori [15]. In scopul reduceri
probabilitati, urgentei, in cazul celulelor rezistente ale medicamentelor,
localizarea tumori este constransa pentru a fi redusa la cel putin 50% in
fiecare 3 saptamani [4], deci:
x![]() (21)
(21)![]() ln(200) (9)
ln(200) (9)
x![]() (42)
(42)![]() ln(400) (10)
ln(400) (10)
x![]() (63)
(63)![]() ln(800) (11)
ln(800) (11)
Pentru acest medicament planificarea
problemei cu cele trei puncte constranse este descrisa in (9)- (11), realizarea
indiciului I obtinut de Martin [1] este 16,836 care corespunde cu marimea
tumori finale, N= 4,878 x 10![]() celule. Martin a folosit o numerotatie stabila in solutia
tehnici, cunoscuta ca un control parametric si analitic al gradientilor pentru
a realiza un model matematic cu toate constrangerile valabil pentru software
comercial. Folosind un acces intuitiv impreuna cu procedura de optimizare, de
cautare directa propusa in [3] pentru realizarea unui indiciu de 17,223, a fost
obtinut in [2] corespunzand cu N= 3,31 x 10
celule. Martin a folosit o numerotatie stabila in solutia
tehnici, cunoscuta ca un control parametric si analitic al gradientilor pentru
a realiza un model matematic cu toate constrangerile valabil pentru software
comercial. Folosind un acces intuitiv impreuna cu procedura de optimizare, de
cautare directa propusa in [3] pentru realizarea unui indiciu de 17,223, a fost
obtinut in [2] corespunzand cu N= 3,31 x 10![]() celule. Realizarea valorilor indiciilor unde ulterior au
fost imbunatatite la 17,476 [4] si 17,481 [18] care corespunde cu marimea
tumori finale de N=2,57 x 10
celule. Realizarea valorilor indiciilor unde ulterior au
fost imbunatatite la 17,476 [4] si 17,481 [18] care corespunde cu marimea
tumori finale de N=2,57 x 10 ![]() celule si 2,56 x 10
celule si 2,56 x 10![]() celule.
celule.
Pentru a simplifica problema planificarii
medicamentului fara cele trei puncte constranse Luus [21] a aplicat metoda
iterativa a programarii dinamice (IDP) si Tan, et al. [6] a aplicat distributia evolutionista calculand
software-ul pentru a obtine rezultatele indiciului de 17,993 care corespunde cu
N= 1,534 x 10![]() celule. Banga si Carrasco [19] au aplicat algoritmul
aleatoriu cuplat cu gradientul bazat pe cercetare pentru a imbunatati valoarea
la 18,030 care corespunde cu N= 1,478 x 10
celule. Banga si Carrasco [19] au aplicat algoritmul
aleatoriu cuplat cu gradientul bazat pe cercetare pentru a imbunatati valoarea
la 18,030 care corespunde cu N= 1,478 x 10![]() celule, care in curent este cel mai cunoscut rezultat pentru
problemele de cancer chimioterapeutic. Multe cercetari s-au ocupat de modelul
planificari medicamentului al lui Martin chiar daca rezultatele obtinute au
fost aceleasi.
celule, care in curent este cel mai cunoscut rezultat pentru
problemele de cancer chimioterapeutic. Multe cercetari s-au ocupat de modelul
planificari medicamentului al lui Martin chiar daca rezultatele obtinute au
fost aceleasi.
III. Modelul Modificat Al Planificarii Medicamentelor Pentru
Chimioterapia Cancerului
Fig. 1 (a) si (b) arata cele mai cunoscute planificari ale medicamentului care asigura cu sau fara trei puncte constranse, care sunt obtinute de Banga [19] si Carrasco [18]. In lucrarile anterioare putem observa rezultatele similare obtinute prin modelul planificari medicamentului a lui Martin, doua probleme inexplicabile au fost descoperite:
planificarea irationala pentru primul tratament; si
trei puncte obliga sa nu poata imbunatati eficienta tratamentului de cancer
In 84 de zile de tratament, doua dintre cele mai bune controale asigurate sunt primele oferite de medicament in 42 de zile, sunt modelul cu cele trei puncte constranse si in 18 zile cu modelul din cele trei puncte constranse. Aceasta este prima problema nerozonabila pentru ca aceste masuri in cazul medicamentelor, in mod sigur nu corespund cu experienta clinica. In tratamentul clinic, masura generala pentru reducerea eficienta a celulelor cu tumoare, este sa se dea o multidoza de medicament, mai degraba decat o doza normala cu prima zi. In primele zile ale tratamentului, corpul pacientului are un metabolism puternic si de asemenea eficacitatea medicamentului contra celulelor cu tumoare este mai slaba. Asadar administrand om multidoza de medicament in acest timp, poate fi eficace in tratamentul cancerului, distrugand numarul maxim de celule cu tumoare, medicamentul avand o toxicitatea minima. Raportand la aceasta experienta clinica, putem presupune ca o masura importanta in planificarea medicamentului ar trebui sa includa schema care da o multidoza de medicament inca din prima zi a tratamentului cancerului.
Cea de a doua problema este ca cele trei
puncte constranse nu pot demonstra eficacitatea tratamentului cancerului. Cea
mai cunoscuta realizare, pe langa modelul cu cele trei puncte constranse este
17,481 ( corespunzand unei marimi a tumorii finale cu N = 2,56 x 10![]() celule ). Nu este mai buna decat indiciul celei mai bune
performante cunoscute care este 18,030 ( corespunzand unei marimi ale tumorii
finale cu N= 1,48 x 10
celule ). Nu este mai buna decat indiciul celei mai bune
performante cunoscute care este 18,030 ( corespunzand unei marimi ale tumorii
finale cu N= 1,48 x 10![]() celule ). Aceasta inseamna ca cele trei puncte constranse nu
pot demonstra eficacitatea in tratamentul cancerului, dar contrar asteptarilor,
scopul celor trei puncte constranse este sa obtina o eficacitate mai mare a
masurilor luate pentru medicamente. Aceasta este necesara pentru ca rezistenta
medicamentului in cazul celulelor cu tumoare creste in timp si urgenta
rezistentei medicamentului pare sa fie un factor important al esecului
chimioterapeutic [16], [17]. In [6], autori au pretins pentru a reduce
probabilitatea unei urgente in cazul celulelor rezistente la medicament, celulele
cu tumoare sunt fortate sa se reduca cel putin 50% la fiecare 3 saptamani. Orcum, acestea nu sunt absolut
necesare, dar sunt folositoare pentru a satisface dorintele pacientilor pentru
a vedea rezultate vizibile in reducerea marimii tumorii. Deci, cele 3 puncte
constranse ar trebui sa ajute la acumularea unor masuri mai eficiente pentru
medicamente in chimioterapia cancerului.
celule ). Aceasta inseamna ca cele trei puncte constranse nu
pot demonstra eficacitatea in tratamentul cancerului, dar contrar asteptarilor,
scopul celor trei puncte constranse este sa obtina o eficacitate mai mare a
masurilor luate pentru medicamente. Aceasta este necesara pentru ca rezistenta
medicamentului in cazul celulelor cu tumoare creste in timp si urgenta
rezistentei medicamentului pare sa fie un factor important al esecului
chimioterapeutic [16], [17]. In [6], autori au pretins pentru a reduce
probabilitatea unei urgente in cazul celulelor rezistente la medicament, celulele
cu tumoare sunt fortate sa se reduca cel putin 50% la fiecare 3 saptamani. Orcum, acestea nu sunt absolut
necesare, dar sunt folositoare pentru a satisface dorintele pacientilor pentru
a vedea rezultate vizibile in reducerea marimii tumorii. Deci, cele 3 puncte
constranse ar trebui sa ajute la acumularea unor masuri mai eficiente pentru
medicamente in chimioterapia cancerului.
In [7], pentru a rezolva problemele
nerezonabile si pentru a descrie procesul metabolic al acumulari toxicitati
medicamentului x![]() in organism, a modificat cea dea treia ecuatie in urmatoarea
ecuatie diferentiala:
in organism, a modificat cea dea treia ecuatie in urmatoarea
ecuatie diferentiala:
![]() (12)
(12)
Ecuatia (12) descrie schimbarea neta a
acumulari toxicitati medicamentului pe unitatea de timp. In partea dreapta al
lui (12), x![]() descrie cresterea acumulari toxicitati medicamentului x
descrie cresterea acumulari toxicitati medicamentului x![]() raportata la concentratia medicamentului x
raportata la concentratia medicamentului x![]() si cel de al doilea termen -
si cel de al doilea termen -![]() descrie scaderea toxicitati medicamentului raportata la
metabolismul organismului. Definim parametrul
descrie scaderea toxicitati medicamentului raportata la
metabolismul organismului. Definim parametrul ![]() ca o constanta
elimitoare a toxicitatii organismului, care leaga viteza metabolismului
medicamentului de corp. Se asuma ca aceasta viteza a metabolismului este direct
proportionala cu cantitatea acumularii curente a toxicitatii medicamentului x
ca o constanta
elimitoare a toxicitatii organismului, care leaga viteza metabolismului
medicamentului de corp. Se asuma ca aceasta viteza a metabolismului este direct
proportionala cu cantitatea acumularii curente a toxicitatii medicamentului x![]() .
.
Folosim (12) ca sa inlocuim (3), pentru
a realiza un model modificat al planificarii medicamentelor. Daca constanta
anterioara x![]()
![]() nu este potrivita pentru (12), folosim cele mai cunoscute
doua solutii din modelul lui Martin si fara cele trei puncte constranse pentru
a evalua noua constanta pentru variabila
nu este potrivita pentru (12), folosim cele mai cunoscute
doua solutii din modelul lui Martin si fara cele trei puncte constranse pentru
a evalua noua constanta pentru variabila ![]() . Aici, setam parametrul
. Aici, setam parametrul ![]() = 0,4 in (12) si acumularea maxima a toxicitatii
medicamentului a acestor celor mai bune doua solutii este 99,854 si 99,999.
Aceste doua maxime acumulari ale toxicitatii sunt foarte apropiate si sunt
amandoua mai mici decat 100. Bazandu-ne pe acest lucru, noua constanta pentru x
= 0,4 in (12) si acumularea maxima a toxicitatii
medicamentului a acestor celor mai bune doua solutii este 99,854 si 99,999.
Aceste doua maxime acumulari ale toxicitatii sunt foarte apropiate si sunt
amandoua mai mici decat 100. Bazandu-ne pe acest lucru, noua constanta pentru x![]() poate fi data ca
poate fi data ca
![]() (13)
(13)
Folosim aceasta constanta (13) pentru a inlocui (8) si pentru a pastra valorile pentru ceilalti parametri in modelul modificat, aceeasi parametri ca si in modelul lui Martin pentru comparatiile directe si corecte ale rezultatelor preliminarii.
IV. Planificarea Evolutionista A Medicamentului Via The AEGA
In aceasta sectiune introducem AEGA, pe care ne-am propus-o, care este un algoritm multimodal, optim eficient pentru a implementa autonomia modelului planificarii medicamentului si pentru a explora eficientele multiple in cazul in planificarii medicamentului [8], [7].
In AEGA principiul asemanarilor individuale
depinde de cresterea (descresterea) relativa a directiilor ambilor indivizi in
problemele maxime (minime) si un parametru pe care il numim distanta paragrului
de sensibilitate, care este notata prin ![]() . Principiul pentru masurarea asemanarilor individuale in
problemele maxime este descrisa in randurile urmatoare:
. Principiul pentru masurarea asemanarilor individuale in
problemele maxime este descrisa in randurile urmatoare:
daca directiile de ascensiune ale ambilor indivizi sunt
spate in spate sau daca distantele dintre ele sunt egale sau mai mari decat ![]() , atunci acesti doi indivizi sunt considerati a fi
asemanatori si localizati in atractii optime diferite; si
, atunci acesti doi indivizi sunt considerati a fi
asemanatori si localizati in atractii optime diferite; si
daca directiile de accesiune ale ambilor indivizi sunt
fata in fata sau intr-o singura directie si distanta dintre ele este mai mica
decat ![]() atunci acesti doi indivizi sunt considerati a fi asemanatori
si localizati in aceasi atractie optima.
atunci acesti doi indivizi sunt considerati a fi asemanatori
si localizati in aceasi atractie optima.
Populatia elitista si adaptabila propusa de noi ce cauta tehnici include doau parti principale: operatia de trecere elitista daca parinti au atractii diferite, operatia de mutare elitista o sa-i pastreze impreuna pentru populatia viitoare si astfel se asigura diversitatea populatie.
Deasemenea, tehnica de cautare pentru adaptarea populatiei elitiste, poate ajusta marimea populatie raportata la obtinerea problemelor multimodale: 1) un numar dinamic de indivizi din populatie asa ca doar nu numar minim de indivizii elitisti este folosit pentru cautarea optima a fiecaruia; 2) toti indivizii din populatie sunt cautati in paralel.
Aici, pentru ca problema planificarii medicamentelor include niste constrangeri, solutia sa spatiala este alcatuita din mai multe subregiuni care sunt discontinue. Este dificil pentru algoritmele globale optime sa caute toate subregiunile. Folosind algoritmul multimodal optim, putem obtine solutii optime, spatiale ale problemei. Mai mult, in tratamentul clinic, doctorul asteapta sa selecteze planificari diferite de medicamente pentru pacienti diferiti. Asa ca, putem folosi algoritmul de optimizare multimodal pentru a rezolva modelul planificarii medicamentului si sa obtinem asigurari multiple in planificarea medicamentelor in cazul tratamentului clinic ales de doctor, depinzand de conditiile particulare ale pacientului aflat sub tratament.
Pentru modele planificarii medicamentelor in chimioterapia cancerului descrise in sectiunile II si III sunt 84 variabile de control ce trebuie optimizate, acestea reprezentand dozele de medicament pentru 84 de zile. Modele planificarii medicamentelor sunt probleme optime multimodale si de dimensiuni mari. Cu privire la numarul mare de variabile implicate, au fost investigate cateva scheme evolutioniste in cazul variabilelor. De exemplu, cativa cercetatori au folosit o pereche inteleapta de reprezentare de variabile pentru a reduce complixitatea variabilelor [6]. Informatia despre nivelul de doza al medicamentului si prima zi sunt codificate in perechi de variabile sub o anumita reprezentare, e.g., (30,5, 28). Aceasta inseamna planificarea medicamentelor incepand cu a 28 zi un nivel de doza de 30,5 D. Oricum perechea inteleapta de variabile este folositoare numai atunci cand doza de medicament nu este schimbata de multe ori pe parcursul tratamentului
In [7], propunem o noua reprezentare a variabilei ce cuprinde doua parti: inainte si ciclic. De exemplu, reprezentarea variabila a ciclului intelept este care inseamna o doza de medicament de 57,05D in prima zi si apoi repetand de 27 ori se da o doza d medicament de 21,5D la fiecare trei zile. Reprezentarea variabila a ciclui intelept este foarte potrivita pentru problemele planificarii medicamentelor. Corpul pacientului poate sa nu se fi adaptat cu medicamentul inca din primele zile si pentru a distruge cat mai multe celule cu tumoare posibile, doza de medicament va fi modificata in fiecare zi, pentru a reprezenta doza de medicament in perioada initiala folisind partea de inceput. Apoi, cand corpul pacientului se obisnuieste cu medicamentul, planificarea administrarii medicamentului o sa urmeze un ciclu fix si o doza paterna fixata ce este reprentata de partea ciclica.
B. Operatorul elitist de reductie pentru reprezentarea variabila a ciclului intelept
In [7], am combinat mai multe puncte standard
(2 puncte) a operatorului de reductie, cu tehnica de cautare adaptata a
populatiei elitiste ca sa construim o populatie elitista adaptata, bazata pe
operatorul de reductie al reprezentarii variabile a ciclului intelept. Fie r![]() si r
si r![]() punctele de reductie in partea ciclica si din fata, respectiv
cei doi parinti alesi aleatori din populatie. Urmasul este produs realizand
toate combinatiile posibile ale celor trei segmente ale reprezentarii
parintilor. In tabelul II cele doua puncte ale operatorului de reductie, produc
in general sase urmasi pentru a ameliora succesul in procesul de cautare. Cele
mai bune doua solutii ce satisfac toate constrangerile sunt apoi selectate de
parinti si de urmasul lor in genratia viitoare.
punctele de reductie in partea ciclica si din fata, respectiv
cei doi parinti alesi aleatori din populatie. Urmasul este produs realizand
toate combinatiile posibile ale celor trei segmente ale reprezentarii
parintilor. In tabelul II cele doua puncte ale operatorului de reductie, produc
in general sase urmasi pentru a ameliora succesul in procesul de cautare. Cele
mai bune doua solutii ce satisfac toate constrangerile sunt apoi selectate de
parinti si de urmasul lor in genratia viitoare.
Inainte de a trece peste operatia de reductie, daca doi parinti selectati sunt localizati in aceasi atractie optima tehnica noastra de cautare a populatiei elitiste incorporata in operatorul de reductie il v-a sterge pe cel nefolositor pentru a reduce excesul de populatie. Bineinteles, daca trecem peste, nici o operatie nu va fi facuta. Raportand la acest principiu, daca cei doi parinti au aceasi parte ciclica si aceasi parte din fata (distanta lor este mai mica decat distanta dintre urmasi) si directiile de ascensiune din partile din fata sunt fata in fata sau una singura, operatia elitista il va pastra pe cel mai bun dintre cei doi parinti pentru generatia viitoare si il va sterge pe celalalt [8]. Aici, vom folosi doar partile din fata si nu reprezentarea completa a ciclului intelept pentru a determina directiile relative de ascensiune a ambilor parinti, pentru a reduce complexitatea organismului.
Intr-o lucrare modificata elitista, schimbarea de baza lucreaza astfel: pentru o oarecare pozitie de reprezentare in ciclu intelept, vom inlocui valoarea lui cu o oarecare valoare aleasa (nu aceasi cu care a fost inlocuita ) cu probabilitatea de o schimbare sigura. De exemplu, in tabelul III, al treilea punct al parintelui este schimbat din 7.6- 10,8 pentru a genera urmasul sau 1, sau valoarea anterioara a parti ciclice, to anterior parintelui este schimbat din 19,58- 21,64 pentru a genera urmasul 2, sau numarul de cicluri din ciclul interior a parti ciclice este schimbat din 2 la 3 la genrarea urmasului 3.
Populatia elitista adaptabila a cautat tehnici in schimbari, adica, cand parintele si urmasul sau sunt localizati in diferite atractii optime, ei sunt conservati impreuna cu generatia urmatoare pentru cresterea diferita a populatiei. Pentru reprezenatrea ciclului intelept, daca schimbarea operatiei este aplicata in partea ei din fata si directiile ascendente relative a partilor din fata a parintilor si a urmasilor sunt spate in spate, sau distanta dintre parinte si urmasul sau este mai mare decat distanta pragului de sensibilitatea, schimbarea operatiei elitiste va conserva parintele si urmasul sau impreuna pentru urmatoarea generatie. Daca schimbarea operatiei este aplicata partii ciclice, schimbarea operatiei elitiste va conserva mai bine unul din parinti si urmasul sau pentru generatia urmatoare.
Pentru a explora cu success solutiile optime pentru modelul modificat al planificarii medicamentelor, AEGA este implementata dupa cum urmeaza:
setam t=0 si initializam populatia de cromozomi cu P(t) (initializare aleatoare fara limite)
evaluam P(t) folosind masuratori
cat timp (conditia finala nu este satisfacuta )
a) operatia de reductie elitista va genera P(t+1)
i) verifica diferentele a parintilor selectati aleator Pi si Pj
ii) daca parintii Pi si Pj sunt la fel, operatia elitista il va pastra pe cel mai bun dintre ei pentru generatia viitoare; altfel raportand la operatia de reductie cu mai multe puncte, ce genereaza sase urmasi, se selecteaza cei mai buni doi parinti ai urmasilor pentru generatia urmatoare.
b) operatia de mutare elitista sa genereze P(t+1);
i) raportand la
operatia de mutare a unui singur punct, genereaza urmasul c![]() si de la parintele P
si de la parintele P![]() ;
;
ii) daca P![]() si c
si c![]() sunt diferite, operatia elitista pastreaza P
sunt diferite, operatia elitista pastreaza P![]() si c
si c![]() impreuna pentru generatia viitoare; altfel o selectam pe cea
mai buna dintre ele pentru generatia urmatoare;
impreuna pentru generatia viitoare; altfel o selectam pe cea
mai buna dintre ele pentru generatia urmatoare;
evaluam P(t+1);
ne oprim daca conditia finala este satisfacuta; altfel, t![]() t+1 si mergem la pasul trei;
t+1 si mergem la pasul trei;
E. Setarile Parametrice
Simulam si optmizam modelul planificarii
medicamentelor AEGA, folosind urmatorii parametrii: marimiea populatiei
initiale= 2000; marimea generatiei= 25000; rata de reductie= 1,0; rata de
mutare= 1,0 si distanta urmasilor= 10. Aici distanta dintre doi indivizi x=(x![]() ,x
,x![]() ..x
..x![]() ) si y= (y
) si y= (y![]() ,y
,y![]() y
y![]() ) a fost definita prin d(x, y)=
) a fost definita prin d(x, y)= 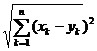 , n= 84 (14)
, n= 84 (14)
Modelul modificat al planificarii medicamentelor este simulat folind metoda diferentiala numerica Runge- Kutta [20] cu un mic interval de 0,01 zi pentru acumulare buna.
F. Rezultatele Partiale din Modelul Modificat
Automatizand modelul modificat al
planificarii medicamentelor si folosind algoritmul multimodal de optmizare AEGA
putem obtine cele mai bune patru planificari ale medicamentelor ce apar in
tabelul IV. Pentru ca aceste patru rezulate partiale, ce sunt considerate a fi
cele mai bune, satisfac cele trei puncte constranse, nu este necesar sa gasim
solutii speciale pentru modelul modificat, adica sa folosim cele trei puncte
constranse separat. Solutiile optime globale ilustrate in Fig. 2(a) -(d),
ilustreaza schimbarea paternitatii, prin controlul variabilei u si a cantiati finale de tumoare N
(invers legata de cea mai buna performanta indexata x![]() ), concentratrea medicamentului x
), concentratrea medicamentului x![]() si acumularea toxicitatii medicamentului x
si acumularea toxicitatii medicamentului x![]() in organism in 84 de zile.
in organism in 84 de zile.
Tabelul V arata cele mai bune patru
performante indexate x![]() , gasite sub modelul nostru modificat prin AEGA si corespunzand
unui numar al celulelor finale cu tumoare.
, gasite sub modelul nostru modificat prin AEGA si corespunzand
unui numar al celulelor finale cu tumoare.
Cele mai performante valori indexate in
literatura, folosind unele apropiate din modelul lui Martin si fara cele trei
puncte constranse sunt x![]() = 17,474, [4] si x
= 17,474, [4] si x![]() = 17, 993, [21], [6], ce corespund unei marimi ale tumorii
finale cu n=25720 respectiv n= 15337. Comparand aceste rezulate partiale, cele
mai bune planificari ale medicamentelor obtinute prin modelul nostru modificat
este de cel putin 29 de ori mai bun decat modelul lui Martin fara cele trei
puncte constranse si de cel putin 49 de ori mai bun decat modelul lui Martin cu
cele trei puncte constranse. Aceasta inseamna ca modelul nostru modificat este
mai real; s-a obtinut planificari apropiate ale medicamentelor mai bune cu cel
mai apropiat AEGA folosit.
= 17, 993, [21], [6], ce corespund unei marimi ale tumorii
finale cu n=25720 respectiv n= 15337. Comparand aceste rezulate partiale, cele
mai bune planificari ale medicamentelor obtinute prin modelul nostru modificat
este de cel putin 29 de ori mai bun decat modelul lui Martin fara cele trei
puncte constranse si de cel putin 49 de ori mai bun decat modelul lui Martin cu
cele trei puncte constranse. Aceasta inseamna ca modelul nostru modificat este
mai real; s-a obtinut planificari apropiate ale medicamentelor mai bune cu cel
mai apropiat AEGA folosit.
Pe de alta parte, eficientele multiple ale planificarii medicamentelor sub modelul modificat, se potrivesc bine cu experienta clinica. In tratamentul clinic, in general planificarea medicamentelor este de doua feluri: continua si repetata. Asigurarea planificari medicamentelor 1 si asigurarea planificarii medicamentelor 2-4 reprezinta aceste doua feluri. Fig. 3 arata asigurarea optima a planificarii medicamentelor 4 repetata. Pentru unii pacienti, cheia tratamentului ar putea fi reducerea marimii tumorii cu toxicitate minima si astfel asigurarea planificarii medicamentelor 4 este potrivita, pentru ca toxicitatea medicamentului acumulata este mai mica si deseori descreste la 80. Pentru alti pacienti, asigurarea planificari medicamentelor 1 este potrivita, pentru ca aceasta asigurare este eficienta, dar are o toxicitate mare. Deci, aceste asigurari multiple in planificarea medicamentelor obtinute din modelul modificat sunt mai folositoare. Raportand la conditiile diferite ale pacientilor, doctorul poate selecta asigurarea potrivita a planificarii medicamentelor pentru a trata cancerul si pentru a obtine cel mai bun rezultat.
V. Analiza Parametrilor Si Discutia Asupra Modelului Modificat
A. Analiza parametrilor modelului modificat
In
modelul modificat al planificarii medicamentelor, am adaugat un parametru![]() in (12) si am ajustat acumularea toxicitatii medicamentului
in (12) si am ajustat acumularea toxicitatii medicamentului ![]() pentru urmasii
constransi. Valoarea posibila a lui
pentru urmasii
constransi. Valoarea posibila a lui ![]() este de la 0 la 1. In
sectiunile precedente, am pus
este de la 0 la 1. In
sectiunile precedente, am pus ![]() =0,4 si
=0,4 si ![]()
![]() 100 pentru a studia asigurarile optime in planificarea
medicamentelor. Cand valorile lui
100 pentru a studia asigurarile optime in planificarea
medicamentelor. Cand valorile lui ![]() si urmasii constransi
sunt schimbati, sunt trei situatii posibile in modelul nostru modificat. Prima
data analizam aceste trei cazuri cand fixam
si urmasii constransi
sunt schimbati, sunt trei situatii posibile in modelul nostru modificat. Prima
data analizam aceste trei cazuri cand fixam ![]() =0,4 si schimbam constanta
=0,4 si schimbam constanta ![]() dupa cum urmeaza:
dupa cum urmeaza:
1)
Daca constanta ![]() a urmasilor creste la
a urmasilor creste la ![]()
![]() 125, concentratia medicamentului x
125, concentratia medicamentului x![]() a celei mai bune planificari a medicamentului atinge
intotdeauna 50 si acumularea toxicitatii medicamentului
a celei mai bune planificari a medicamentului atinge
intotdeauna 50 si acumularea toxicitatii medicamentului![]() satisface conditia "
satisface conditia "![]() 125" pe toata perioada tratamentului. Pentru acest caz, doar
o asigurare optima in planificarea medicamentului poate fi produsa din modelul
modificat (fig.4). In alte cuvinte , cand constanta acumularii toxicitatii
drogului in organism se pierde, asigurarea continua, este cea mai eficienta in
asigurarea planificarii medicamentelor in tratamentul clinic.
125" pe toata perioada tratamentului. Pentru acest caz, doar
o asigurare optima in planificarea medicamentului poate fi produsa din modelul
modificat (fig.4). In alte cuvinte , cand constanta acumularii toxicitatii
drogului in organism se pierde, asigurarea continua, este cea mai eficienta in
asigurarea planificarii medicamentelor in tratamentul clinic.
2)
Daca constanta ![]() a urmasilor descreste
la
a urmasilor descreste
la ![]()
![]() 25, concentratia medicamentului x
25, concentratia medicamentului x![]() a asigurarii optime a medicamentului va satisface relatia
a asigurarii optime a medicamentului va satisface relatia ![]()
![]() 25 si va fi intotdeauna mai mica decat a urmasilor, sub care
medicamentul nu mai este eficient. Asadar, celulele cu tumoare vor creste pe
perioada tratamentului (fig.5), deci, nu este o solutie potrivita pentru acest
caz. Aceasta inseamna ca un medicament cu constanta
25 si va fi intotdeauna mai mica decat a urmasilor, sub care
medicamentul nu mai este eficient. Asadar, celulele cu tumoare vor creste pe
perioada tratamentului (fig.5), deci, nu este o solutie potrivita pentru acest
caz. Aceasta inseamna ca un medicament cu constanta ![]()
![]() 25 nu poate fi folosita efectiv pentru tratarea cancerului,
pentru ca toxicitatea lui va fi excesiva.
25 nu poate fi folosita efectiv pentru tratarea cancerului,
pentru ca toxicitatea lui va fi excesiva.
3)
Daca constanta ![]() a urmasilor este in regiunea
(25,125), modelul modificat al planificarii medicamentelor opteaza pentru
algoritmul optim AEGA, ce poate obtine cele mai bune patru asigurari in
planificarea medicamentelor. De exemplu, cand pentru constanta
a urmasilor este in regiunea
(25,125), modelul modificat al planificarii medicamentelor opteaza pentru
algoritmul optim AEGA, ce poate obtine cele mai bune patru asigurari in
planificarea medicamentelor. De exemplu, cand pentru constanta ![]() se foloseste
se foloseste![]()
![]() 100, cele mai bune patru rezultate apar in tabelul IV si sunt
partial ilustrate in fig.2 si 3.
100, cele mai bune patru rezultate apar in tabelul IV si sunt
partial ilustrate in fig.2 si 3.
Pe de alta parte, daca pentru constanta ![]() fixam
fixam ![]()
![]() 100 si variabila
100 si variabila![]() ,avem urmatoarele 3 cazuri: 1) cand
,avem urmatoarele 3 cazuri: 1) cand ![]() >0,5, modelul modificat are doar un optim global ca si in
cazul 1. Aceasta inseamna ca metabolismul impotriva toxicitatii medicamentului
este puternica in organism pentru a mentine acumularea toxicitatii
medicamentului mai mica decat constanta sa. Asigurarea continua a planificarii
medicamentelor poate fi selectata pentru a avea cel mai bun efect asupra
tratamentului.2) Cand
>0,5, modelul modificat are doar un optim global ca si in
cazul 1. Aceasta inseamna ca metabolismul impotriva toxicitatii medicamentului
este puternica in organism pentru a mentine acumularea toxicitatii
medicamentului mai mica decat constanta sa. Asigurarea continua a planificarii
medicamentelor poate fi selectata pentru a avea cel mai bun efect asupra
tratamentului.2) Cand ![]() <0,1, modelul modificat nu are solutii eficiente pentru ca
in timpul asta este prea greu ca toxicitatea medicamentului sa fie eliminata
din organism. 3) In cele din urma, cand 0,1
<0,1, modelul modificat nu are solutii eficiente pentru ca
in timpul asta este prea greu ca toxicitatea medicamentului sa fie eliminata
din organism. 3) In cele din urma, cand 0,1![]()
![]()
![]() 0,5, modelul modificat are patru solutii partiale ca si in
cazul 3. Intre timp, doctorul poate seta valori diferite ale parametrilor si
constantelor pentru a obtine diferite solutii partiale pentru posibile
tratamente ce vor depinde de conditii clinice diferite.
0,5, modelul modificat are patru solutii partiale ca si in
cazul 3. Intre timp, doctorul poate seta valori diferite ale parametrilor si
constantelor pentru a obtine diferite solutii partiale pentru posibile
tratamente ce vor depinde de conditii clinice diferite.
B. Discutie: Folosirea AEGA
In munca anterioara multi cercetatori au folosit procedurile diferite pentru a rezolva programul problemelor. Printre ei IDP [21] imparte problema intreaga in niste probleme mici, si algoritmii adaptabili aleatori [5] folosesc gradientul bazat are tehnicile de cautare pentru a rezolva problemele de control optim.
Eficientele lor sunt superioare decat ale noastre propuse de AEGA, deoarece AEGA este o populatie aleatoare bazata pe un algoritm de cautare si rezolva problema globala. Dar el este o incercare semnificativa pentru a folosi AEGA pentru a rezolva programul problemei. Exista doua motive: AEGA are capacitatea puternica pentru a obtine solutiile problemei multiple, incluzand globala si locala optima, deoarece el este populatia bazata pe algoritmul de cautare. Capacitatea de cautare modala este importanta pentru reala-viata a problemelor. Conform cu oncologul, solutiile optime se intrebuinteaza sau sunt luate in considerare precum si alternativele posibile pentru conducerea de medicament depinzand de conditiile speciale.
AEGA este un acces de cautare general, care poate sa rezolve cu vigoare diferit oarecum problemele de optimizare. Unica modala si populatia caracteristicilor dinamice, AEGA poate sa fie combinata cu unele dintre tehnici in acesti algoritmi pentru a rezolva programul modelului de medicament complex pentru studiile de tratament de medicament.
C. Discutie Despre Modelul Modificat
Studiile noastre curente in aceasta hartie se concentreaza sa rezolve problemele irationale in programul modelului de medicament Martin s-a bazat pe farmacocinetica. Informatiile au obisnuit sa rezolve problema cu reglare numerica in special sintetica. Aceste medii cu informatiile si parametrii au fost in mod artificial si au preferat sa reprezinte tratamentele tipice unei tumori solide cu un medicament de cancer, spre deosebire de informatiile bazate pe masuratorile clinice.
De fapt, medicamentul optim programand modelul putea sa fie impartit in cateva componente, care pot sa fie schimbate pentru categoriile diferite de tumori si medicamentele de cancer. De exemplu,(1) in model reprezinta cresterea de tumoare si efectul medicamentului pe modelele de tumoare. Functia de crestere de tumoare F(x), care este pozitiv-evaluata continua, si sirul monoton crescator sporind functia, descrie sporirea pe timpul de unitate in populatia de celula de tumoare. In studiile noastre curente, noi am folosit un model exponential de cresterea de tumoare.
Alte ecuatii specifice diferentiale puteti sa fiti obisnuit cu informatiile potrivite clinice de categoriile specifice de tumori.
Pentru ca, parametrii sa fie calculati de masuratorile tumorii dimensiunilor succesive care, de fapt, sa va intrebuinteze in alt model de mic-celula cancerul de plamani.
Pe masura ce au sugerat niste experti, durata de ciclu de celula cu tumoare, repartizarea in spatiu de angiogenesis in mai putin de o data tumoarea distribuirea tumorii celulelor solide in celula sa mearga cu faze, si distribuirea activitatii metabolice in mai putin de o tumoare data sunt trasaturile importante pentru alegere, cresterea de tumoare si efectul medicamentului pe modelele de tumoare, si mai de efect sa fie manipulat regland parametrii x si k.
Conform cu farmacodinamica / farmacocinetica si clasele diferite de agentii de chimioterapeutica, mai noi sa ne invredniceasca sa reglam parametrii si constrangerile pentru a construi un program unui model de medicament pentru categoriile specifice de tumori si medicamentele de cancer specifice. Mai noi de asemenea sa incerce sa incadreze informatia de tumoare genetica in model pentru a spori modelul potential, pentru individualizare rabdatoare de tratament.
Ultimul nostru autor, care este oncolog, a terminat o faza aleatoare, un studiu, comparand combinatia de gemeitabine si cisplatine. Toate informatiile in legatura cu administrarea medicamentelor conducere, dozare, raspunsul de tumoare, si toxicitate sunt in perspectiva stransa. In viitoarea noastra munca, noi vom selecta incercarea de informatie pentru o reala clinica, si va regla ecuatiile, parametrii, si constrangerile modelului nostru modificat sa simuleze farmacocinetica, farmacodinamica.
VI. Concluzie
Aceasta hartie a prezentat un model de control modificat optim de programul de medicament in chimioterapia de cancer. Lucrand aproape cu oncolog, mai intai modelul modificat a lui Martin (deoarece ecuatia 3, care controleaza toxicitatea de medicament cumulativa, nu este consecventa cu, cunoasterea medicala si experienta clinica). Pentru explorarea programului politicilor, de medicament multiple eficiente noi am folosit algoritmul nostru propus modal genetic AEGA pentru a rezolva aceasta problema de optimizare complexa modala.
Noi am prezentat o reprezentare neobisnuita variabila, ciclul-intelept reprezentarea variabila pentru programul politicii, de medicament si a reglat mecanismul de cautare al elitistilor genetici in AEGA pentru a explora programul politic. Rezultatele de simulare de medicament multiple eficiente obtinute de la modelul modificat egaleaza bine cu experientele de tratament clinic, si pot sa furnizeze solutiile imbunatatite multiple realiste comparate cu modelul lui Martin. In plus, el are sa arate acel program accesului de medicament evolutionar este simplu si rezolva problemele de chimioterapie de cancer complexe facand uz de codificarea corespunzatoare si versiunile modale de Eas.
In viitoarea noastra munca, mai intai noi vom folosi informatii de la incercarile reale clinice pe medicamentele singure, reglati parametrii in modelul nostru modificat, si simulati farmacocinetice, farmacodinamica, si toxicitate medicamentului. Dupa aceea, vrea sa concentreze pe modelul chimioterapiei, tintele de medicament care pentru a prezice combinatiile de medicament, dozele, si programeaza pentru eficace reducand celulele de tumoare si prelungind viata rabdatoare. Noi vom incerca de asemenea pentru a combina tehnicile specifice de alte accese si inca multe alte strategii de calculare neobisnuite.
Copyright © 2024 - Toate drepturile rezervate