 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Volumetria sau titrimetria reprezinta o parte importanta a chimiei analitice cantitative.
Denumirea de volumetrie deriva de la faptul ca pentru determinarea concentratiei unei substante chimice, se procedeaza la masurarea volumelor a doua solutii ale caror specii chimice reactioneaza intre ele, concentratia uneia dintre solutii fiind cunoscuta.
Adesea se foloseste
termenul de titrimetrie care provine de la operatia
de titrare. Aceasta este procesul de adaugare a unui reactiv
Punctul final al titrarii se determina
pe cale vizuala, cu ajutorul unui indicator care isi
schimba brusc, in acest moment, o anumita proprietate usor
observabila
În general, punctul final al titrarii, insa, nu coincide cu punctul de echivalenta.
Diferenta dintre cantitatea de titrant corespunzatoare punctului final si cea corespunzatoare punctului de echivalenta reprezinta o eroare de titrare. Daca proprietatile substantei titrate, a celei titrante si ale indicatorului folosit sunt cunoscute, este posibil ca eroarea de titrare sa fie calculata sau determinata experimental.
În functie de echilibrele chimice care se produc intre titrant si substanta titrata, metodele volumetrice se pot clasifica in:
I - metode volumetrice bazate pe echilibre cu transfer de protoni (neutralizare);
II - metode volumetrice bazate pe echilibre cu transfer de electroni (redox);
III - metode volumetrice bazate pe echilibre de precipitare;
IV - metode volumetrice bazate pe echilibre de complexare.
Reactiile chimice utilizate in volumetrie trebuie sa indeplineasca anumite conditii si anume:
Ø reactia dintre substanta de determinat si titrant trebuie sa se produca cu viteza mare, daca este posibil spontan. În general, reactia cu transfer de protoni si cele de complexare se produc cu viteze mari, in timp ce echilibrele de precipitare si cele cu transfer de electroni au de obicei viteze mici. La echilibrele redox pentru a li se mari viteza li se adauga catalizatori;
Ø substanta de determinat este necesar sa reactioneze stoichiometric cu reactivul;
Ø daca in solutia substantei de analizat sunt prezente si alte substante, acestea nu trebuie sa reactioneze cu titrantul sau cu produsele de reactie si nici sa nu deranjeze in vreun mod reactia principala. În volumetria redox se folosesc adesea solutii de reducatori care in contact prelungit cu O2 din aer reactioneaza cu acesta. Din aceste motive, se folosesc solutii cu concentratia determinata cu putin timp inaintea titrarii;
Ø unei reactii volumetrice trebuie sa i se gaseasca un indicator care sa arate punctul final de titrare. Daca nu se gaseste un astfel de indicator, se face apel la metodele fizico-chimice de detectie a punctului final de titrare, de exemplu potentiometric (solutia isi schimba potentialul fata de un anumit electrod (platina, sticla, etc) sau conductometric (solutia isi schimba conductivitatea).
În cadrul chimiei experimentale, a biotehnologiilor, pentru toate aplicatiile chimice si instrumentale, este esential sa se pastreze un control asupra pH-ului. Adeseori, rezultatul obtinut, succesul unor experimentari, depinde de modul in care a fost controlat si mentinut pH-ul. În acest scop, un loc deosebit il au:
Ø relatia lui Henderson;
Ø solutiile tampon;
Ø solutiile standard.
Se considera un cuplu acid-baza oarecare:
Acid + HOH D Baza + H3O+
pentru care se poate scrie constanta de aciditate corespunzatoare:
![]()
prin logaritmare, obtinem:
![]()
sau
![]()
Aceasta relatie reprezinta relatia lui Henderson si stabileste o corelatie directa intre pH-ul unei solutii de acid, constanta sa de aciditate si raportul dintre concentratia bazei sale conjugate in conditii de echilibru.
Daca intr-o solutie apoasa sunt prezente doua cupluri acid-baza, intre acestea se vor produce echilibrele:
a) A + HOH ═ B1 + H3O+
b) H O+ + B ═ HOH + A2
A1 + B2 ═ B1 + A2
pentru fiecare din cele doua echilibre, putem scrie ecuatiile:
![]()
![]()
Deoarece cele doua reactii au loc in acelasi sistem la echilibru pH1=pH2=pH-ul solutiei rezultate prin dizolvarea a doua cupluri acid-baza diferite. Deci,
![]()
![]()
sau
![]()
Din reactiile de echilibru de mai sus (a si b) observam, insa, ca [B1]=[A2], deci putem scrie:
![]()
Aceasta relatie Henderson se poate folosi pentru calcularea pH-ului solutiilor de acizi, baze si saruri.
Reactiile
chimice, proprii chimiei analitice, se produc de obicei la un anumit pH. De exemplu,
un proces foarte important in chimia analitica calitativa este
precipitarea sub forma de sulfuri a grupei hidrogenului sulfurat ![]()
![]() incepe sa
precipite si ionul Zn2+
ce face parte din grupa sulfurii de amoniu. Deci, pentru a avea o precipitare
corespunzatoare este necesar ca pH-ul solutiei sa fie
mentinut la valori mai mici de 1,5.
incepe sa
precipite si ionul Zn2+
ce face parte din grupa sulfurii de amoniu. Deci, pentru a avea o precipitare
corespunzatoare este necesar ca pH-ul solutiei sa fie
mentinut la valori mai mici de 1,5.
Posibilitatile pe care le are chimistul de a mentine pH-ul unei solutii intre anumite limite bine definite, astfel incat valoarea acestuia sa nu varieze decat foarte putin, chiar la adaugarea unui anumit exces de ioni H+ sau HO-, sunt oferite de solutiile tampon.
Solutiile tampon sunt acele solutii care isi modifica pH-ul numai in mica masura la adaugare de acizi si baze tari.
Întrucat pH-ul unei solutii depinde de concentratia de Baza, respectiv acid adaugate, pentru a se stabili domeniul pentru care o solutie tampon pastreaza o valoare pH constanta se foloseste relatia lui Henderson.
Daca se reprezinta conform acestei relatii pe grafic pH in raport cu concentratia de baza adaugata, respectiv acid adaugat, vom obtine curbele:
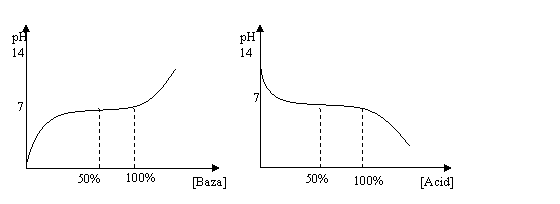
Fig . Curbe de titrare obtinute la adaugarea unei baze,
respectiv unui acid intr-o solutie tampon
Solutiile tampon sunt caracterizate prin indicele de tamponare care se defineste ca fiind raportul dintre adaosul de acid tare sau baza tare, exprimat in echivalenti la litru si variatia corespunzatoare a pH-ului, deci:
![]()
unde: dn este numarul de echivalenti de acid sau baza tare adaugat; dpH - variatia de pH la adaosul de acid sau baza tare.
În general, solutiile tampon se obtin prin dizolvarea in apa a unui acid slab si a uneia dintre sarurile sale sau prin dizolvarea in apa a unei baze slabe si a uneia din sarurile sale.
O serie de solutii tampon de baza sau standard se folosesc in mod curent in toate domeniile care utilizeaza analize chimice. Compozitia si modul de realizare a acestora a fost stabilit de organisme internationale (principalul organism care s-a ocupat de-a lungul anilor si a coordonat acest lucru a fost Biroul National de Standarde din SUA).
3. Solutii standard
Asa cum am mentionat, solutiile de titrant cu ajutorul carora se efectueaza determinarile se cunosc si sub numele de solutii standard.
Acestea
se obtin prin dizolvarea in solventul convenabil ales
De exemplu, din clasa substantelor standard fac
parte: ftalatul acid de potasiu ![]() )
)
Solutiile obtinute se numesc solutii standard primare sau de baza. Alte solutii folosite in volumetrie sunt solutiile standard secundare.
Concentratia exacta a unei solutii standard secundare se determina prin utilizarea solutiilor standard primare sau o metoda gravimetrica cu o precizie foarte buna.
De exemplu, solutia de H2SO4
este solutie standard secundara si i se determina
concentratia exacta fie cu ajutorul standardului primar de Na2CO3, fie gravimetric prin determinarea ionului sulfat (![]() ) ca sulfat de bariu (BaSO4).
) ca sulfat de bariu (BaSO4).
Solutiile standard secundare sunt foarte folosite in laboratorul de chimie analitica si substanta activa a acestora se determina in general cu ajutorul unei solutii standard primare.
Toate solutiile standard trebuie astfel pastrate incat sa nu se: altereze, sa nu-si modifice concentratia, sa nu absoarba H2O si sa nu fie oxidate de O2 din aer.
4. Unitati utilizate in volumetrie
a) Concentratia solutiilor titrimetrice
În aceasta metoda se utilizeaza concentratii
normale ![]() solutii normale.
solutii normale.
b) Titrul solutiilor - reprezinta cantitatea in grame dintr-o substanta continuta intr-un cm3. Se noteaza cu T. Relatia dintre titru si diferitele concentratii utilizate in volumetrie este urmatoarea:
![]()
G - cantitatea de substanta dizolvata in 1.000 cm3 solutie.
c) Factorul solutiilor
Prepararea unei solutii cu o normalitate exacta nu este o problema simpla. Dar realizarea unei solutii cu o normalitate oarecare este mult mai usoara. În acest caz, este necesar sa se cunoasca coeficientul de trecere de la un anumit volum din solutia cu normalitate aproximativa la volumul de solutie cu normalitate exacta.
Acest lucru se realizeaza cu ajutorul unui numar numit factor si acesta reprezinta raportul dintre titrul real si cel teoretic. Se noteaza cu F:
![]()
Relatia dintre cele doua volume, de concentratie exacta si de concentratie aproximativa este:
![]()
Se recomanda pentru a se avea rezultate corespunzatoare ca F sa aiba valoarea cuprinsa intre 0,9000 si 1,1000.
Pentru determinarea punctului de echivalenta se folosesc asa numitii indicatori.
Indicatorii sunt sisteme chimice care-si schimba o proprietate usor observabila (culoare, fluorescenta etc), in functie de concentratia anumitor ioni in solutie.
Indicatorii pot fi calificati in functie de echilibrele care sunt urmarite cu ajutorul lor, astfel:
a) indicatori acido-bazici, de pH sau neutralizare;
b) indicatori redox sau de potential redox;
c) indicatori de precipitare;
d) indicatori complexometrici.
Substantele chimice folosite drept indicatori trebuie sa indeplineasca anumite conditii:
1) sa fie o substanta stabila in solutie, in conditiile de lucru; sa nu fie influentata de lumina, O2 si CO2 din aer;
2) sa-si modifice rapid, practic spontan, culoarea sau proprietatea observabila urmarita la punctul final al titrarii;
3) sa aiba o putere de colorare mare pentru a putea fi utilizata in solutii foarte diluate;
4) sa fie suficient de solubila in H2O sau in solventi miscibili cu apa (de exemplu, etanolul).
a) Indicatori de pH sunt cupluri acid-baza in care forma acida este colorata diferit de baza conjugata. În general, acestia sunt coloranti organici. Pe langa acesti indicatori de culoare se mai utilizeaza si indicatori turbidimetrici, de fluorescenta, de adsorbtie. Cei mai utilizati insa pentru acest tip de titrari sunt cei de culoare. De exemplu:
Fenolftaleina
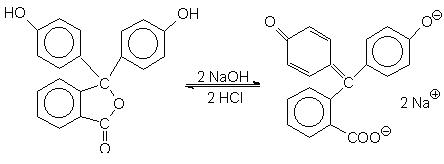
H+, lactona, incolora HO-, rosie, chinona
În mediul acid este o lactona incolora, iar in mediul bazic este o chinona a carei culoare rosie se accentueaza cu cresterea concentratiei de HO -. La o concentratie suficient de mare, culoarea rosie vie, este determinata de prezenta oxigenului carbonilic si a celui ionizat la capatul unui lant de legaturi duble conjugate.
Domeniul de viraj al fenolftaleinei este cuprins intre 8,2-10.
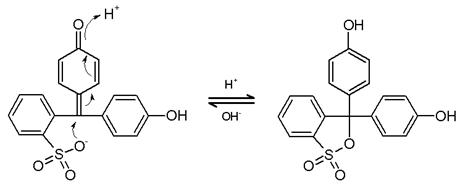
HO-, rosu H+, galben
Rosu de fenol galben in mediu acid se coloreaza in rosu, in mediu bazic prin ionizarea oxidrilului.
Metilorange
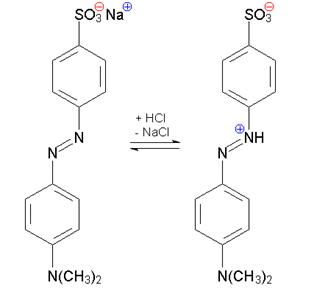
HO-, galben-orange H+, rosu
Metiloranjul trece de la forma azoica in mediul bazic, de culoare galbena la rosu, forma chinoida in mediul acid.
Domeniul de viraj este cuprins intre 3,1 - 4.
Indicatori redox: sunt sisteme chimice capabile sa cedeze si sa accepte e -. Culoarea acestora se schimba in functie de potentialul redox al solutiei, adica forma oxidata va avea o alta culoare decat cea redusa. De exemplu, in manganometrie, indicatorul este insusi permanganatul care prin reducere trece de la culoarea violet la incolor.
Un indicator frecvent utilizat in titrari redox este orto-fenantrolina. Aceasta formeaza complecsi cu fierul de culori diferite, in functie de starea de oxidare a acestuia.
Astfel, cu fierul Fe2+, va rezulta o culoare rosie, iar cu Fe3+ un complex albastru pal.
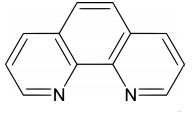
c) Indicatori complexonometrici - sunt indicatori ai concentratiei de cationi, metalocromici sau metaloindicatori.
În aceasta reactie, metalul ce se determina formeaza combinatii complexe cu o substanta organica.
Cei mai utilizati sunt negrul eriocrom si murexidul.
Eriocromul negru T:
|
pH < 7 H2I- rosu 7 < pH < 11,5 HI2- albastru pH > 11,5 I3- portocaliu |
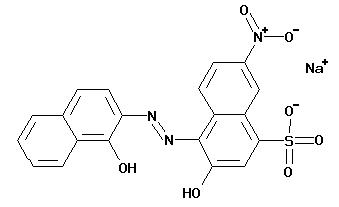
Sarcinile negative ale indicatorului sunt compensate de metalul ce se determina.
Murexidul sarea de amoniu a acidului purpuric):
|
pH < 9 - H4I- rosu violet 9 < pH < 11,5 H3I2- violet pH > 11,5 H2I3- albastru-violet |
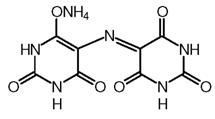
d) Indicatori de precipitare
Pentru detectarea punctului final al acestui tip de titrare se folosesc indicatorii reactivi ai ionilor angajati in formarea precipitatului. Astfel, la titrarea Cl- cu ionul Ag+ se foloseste ca indicator K2CrO4 ca indicator. Acesta formeaza cu Ag+ un precipitat rosu caramiziu. Ag2CrO4 mai solubil decat AgCl. Deci la titrarea solutiei ionilor de Cl- la care se adauga cateva picaturi din solutie de K2CrO4, la adaugarea Ag+ se va forma mai intai AgCl care este mai greu solubila, iar la sfarsitul titrarii se va forma si Ag2CrO4 ce va evidentia sfarsitul titrarii (metoda Mohr).
În unele cazuri se folosesc indicatori de adsorbtie sau turbidimetrici.
5. Volumetria de neutralizare studiaza metodele de analiza prin care se dozeaza acizii prin titrare cu baze (alcalimetrie) sau baze prin titrare cu acizi (acidimetrie) pana la punctul de echivalenta.
Vom discuta titrarea acizilor de diverse tarii cu ajutorul hidroxizilor, intrucat titrarile inverse pot fi deduse prin analogie.
1. Titrarea acizilor tari cu baze tari (sau titrarea bazelor tari cu acizi tari)
Deoarece acizii tari si bazele tari sunt total disociate, este simplu de calculat concentratia, respectiv activitatea - daca este cazul - a ionilor de hidrogen din solutie in timpul titrarii unui acid tare cu o baza tare sau invers.
În cazul general al titrarii unui acid tare, HA, cu NaOH, vom avea:
HA + NaOH ═ NaA + HOH
Titrarea are trei momente importante:
Ø momentul dinaintea punctului de echivalenta - este un domeniu inca acid, in timpul caruia, pentru a calcula [H+] din solutie trebuie cunoscuta cantitatea de acid ramasa netitrata;
Astfel, daca initial [HA] = Co, volumul solutiei este V1, p - procentul de acid titrat, iar volumul final al solutiei este V2, putem scrie ca:
[HA] netitrat
=![]()
Ø
Momentul de echivalenta
cand
![]() .
.
Ø
Momentul de dupa
echivalenta cand in solutie este adaugat un
exces de hidroxid de Na. Deci, pentru calculul concentratiei H+, intai se
calculeaza concentratia ionilor de HO-,
care este exact [![]() .
.
Daca dorim sa exprimam concentratia ionilor de hidroxil in raport cu volumul initial de acid si concentratia initiala de acid, calculam in felul urmator:
La neutralizare totala stim ca:
![]()
iar la exces de volum, v, vom avea:
![]()
deci
![]()
Pe de alta parte, volumul de baza
necesar neutralizarii unui volum V1
de acid este tot V1. Deci,
la V1 ![]() 100% necesar de
hidroxil
100% necesar de
hidroxil
v ![]() p' % exces de hidroxil
p' % exces de hidroxil
deci ![]()
Înlocuind in relatia de mai sus pe p' obtinem:
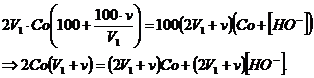
![]()
În acest caz, pH-ul solutiei devine:
![]()
Rezultatele acestor calcule efectuate pentru mai multe concentratii ale acidului tare se reprezinta grafic, obtinandu-se asa numitele curbe de titrare sau curbe de neutralizare.
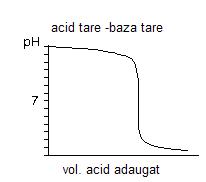
Fig.3. Curba de titrare a unei baze tari cu un acid monobazic tare
La punctul de echivalenta, schimbarea pantei este abrupta, iar cu cat concentratia este mai mare, saltul este mai mare, chiar de 8 unitati.
Pe baza acestor diagrame se aleg si indicatorii susceptibili de punere in evidenta a virajului. De asemenea, se observa, cu cat concentratia acidului este mai mare, plaja la echivalenta, saltul echivalent este mai mare.
2. Titrarea acizilor slabi cu baze tari
În cazul acestor titrari, trebuie sa se tina cont de cele trei momente ale titrarii, deoarece acestea sunt caracterizate de comportari diferite ale solutiilor fata de cele intalnite in cazul acizilor tari titrati cu baze tari.
Momentul initial: inainte de a adauga titrantului, solutia este cea a unui acid slab, a carui concentratie de H+ se calculeaza cu relatia cunoscuta:
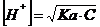
Momentul anterior
punctului de echivalenta. Imediat dupa primul adaos in vasul de
titrare, ia nastere o sare in urma reactiei dintre acidul slab
si baza tare. Aceasta sare se gaseste impreuna
cu acidul slab, alcatuind astfel o solutie tampon pentru care
concentratia ionilor de hidrogen se calculeaza
![]()
Daca notam concentratia initiala cu Co, iar V1 si V2 respectiv volumul initial si final, iar p procentul de NaOH adaugate, concentratia acidului netitrat va fi urmatoarea:
![]()
iar sarea formata prin neutralizare va fi:
![]()
Înlocuind in valoarea [H+], concentratia acidului, respectiv a sarii formate avem:
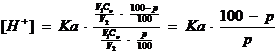
de unde:
![]()
cu ajutorul acestei solutii se poate calcula pH-ul oricarei solutii de acid slab titrate cu o baza tare pana la punctul de echivalenta.
Momentul punctului de echivalenta. La punctul de echivalenta, intreaga cantitate de acid slab este transformata in sare, a carei cantitate este echivalenta cu a acidului titrat. Tinand seama ca aceasta sare este dizolvata la echivalenta in volumul V2, iar acidul initial a fost dizolvat in volum V1, concentratia [H+] se calculeaza cu ajutorul relatiei, tinand cont ca in acest moment [H+] se datoreaza hidrolizei apei, dar si hidrolizei sarii care se formeaza:
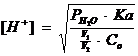
corespunzatoare sarurilor cu hidroliza alcalina, iar Co este concentratia
initiala a acidului
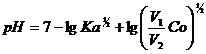
Momentul de dupa punctul de echivalenta. În acest moment, pentru a evalua corect concentratia H+, trebuie sa se ia in consideratie si reactia de hidroliza alcalina
y y
![]() D
D![]()
si concentratia ![]() din hidroliza este
astfel egala cu y.
din hidroliza este
astfel egala cu y.
În aceste conditii, alcalinitatea totala din solutia titrata este data de hidroxidul in exces care determina o hidroliza si de concentratia ionilor de HO- rezultati in urma fenomenului de hidroliza redusa:
![]()
b y
sau
![]()
Constanta de aciditate a acidului titrat este:
![]()
Din reactia de hidroliza am vazut ca [HA]=[HO-]h=y iar [A-]=C -concentratia sarii formate.
![]()
Tinand cont ca exista relatia de hidroliza, constanta de hidroliza va fi:
![]()
Înlocuind in aceasta relatie pe y obtinut din relatia constantei de aciditate, vom avea:
![]()
![]()
![]() .
.
În acest caz, saltul la echivalenta este mult mai redus decat la titrarea acizilor tari.
3. Titrarea acizilor slabi cu baze slabe si invers
Într-o
asemenea titrare, pana la punctul de echivalenta,
rezulta sarea acidului slab cu baza slaba si acidul slab
c c x x + a
B + A- + H O D BOH + HA
Înaintea punctului de echivalenta, deci in
prezenta unui exces de acid, notat cu a
si avand ![]() in reactia
de hidroliza si
in reactia
de hidroliza si ![]() .
.
unde [HA]total = x + a
Daca HADH + A-
si ![]() , de unde:
, de unde:
![]()
La punctul de echivalenta:
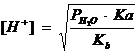 si
si 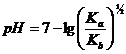
Imediat dupa punctul de echivalenta, cand exista deci exces de BOH si considerand [-OH]exces = b, iar [-OH]hidrolizat = y, iar excesul de hidroxid este mult mai mic decat concentratia sarii, vom avea:
![]()
Curbele de titrare la acizii slabi cu baza slaba au variatia pH-ului la punctul de echivalenta mica.
4. Titrarea amestecurilor de acizi
a) Daca in solutie este un amestec de acizi tari, nu se vor putea titra diferentiat, intrucat functia acida este aditiva si se va titra suma acestora.
b) Daca amestecul de acizi este format dintr-un acid tare si unul slab, iar titrarea se efectueaza cu o baza tare, acidul slab va incepe sa se neutralizeze abia din momentul cand, dupa ce o parte din acidul tare a fost neutralizat, s-a ajuns in solutie la pH-ul pe care l-ar avea daca ar fi fost numai acidul slab. Din cele prezentate, este clar ca exactitatea titrarii acidului tare este nesatisfacatoare si va da o eroare in minus, iar cea a acidului slab va fi cu o eroare in plus, deoarece dupa neutralizarea acidului tare, acidul slab se va titra ca si cum are fi singur dar cu un consum ridicat de baza.
În acest caz, pentru a avea o titrare satisfacatoare, se foloseste fie in prezenta unui indicator mixt, fie cu ajutorul unei solutii de comparatie.
c) Daca amestecul este alcatuit din doi acizi slabi, pot fi titrati cu o baza tare, intalnindu-se urmatoarele situatii:
Ø ambii acizi au constantele de aciditate de acelasi ordin de marime, functiilor lor acide sunt neutralizate simultan fara sa se distinga puncte de inflexiune diferite pe curba de titrare;
Ø acizii din amestec au
constantele de aciditate diferite, iar raportul lor este ![]() . În acest caz, este neutralizata mai
intai functia acida a acidului mai tare impreuna cu o mica parte din
aciditatea celui mai slab
. În acest caz, este neutralizata mai
intai functia acida a acidului mai tare impreuna cu o mica parte din
aciditatea celui mai slab
Precizia detectarii punctului de
echivalenta in aceste cazuri este scazuta. Se
folosesc pentru punerea in evidenta a punctului de
echivalenta, amestecuri de indicatori si solutii de
comparatie. Totusi, deoarece indicatorii de culoare isi
schimba culoarea intr-un domeniu de aproximativ doua
unitati, iar saltul in jurul punctului de echivalenta
la acest gen de amestecuri este, in general, mai mic de 1 unitate
Un acid polivalent se comporta in solutie intocmai ca un amestec de acizi slabi de tarie diferita, dar in concentratii egale.
La neutralizarea primei trepte de disociatie a acidului polivalent se calculeaza pH-ul, folosind formula:
![]()
La neutralizarea treptei a doua, se calculeaza pH-ul folosind aceeasi formula, dar care utilizeaza celelalte constante de disociatie:
![]()
si, in general, pentru neutralizarea in treapta n-1,
![]()
Pentru neutralizarea in ultima treapta, se considera cazul ca la un acid slab care are constanta de disociatie Kn si deci la ultima echivalenta:
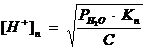
in care C este concentratia molara a sarii BnA la ultimul punct de echivalenta. Conform acestei relatii, deci, pentru neutralizarea la ultima treapta a unui acid polivalent se aplica toate consideratiile expuse la neutralizarea acizilor slabi cu baze tari.
Prin eroare de titrare se intelege eroarea datorita unui consum in minus sau in plus de reactiv din cauza schimbarii culorii indicatorului la un pH inaintea sau dupa pH-ul de echivalenta. Pentru calculul acestei erori, in titrimetria de neutralizare se va lua in considerare totdeauna reactia care are loc. Dam cateva exemple specifice, astfel:
a) la titrarea acizilor tari monovalenti cu baze tari, eroarea de titrare este data de relatia:
Ø
la pT < pHechiv
avem: ![]()
Ø
la pT > pHechiv: ![]()
În relatie: V2 este volumul la sfarsitul titrarii, V1 - volumul initial al solutiei, pT - pH-ul punctului de echivalenta, CHA - concentratia initiala a acidului.
Pentru cazul cand pH-ul la
punctul de titrare
b) titrarea acizilor slabi cu baze tari:
Ø
la pT < pHechiv: ![]()
in
care Ka -
Ø
la pT > pHechiv: ![]()
unde CBOH este concentratia initiala a bazei
c) titrarea acizilor slabi cu baze slabe
Ø
la pT < pHechiv: ![]()
la pT
> pHechiv: ![]()
Copyright © 2024 - Toate drepturile rezervate