 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
COROZIUNEA METALICA
1.1. Definitia si clasificarea coroziunii metalice
Coroziunea este un proces de distrugere a materialelor metalice sub actiunea chimica sau electrochimica a mediului inconjurator sau a substantelor cu care acestea vin in contact.
Procesele chimice si electrochimice se desfasoara la interfata metal-mediu agresiv, deci reactiile sunt eterogene. Spre deosebire de coroziune, eroziunea reprezinta un proces mecanic de distrugere a suprafetei metalelor. Deseori coroziunea si eroziunea actioneaza simultan asupra suprafetelor metalice. In cazurile cand aceste fenomene actioneaza separat provoaca distrugeri cu aspect atat de asemanator incat adevarata cauza se stabileste in urma unui studiu amanuntit.
Notiunea de rezistenta la coroziune se exprima adesea prin termeni echivalenti : stabilitate chimica, rezistenta anticoroziva, pasivitatea metalului (atunci cand stare metalului in mediul dat nu se schimba o perioada indelungata de timp).
Clasificarea coroziunii
a. Dupa mecanismul procesului de distrugere:
1.Coroziunea chimica
distrugerea metalului in gaze uscate, lichide organice, solutii de materiale anorganice, ce nu conduc curentul electric (nepolare).
oxidarea metalelor la temperaturi inalte (in timpul forjarii, tratamentelor termice).
oxidarea rezistentelor electrice, cazanelor si arzatoarelor in contact cu gazele de ardere.
distrugerea metalelor in contact cu gazele industriale.
2. Coroziunea electrochimica
este insotita de trecerea curentului electric prin metalul sau aliajul corodat.
are loc la contactul diferitelor metale intre ele in acelasi mediu agresiv (fiecare metal are un anumit potential electrochimic).
pe suprafata metalului pur in contact cu solutii de electroliti, topituri de saruri, pelicule de umezeala sau pe suprafetele metalelor aflate in atmosfera sau in sol, se formeaza pile electrice.
b. Dupa mediul in care se produce:
Coroziunea atmosferica - in atmosfera.
Coroziunea subterana - in sol.
Biocoroziunea - in medii ce contin organisme vii.
Coroziunea prin curenti de dispersie - in camp electric.
c. Dupa combinarea cu alte tipuri de distrugere:
1. Coroziunea sub tensiune statica. (Ex.- tensiuni de intindere-rasucire).
2. Coroziunea in conditii de oboseala. - se produce la solicitari alternative cu anumite frecvente.
3. Fisurarea coroziva - reprezinta o accelerare a coroziunii, ca urmare a actiunii unor eforturi mecanice de tensionare, rezultate in urma prelucrarilor mecanice sau a tratamentelor termice.
4. Coroziunea eroziva - se produce cand lichidul coroziv are viteza mare si distruge peliculele protectoare pe cale mecanica, actionand simultan pe cale electrochimica asupra metalului
5. Coroziunea in conditii de cavitatie - peliculele protectoare si metalul se distrug in cea mai mare parte sub actiunea lichidului. (Ex.- elice navale).
d. Dupa aspectul distrugerii
Coroziune continua. - cand intreaga suprafata metalica a avut de suferit in urma actiunii mediului agresiv; poate fi uniforma cand viteza procesului coroziv a fost constanta si neuniforma pentru viteze diferite pe diverse suprafete ale metalului.
2. Coroziune locala - cand distrugerea coroziva se concentreaza de preferinta pe anumite suprafete fara a atinge simtitor si alte suprafete. Dupa gradul de concentrare coroziunea locala produce:
pete de coroziune - portiuni relativ mari si de adancime mica.
placi de coroziune - suprafete relativ mici dar de adancimi mai mari.
puncte de coroziune (Pitting) - concentrate pe suprafete mici, de 0,1÷0,2 mm2 dar profunde (adanci).
e. Dupa caracterul distrugerii in raport cu structura metalului
Coroziune intercristalina - cand se propaga in interior prin distrugerea limitelor dintre graunti. Produsele de coroziune slabesc coeziunea interna a metalului incat pierderi mici duc la scaderi mari ale rezistentei mecanice (Ex.- aliaje de aluminiu, oteluri inoxidabile tip 18Cr, 8Ni,etc.).
Coroziune fisuranta - datorata actiunii simultane a mediului coroziv si a solicitarii la intindere. Se raspandeste intercristalin si transcristalin pe directiile eforturilor maxime.
Coroziunea selectiva - distruge aliajul prin trecerea in solutie a unui component si prin acumularea la suprafata a celorlalte elemente (Ex.- Alama in mediu acid sufera dezincare in cadrul careia Zn trece in solutie iar pe suprafata pieselor ramane Cu.).
Coroziunea sub suprafata - incepe la suprafata metalului si se raspandeste in interior sub un strat aparent nealterat.
1.2.Coroziunea chimica a metalelor
Coroziunea chimica a metalelor este procesul care se desfasoara pe suprafata metalelor in contact cu gazele uscate sau cu solutiile de neelectroliti. In urma reactiilor dintre metal si mediul agresiv, pe suprafata metalului raman produsele coroziunii ce se numesc pelicule de coroziune. Aceste pelicule franeaza coroziunea rezultand o protectie mai mult sau mai putin pronuntata, dupa cum peliculele sunt mai izolatoare respectiv mai penetrabile. In cele mai multe cazuri peliculele nu sunt nici complet penetrabile nici complet izolatoare.
1.2.1. Pelicule de coroziune
Termenul de pelicula de coroziune este mai indicat decat cel de pelicula protectoare deoarece nu toate peliculele de coroziune sunt protectoare. Grosimea peliculelor de coroziune depinde in mare masura de temperatura mediului, de durata procesului si de agresivitatea mediului coroziv.
Grosimea peliculelor poate varia in limite foarte largi. Conventional sunt considerate pelicule subtiri cele invizibile cu grosimea sub 400Å, putand fi alcatuite chiar dintr-un strat monomolecular. In acest caz culoarea specifica a metalului nu este afectata. Peliculele medii au grosimea comparabila cu lungimile de unda ale undelor vizibile 400-5000Å. Sunt vizibile datorita fenomenului de interferenta a luminii si apar colorate putin diferit. Peliculele groase, mai mari de 5000Å, pot fi de ordinul micronilor sau chiar milimetrilor. Culoarea lor difera mult fata de culoarea metalului.
Grosimea peliculelor nu caracterizeaza suficient proprietatile anticorozive. Pentru a avea o actiune protectoare pelicula trebuie sa indeplineasca urmatoarele conditii:
1. Pelicula trebuie sa fie aderenta, compacta, continua (fara fisuri, pori).
In cazul peliculelor oxidice sunt continue acelea care au volum mai mare decat al metalului de baza:
![]() > 1; 1.2.1.1
> 1; 1.2.1.1
Daca volumul oxidului produs este mai mic decat volumul metalului generator rezulta ca raportul este subunitar iar pelicula de oxid se fisureaza fiind mai putin protectoare.
Metalele alcaline (Li, Na, K,
Rb, Cs, Fr) si alcalino-pamantoase (Be, Mg, Ca, Sr, Ba, Ra) au raportul ![]() < 1, deci
formeaza pelicule discontinue, afanate, cu proprietati slab protectoare. Pe
alte metale ca Al, Ti, Zr, volumul oxidului format la incalzire este putin mai
mare ca al metalului deci se pot forma pelicule continue de oxizi.
< 1, deci
formeaza pelicule discontinue, afanate, cu proprietati slab protectoare. Pe
alte metale ca Al, Ti, Zr, volumul oxidului format la incalzire este putin mai
mare ca al metalului deci se pot forma pelicule continue de oxizi.
Pelicula trebuie sa fie durabila in conditii de exploatare. O influenta foarte mare asupra comportarii anticorozive a piesei o au tensiunile interne ce apar in timpul cresterii peliculelor de coroziune chiar la temperatura constanta. In timpul formarii peliculelor are loc o crestere de volum ce produce tensiuni interne in pelicula.
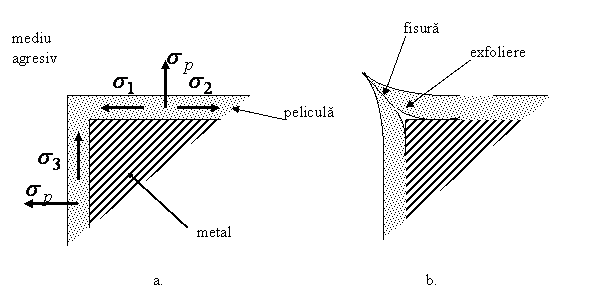
Fig.1.2.1.1 Influenta tensiunilor interne asupra peliculelor de oxizi
a.- cresterea peliculei si aparitia tensiunilor; b.- fisurarea si exfolierea.
La
compunerea celor doua eforturi de crestere a pelicule ![]() si
si ![]() are loc
desprinderea (exfolierea) peliculei de oxid. La muchii si colturi pelicula va
prezenta fisuri si de aceea nu va fi durabila in exploatare. Durabilitatea ei
este influentata de gradul de prelucrare a suprafetelor. O piesa degrosata va
favoriza mentinerea mediului agresiv o durata indelungata de timp si aparitia
rapida a fisurarilor si exfolierilor, in timp ce o piesa rectificata sau
lustruita va avea o durabilitate mai mare. O piesa cu muchii si colturi nete va
avea o durabilitate mai mica.
are loc
desprinderea (exfolierea) peliculei de oxid. La muchii si colturi pelicula va
prezenta fisuri si de aceea nu va fi durabila in exploatare. Durabilitatea ei
este influentata de gradul de prelucrare a suprafetelor. O piesa degrosata va
favoriza mentinerea mediului agresiv o durata indelungata de timp si aparitia
rapida a fisurarilor si exfolierilor, in timp ce o piesa rectificata sau
lustruita va avea o durabilitate mai mare. O piesa cu muchii si colturi nete va
avea o durabilitate mai mica.
3. Pelicula trebuie sa posede proprietati mecanice superioare adica sa reziste la diverse solicitari mecanice, la socuri si eforturi alternative ce apar in exploatare.
4. Diferenta dintre coeficientii de dilatare (liniara sau de volum) al peliculei si al metalului trebuie sa fie cat mai mica, astfel incat pelicula sa reziste la variatii cat mai mari de temperatura, fara sa se fisureze si exfolieze.
Peliculele prea subtiri nu protejeaza suficient de obicei, deoarece opun o rezistenta scazuta difuziei, in timp ce peliculele prea groase se pot fisura sub actiunea tensiunilor interne. Din punct de vedere al protectiei anticorozive, cele mai bune rezultate le dau peliculele de grosime intermediara.
Probabilitatea termodinamica a coroziunii chimice in mediul gazos depinde in mare masura de presiunea partiala a mediului agresiv. Prin compararea acesteia cu tensiunea de disociere a produselor de coroziune se poate aprecia stabilitatea sau instabilitatea metalului in mediul respectiv. Un proces chimic spontan ce se desfasoara la presiune constanta si la temperatura constanta este insotit de micsorarea potentialului termodinamic izobar Z.
Daca : ΔZ < 0 procesul termodinamic decurge spontan;
ΔZ = 0 procesul termodinamic este in echilibru;
ΔZ > 0 procesul este imposibil din punct de vedere termodinamic.
bB + cC + . D mM + nN + . 1.2.2.1
B, C, . - reactanti initiali;
M, N, . - produse de coroziune;
b, c, m, n, . - coeficientii stoechiometrici ai reactiei;
Δ![]() = R
= R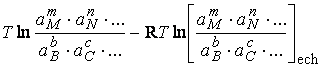 ; Û 1.2.2.2
; Û 1.2.2.2
Δ![]() = R
= R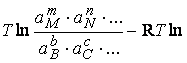 Ka ; Û 1.2.2.3
Ka ; Û 1.2.2.3
Δ![]() = R
= R + Δ
+ Δ![]() unde
: 1.2.2.4
unde
: 1.2.2.4
Δ![]() = variatia standard a potentialului izobar
= variatia standard a potentialului izobar
Δ![]() ¹ Þ Δ
¹ Þ Δ![]() > 0 ; Û proces
termodinamic imposibil 1.2.2.5
> 0 ; Û proces
termodinamic imposibil 1.2.2.5
Δ![]() << 0 Þ Δ
<< 0 Þ Δ![]() < 0 ; Û proces termodinamic
posibil 1.2.2.6
< 0 ; Û proces termodinamic
posibil 1.2.2.6
Δ![]() >> 0 Þ Δ
>> 0 Þ Δ![]() > 0 ; Û proces
termodinamic imposibil 1.2.2.7
> 0 ; Û proces
termodinamic imposibil 1.2.2.7
La oxidarea metalului in aer:
xMe + y/2 O2 D MexOy ; 1.2.2.8
Sensul reactiei depinde de
presiunea partiala a oxigenului ![]() si de tensiunea
de disociere a oxidului metalului
si de tensiunea
de disociere a oxidului metalului ![]() .
.
![]() >
> ![]() Þ reactie termodinamica posibila (oxidare) 1.2.2.9
Þ reactie termodinamica posibila (oxidare) 1.2.2.9
![]() <
< ![]() Þ reactie termodinamica imposibila
(reducere) 1.2.2.10
Þ reactie termodinamica imposibila
(reducere) 1.2.2.10
![]()
![]() Þ echilibru termodinamic 1.2.2.11
Þ echilibru termodinamic 1.2.2.11
Fara a cunoaste exact valoarea lui Δ![]() , se poate aproxima ca in atmosfera curata , sunt
termodinamic posibile acele reactii de oxidare, care conduc la formarea
oxizilor cu tensiuni de disociere mai mici de 0,2 atm. Tensiunea de disociere a
oxizilor creste cu temperatura. Pentru reducerea afinitatii chimice a metalului
fata de oxigen si pentru reducerea oxidului MexOy,
trebuie asigurata o presiune partiala a oxigenului mai mica decat tensiunea de
disociere a oxidului.
, se poate aproxima ca in atmosfera curata , sunt
termodinamic posibile acele reactii de oxidare, care conduc la formarea
oxizilor cu tensiuni de disociere mai mici de 0,2 atm. Tensiunea de disociere a
oxizilor creste cu temperatura. Pentru reducerea afinitatii chimice a metalului
fata de oxigen si pentru reducerea oxidului MexOy,
trebuie asigurata o presiune partiala a oxigenului mai mica decat tensiunea de
disociere a oxidului.
1.2.3. Cinetica coroziunii chimice
Pentru practica prezinta interes nu atat posibilitatea termodinamica de producere a coroziunii, cat viteza efectiva de producere a ei. Pentru a se cunoaste legile vitezei de coroziune este necesar sa se cunoasca legile de crestere a peliculelor de coroziune.
Dupa viteza de crestere a peliculelor, metalele sunt:
a. Metale
ce nu pot forma pelicule de coroziune. Aceste metale fie ca au
pelicule discontinue (![]() < 1), fie ca prezinta produse de oxidare volatile
la temperaturi inalte (V, Mo, W, Ir ). Aceste metale se oxideaza dupa o lege
liniara cu viteza constanta in timp.
< 1), fie ca prezinta produse de oxidare volatile
la temperaturi inalte (V, Mo, W, Ir ). Aceste metale se oxideaza dupa o lege
liniara cu viteza constanta in timp.
![]() 1.2.3.1
1.2.3.1
unde: y = grosimea peliculei;
t = timpul de oxidare;
K = constanta;
Integrand relatia 3.1 si considerand suprafata curata la inceputul oxidarii (c = 0), avem:
y = Kt + c ; 1.2.3.2
respectiv:
y = Kt (pentru. c = 0); 1.2.3.

Fig.1.2.3.1 - Legea de oxidare a metalelor
a.- teoretic ; b.- practic
Conform legii liniare ar urma ca procesul de corodare al acestor metale sa se desfasoare cu o viteza egala cu viteza reactiei dintre metal si oxigen. In practica viteza efectiva a coroziunii este mult mai mica decat viteza reactiei dintre metal si oxigen.
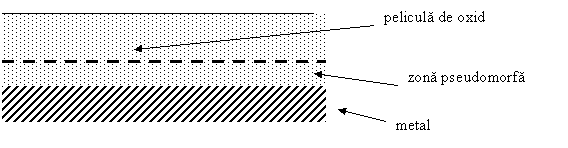
Fig.1.2.3.2 - Structura peliculei de oxid
Zona pseudomorfa a peliculei nu are o structura proprie oxidului ci una asemanatoare cu cea a metalului, deci aceasta zona va proteja metalul. Ea apare la inceputul oxidarii, atinge o grosime maxima, care ramane constanta in timpul coroziunii, dupa care metalul se corodeaza corespunzator legii liniare dar cu viteza mai mica .
b. Metale
pe care oxidarea produce pelicule continue. (![]() > 1). In acest caz coroziunea se atenueaza in timp, adica odata cu ingrosarea peliculei.
Procesul decurge dupa o lege parabolica.
> 1). In acest caz coroziunea se atenueaza in timp, adica odata cu ingrosarea peliculei.
Procesul decurge dupa o lege parabolica.
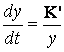 Û
Û 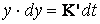 1.2.3.4
1.2.3.4
integrand si considerand c' = 0, rezulta:
y = 2K t + c 1.2.3.5 respectiv:
y = Kt (pentru c' = 0, K = 2K') ; 1.2.3.6
unde: y = grosimea peliculei;
K,K' = constante;
In practica peliculele cresc frecvent si dupa ecuatia generala:
yn = Kt , n ¹ 1 < n < 3 1.2.3.7
care este expresia matematica a legii radacinii cubice.
cand apar distrugeri partiale ale peliculei procesul se intensifica: 1<n<2;
cand pelicula se ingroasa distrugerea are loc mai greu: 2<n<3. Din aceasta categorie fac parte elementele : Co, Mn, Be, Zn, Ti.
c. Metale care la temperatura ambianta se oxideaza greu si foarte greu fiind protejate de pelicule eficiente si foarte fine. Procesul de oxidare a acestor metale se supune unei legi logaritmice:
ey dy
= Kdt Û 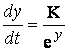 1.2.3.8
1.2.3.8
Metalele din aceasta categorie (Al, Cr, Si) dau pelicule oxidice termorezistente, fiind folosite ca adaosuri pentru obtinerea otelurilor refractare speciale.
Clasificarea metalelor dupa criteriul mentionat nu este riguroasa, pentru ca metalele se comporta dupa legi diferite in functie de temperatura, concentratiile reactantilor si durata de expunere. In general la temperaturi joase metalele se comporta dupa legea logaritmica iar la temperaturi inalte dupa legea parabolica.

Fig 1.2.3.3
1- Legea liniara ; 2 - Legea parabolica
3 - Legea logaritmica ; 4 - Legea cubica
Dm = cresterea dimensiunii probei)
Cresterea peliculelor are loc pana la anumite grosimi specifice, dupa care tensiunile interne aparute in timpul formarii lor, ating la un moment dat valori foarte mari determinand fisurarea sau exfolierea peliculelor.
1.2.4. Mecanismul reactiilor de oxidare chimica
Considerentele anterioare legate de proprietatile, legile de crestere si structura peliculelor de coroziune n-au tinut seama de natura particulelor si de sensul in care difuzeaza acestea in timpul procesului.
In prezent, conform datelor experimentale, se admite ca in majoritatea cazurilor are loc deplasarea atomilor sau ionilor de Me+ si a electronilor e- prin pelicula spre exterior si numai in foarte mica masura, a oxidantului spre interior.

Fig.1.2.4.1
In cazul a.(Fig 1.2.4.1-a) difuzeaza numai ionii metalici Me+ si electronii e- si este specific formarii compusilor oxid de cupru (CuO) sau sulfura de argint (Ag2S), cand pelicula creste exclusiv la suprafata.
In cazul b. difuzeaza de la metal spre mediu ionii metalici Me+ si electronii e- iar dinspre mediul oxidant difuzeaza agentul oxidant O2.
Din compararea dimensiunilor parametrilor retelei cristaline cu dimensiunile particulelor, rezulta ca prin pelicula difuzeaza de preferinta ionii de metal, avand diametrul mai mic decat atomii de metal si atomii de oxigen, cu diametrul mai mic decat al ionilor de oxigen O2- .
Unii compusi ca Al2O3, ZnO, CdO, AgCl, Ag2S, contin un exces de ioni metalici Me+ si electronii e- disponibili a se deplasa prin interstitiile retelei cristaline, deoarece au dimensiuni mici fata de parametrii retelei.
Alti compusi ca FeO, CaO, NiO, Cu2S contin exces de ioni de O2 si goluri sau noduri catodice.
Teoria ionoelectronica a cresterii peliculelor de coroziune arata ca aceasta crestere a peliculei este rezultatul functionarii unei pile galvanice cu circuitele interior si exterior dispuse in interiorul aceleiasi faze (pelicula de coroziune).
Anodul pilei, constituit de suprafata de la interfata metal-pelicula, cedeaza ioni metalici Me+ si electronii e- iar catodul alcatuit din suprafata exterioara a peliculei si partial insasi masa peliculei accepta electronii e-. Aceasta teorie admite ca deplasarea ionilor in pelicula se produce nu atat sub influenta gradientului de concentratie, cat indeosebi ca urmare a migratiei ionilor in campul electric creat de diferenta dintre potentialul electric intern si cel extern.
1.2.5. Coroziunea metalelor in medii lichide neapoase
Procesele de coroziune in medii lichide neapoase pot fi mai rapide decat cele in medii lichide apoase, desfasurandu-se dupa aceleasi legi ca si reactiile in gaze la temperaturi inalte. Procesele de coroziune in lichidele organice polare (alcooli), se desfasoara in general dupa un mecanism electrochimic, in timp ce procesele de coroziune in mediile nepolare (combustibili lichizi, uleiuri) se desfasoara dupa un mecanism chimic.
Rezistenta la coroziune a metalelor uzuale in medii lichide si neapoase
Metalele si aliajele tehnice uzuale sunt foarte stabile in contact cu lichidele neapoase, deoarece adesea pe suprafata lor se formeaza pelicule fine, care determina ulterior comportarea acestor metale la coroziune.
Ferul si aliajele feroase sunt stabile in contact cu tetraclorura de carbon (CCl4) si cu alti solventi clorurati la diferite temperaturi, pana la punctul de fierbere al acestora. In clorura de sulf (SCl2) la 140 oC, fierul se corodeaza cu viteza de 5,6 mm/an, iar in vaporii aceleiasi substante se corodeaza mai intens. In fenol anhidru (C6H5-OH)la 300 oC se corodeaza cu 1,3 mm/am, iar in cel cu 10% H2O, numai cu 0,6 mm/an.
Otelurile inoxidabile austenitice rezista bine la actiunea majoritatii acizilor organici, la temperatura camerei cu exceptia acidului formic (HCOOH) si acidului oxalic (COOH-COOH) cand acestia contin in molecula lor si atomi de Cl. Solutiile neutre nu au influenta deosebita. Otelurile inoxidabile austenitice nu rezista bine in solutii de Br si I, iar in acetona (C3H6O), tetraclorura de carbon (CCl4), alcool etilic (C2H5-OH) si fenol (C6H5-OH), coroziunea nu depaseste 0,1 mm/an.
Aluminiul si aliajele de alumniu rezista bine la majoritatea acizilor organici. Solutiile neutre nu au actiune coroziva asupra aluminiului si aliajelor sale, in schimb lichidele organice bazice ataca aluminiul. La temperaturi inalte alcoolul metilic (CH3-OH), fenolul (C6H5-OH) si alte substante organice devin agresive fata de Al.
Magneziul si aliajele de magneziu practic nu se corodeaza in contact cu hidrocarburile alifatice, derivatii lor clorurati si alcoolii anhidrii dar se corodeaza in acizii alifatici si in multe medii care contin azot.
Cuprul si aliajele de cupru se corodeaza in contact cu lichidele organice care contin compusi halogenati si impuritati de apa, in absenta apei Cu rezistand la actiunea compusilor halogenati. Alama (Cu-Zn) este foarte stabila in alcooli si tetraclorura de carbon (CCl4) uscata. Bronzurile (Cu-Sn, Cu-Al, Cu-Pb) se corodeaza foarte incet in solutiile apoase ale alcoolului etilic (C2H5-OH), fiind atacate mai intens de alcoolul metilic tehnic (CH3-OH).
Nichelul si aliajele de nichel rezista bine in contact cu acizii grasi (oleic(), stearic(CH3-(CH2)12-COOH)), chiar la temperaturi inalte, sunt relativ stabili in acizi organici la temperaturi ambiante dar la temperaturi ridicate acidul formic (HCOOH) si acidul acetic (CH3-COOH) ii corodeaza puternic. Utilizarea nichelului in industria alimentara, se bazeaza pe rezistenta mare la actiunea acizilor diluati si a altor substante din legume, fructe, lapte, bauturi alcoolice. Astfel aliajul monel (70% Ni - 30% Cu) rezista la actiunea tuturor acizilor organici, rezista la fierberea in acid acetic si are o stabilitate satisfacatoare la actiunea acizilor grasi, aflati la temperaturi ridicate.
Aliajele Ni-Cu (63-88% Ni), rezista foarte bine in contact cu produsele alimentare si cu acizii grasi, chiar in conditiile distilarii.
Zincul rezista in contact cu mediile lichide organice cu conditia ca acestea sa fie neutre, anhidre si pure.
Staniul este foarte utilizat sub forma de foi subtiri la ambalarea si depozitarea produselor alimentare dar nu poate fi folosit in contact cu vinurile.
Copyright © 2024 - Toate drepturile rezervate