 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
PARTEA EXPERIMENTALA

1.Obtinerea produsului vegetal Trigonellae coerulea herba
Definitie: produsul este format din partile aeriene ale plantei Trigonella coerulea (schinduf albastru, molotru albastru) fam Papilionaceae. Produsul a fost recoltat in perioada iunie-iulie, dupa fructificare, din orasul Alexandria, judetul Teleorman, anul 2006.
Produsul nu se gaseste in unitatile PLAFAR, la PLAFAR se comercializeaza doar semintele speciei Trigonella foenum-graecum.
Uscarea plantei s-a realizat pe cale naturala, la o temperatura moderata si conservarea s-a efectuat in pungi de hartie pentru a nu degrada substantele active.
2.Verificarea identitatii si calitatii pentru produsul vegetal Trigonellae coerulea herba
Pentru verificarea identitatii s-au aplicat metodele calitative de analiza: examen macroscopic, microscopic, examen chimic calitativ.
2.1. Examen macroscopic
Prin acest examen, care reprezinta primul stadiu de investigare al produselor noi sau cunoscute, se urmareste stabilirea caracterelor morfologice observate cu ochiul liber sau cu lupa si cele organoleptice percepute prin miros si gust. In acest mod este analizata intreaga varietate de produse vegetale ale caror caracteristici sunt determinate de natura organelor din care sunt constitute, pozitia taxonomica a plantelor de la care provin si de forma lor de prezentare: produse intregi (in toto), fragmentate (concissum) sau pulverizate (pulveratum).
Examenul macroscopic se efectueaza in ordinea urmatoarelor elemente:
Aspectul, prin care se stabileste:
forma produsului (intreg sau fragmentat),
particularitatile fetelor,
fractura,
consistenta,
tipul sectiunii transversale si raportul dintre tesuturi (la lupa).
Dimensiunile se apreciaza in:
centimetri, pentru majoritatea produselor (folosind rigla),
milimetri, pentru fructele si semintele mici (folosind hartia milimetrica)
nanometri, pentru celule, incluziuni celulare (granule de amidon, cristale etc., folosind micrometrul ocular sau obiectiv).
Culoarea se observa la exterior si la interior.
Mirosul se percepe pe produsul ca atare, zdrobit intre degete (frunze, flori) sau pulverizat.
Gustul se determina pe produsul ca atare sau pe decoct (nu se inghite, seelimina si se clateste gura cu apa).[28]
Examenele macroscopice ale produselor intregi sunt, de cele mai multe ori, suficiente pentru determinarea identitatii acestora. Caracterele organoleptice mai ofera si unele orientari asupra compozitiei chimice a produselor analizate prin culoare, gust etc. Pentru produsele fragmentate sau pulverizate, examenul macroscopic da unele informatii care, adeseori nu sunt suficiente identificarii, in acest caz investigarea continuandu-se prin examenul microscopic.
Astfel, culoarea galbena, rosie, albastra, portocalie a florilor si fructelor presupune prezenta pigmentilor flavonoidici sau carotenoidici, culoarea portocalie la scoarte, codite si organe subterane indica prezenta
derivatilor antrachinonici, culoarea bruna la frunze, organe subterane si unele cotiledoane este explicata de continutul in taninuri catehice ale acestor produse.
Gustul amar al produselor se poate datora prezentei substantelor amare, heteroizidelor cardiotonice sau unor alcaloizi; gustul astringent- taninurilor; gustul aromat- uleiurilor volatile, rezinelor; gustul dulce- glucidelor .
Rezultate si discutii
In urma examinarii macroscopice a produsului vegetal Trigonellae coerulea herba am observat:
Aspect: tulpini lungi, de 15-20cm, subtiri, pe care sunt prinse frunze mici, trifoliate, alterne. Florile sunt mici, de culoare albastra, prinse in raceme. Fructul este o pastaie de dimensiuni mici, 1cm, cu 6-7 seminte galben-brun.
Culoarea: brun -verzui.
Miros: puternic, caracteristic.
Gust: amarui si astringent.


Fig. nr.25 Trigonella coerulea Fig.nr.26 T. coerulea produsul uscat
2.2. Examen microscopic[20]
Acest examen, ce reprezinta o faza mai avansata a analizei calitative a produselor vegetale, urmareste stabilirea tesuturilor si elementelor anatomice caracteristice ale sectiunilor si preparatelor clarificate din pulberi sau produse fragmentate.
Caracterele anatomice ale diferitelor organe de planta servesc in unele cazuri si la precizarea pozitiei taxonomice a speciilor producatoare.
Un produs vegetal poate fi supus examenului microscopic in urma unei anumite prelucrari in vederea obtinerii unor preparate ce pot fi analizate la microscop.
Preparatele microscopice se realizeaza prin metode diferite in functie de natura, starea produsului (intreg, fragmentat sau pulverizat), dupa consistenta si chiar compozitia chimica.
Examenul microscopic al materialului vegetal ''concissum''
clarificat
S-a efectuat analiza microscopica a preparatelor superficiale obtinute din petale, frunze, seminte, clarificate cu NaOH 50g/L.
Acesta metoda se utilizeaza in examenul microscopic al fragmentelor vegetale provenite de la organe vegetale subtiri: frunze, flori, herba.
Fragmentele de produs vegetal de dimensiuni mici, se aduc intr-o eprubeta, se adauga cativa ml de solutie de NaOH 50g/L si se fierb timp de 3-5 minute. Dupa racire se decanteaza solutia de hidroxid, apoi produsul se spala de mai multe ori cu apa distilata. Pe o lama de sticla se aduc fragmente de produs vegetal asezate cu fata superioara in sus, o picatura de apa, apoi cu o lamela, apasand usor cu degetul, dupa care se examineaza la microscop.
S-a utilizat un microscop Labophot 2-Nikon cu ocular 10x si obiective de 4x, 10x, 40x.
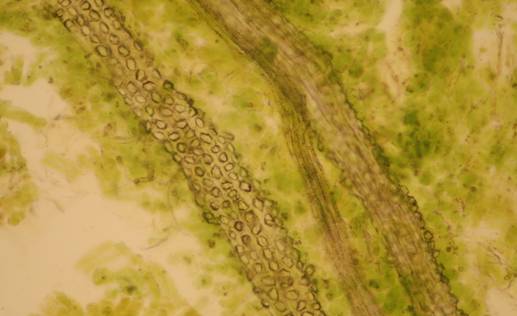
Fig. nr.25 Frunza (preparat superficial) Teci cristaligene (ob. 10x)

Fig. nr.26 Frunza (preparat superficial) Epiderma- striuri cuticulare
(ob. 10x)
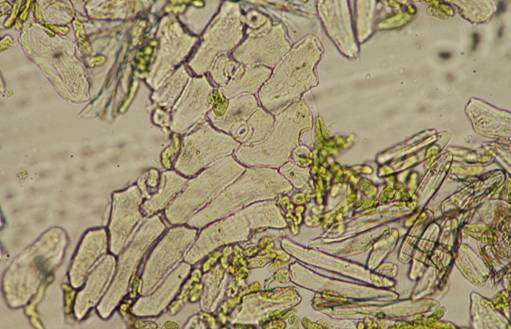
Fig. nr.27 Frunza (preparat superficial) Epiderma cu stomate (ob. 4x)
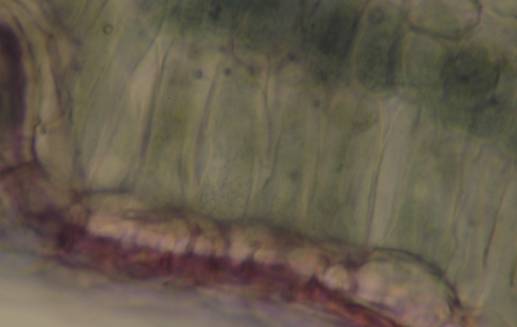
Fig. nr.28 Frunza (preparat superficial) Epiderma superioara si palisada
(ob 40x)
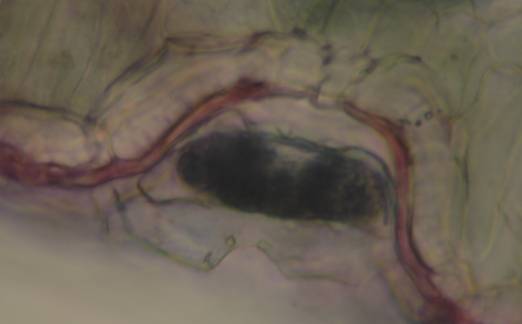
Fig. nr.29 Frunza (preparat superficial) Par glandular pluricelular, aflat intr-o invaginatie a epidermei superioare (ob 40x)

Fig. nr.30 Frunza (preparat superficial) Vase lemnoase reticulate
(ob 10x)
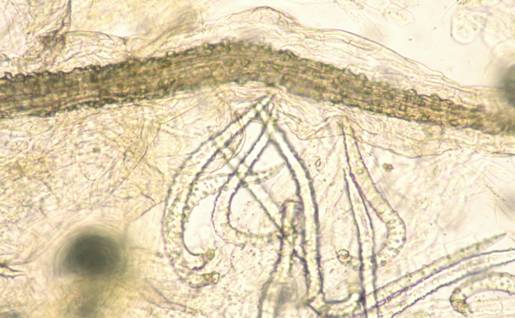
Fig. nr.31 Sepala (preparat superficial) Peri tectori si teaca cristaligena
(ob 4x)

Fig. nr.32 Floare (preparat superficial) Petala- epiderma, vase de lemn
(ob 4x)
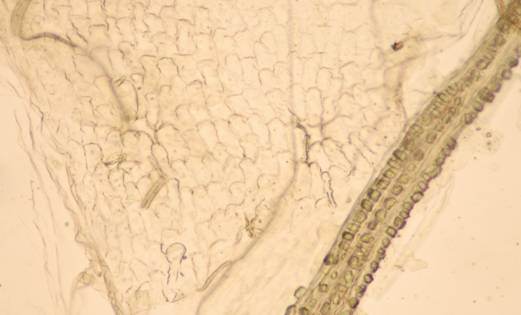
Fig. nr.33 Floare (preparat superficial) Papile si teaca cu
cristale de oxalat de calciu (ob 10x)
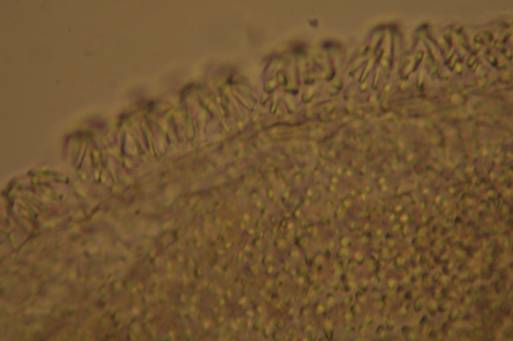
Fig. nr.34 Antera (preparat superficial)- endoteciu (ob 10x)

Fig. nr.35 Samanta (preparat superficial) Macrosclereide dispuse in palisada (ob 40x)
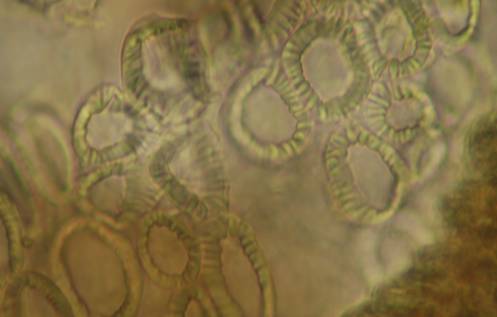
Fig. nr.36 Samanta (preparat superficial) Macrosclereide
(ob 40x)
Obtinerea preparatelor microscopice sub forma de sectiuni
Sectionarea unui produs vegetal intreg sau fragmentat se face de obicei in plan transversal si, daca este necesar, in plan longitudinal (radiar sau tangential).
Pentru sectionare, produsele vegetale uscate si fragmentate convenabil se aduc la consistenta necesara acestei operatii prin inmuierea in apa fierbinte (frunzele, florile) sau prin fierbere pentru un timp mai indelungat (radacinile, scoartele, tulpinile etc). in cazul produselor cu mucilagii se foloseste macerarea (24 ore) intr-un amestec de alcool si glicerina.
Sectiunile se obtin cu ajutorul unui brici sau a unui microtom (produsul fiind introdus in parafina).
Daca fragmentele ce trebuie sectionate sunt subtiri, cum sunt frunzele si unele scoarte, sau sunt mici (fructe, seminte), se includ intre doua fragmente de maduva de soc sectionata longitudinal.
Pentru obtinerea unei sectiuni transversale intr-o frunza, se separa un fragment care sa cuprinda nervura mediana si o parte a mezofilului din apropierea petiolului. Sectionarea se realizeaza printr-o miscare uniforma a lamei briciului de la baza spre varf, fara opriri, pentru obtinerea de sectiuni de aceeasi grosime.
Sectiunile obtinute se prind intr-un cristalizor cu apa distilata, dupa care sunt clarificate si apoi colorate. Clarificarea se face de regula cu apa de Javel timp de 20 de minute, cu o solutie cloralhidrat 80 sau cu o solutie de hidroxid de potasiu 5-8%. Dupa spalare repetata, sectiunile clarificate se coloreaza..
Colorarea sectiunilor se poate realiza prin mai multe procedee, din care cele mai uzuale sunt:
a) Colorarea cu floroglucina in mediu de acid clorhidric (floroglucina clorhidrica).
In sectiunile clarificate cu o solutie de cloral hidrat 80% si apoi tratate cu cateva picaturi dintr-o solutie alcoolica de floroglucina clorhidrica, peretii lignificati ai celulelor se coloreaza in rosu.
Pentru indepartarea acidului clorhidric, sectiunile sunt aduse in glicerina diluata (1:3), apoi montate in glicerina pe o lama de microscop si acoperite cu o lamela.
b) Examinarea cu reactivul Steimetz
Datorita compozitiei complexe a acestui reactiv, se realizeaza atat clarificarea tesuturilor, precum si colorarea lor selectiva. Agentii de clarificare sunt: cloralhidratul, glicerina si alcoolul. Sulfatul de anilina coloreaza in galben tesuturile lignificate; Sudanul III coloreaza in rosu sau portocaliu uleiul volatil, rezinele etc; alaunul de fier amoniacal da precipitate sau coloratii cu taninurile sau compusii fenolici, iodul coloreaza amidonul in albastru-violet.
c) Dubla coloratie cu verde de iod si carmin-alaun.
Este o metoda folosita pentru colorarea peretelui celular si care permite diferentierea tesuturilor.
Tehnica necesita distrugerea continutului celular, cu mentinerea numai a peretelui pecto-celulozic, suberificat si lignificat. De aceea, dubla coloratie include urmatoarele faze:
javelizarea (operatia de clarificare) reprezinta descompunerea si inlaturarea continutului celular. Pentru aceasta, sectiunile se mentin 15-30 minute intr-o solutie de hipoclorit de sodiu ( apa de Javel) intr-un cristalizor acoperit cu sticla de ceas;
spalarea sectiunilor decolorate se face cu apa distilata, in 5-6 bai succesive si se realizeaza pana se inlatura complet apa de Javel (nu se percepe miros de clor);
colorarea cu verde de iod reprezinta tratarea sectiunilor cu
solutie de verde de iod 1% timp de 2-3 minute. Colorantul se adauga peste sectiunile din cristalizor, aflate in apa distilata, dupa care se spala pentru a indeparta excesul de colorant;
tratarea cu carmin-alaun timp de 10-15 minute presupune aducerea peste sectiunile colorate intens in verde de iod a unei solutii concentrate de carmin-alaun. Apoi, sectiunile se spala cu apa distilata pana la indepartarea urmelor de colorant.
Prin aceasta tehnica, peretele celular se coloreaza astfel:
in roz sau rosu-violaceu peretele celulozic, datorita carminului (epiderma, parenchimurile fundamentale, colenchimul);
in verde sau verde-albastrui peretele lignificat, datorita verdelui de iod ( vasele lemnoase si sclerenchimul);
in galben-verzui, brun-verzui sau verde: peretele suberificat, datorita verdelui de iod (suberul, exoderma, cuticula epidermelelor si a perilor tectori, rizoderma exfoliata
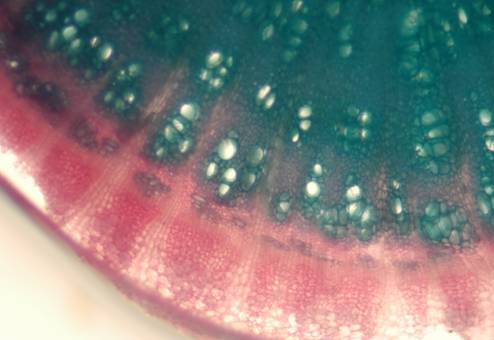
Fig. nr.37 Radacina (sectiune transversala)
Structura secundara- lemn si liber secundar, raze medulare multiseriate in lemnul si liberul secundar (ob 10x)
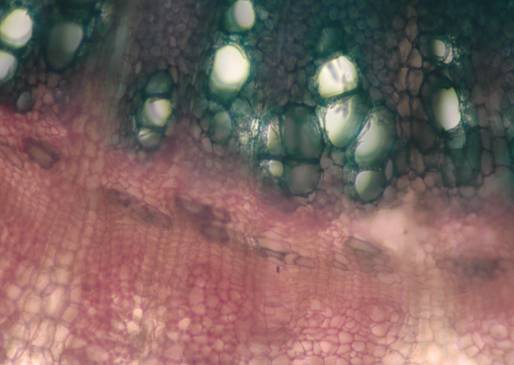
Fig. nr.38 Radacina (sectiune transversala)
Liber si lemn secundar, raze secundare multiseriate in lemnul si liberul secundar (ob 10x)
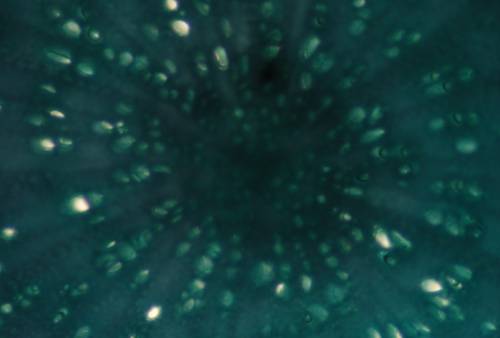
Fig. nr.39 Radacina (sectiune transversala)
Lemn secundar cu parenchim sclerificat (ob 10x)
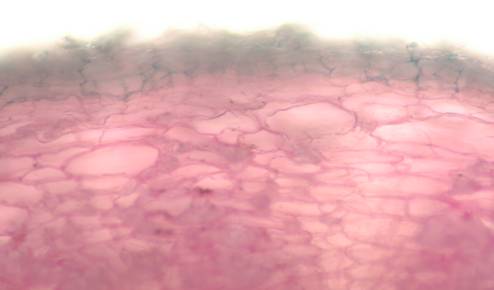
Fig. nr.40 Radacina (sectiune transversala)
Suber, felogen, feloderm si cu celule cu mucilagii in scoarta
(ob 10x)
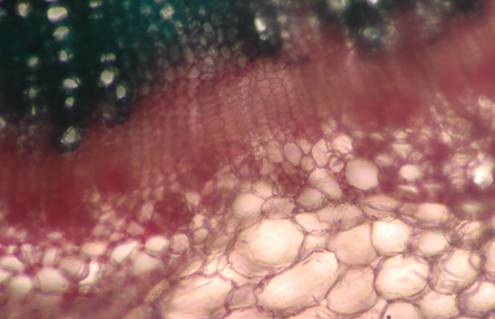
Fig. nr.41 Tulpina (sectiune transversala)
Structura secundara incompleta- liber si lemn primar, liber si lemn secundar (ob 10x)
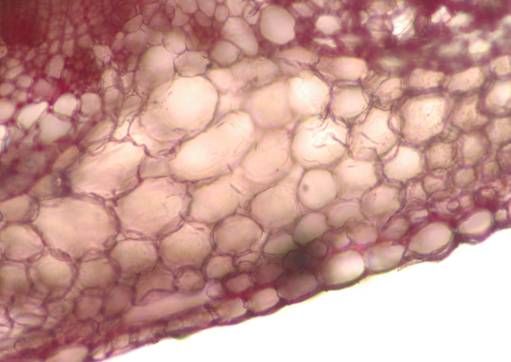
Fig. nr.42 Tulpina (sectiune transversala)
Epiderma cu cuticula, stomata (ob 10x)

Fig. nr.43 Tulpina (sectiune transversala)
Colenchim angular subepidermal (ob 10x)
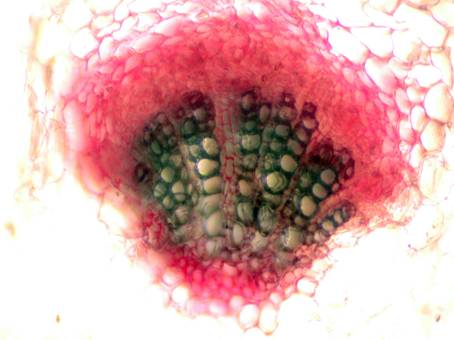
Fig. nr.44 Frunza (sectiune transversala in zona nervurii principale)
Fascicul libero-lemnos colateral deschis (ob 10x)
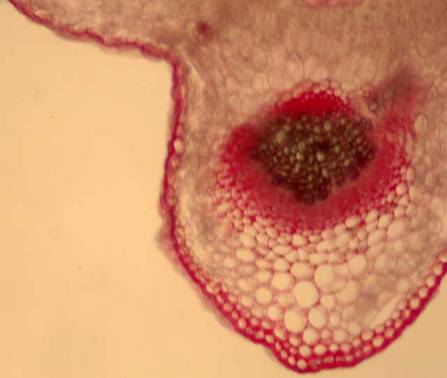
Fig. nr.45 Frunza (sectiune transversala in zona nervurii principale)
Colenchim angular subepidermal, fascicul libero-lemnos colateral deschis (ob 10x)
Rezultate:
In urma observarii preparatelor microscopice s-au evidentiat elemente anatomice caracteristice organelor respective:
Radacina prezinta structura secundara cu celule cu mucilagii in scoarta, liber si lemn secundar, raze medulare secundare multiseriate in liberul si lemnul secundar, fibre sclerificate in liberul secundar, parenchim lemnos cu fibre sclerificate (fig.nr. 37, 38, 39, 40).
Tulpina prezinta structura sedundara incompleta cu epiderma formata dintr-un singur rand de celule cu cuticula bine definita; colenchim angular; vase libero-lemnoase de tip colateral deschis, liber si lemn secundar (fig.nr. 41, 42, 43).
Frunza are structura heterogen asimetrica: epiderma superioara cu cuticula striata, fara stomate, doua straturi de celule alungite ce formeaza palisada (parenchimul asimilator); tesutul lacunar; fibre de sclerenchim cu cristale de oxalat de calciu. Epiderma inferioara prezinta numeroase stomate anomocitice, peri glandulari sesili pluricelulari localizati intr-o invaginatie a epidermei. La nivelul nervurii principale se observa fascicul libero-lemnos colateral deschis, cu vase de lemn spiralate si inelate si cu periciclu colenchimatos, teci cristaligene (fig.nr. 44, 45).
2.3. Examen chimic calitativ[12]
Examenul chimic calitativ are ca scop identificarea principiilor active din produsul vegetal.
Metoda:
Separarea principalelor grupe de principii active se face prin extractie succesiva si selectiva a produsului vegetal cu solventi de polaritati diferite, incepand cu solventul apolar si terminand cu un solvent polar.
Primul solvent care s-a utilizat a fost eterul etilic. Solutia extractiva eterica a fost analizata conform schemei nr.l.
Produsul vegetal epuizat cu eter s-a supus extractiei cu metanol. Solutia extractiva metanolica obtinuta s-a analizat conform schemei nr. 2.
Produsul vegetal epuizat cu eter si metanol s-a supus extractiei cu apa. Solutia extractiva apoasa obtinuta s-a analizat conform schemei nr. 3.
Schema nr.1 Analiza chimica a unui produs vegetal 10g produs vegetal se epuizeaza cu eter (concentrare la 50ml)
![]()
![]() Extract eteric Produs
vegetal schema
Extract eteric Produs
vegetal schema
![]()
![]()
![]()
![]() nr.2
nr.2
![]()
![]()
![]()
![]()
10ml 3ml 3ml
20ml sol. 3ml evaporare 3ml evaporare evaare
![]()
![]()
![]()
![]()
![]()
![]() evaporare evaporare
evaporare evaporare
![]() reziduu reziduu reziduu reziduu
reziduu reziduu reziduu reziduu
![]() reziduu+alcool +1.5ml
CH3OH +1.5ml
HCl 2% +1ml
reziduu+alcool +1.5ml
CH3OH +1.5ml
HCl 2% +1ml
![]()
![]()
![]()
![]()
![]()
![]()
![]() NH4OH
NH4OH
sol. apoasa acida
![]() solutie reziduul
gras Reactia
Shibata
solutie reziduul
gras Reactia
Shibata
![]() alcoolica se saponifica (distilare)
alcoolica se saponifica (distilare)
![]() +apa +eter
+apa +eter
![]()
![]()
![]() 1-2pic
reactiv Mayer Reactia Reactia Reactia
1-2pic
reactiv Mayer Reactia Reactia Reactia
![]() reziduu Borntrager Liebermann Carr-
reziduu Borntrager Liebermann Carr-
![]()
![]() sol
eterica (insaponificabila) sol. apoasa alcalina Burchard Price
sol
eterica (insaponificabila) sol. apoasa alcalina Burchard Price
![]()
![]()
![]()
![]()
![]()
![]() aromat
aromat
3ml sol evap. 3ml sol.evap acidulare
![]()
![]()
![]() +eter
+eter
antrenare
![]()
![]()
![]() cu vapori reziduu reziduu sol.eterica
cu vapori reziduu reziduu sol.eterica
de apa
![]() a 10-20g p.v. Reactia
Liebermann Reactia
Carr-Price reziduu
a 10-20g p.v. Reactia
Liebermann Reactia
Carr-Price reziduu
![]()
![]() -Burchard
-Burchard
![]()
ulei volatil steroli; triterpene carotenoide acizi grasi agliconi flavonici alcaloizi baza emodoli steroli; triterpene carotenoide
Schema nr.2 ![]()
![]()
![]() Produsul vegetal epuizat cu eter
Produsul vegetal epuizat cu eter
Epuizare cu CH3OH prin refluxari repetate (20-40min.) si concentrare
![]() Extract alcoolic (5oml) Produs vegetal epuizat cu alcool schema
Extract alcoolic (5oml) Produs vegetal epuizat cu alcool schema
nr.3

![]()
![]()
![]() reactii executate direct
pe solutie 25ml reactii
executate pe sol. hidrolizata 25ml
reactii executate direct
pe solutie 25ml reactii
executate pe sol. hidrolizata 25ml
(reflux 30min. cu 15ml HCl 10%, racire si extragere de 3x cu 15ml eter)
![]()
![]()
![]()
![]() 1ml sol 1ml sol. 5ml
sol.evap. extract
eteric sol.
apoasa acida
1ml sol 1ml sol. 5ml
sol.evap. extract
eteric sol.
apoasa acida
+2ml apa +2ml apa
![]()
![]()
![]()
![]() +2-3pic +20 pic
+2-3pic +20 pic
FeCl3 Reactiv Fehling reziduu culoare rosie
![]()
![]() diluata (incalzire) 3ml sol. 10ml sol.
evap. 5ml
sol. evap. (antocianozide)
diluata (incalzire) 3ml sol. 10ml sol.
evap. 5ml
sol. evap. (antocianozide)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() (galben-pai)
(galben-pai)
1ml apa calda
![]()
reziduu + 0.5ml anhidrida reziduu + 1ml
acetica si 0.5ml cloroform CH3OH 50%
![]() 0.5ml
sol. reactiv (la cald) viraj
culoare ,
0.5ml
sol. reactiv (la cald) viraj
culoare ,
![]()
![]() albastru verde ninhidrina Borntrager pH diferit
albastru verde ninhidrina Borntrager pH diferit
![]()
![]()
![]() negricios negricios Reactiv
Liebermann-Burchard
negricios negricios Reactiv
Liebermann-Burchard
![]()
![]()
![]()
![]()
![]() pp.
rosu Reactia
pp.
rosu Reactia
![]()
![]() caramiziu violet Shibata
caramiziu violet Shibata
![]() verde verde
verde verde
![]()
![]() albastru violet
albastru violet
tanin tanin compusi aminoacizi antracenozide heterozide heterozide flavonozide antocianozide
galic catechic reducatori steroidice triterpenice
Schema nr.3 Produsul vegetal epuizat cu eter si alcool
![]()
![]()
![]() 10g produs vegetal se epuizeaza cu
apa la cald
10g produs vegetal se epuizeaza cu
apa la cald
![]()
![]()
![]() Extract apos (50ml Produs vegetal
epuizat ( se
arunca )
Extract apos (50ml Produs vegetal
epuizat ( se
arunca )
![]()
![]()
![]()
![]() (vezi solutia
extractiva alcoolica)
(vezi solutia
extractiva alcoolica)
![]()
1ml sol 1ml sol. 1ml sol. 1ml sol.
+ 1-2ml apa + 5-8 pic agitare puternica + 1ml apa
![]() + 1-2 pic sol. R. Fehling (t0) +
1-2 pic. FeCl3
+ 1-2 pic sol. R. Fehling (t0) +
1-2 pic. FeCl3
![]()
![]()
![]() Lugol diluata
Lugol diluata
![]() albastru pp. rosu spuma persistenta albastru-negricios
albastru pp. rosu spuma persistenta albastru-negricios
![]() R.
Liebermann-Burchard sau
R.
Liebermann-Burchard sau
![]() verde-negricios
verde-negricios
![]()
amidon compusi reducatori saponozide taninuri galice sau catechice
Identificarea alcaloizilor
Alcaloizii sunt substante organice cu caracter bazic ce contin in molecula un atom de N heterociclic si au activitate farmacodinamica specifica si toxicitate ridicata.
Desi prezinta structuri chimice foarte variate, toti alcaloizii se comporta aproape identic fata de anumiti reactivi denumiti reactivi generali ai alcaloizilor din care fac parte doua categorii: reactivi generali de precipitare si reactivi generali de culoare. Reactiile de precipitare se efectueaza pe sarurile alcaloizilor (deci in mediu acid apos), iar cele de culoare pe reziduurile bazelor alcaloidice.
Reactii de precipitare
Principiul metodei:
Toti alcaloizii, cu mici exceptii, dau cu reactivii de precipitare, precipitate albe, galbene, portocalii, brune si, mai rar, de alte culori.
Reactivi necesari:
acid clorhidric 2%
reactiv Mayer (solutie apoasa de tetraiodomercuriat de potasiu cu adaos de clorhidrat)
reactiv Bertrand (solutie apoasa de acid silicotungstic).
Tehnica de lucru: 10 ml extract eteric se evapora intr-o capsula de portelan pe baia de nisip. Reziduul se dizolva in 1,5 ml acid clorhidric 2% prin amestecare cu o mica bagheta de sticla la cald (pe baia de apa). Solutia decantata se imparte in trei eprubete, in volume egale. La una din probe (eprubete) se adauga 2-3 picaturi de reactiv Mayer (R), la a doua proba se adauga 2-3 picaturi de reactiv Bertrand (R) si ultima eprubeta serveste ca proba martor. Daca probele tratate cu reactivi dau opalescente sau precipitate evidente (de culoare alb-galbuie), alcaloizii sunt prezenti.
2.3.2 Identificarea aminoacizilor
Reactia cu ninhidrina
Principiul metodei:
Reactia de culoare data de catre aminoacizi cu ninhidrina in mediu acetonic.
Reactivi necesari:
solutie acetonica de ninhidrina 1%.
Tehnica de lucru: 5 ml extract se evapora intr-o capsula la sec. Reziduul se reia cu 1,5 ml apa la cald, se filtreaza intr-o eprubeta si se adauga 10 picaturi solutie acetonica de ninhidrina 1 %. Se incalzeste intr-o baie de apa la fierbere 20-25 min . Aparitia unei culori violete sau albastru-violet indica prezenta aminoacizilor.
2.3.3 Identificarea carotenoidelor
Reactia Carr-Price
Principiul metodei:
Reactia de culoare pe care carotenoidele o dau cu anumiti compusi.
Reactivi necesari:
reactiv Carr-Price (triclorura de stibiu, solutie saturata in cloroform)
solutie H2SO4 concentrat.
Tehnica de lucru: 0,5 ml solutie extractiva eterica se evapora la sicitate intr-o capsula de portelan (pe baia de nisip). Reziduul se trateaza cu 1-2 picaturi reactiv Carr-Price sau cu 1-2 picaturi H2SO4 concentrat sau cu 1-2 picaturi HCl concentrat. In cazul unei reactii pozitive, apare o coloratie albastru-intens in prezenta H2SO4 concentrat si
a HCl concentrat, sau o coloratie albastra care trece in rosu-purpuriu, apoi in rosu-brun in prezenta reactivului Carr-Price.
Identificarea cumarinelor
Heterozidele si agliconii cumarinici sunt substante solide, cristalizate, incolore sau slab colorate in galben, cu miros aromat caracteristic. Cumarinele sunt lipsite de gust si sublimeaza, fiind solubile in solventi polari (apa, metanol, etanol si acetona) si insolubile in solventi organici apolari.
Heterozidele hidrolizeaza in prezenta acizilor minerali diluati cu eliberarea agliconului. Agliconii sunt solubili in solventi apolari (eter etilic) si insolubili in apa.
Principiul metodei:
Heterozidele si agliconii emit radiatii in lumina UV, prezentand fluorescenta caracteristica: albastra, albastra-verzuie, violet.
Reactivi necesari:
solutie NaOH 10%
lumina UV.
Tehnica de lucru: 2-3 ml solutie extractiva apoasa concentrata se impart in doua portiuni egale. Prima portiune reprezinta proba martor, iar cealalta se combina cu 1 ml solutie NaOH 10%. Ambele probe se analizeaza in lumina UV, iar aparitia unei fluorescente albastru-violet in proba cu NaOH 10% indica prezenta cumarinelor in solutia de analizat.
2.3.5 Identificarea emodolilor
Reactia Bontrager
Principiul metodei:
Se bazeaza pe proprietatea agliconilor forme oxidate (antrachinone) de a trece din emodoli in fenoxizi (emodinati) de culoare rosie-visinie, in prezenta solutiilor alcaline. Sensibilitatea
reactiei este de 10-5. Aceasta poate fi efectuata direct pe produsul vegetal, pe microsublimat sau in solutie apolara de agliconi. Agliconii cu functie carboxilica formeaza fenoxizi chiar in prezenta carbonatului acid de sodiu.
Reactivi necesari:
solutie HC1 10%
solutie NaOH 10%.
Tehnica de lucru: solutia extractiva apoasa se hidrolizeaza cu HC1 10 % si se extrage apoi cu eter. Se iau 3-4 ml solutie eterica intr-o eprubeta si se adauga 0,5-1 ml solutie NaOH 10%. in cazul unei reactii pozitive, stratul inferior apos se coloreaza in rosu, iar cel superior, apolar, se decoloreaza .
Identificarea flavonelor
Flavonele sunt substante solide, cristalizate, colorate in galben de diferite intensitati. Heterozidele flavonice sunt solubile in apa, alcool diluat si concentrat, solubile specific in acetat de etil, acetona, insolubile in solventi apolari..
Agliconii sunt solubili in alcool, acetat de etil, acetona, insolubili in solventi apolari. Heterozidele hidrolizeaza numai in prezenta acizilor minerali (nu hidrolizeaza enzimatic). In conditii diferite, in functie de atomul de legatura dintre aglicon si partea glucidica: O-heterozidele hidrolizeaza usor, C-heterozidele hidrolizeaza in prezenta unor concentratii mari de acid, intr-un timp mai indelungat, la presiune ridicata si in prezenta unor catalizatori.
Datorita gruparii cetonice de la C, flavonele se pot reduce cu hidrogen nascand in mediu hidroalcoolic cand se formeaza antocianidoli (reactia Shibata). Culoarea acestora poate fi rosie (flavonoli) sau portocalie (flavone).
Prezenta gruparilor hidroxil fenolice permite transformarea, in mediu alcalin, a flavonelor in fenoxizi de culoare galbena mai intensa decat flavona initiala
Gruparile hidroxil alcoolice din vecinatatea gruparii ceto permit formarea de chelati cu metale bi- si trivalente, colorati in galben mai intens decat flavona initiala.
Reactia Shibata cianidolului)
Principiul metodei
Reducerea gruparii cetonice a flavonelor cu hidrogen nativ (rezultat in reactia dintre magneziu si acid clorhidric concentrat). Se formeaza clorura de oxoniu colorata in rosu:
Reactivi necesari:
acid clorhidric concentrat
magneziu metalic
Tehnica de lucru: 1 ml solutie se introduce intr-o eprubeta cu cateva fragmente de magneziu metalic (span). La adaugarea de 4-6
picaturi de acid clorhidric concentrat apare o coloratie rosie sau portocalie.
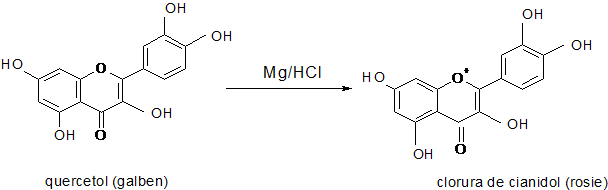
Reactia cu hidroxidul de sodiu (NaOH)
Principiul metodei
Dizolvarea flavonozidelor in alcalii cu obtinerea de fenolati (flavoxizi) intens colorati in galben.
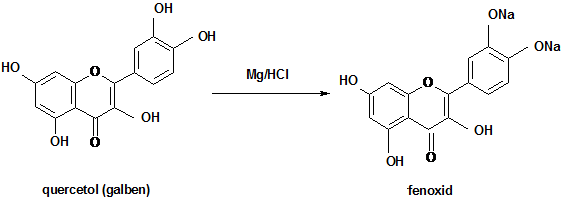
Reactivi necesari:
. solutie hidroxid de sodiu 5%
Tehnica de lucru: la 1 ml solutie de analizat se adauga 1 ml solutie hidroxid de sodiu 5%. in cazul unei reactii pozitive, coloratia galbena a solutiei de analizat se intensifica fata de cea a martorului in care nu s-a adaugat solutie de NaOH 5%.
Reactia cu clorura de aluminiu (AlCl3)
Principiul metodei
Chelatarea cu saruri ale metalelor bi- si trivalente.
Flavonele cu grupari libere de C3 sau C5 formeaza impreuna cu gruparea ceto de la C4 chelati in pozitia orto (I) sau para (II). Acesti compusi se pot obtine si atunci cand pe nucleu exista doua grupari -OH vicinale, iar mediul de reactie este alcalin, pentru ca in aceste conditii gruparea -OH din 4 se transforma in grupare cetonica prin tautomerie - pozitie para(III). Chelatii obtinuti sunt de culoare galbena intensa si au o fluorescenta galben-verzuie sau albastra in UV.
Reactivi necesari:
solutie de acetat de sodiu 10%
solutie de clorura de aluminiu 2,5%
Tehnica de lucru: la 1 ml solutie de analizat de adauga 0,5 ml acetat de sodiu (R) si 1 ml clorura de aluminiu 2,5%. Coloratia galbena a solutiei de analizat se intensifica.
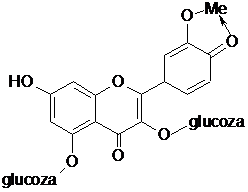
2.3.7 Identificarea compusilor polihidroxifenolici
Reactia Arnow
Principiul metodei
Consta in proprietatea fenolilor de a forma cu acidul azotos nitrozoderivati care se izomerizeaza spontan in izonitrozoderivati sau oxime care, datorita caracterului lor slab acid, se dizolva in solutii alcaline dand coloratii rosii.
Reactivi necesari:
solutie HC1 0,1 N
reactiv Arnow
solutie NaOH 0,1 N

Tehnica de lucru: la 0,5 ml solutie de analizat se adauga 1 ml HC1 0,1N, l ml reactiv Arnow si 1 ml solutie NaOH 0,1N. In cazul unei reactii pozitive se obtine o coloratie rosie.
Identificarea ozelor si poliholozidelor
Ozele simple se identifica datorita caracterului reducator prin reactia cu reactivii Fehling sau Tollens si prin cuplarea cu o-toluidina sau fenilhidrazinele.
Poliholozidele se identifica prin reactia de culoare cu hematoxilina sau prin precipitare in alcool.
a) Reactia Molish
Este comuna pentru ozele simple si pentru poliholozide.
Principiul metodei
Condensarea furfuralului cu timol, in cazul poliholozidelor in urma depolimerizarii cu H2SO4 concentrat.
Reactivi necesari:
H2SO4 concentrat
timol
Tehnica de lucru: 10 ml solutie extractiva apoasa se concentreaza la sec intr-o capsula de portelan. Peste reziduu se aduc 1-2 picaturi H2SO4 concentrat si dupa 3-5 minute se aduce o
picatura de timol. In cazul unei reactii pozitive apare o coloratie rosie.
b) Precipitarea in alcool si colorarea cu hematoxilina
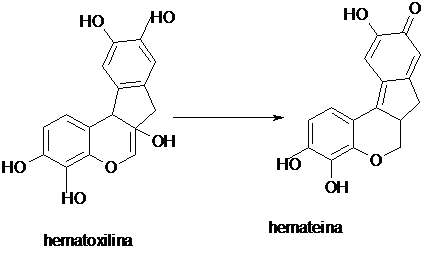
Principiul metodei
Se bazeaza pe precipitarea poliholozidelor in alcool si colorarea precipitatului cu hematoxilina:
Reactivi necesari:
metanol
hematoxilina
Tehnica de lucru: 10-15 ml solutie extractiva apoasa se concentreaza la 2 ml intr-o capsula de portelan. Dupa racire, solutia concentrata se toarna in fir subtire peste 20 ml metanol. In cazul prezentei poliholozidelor se va obtine un precipitat care, in prezenta hematoxilinei, se va colora in violet datorita hemateinei.
2.3.9 Identificarea proantocianilor
Antocianii sunt substante solide, cristalizate, colorate, solubile in alcool concentrat sau diluat si in solventi organici
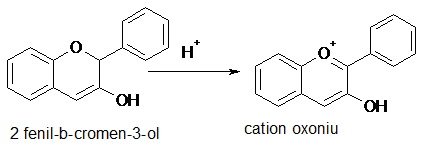
apolari, la pH = 7, insolubili in apa; in apa acidulata (pH < 3) formeaza saruri de oxoniu solubile, colorate in rosu. Cu bazele formeaza fenoxizi solubili de diferite nuante, de la violet la albastru.
Se presupune ca la pH = 7 antocianii sunt derivati de 2-fenil-3 cromen-3-ol, labil, care se stabilizeaza prin aromatizare in mediu acid, cand trec in saruri de oxoniu.
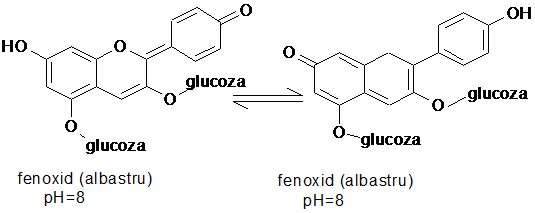
Heterozidele hidrolizeaza prin incalzire cu acizi diluati cu eliberarea antocianidolilor. Prin alcalinizare, daca se adauga solutii alcaline treptat, si modificarea pH-ului este lenta, se obtine mai intai o pseudobaza incolora (instabila la pH = 7), apoi forma chinonica violeta (stabila la pH foarte slab bazic), fenoxid de culoare albastra (stabil la pH = 8-10); la pH = 12 se obtin calchone colorate in galben.
In sucul vacuolar (pH~3) ar putea avea loc aditia nucleofila a apei care ar destabiliza structura oxonica. Se presupune insa ca plantele pot preveni astfel de reactii prin acilare, co-pigmentare intermoleculara cu flavonoidele, chelatare cu metalele si autoasociere.
Principiul metodei
Se bazeaza pe proprietatea acestora de a se transforma in antociani prin refluxare in mediu acid, conform reactiei:
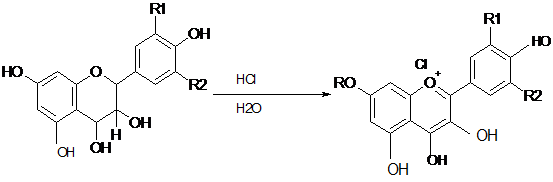
Reactivi necesari:
solutie de acid clorhidric 10%
Tehnica de lucru: 10 ml solutie extractiva apoasa nehidrolizata se concentreaza la reziduu. Acesta se reia cu 10 ml HC1 si se divide in doua portiuni egale care se aduc in doua eprubete. Una dintre ele se mentine intr-o baie de apa in fierbere timp de 30 de minute pentru transformarea proantocianidolului in antocian, cealalta serveste drept martor. Dupa racire, ambele solutii sunt agitate cu 3 ml butanol (pentru extractia antocianilor). Daca solutia butanolica obtinuta prin incalzire prezinta o intensitate mai mare a culorii decat proba martor, in solutia de analizat exista proantociani .
Identificarea compusilor reducatori
Principiul metodei
Se bazeaza pe proprietatea lor de a reduce solutia de reactiv Fehling la oxid cupros.
Reactivi necesari:
solutie Fehling I (solutie apoasa de sulfat de cupru)
solutie Fehling II (solutia apoasa de tartrat de sodiu si potasiu in hidroxid de sodiu)
Tehnica de lucru: peste 3 ml solutie se adauga un amestec constituit din parti egale de solutie Fehling I si II si se incalzeste pe baia de apa. Aparitia unui precipitat rosu-brun care se depune in timp indica prezenta compusilor reducatori.
Identificarea saponozidelor
Saponozidele triterpenice precipita cu acetatul neutru de plumb. Solubilitatea in apa a saponozidelor cu grupari carboxilice poate fi marita prin alcalinizarea solutiei (cu hidrogenocarbonati, carbonati, fosfati). Se formeaza saruri mai solubile.
Saponozidele triterpenice hidrolizeaza enzimatic, treptat, mai usor decat cele sterolice, cu formare de heterozide secundare sau prosapogenoli si oze. La inceput se scindeaza hexozele apoi pentozele si, in final, acizii uronici. Hidroliza acida, desi totala, este nespecifica in mediu de reactie regasindu-se agliconii, ozele si eventual acizii uronici sau acizii organici care participa la structura saponozidei respective.
a) Proba de spumefiere: se executa asupra solutiei extractive apoasecare se agita timp de 15 sec intr-o eprubeta cu diametrul de 16 mm. Se formeaza o coloana de spuma care persista cel putin 15 mm.
b) Reactia cu acetatul de plumb: saponozidele triterpenice reactioneaza cu acetatul de plumb 5% cand se formeaza un precipitat alb.
c) Reactia cu hidroxidul de bariu: saponozidele formeaza cu hidroxidul de bariu un precipitat alb .
Identificarea sterolilor sau a triterpenelor
Reactia Liebermann-Burchard:
Principiul metodei
Formarea unei coloratii violet sau verde (datorita formarii unui dimer) in prezenta H2SO4 concentrat si a anhidridei acetice.
Reactivi necesari:
H2SO4 concentrat
anhidrida acetica
Tehnica de lucru: din solutiile hidrolizate, extrase cu eter la palnia de separare, se iau 3-4 ml, se evapora la sicitate, pe baia de apa, iar reziduul se dizolva cu 1 -2 ml solutie anhidrida acetica; 0,5-1 ml servesc ca martor si restul se toarna cu grija peste un volum egal de H2SO4 concentrat. Aparitia culorii verde indica o reactie pozitiva .
Identificarea taninurilor
Taninurile sunt substante solide, amorfe. Combinatiile cu masa moleculara mica pot cristaliza, fiind incolore. Taninurile se dizolva in apa la cald, mai greu la rece, formand solutii coloidale (solubilitatea variaza cu gradul de condensare) in alcool, acetona, acetat de etil; sunt insolubile in eter, cloroform, benzen, eter de petrol, sulfura de carbon si in alti solventi organici apolari.
Au gust astringent, fiind lipsite de miros; au activitate optica si sunt higroscopice. Sunt absorbite de pulberea de piele, carbune, vata,
oxid de aluminiu, caolin. Acizii si sarurile minerale precipita taninurile din solutiile coloidale.
Fiind fenoli cu caracter reducator (reduc reactivii Tollens, Fehling si KMnO4, H2O2, I2), dau coloratii caracteristice cu sarurile de Fe (III): verde-negricios in cazul taninurilor catehice si albastru-negricios cand sunt prezente taninurile galice. Caracterul acid se datoreaza gruparilor -COOH si -OH fenolice libere.
Cu proteinele (substante amidice) formeaza combinatii macromoleculare tridimensionale, impermeabile si impenetrabile (se stabilesc punti de hidrogen cu gruparile polare ale proteinelor).
Principiul metodei
Se bazeaza pe proprietatea taninurilor de a determina coloratii albastre (taninuri galice) sau verzi (taninuri catehice) in prezenta sarurilor de Fe+3 . Pentru decelarea exacta a tipului de tanin existent se precipita taninurile catehice sub forma de flobafene (precipitat rosu) cu reactiv Styassny. Dupa separarea precipitatului, in filtrat se executa reactia cu Fe+3 in scopul identificarii taninurilor galice. O coloratie albastru-negricioasa indica o reactie pozitiva.
Reactivi necesari:
reactiv Styassny (amestec HC1 : CH2O
solutie FeCl3 1% sau alaun feric 1%
solutie de acetat de sodiu 10%
Tehnica de lucru: peste 2 ml solutie apoasa de adauga 0,5 ml solutie FeCl3 1%. Se formeaza o coloratie verde-bruna datorita prezentei taninurilor catehice. Separat se incalzeste la fierbere pe baia de apa, timp de 30 minute, o proba de 4 ml solutie apoasa si o cantitate echivalenta de reactiv Styassny. Se formeaza un precipitat rosu care se filtreaza prin hartie de filtru. Filtratul se neutralizeaza cu solutie de acetat de sodiu
10% si se adauga 2-4 picaturi solutie FeCl3 1%. Colorarea in albastru a solutiei indica prezenta taninurilor galice.
Rezultate si discutii
Rezultatele analizei solutiilor extractive: eterica, alcoolica si apoasa sunt cuprinse in tabelele nr. 1, 2 si3.
Tabelul nr.1 Analiza solutiei extractive eterice a produsului vegetal
Trigonellae coerulea herba
|
Nr. Crt |
Compus cautat |
R. de identificare |
Culoare |
Intensitatea coloratiei |
Rezultate |
|
Alcaloizi baza |
R. Mayer |
Precipitat galben |
Absent |
||
|
R. Bertrand |
Precipitat galben |
Absent |
|||
|
Carotenoide |
R. Carr Price |
Galben-brun |
Compus absent |
||
|
H2SO4 concentrat |
Brun |
Compus absent |
|||
|
HCl concentrat |
Brun |
Compus absent |
|||
|
Cumarine |
NaOH 10% in mediu alcoolic |
Galben |
Compus absent |
||
|
Emodoli |
R. Borntrager |
Galben |
Compus absent |
||
|
Flavone (agliconi) |
R. Shibata |
Galben intens |
Compusi prezenti |
||
|
R. cu NaOH |
Galben |
Compusi prezenti |
|||
|
R. cu AlCl3 |
Galben |
Compusi prezenti |
|||
|
Saponozide sterolice |
R. Lieberman |
Inel rosu |
Prezenta incerta |
Tabelul nr.2 Analiza solutiei extractive alcoolice a produsului vegetal
Trigonellae coerulea herba
|
Nr.crt |
Compus cautat |
Solutie extractiva analizata |
Reactie de identficare folosita |
Culoare obtinuta |
Intensitate |
Rezultate |
|
Proantociani |
solutie alcoolica |
HCl 10% |
portocaliu-rosu |
compusi prezenti |
||
|
Cumarine |
solutie alcoolica hidrolizata |
NaOh 10% in mediu alcoolic |
galben |
|
compusi absenti |
|
|
Flavonozide |
solutie alcoolica si alcoolica hidrolizata |
Shibata |
portocaliu |
compusi prezenti |
||
|
NaOH |
galben | |||||
|
AlCl3 |
galben | |||||
|
ODP-uri |
solutie alcoolica |
Arnow |
galben |
compusi absenti |
||
|
Oze si alti compusi reducatori |
solutie alcoolica si alcoolica hidrolizata |
Fehling |
precipitat caramiziu |
compusi prezenti |
||
|
Molish |
violet |
compusi prezenti |
||||
|
Saponozide sterolice |
solutie alcoolica si alcoolica hidrolizata |
Libermann-Burchard |
inel verde-brun |
compusi prezenti |
||
|
spumefiere |
spuma | |||||
|
acetat bazic de Pb |
precipitat alb | |||||
|
Ba(OH)2 |
precipitat alb |
|
Nr.crt |
Compus cautat |
Solutie extractiva analizata |
Reactie de identficare folosita |
Culoare obtinuta |
Intensitate |
Rezultate |
|
Taninuri |
solutie alcoolica |
R. Styassny |
Precipitat verde brun |
compusi prezenti |
||
|
FeCl3 |
Precipitat Verde negricios | |||||
|
Carotenoide |
solutie alcoolica |
Carr-Price |
galben-brun |
compusi absenti |
||
|
H2SO4 conc |
brun | |||||
|
HCl conc |
brun | |||||
|
Antociani |
solutie alcoolica si alcoolica hidrolizata |
NaOH 10% |
galben |
compusi absenti |
||
|
Aminoacizi |
solutie alcoolica |
R. cu ninhidrina |
Incolor |
compusi absenti |
Tabelul nr.3 Analiza solutiei extractive apoase pentru produsul vegetal
Trigonellae coerulea herba
|
Nr.crt |
Compus cautat |
Solutie extractiva analizata |
Reactia de identificare |
Culoare obtinuta |
Intensitate |
Rezultate |
|
Flavonozide |
Solutie apoasa si apoasa hidrolizata |
Shibata |
rosu |
compusi prezenti |
||
|
NaOH |
galben | |||||
|
AlCl3 |
galben | |||||
|
Poliholozide mixte |
Solutie apoasa |
pp.in alcool si colorare cu hematoxilina |
Pecipitat alb si dupa colorare rosu |
compusi prezenti |
||
|
Oze si compusi reducatori |
Solutie apoasa si apoasa hidrolizata |
Molish |
violet |
compusi prezenti |
||
|
Fehling |
pp.rosu caramiziu |
compusi prezenti |
||||
|
Saponozide sterolice |
Solutie apoasa si apoasa hidrolizata |
Liebermann-Burchard |
inel verzui |
compusi prezenti |
||
|
spumefiere |
spuma | |||||
|
acetat bazic de Pb |
pp.alb | |||||
|
Ba(OH)2 |
pp.alb | |||||
|
Taninuri |
Solutie apoasa |
FeCl3 |
precipitat verde brun |
Compusi prezenti |
||
|
ODP-uri |
Solutie apoasa |
Arnow |
galben |
compusi absenti |
Legenda: ++ reactie intens pozitiva
+ reactie pozitiva
- reactie negativa
Concluzii:
In urma examenului chimic calitativ al solutiilor extractive obtinute din produsul vegetal Trigonellae coerulea herba s-au identificat urmatorii compusi:
saponozide sterolice
flavone
proantocianozide
taninuri catehice
poliholozide
oze reducatoare
Determinarea puritatii
Dupa identificarea produselor vegetale prin metodele prezentate anterior urmeaza stabilirea puritatii acestora. Determinarea puritatii se face conform normelor prevazute de farmacopee, standarde, norme interne sau fise tehnice care prevad urmatoarele:
3.1. Determinarea impuritatilor din planta
Aceste impuritati pot fi constituite din parti ale altor organe ale plantei producatoare sau produse degradate.
Adeseori, la cu recoltarea diverselor organe de plante care constituie produsele vegetale sunt recoltate si alte organe care nu contin principii active.
Tot in aceasta categorie intra produsele alterate (atacate de boli, insecte) sau degradate (exemplu: frunze zdrobite, frunze brunificate etc).
Normele de calitate prevazute pentru fiecare produs vegetal se refera la anumite procentaje din aceste impuritati sau exclud prezenta lor.
3.2. Determinarea corpurilor straine
Aceleasi norme prevad sau exclud prezenta in produsele vegetale a unor corpuri straine (parti din alte plante, substante minerale, pamant, nisip etc).
Normele existente prevad prelevarea pentru determinarea impuritatilor si a corpurilor straine din produsele vegetale a urmatoarelor cantitati de probe de analizat:
pentru seminte si fructe foarte mici (mustar) 2-5 g
pentru alte seminte si fructe mici (anason, fenicul) 20
pentru produse vegetale fragmentate 50 g
pentru flori, frunze, ierburi, scoarte
Impuritatile din planta sau parti din alte plante si substante minerale (pamant, praf, nisip, pietricele), indicate in monografia produsului vegetal respectiv, se aleg cu o penseta, se cantaresc separat, iar rezultatele se exprima in procente la 100 g de produs.
Conditii de puritate conform FR.X:
impuritati din plante: samburi, resturi de frunze, cel mult 5%;
parti din alte plante: cel mult 0.5%;
substante minerale: nu se admit;
pierdere prin uscare: cel mult 12%;
cenusa: cel mult 8%.
Rezultate si discutii:
Produsul vegetal a fost recoltat de noi si nu a prezentat impuritati.
4.Verificarea calitatii
Determinarea calitatii produselor vegetale este o conditie absolut necesara pentru avizarea folosirii acestora in terapeutica sau ca materie prima in laboratoarele galenice sau in industria farmaceutica.
Stabilirea compozitiei chimice, sub aspect calitativ si cantitativ, a unui produs vegetal este precedata de efectuarea unor probe preliminare care prezinta valoare orientativa pentru investigatiile chimice ce urmeaza a fi aplicate.
Material si metode:
Ca material de studiu s-a folosit Trigonella coerulea herba, recoltat din orasul Alexandria, jud. Teleorman, uscat si pastrat in conditii de laborator.
Pentru a stabili calitatea s-au efectuat determinari preliminare (determinarea umiditatii) si dozarea principiilor active.
4.1. Determinari preliminare
Determinarea umiditatii
Gradul de umiditate al produselor vegetale trebuie sa se incadreze in anumite limite care permit asigurarea conservarii lor.[11]
Cantitatea de apa din produsele vegetale este influentata de gradul de uscare, de mediul ambiant si de compozitia chimica a acestora.
Metoda
Procedeele de determinare a continutului de apa din produsele vegetale sunt diferite: uscare la etuva, uscare la vid, uscare la exicator, antrenare cu solventi organici.
Dintre aceste procedee s-a ales uscarea la etuva.
Tehnica de lucru: intr-o fiola de cantarire adusa la greutate constanta prin incalzire la etuva, la aceeasi temperatura la care urmeaza sa se faca uscarea si racita la exicator, se introduc 3-5 grame din proba de analizat. Diametrul fiolei se alege astfel incat cantitatea de material vegetal luata in lucru sa nu formeze un strat mai gros de 5 mm. Fiola cu produsul vegetal se mentine 4 ore la etuva, la 105° C, se raceste la exicator si se cantareste. Se continua uscarea cate 60 minute, racirea in exicator si cantarirea pana la greutate constanta.
Rezultate si discutii
In urma aplicarii acestei metode am stabilit pentru produsele vegetale luate in studiu valori ale umiditatii cuprinse in intervalul de: 9-11%. Pentru produsele de tip frunza literatura de specialitate indica limitele 9-10%, iar pentru seminte 8-9%. Frunzele au prezentat umiditate 11%, iar semintele 9%.
5. Dozarea principiilor active
5.1. Dozarea flavonelor din frunze si seminte
Pentru determinarea cantitativa a flavonelor se pot utiliza:
metode fizico-chimice (colorimetrice, spectrofotometrice, densitometrice, HPLC);
biologice (masurarea rezistentei capilare pentru determinarea timpului de aparitie a petesiilor pe cobai sau testarea permeabilitatii capilare pe iepure, folosind metoda difuziei unui colorant inchis).
Metoda
Pentru aceasta determinare s-a folosit metoda spectrofotometrica bazata pe complexarea cu AICI3, elaborata de prof. D. Gr. Constantinescu si colab. (prevazuta si in FRX).
Au fost dozate flavonele din seminte si din frunzele plantei Trigonella coerulea, apoi rezultatele au fost studiate comparativ.
Principiul metodei
Consta in formarea de catre flavone care au grupe OH libere in pozitiile orto, para sau peri, extrase in solventi hidrofili, la tratare cu clorura de Al(III), de complecsi (chelati) cu o intensa coloratie galbena, colorimetrabila.
Reactivi si solventi necesari:
apa
metanol
solutie de clorura de aluminiu 2,5%
solutie de acetat de sodiu 10%
rutozid (s.r.)
Prepararea solutiei de analizat[28]:
1 g seminte, respectiv frunze de schinduf albastru se aduc intr-un balon cu dop rodat, se adauga 100 ml alcool 50 si se incalzeste la fierbere, pe baia electrica, la reflux, timp de 30 minute. Solutia fierbinte se filtreaza prin vata intr-un balon cotat si dupa racire se completeaza la 100 ml, prin spalarea reziduului cu acelasi solvent (solutia A).
Tehnica de lucru:
10ml solutie A se dilueaza cu metanol (R) la 25 ml, intr-un balon cotat. Se agita timp de 2-3 min si se lasa in repaus timp de 10 minute. Se filtreaza si se indeparteaza primele portiuni de filtrat. La 5 ml filtrat se adauga 5 ml acetat de sodiu 100 g/l (R) si 3 ml clorura de aluminiu 25 g/l (R), se agita si se completeaza cu metanol (R) la 25 ml, intr-un balon cotat (solutia-proba).
Dupa 15 minute, daca este cazul, se completeaza din nou cu metanol (R) la 25 ml si se determina absorbanta solutiei la 430 nm, folosind ca lichid de compensare o solutie obtinuta in aceleasi conditii cu solutia proba, din 5 ml filtrat, 8 ml apa si metanol (R) la 25 ml, intr-un balon cotat. Citirea s-a efectuat la spectrofotometrul Cecil seies, in cuve de 1 cm.
Stabilirea curbei etalon pentru rutozid (s.r.)
Concentratia in flavonoide a probei de analizat se calculeaza cu ajutorul unei curbe etalon, stabilite in paralel si in aceleasi conditii cu solutia proba, luand in lucru: 1,0; 2,0; 3,0 si 4,0 ml solutie etalon de rutozida (s.r.) 0,1 g/l in metanol, 5 ml acetat de sodiu 100 g/l (R), 3 ml clorura de aluminiu 25 g/l (R) si metanol (R) la 25 ml, in fiecare balon cotat. S-a agitat fiecare proba, s-a lasat in repaus timp de 45 minute si s-a citit absorbanta la l 427 nm, in cuve de 1 cm, fata de martorii preparati in aceleasi conditii, dar inlocuind clorura de aluminiu cu metanol. Cu valorile absorbatelor si ale concentratiilor corespunzatoare, s-a trasat curba etalon.
Tabelul nr.4 Extinctiile solutiilor necesare pentru stabilirea curbei
etalon de rutozid
|
mg rutozid/ml |
E |
Rezultate si discutii
Continutul in flavone din probe a fost calculat prin interpolarea extinctiilor citite pe curba etalon a rutozidei si raportarea la 100 g produs
vegetal (substanta uscata) seminte, respectiv frunze. Astfel s-a determinat pentru seminte aproximativ aceeasi cantitate de flavone ca si in frunze.
In seminte s-a dozat o cantitate de 0.196 + 0.101 g% flavone exprimate in rutozid, iar in frunze s-au gasit 0.201 + 0.095 g% flavone. Statistic, nu se observa o diferenta semnificativa intre seminte si frunze.
|
Proba |
Flavone (g % rutozid) |
|
Trigonella coerulea semen | |
|
Trigonella coerulea folium |
5.2. Separarea si identificarea prin cromatografie in strat subtire a flavonelor din frunze si seminte
Cromatografia este o metoda moderna de separare a componentelor din amestecuri organice si anorganice, de identificare a unor substante, precum si de decelare si determinare a unor eventuale impuritati si produsi de degradare a medicamentelor.
Metodele cromatografice folosesc in principiu o faza stationara, constituita dintr-un suport solid si o faza mobila (developant) constituita din unul sau mai multi solventi.
In functie de materialul utilizat pentru separare exista:
cromatografie pe strat subtire
cromatografie pe hartie
cromatografie pe gaze
cromatografie pe lichide sub presiune
Cromatografia pe strat subtire se bazeaza pe distributia diferita a componentilor unui amestec intre doua faze, dintre care una stationara constituita din cromatoplaca cu strat absorbant si una mobila constituita din solvent sau amestecul de solventi ce se developeaza pe cromatoplaca.
Absorbantii (siligel G, oxid de aluminiu, silicat de magneziu, kieselgur, poliamida, safadex) si eventualii lianti (gips, amidon, carboximetil celuloza, agar) trebuie sa aiba o anumita finete a particulelor si sa indeplineasca conditiile de puritate pentru cromatografie.
Se are in vedere urmatoarea succesiune de operatii:
prepararea solutiilor de analizat
pregatirea cromatoplacii
aplicarea spoturilor
developarea
relevarea
calcularea Rf-urilor si identificarea spoturilor
Prepararea solutiei de analizat
Am analizat solutia extractiva in metanol.
Ca material de studiu s-a folosit semintele si frunzele speciei Trigonella coerulea, recoltate din orasul Alexandria, jud. Teleorman, in perioada iulie 2007, uscate la temperatura camerei si pastrate in conditii de laborator.
S-au realizat 2 solutii concentrate, din frunze, respectiv seminte. S-au refluxat pe baia electrica, timp de 10 min.
Pregatirea cromatoplacii
S-au utilizat placi de silicagel 60 F254, Merck (20 x 20 cm), gata preparate. Aceste placi au fost activate prin mentinere timp de 1 ora, la etuva, la 105° C.
Aplicarea spoturilor
Se face cu ajutorul unei micropipete, linia de start fiind situata la 2 cm de marginea placii. Distanta dintre punctele de start trebuie sa fie de cel putin 1,5 cm, iar cea dintre punctele marginale si latura placii de 2 cm.
Dupa filtrarea solutiilor extractive, se aplica spoturile in banda.
Developarea
S-au folosit ca developant sistemul: acetat de etil: acid formic anhidru : apa = 80 : 8 : 12.
Developantul se prepara prin amestecarea solventilor mentionati in cantitatile corespunzatoare intr-o palnie de separare, se lasa in repaus cateva minute si apoi se introduce in bacul de cromatografie. Inaltimea lichidului nu trebuie sa depaseasca 1 cm. Se inchide etans si se lasa cel putin 30 de minute pentru saturarea camerei cu vapori de solvent.
Placile cromatografice pregatite se introduc in pozitie verticala. Se delimiteaza linia de start si frontul solventului, iar placa se lasa sa se usuce.
Pentru identificarea flavonelor s-a folosit ca revelator difenilboril oxietilamina-solutie alcoolica 1%. Placile sunt examinate in vizibil si apoi pulverizate omogen cu solutie de difenilboril oxietilamina si examinate la lumina UV (lampa Comag).
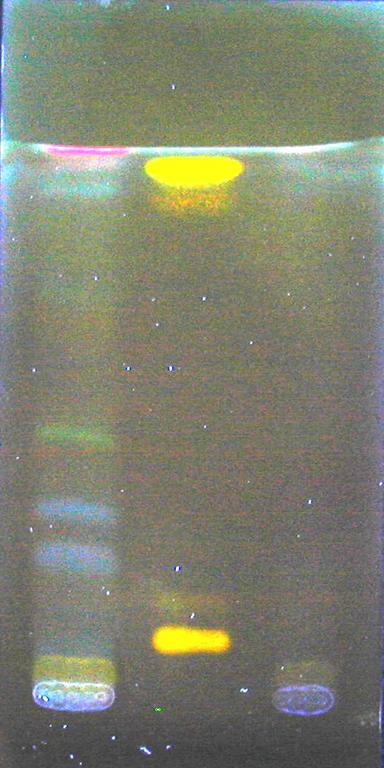
Fig.nr. 46. CSS flavone, UV 366 nm
Tabelul nr.5. Separarea cromatografica a flavonelor din produsul vegetal Trigonella coerulea
|
Proba |
Rf |
DFBOEA 366 nm |
DFBOEA vizibil |
Observatii |
|
Proba I: solutia etalon de quercutol si rutozida |
Galben |
Galben |
Quercetol |
|
|
Galben |
Galben |
Rutozida |
||
|
Proba II: solutie extractiva frunze |
Galben-verzui |
Posibil flavona |
||
|
albastru |
Derivati fenil-propanici |
|||
|
albastru |
Derivti fenil-propanici |
|||
|
Verde |
Galben |
Flavona |
||
|
Brun-portocaliu |
Flavona (?) |
|||
|
Brun-portocaliu |
Flavona (?) |
|||
|
Albastru |
Derivati fenil-propanici |
|||
|
Albastru |
Derivati fenil-propanici |
|||
|
Rosu |
Clorofila |
|||
|
Proba III: solutie extractiva seminte |
Galben-verzui |
Flavona |
||
|
Brun-portocaliu |
Flavona (?) |
|||
|
Albastru |
Derivati fenil-propanici |
Concluzii:
In urma realizarii cromatografiei in strat subtire, s-au identificat
In proba I: flavona la Rf= 0,50, derivati fenil propanici la Rf= 0,32; 0,37; 0,90; 0,98, posibile flavone la Rf= 0,68; 0,72 si clorofila la Rf=1.
In proba II: s-a identificat etalonul de quercetol la Rf= 0,98 si etalonul de rutozida la Rf= 0,16.
In proba III: flavona la Rf= 0,14, posibil flavona la Rf= 0,87 si derivati fenil propanici la Rf= 0,98.
6. Testarea Fitobiologica
Materialul biologic pe care am efectuat cercetarile a fost constituit din radacini embrionare de grau (Triticum vulgare Mill, soiul Dropia, Gramineae, provenit de la ICCPT Fundulea).
Testarea actiunii diferitelor fractiuni obtinute din Trigonella coerulea, asupra alungirii radiculare si asupra filmului mitotic al celulei vegetale, s-a realizat prin metoda profesorului D. Gr. Constantinescu (metoda fitobiologica - testul Triticum).
Principiul metodei consta in determinarea dilutiei maxime active a substantei studiate care, in functie de durata de actiune, influenteaza alungirea radiculara si filmul cariochinetic.
Pentru testari s-au utilizat mai multe solutii,de concentratii diferite.
1.Pregatirea solutiilor de analizat
o solutia extractiva apoasa 2%, rezultata prin refluxarea produsului uscat (seminte) cu apa (proba S).
o solutia extractiva apoasa 2%, rezultata prin refluxarea produsului uscat cu apa (frunze) (proba F).
Pentru a observa influenta concentratiei asupra alungirii radiculare si mitozei, din fiecare solutie au fost obtinute mai multe dilutii, folosind volume diferite din solutia de testat si completand la 15 ml, cu apa distilata.[10]
Tabelul nr.6 Concentratia probelor de analizat obtinute din frunze (F) si seminte (S)
|
Proba |
Vol sol de analizat (mL) |
Vol apa distilata (mL) |
Vol total |
C% |
|
M | ||||
|
F1 | ||||
|
F2 | ||||
|
F3 | ||||
|
F4 | ||||
|
F5 | ||||
|
F6 | ||||
|
S1 | ||||
|
S2 | ||||
|
S3 | ||||
|
S4 | ||||
|
S5 | ||||
|
S6 |
2.Germinarea semintelor
Cariopsele de grau, selectionate pentru a fi cat mai omogene, se imbiba cu apa distilata, timp de 24 de ore, la temperatura din laborator (18 - 25 °C), dupa care se pun la germinat in cutii Petri, cu diametrul de 15 - 20 cm, pe substrat de hartie de filtru umectata cu apa. Cand lungimea radacinilor principale atinge 1 cm, se introduc cate 8 cariopse germinate
intr-o cutie Petri care contine 15 ml solutie de testat si se pastreaza la temperatura camerei.
3.Evaluarea cresterii in lungime a radacinilor
Se foloseste tehnica masuratorilor lineare, apreciind alungirea radacinii principale din momentul initial al tratamentului, respectiv din prima zi, la intervale de 24 de ore, pe parcursul a 5 zile, considerand aceasta perioada drept faza cea mai activa de crestere. Rezultatele se exprima comparativ cu un martor M, unde s-a utilizat apa distilata in locul solutiei de cercetat. Se fac observatii asupra modificarilor morfologice: aspectul si numarul radicelelor, aspectul si lungimea epicotilului.
4. Obtinerea preparatelor microscopice
Examenul microscopic urmareste modificarile filmului mitotic induse in varfurile radiculare de Triticum vulgare. Observatiile s-au facut la 24 de ore de la introducerea cariopselor in solutia de cercetat. Studiul se face comparativ cu un martor (apa distilata) mentinut in aceleasi conditii cu probele. Radacinile embrionare de grau au fost sectionate la aproximativ 5 mm distanta de varf si colorate cu orceina acetica diluata, conform procedeului La Cour. Orceina este un colorant natural extras din licheni din genurile Rocella si Lecanora. Procedeul se bazeaza pe afinitatea mare pentru cromatina a orceinei in mediu acid (pH -ul acid este necesar pentru hidroliza materialului cromatic din meristeme, care apoi se coloreaza in rosu - violet).
Prepararea solutiei mama de orceina acetica[15]
Se incalzesc 100ml acid acetic glacial p.a. la temperatura de fierbere si se adauga 2,2 g orceina p.a., apoi se lasa 2 - 3 minute pe foc. Se raceste si se filtreaza. Se pastreaza la loc intunecos, in flacoane bine inchise.
Prepararea solutiei standard de orceina acetica 1 %
Se amesteca 45 parti solutia mama de orceina acetica cu 55 parti apa bidistilata.
Prin adaugarea unei parti de solutie HCl 1N la 10 parti solutie standard in momentul intrebuintarii, se obtine solutia diluata de orceina acetica, utilizata la colorare.
5.Colorarea meristemelor radiculare
Se folosesc creuzete mici de portelan, cu diametrul de 3 cm, in care se pipeteaza cate 1,5 ml solutia diluata de orceina acetica. Se sectioneaza varfurile radiculare de 5 mm si se introduc in aceasta solutie. Creuzetele se incalzesc 1-2 minute, pe sita de azbest, la bec de gaz, pana la degajarea primilor vapori de acid acetic. Se acopera si se lasa in repaus 10 minute - 2 ore. Varfurile radiculare astfel colorate se pun pe o lama de microscop, intr-o picatura de solutie diluata de orceina, se acopera cu o lamela si se preseaza pana la strivirea materialului de cercetat.
Preparatele se studiaza, folosind un microscop Labophot 2 Nikon, cu obiectivele 40x si 100x (in imersie de ulei de cedru).
Rezultate si discutii:
Alungirea radacinilor embrionare de Triticum vulgare, exprimata in cm, in functie de timpul de actiune exprimat in zile si de concentratia solutiei de testat este reprezentata in tabelele nr.5, nr. 6 si graficele din fig.46 si fig.47.
|
Nr. Crt. |
Proba |
24 h |
48 h |
72 h |
96 h |
120 h |
|
M | ||||||
|
S1 | ||||||
|
S2 | ||||||
|
S3 | ||||||
|
S4 | ||||||
|
S5 | ||||||
|
S6 |
Tabelul nr. 7 Cresterea radacinii principale (cm) (extract apos din seminte de schinduf)
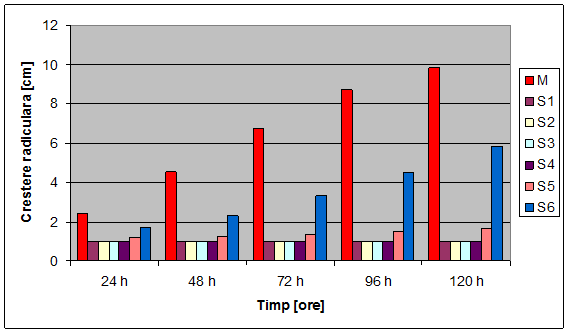
Fig. nr. 46 Cresterea radiculara (cm) (extract apos din seminte de schinduf)
|
Nr. Crt. |
Proba |
24 h |
48 h |
72 h |
96 h |
120 h |
|
M | ||||||
|
F1 | ||||||
|
F2 | ||||||
|
F3 | ||||||
|
F4 | ||||||
|
F5 | ||||||
|
F6 |
Tabelul nr. 8 Cresterea radacinii principale (cm) (extract apos din frunze de schinduf)
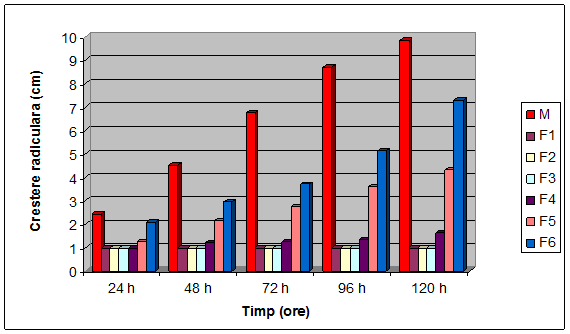
Fig. nr 47 Cresterea radiculara (cm) (extract apos din frunze de schinduf)

Fig. nr. 48 Aspectul plantulelor de grau mentinute 120 de ore in solutiile de testat obtinute din frunze de schinduf

Fig. nr 49. Aspectul plantulelor de grau mentinute 120 de ore in solutiile de testat obtinute din seminte de schinduf
Concluzii:
Prin efectuarea testului Triticum se observa ca a avut loc o inhibare totala a cresterii radiculare indusa de extractul apos din seminte la concentratii de 5.00-1.66% (S1-S ) si din frunze la concentratii de 5.00-2.50% (F -F ). La concentratii de 0.33-0.03% a extractului apos din seminte (S -S ) si la concentratiile 1.66-0.03% pentru extractul apos din frunze (F -F ) s-a inregistrat un efect moderat inhibitor.
Examinarea la microscop a meristemelor radiculare colorate cu orceina acetica
Rezultatele studiului influentei extractelor testate asupra alungirii radiculare, precum si modificarile macroscopice evidentiate de testul Triticum, au impus necesitatea efectuarii cercetarilor la nivel celular, prin examinare microscopica, conform tehnicii mentionate.
Pentru a putea interpreta modificarile filmului mitotic induse de solutiile testate, s-au observat mai intai fazele mitozei normale (la martor): interfaza, profaza, metafaza, anafaza, telofaza.
In interfaza nucleul celulelor meristematice este bine conturat, are aspect granulos, reticulat, se observa nucleolii; cromozomii nu sunt individualizati (cromatina este dispusa sub forma de retea).
In profaza carioteca si nucleolii nu se mai observa (se dezorganizeaza), se individualizeaza cromozomii (prin spiralizare si scurtarea filamentelor de cromatina), dar dispozitia lor este neregulata.
In metafaza se observa cromozomi bicromatidici, dispusi ordonat in zona ecuatoriala a fusului acromatic, formand placa metafazica (aspect monaster).
In anafaza cromozomii monocromatidici migreaza spre cei doi poli, ajungand la jumatatea distantei dintre ecuator si poli (aspect diaster)
In telofaza se formeaza nucleii fii (cromozomii monocromatidici ajunsi la poli se despiralizeaza, refac reteaua de filamente de cromatina, carioteca si nucleolii se reorganizeaza). La sfarsitul acestei faze se observa aparitia membranei despartitoare a celor doua celule fiice.
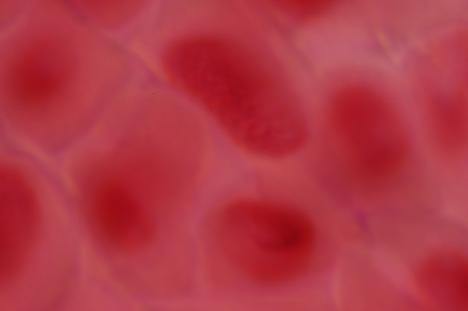
Fig.nr 50 Inhibarea mitozei
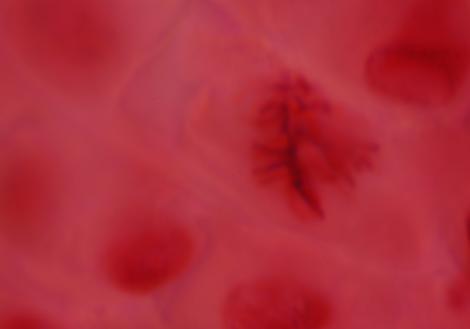
Fig.nr. 51 Metafaza in tropocineza
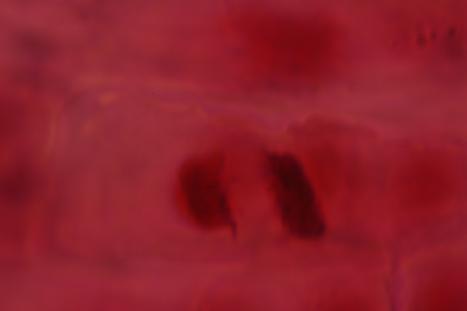
Fig.nr. 52 Telofaza in tropocineza
Rezultate:
La concentratii mari de 5% (S , F s-a observat un efect total inhibitor asupra mitozei celulare (fig.nr. 50).
La concentratii mai mici, 1.66-0.03% si 0.30-0.03% (F4-F6 si S5-S6) se observa un efect antimitotic mai slab, cu modificari in anafaza si telofaza (metafaza in tropocineza, telofaza in tropocineza: fig.nr 51, 52).
Stastistic nu se observa o diferenta a efectului antimitotic dintre semintele si frunzele de schinduf albastru.
Efectul mitoinhibitor al schindufului se explica prin compozitia sa chimica: cumarine, taninuri, saponozide.
Concluzii
In partea teoretica a lucrarii s-au prezentat datele din literatura de specialitate cu privire la speciile Trigonella foenum-graecum si Trigonella coerulea.
Partea experimentala cuprinde analiza farmacognostica a produsului vegetal Trigonellae coerulea herba:
rezultatele obtinute in urma examenului macroscopic coincid cu cele din literatura de specialitate
examenul microscopic a evidentiat urmatoarele elemente anatomice caracteristice:
In frunza (preparat superficial): epiderma cu stomate anomocitice, celule epidermale cu striuri cuticulare, tesut asimilator palisadic, tesut lacunar, vase lemnoase de calibru mic (inelate si spiralate), par glandular pluricelular, sesil, aflat intr-o invaginatie a epidermei superioare, teci cristaligene, granule de oxalat de calciu, fascicul libero-lemnos colateral deschis cu periciclu colenchimatos in dreptul nervurii principale.
In floare (preparat superficial): papile, grauncioare de polen, endoteciu, teci cristaligene cu granule de oxalat de calciu.
In samanta (preparat superficial): macrosclereide specifice familiei Fabaceae.
Radacina (sectiune transversala) prezinta structura secundara: lemn si liber secundar, lemn si liber primar, razele medulare pluriseriate
sclerificate, celulele paranchimului lemnos sclerificate, suber, felogen si feloderm si celule cu mucilagii in scoarta.
Tulpina (sectiune transversala) prezinta structura secundara incompleta: lemn si liber primar, lemn si liber secundar, raze medulare sclerificate, colenchim angular subepidermal, pachete de fibre slerificate.
Frunza (sectiune transversala) prezinta structura heterogen asimetrica, cu epiderma cu cuticula, tesut palisadic asimilator, tesut lacunar, fascicul libero-lemnos colateral deschis cu periciclu colenchimatos in dreptul nervurii principale, epiderma inferioara cu stomate anomocitice.
La determinarea calitatii am stabilit pentru produsul vegetal Trigonella coerulea valori ale umiditatii 9% pentru seminte si 11% pentru frunze.
In urma determinarii cantitative am obtinut:
Prin spectofotometrie: flavone exprimate in rutozid: 0,196g% pentru seminte si 0,201g% pentru frunze.
In urma realizarii cromatografiei in strat subtire, s-au identificat:
In proba I: flavona la Rf= 0,50, derivati fenil propanici la Rf= 0,32; 0,37; 0,90; 0,98, posibile flavone la Rf= 0,68; 0,72 si clorofila la Rf=1.
In proba II: s-a identificat etalonul de quercetol la Rf= 0,98 si etalonul de rutozida la Rf= 0,16.
In proba III: flavona la Rf= 0,14, posibil flavona la Rf= 0,87 si derivati fenil propanici la Rf= 0,98.
In urma efectuarii testului Triticum a fost pusa in evidenta actiunea inhibitoare asupra cresterii radiculare a cariopselor de grau, atat pentru solutia aposa din frunze, cat si pentru solutia apoasa din seminte. Prin observarea la microscop a preparatelor meristematice colorate cu orceina s-a evidentiat actiunea inhibitoare asupra diviziunii celulare.
Prin realizarea acestor determinari s-a ajuns la concluzia ca specia Trigonella coerulea, mai des intalnita la noi in tara, are compozitia chimica similara cu Trigonella foenum-graecum si poate fi folosita in terapeutica alaturi de aceasta.
Bibliografie
Bisset NG, Wichtl Max, Herbal Drugs and Phytopharmaceuticals, Medpharm Scientific Publishers, Stuttgart, 2001, pag. 203-205
Blamey M, Grey-Willson C, La Flore d'Europe Occidentale, Flammarion, Toulouse, 2003, pag. 214
Bojor Ovidiu, Popescu Octavian- Miracolele terapeutice ale plantelor, Ed. Edimpex-Speranta, Bucuresti, 1993, pag 118
Bruneton J, Pharmacognosie. Phytochimie. Plantes médicinales, Lavoisier Tec & Doc (3rd edition), Paris, 1999, pag. 105
Ciocarlan, V - Flora ilustrata a Romaniei, vol. V, Ed. Ceres, Bucuresti, 2000, pag. 365
Ciulei I, Istudor V, Palade M, Albulescu D, Gird C. E.- Analiza farmacognostica si fitochimica a produselor vegetale vol II, Ed. Tehnoplast Company, Bucuresti, 1995, pag. 311-313, 325-329, 409-424
Constantinescu D. Gr., Retezeanu M, Oteleanu R, Constantinescu M. - Die Phytobiologische Prüfung der cytostatischen Wirkung in der Chemotherapie des Krebses angevendeten Athylenimino- benzochinonen- (1,4), Die Pharmazie, 1963, pag. 18, 699
Constantinescu D. Gr., Hatieganu E.- Biologia moleculara a celulei vegetale, Ed. Medicala, 1983, pag 235-241
Cristea A. N. (sub redactia) - Tratat de farmacologie, Ed. Medicala, Bucuresti, 2006, pag 471, 596, 822, 823
Dinu M.- Contributii la studiul speciei Cuscuta campestris Yunck, in vederea stabilirii compozitiei chimice si fundamentarii actiunii citostatice- Teza doctorat, Bucuresti, 1997, pag. 134-139
Gird C. E., Dutu L. E., Popescu M. L., Pavel M.- Farmacognozie Baze practice, vol I, Ed. Universitara Carol Davila, Bucuresti, 2005, pag 9-16
Gird C. E., Dutu L. E., Popescu M. L., Pavel M.- Farmacognozie Baze practice, vol I, Ed. Universitara Carol Davila, Bucuresti, 2006, pag 274-278
Istudor, V.- Farmacognozie, fitochimie, fitoterapie, vol II, Ed. Medicala, Bucuresti 2001, pag 5-7
Istudor, V.- Farmacognozie, fitochimie, fitoterapie, vol III, Ed. Medicala, Bucuresti 2005, pag 312-313.
La Cour, L.- Acetic Orcein Stein Technique, 1941, vol.16, pag 169
Mihele D.- Nutritie, dietoterapie si compozitia alimentelor, Ed. Multi Press International, Bucuresti, 2004, pag 67-69, 109-112
Mocanu S., Raducanu D.- Plante medicinale- tezaur natural in terapeutica, Ed. Medicala, Bucuresti, 1986, pag 15
Palade M.- Botanica sistematica, vol I, editia II, Ed. Tehnica, Bucuresti, 1999, pag. 140-146
Palade M.- Botanica sistematica, vol II, Ed. Tehnica, Bucuresti, 1998, pag. 356
Palade M., Dinu M., Stamanichi M., Teodorescu C. D.- Botanica farmaceutica. Lucrari practice. Citologie, histologie, organografie, vol I, Ed. Tehnoplast Company , Bucuresti, 2001, pag 19-26
Palade M., Dinu M., Stamanichi M., Codreanu M., Pavel M. - Fitotaxonomie baze practice, Ed. Tehnoplast Company SRL, Bucuresti 2003, pag 85
Parvu, C.- Universul plantelor, Ed. Enciclopedica, editia II, Bucuresti, 1997, pag. 595, 596
Teuscher E, Anton R, Lobstein A- Plantes aromatiques Epices, aromates, condiments et huilles essentielles, Lavoisier Tec & Doc, Paris, 2005, pag. 243-247
Tita, I.- Botanica farmaceutica, Ed. Didactica si Pedagogica, R.A., Bucuresti, 2003, pag 693
Tudor I., Minoiu M.- Plante medicinale miraculoase din flora Romaniei, Ed. Artmed, Bucuresti, 2004, pag. 187-189
Valer B.- Enciclopedie de etnobotanica romaneasca, Ed. Stiintifica si enciclopedica, Bucuresti, 1979, pag. 211
Vasilca-Mozaceni, A.- Ghidul plantelor medicinale, Ed. Polirom, Iasi, 2003,pag.354-355
Wichtl M., Anton R.- Plantes thérapeutiques- tradition, pratique officinale, science et thérapeutique, 2e edition, Ed. Tec & Doc, Lavoisier, Paris, 1999, pag 105
XXX - Farmacopeea Romana editia a X-a, Ed. Medicala, Bucuresti, 1993, pag. 335, 1016
XXX - PDR for Herbal Medicines (3rd edition), Thomson, Montvale (NJ), 2004, 318-319
www.pubmed.com- Devasna T., Venugopal Menon P.- Fenugreek seeds modulate 1,2- dimethylhydrazine- induced hepatic oxidative stress during colon carcinogenesis- Ital J Biochem 2007 Mar, 56 (1): 28-34
www.pubmed.com- Rustenbeck I.- Unconventional antidiabetic agents Med Monatsschr Pharm. 2007 Apr. 30 (4): 131-7 Review German
www.pubmed.com- Laroubi A., Touhami M., FarouchL., Zrara I., Aboufatima R.- Prophylaxis effect of Trigonella foenum-graecum L. Seeds on renal stone formation in rats- Phytother 2007 June 20
www.bioterapii.ro/dictionar/index
https://www.uni-graz.at/~katzer/engl/Trig_foe.html
https://www.holistic-online.com/Herbal-Med/_Herbs/h56.html
https://www.viable-herbal.com/singles/herbs/s255html
www.entrezpubmed.com
Copyright © 2026 - Toate drepturile rezervate