 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
ASPECTE
Abstract
Recent studies of the genetic profiles of various tumors suggest the involvement of several genes during tumorigenesis. A case in point is colorectal cancer, perhaps the best studied cancer in terms of the putative sequence of genetic events in its pathogenesis.
Over the past 10 years, an impressive number of studies have been carried out identifying several molecular pathways involved in the development of colorectal cancer. One of these is characterized by allelic losses of tumor suppressor genes. The second group, called MSI (Microsatellite Instability) type, is characterized by genetic instability at microsatellite loci. In this review we discuss the development of colorectal cancer on the basis of molecular biology and the mechanisms that influence the occurence and the evolution of this type of cancer, like angiogenesis and apopthosis.
Key words: tumorigenesis, colorectal cancer, allelic losses, tumor suppressor genes, microsatellite instability
Rezumat
Studii recente asupra profilurilor genetice ale diferitelor tumori sugereaza implicarea a numeroase gee in procesul de tumorigeneza. Un exemplu este cancerul colorectal, probabil cel mai bine studiat, in ceea ce priveste secventa de evenimente genetice implicate in patogeneza sa.
În ultimii 10 ani, au fost desfasurate un numar impresionant de studii cu scopul de aidentifica caile moleculare implicate aparitia cancerului colorectal. Una dintre acestea este caracterizata prin pierderea de alele la nivelul genelor supresoare tumorale. Al doilea grup, numit MSI (instabilitate a microsatelitilor), se caracterizeaza prin instabilitate genetica la nivelul microsatelitilor. În aceasta lucrare, discutam dezvoltarea cancerului colorectal pe bazele biologiei moleculare si evaluam mecanismele implicate in aparitia si evolutia acestui tip de cancer, cum sunt apoptoza si angiogeneza.
Aproximativ 75% din pacientii cu cancer colorectal au o forma sporadica de boala, fara o legatura aparenta cu modificari genetice mostenite. Restul de 25% de pacienti au un istoric familial de cancer colorectal care sugereaza o contributie genetica, expunere frecventa la un factor cancerigen printre membrii familiei, sau o combinatie a acestor doi factori. Un studiu realizat pe gemeni, care a analizat contributia factorilor ereditari la aparitia cancerului colorectal, combinand date de la 44.788 perechi de gemeni din Suedia, Danemarca si Finlanda, a aratat prezenta unei contributii genetice in aparitia cancerului colorectal la aproximativ 35% din toate cazurile. Astfel, este evident ca mecanismul carcinogenezei este declansat atat de anumite modificari genetice, cat si de factori carcinogeni din mediu.
MECANISME GENETICE ALE CARCINOGENEZEI
În cancerul colorectal se disting doua tipuri de instabilitate genetica: instabilitatea cromozomiala (chromosomial instability pathway - CIP) si instabilitatea cauzata de schimbarea nucleotidelor de baza ale ADN-ului (microsatellite instability pathway - MIS). Instabilitatea cromozomiala rezulta din mutatia specifica a genelor care controleaza mitoza celulelor, diferentierea si apoptoza. Aproximativ 60-80% din cancerele colorectale sunt datorate instabilitatii cromozomiale, ca de exemplu cancerul sporadic colorectal si polipoza adenomatoasa familiala (familial adenomatous polyposis - FAP). Ca o cauza importanta a instabilitatii cromozomiale in cancerul colorectal a fost identificata CDC4.
Una din etapele initiale ale dezvoltarii adenomului si transformarea pe calea instabilitatii cromozomiale catre cancerul colorectal este inactivarea genei APC (adenomatous polyposis coli). În secventele moleculare mai intervin si alte gene supresoare tumorale: DCC, DPC4/Smad4, p53, nm32, dar si oncogene: k-ras, c-myc, cneu, c-erb-2, c-src. Aceasta cale este predominanta in cancerul colonului drept si cancerul rectal.
Cea de a doua forma de instabilitate, nepotrivirea (mismatch) nucleotidelor de baza ale ADN-ului se intalneste in 15% din cancerele colorectale sporadice. Mutatia se refera la deficiente in procesul de reparare al anumitor gene, cum este hMLH1 (human mut-L homologue). În cancerul colorectal nonpolipozic ereditar (hereditary nonpolyposis colorectal cancer- HNPCC) mutatiile se refera la genele hMLH1, hMSH2, hMSH6, pPMS1 si pPMS2.
![]()
Tabel. Principalele anomalii genetice corelate cu
|
Gena alterata |
Frecventa |
Functia normala |
Expresia clinica |
|
APC |
Supresor tumoral |
Mutatii corelate cu FAP si |
|
|
DCC (SMAD2/4)' |
Supresor tumoral |
Corelat cu boala avansata si prognostic prost. SMAD4 se asociaza cu polipoza juvenila. |
|
|
Src |
Oncogena |
Supraexpresia/mutatiile conduc la supraactivarea caii Akt/PI3K. |
|
|
MSH2, MSH6 MLH1, alte MMRsB |
15% cazuri sporadice, >95% HNPCC |
stabilitatea microsatelitilor |
Mutatii asociate cu HNPCC ( sdr. Lynch
syndrome). Tumori insotite de instabilitatea microsatelitilor
( |
|
TP53 (p53) |
Supresor tumoral |
Mutatitii asociate cu prognostic nefavorabil |
|
|
KRAS |
Oncogena |
Mutatiile supraexprimate conduc la resistenta la EGFR mAbs |
|
|
BRAF |
Oncogena |
Mutatiile conduc la rezistenta la EGFR mAbs |
|
|
|
Supresor tumoral |
Pierderea activitatii asociata cu raspuns slab la EGFR mAbs, se coreleaza cu sdr. Cowden. |
Abrevieri: APC- polipoza adenomatoasa colonica, CRC cancer colorectal; CT- chimioterapie, EGF-receptorul pentru factorul de crestere epidermal; FAP- polipoza adenomatoasa familiala, HNPCC- carcinomul colorectal familial nonpolipozic, mAbs- anticorpi monoclonali, MMR- reparare deficitara ; MSI- instabilitate a microsatelitilor. The Pharmacogenomics Journal (2009) 9,147 - 160 &2009
În nepotrivirea
nucleotidelor de baza ale ADN-ului sunt implicate ulterior si genele
supresoare tumorale TGFBR11 (transforming growth factor B receptor 11), IGF2R
(insulin-like growth factor 2 receptor) si gena pro-apoptotica
Rolul genei p53 este foarte complex, aceasta influentand functionarea genelor familiei bcl-2, care, la randul lor, influenteaza activitatea p53. Astfel, bcl-x poate inhiba apoptoza moderata de p53. În cancerul colorectal s-a semnalat frecvent inactivarea genei p53 alaturi de mutatiile altor gene, ca mutatiile genei k-ras. Mutatia k-ras apare inaintea formarii adenomului, in timp ce mutatia p 53 apare in timpul transformarii adenomului in carcinom. Experimental s-a aratat ca, daca in celulele de cancer de colon deficitar in gena p53 se transfera aceasta gena, se induce rapid apoptoza. Deci, apoptoza are rolul de a suprima transformarea maligna prin eliminarea celulelor cu leziuni genice.
Apoptoza realizata prin intermediul proteinei p53 inhiba carcinogeneza, mai ales in stadiile initiale, scazand potentialul neoplazic al celulelor. Deci, gena p53 este pro-apoptotica si antitumorala. Inhibitia apoptozei in epiteliul normal se soldeaza cu transformarea maligna a acestuia. De asemenea, s-a constatat ca activarea p53 creste sensibilitatea celulelor din cancerul colorectal la adriamicina si radioterapie. Studiul proteinei p53, alaturi de proteinele p21 si p27 poate fi utilizat in prognosticul cancerului colorectal, alaturi de criteriile stadiului clinic UICC.
Genele bcl, care au fost localizate in mitocondrie, in membrana nucleara si in reticulul endoplasmatic, mai ales la nivelul criptelor epiteliului colonului, sunt de asemenea implicate in controlul apoptozei. Cercetarile au aratat ca aceasta familie include numeroase gene: bcl-xs, bcl-xl, bcl-ws, bax, bak, BI1 si bcd. Unele dintre acestea inhiba apoptoza, ca bcl-2 si bcl-xl, iar altele promoveaza apoptoza, ca bax, bcl-xs, bak.
Principala
actiune a bcl-2 este blocarea apoptozei, favorizand proliferarea
maligna, deci este o oncogena. Bcl-2 si bcl-xl
impiedica eliberarea factorului inductor al apoptozei (
Activitatea antiapoptotica a bcl-2 si bcl-xl este suprimata de catre bax si bcl-xs. Prin cresterea nivelului genei bax de gena p53 se induce apoptoza in celulele tumorale, gena p53 avand rol de supresor al genei bcl-2. În adenocarcinomul colorectal, nivelul genei bcl-2 este crescut, mai ales in fazele de debut. Cresterea expresiei bcl-2 in tumora se asociaza cu prognostic prost si cu evolutie agresiva, comparativ cu tumorile colorectale carora le lipseste aceasta gena, dovedind importanta apoptozei in procesele tumorale. În adenocarcinomul de colon slab diferentiat apare un nivel crescut de bcl-x1.
Genele c-myc si proteinele codificate de acestea, c-myc, n-myc si l-myc, induc apoptoza, dar si cresterea tumorala. Genele c-myc promoveaza proliferarea celulara continua, fara ca celulele sa mai poata raspunde la stimulii care de obicei inhiba proliferarea. Prin inducerea proliferarii continue exista riscul transformarii maligne prin cresterea mutatiilor produse in ciclul celular. Apoptoza indusa de genele c-myc este inhibata de genele bcl-2, iar max este antagonista actiunii c-myc.
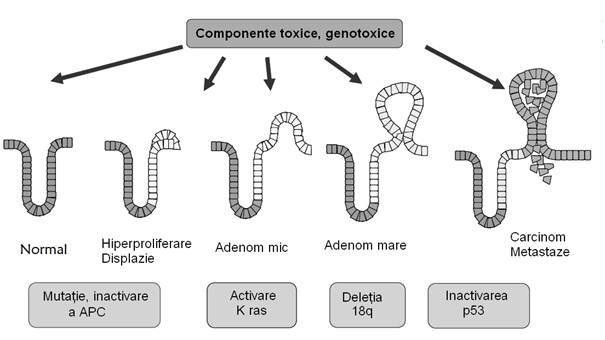
Figura. Formarea carcinomului colonic.
Adaptare dupa Gill si Rawland (Gill and Rawland 2002).
ROLUL APOPTOZEI
Apoptoza, sau moartea programata a celulelor, se intalneste in conditii normale in turnoverul celulelor, in homeostazia tesuturilor, in embriogeneza - in care exista programarea decesului anumitor celulele -, in inducerea si mentinerea tolerantei imunitare, in dezvoltarea sistemului nervos si in atrofia tesuturilor dependente endocrin.
Apoptoza a fost demonstrata ca existand normal in tractul gastrointestinal, in care exista un turnover rapid al celulelor din mucoasa si cripte. Epiteliul prezinta invaginatii adanci in peretele colic, numite cripte. Celulele epiteliului colic provin din celulele stem localizate la baza criptelor care migreaza la suprafata criptelor si sunt eliminate in lumen. Celulele stem se divid asimetric si sintetizeaza ADN, care, impreuna cu aceste celule migreaza catre cripte. Celulele stem raman in particular vulnerabile si dezvolta mutatii care pot evolua catre clone maligne. Contracararea acestei posibilitati se face printr-o mare inclinatie catre apoptoza a acestor celule dupa ce a fost lezat ADN-ul. Cunoasterea mecanismelor care declanseaza apoptoza dupa leziunile ADN poate fi folosita ca un important mijloc de preventie a cancerului.
Apoptoza, proces fiziologic, impreuna cu mitoza, constituie evenimente importante ale ciclului celular. Ciclul celular are patru faze: G1, S, G2 si M. Faza S este legata de replicarea ADN, iar faza M de diviziunea celulara, mitoza. În perioada dintre faza M si faza S, numita faza G1, se sintetizeaza ARN, are loc biosinteza proteinelor si a factorului de crestere ce asigura cresterea masei celulare. Perioada dintre faza S si faza M, numita faza G2, este folosita pentru aranjarea componentelor celulare necesare inainte de mitoza. Expunerea in faza G2 a celulelor cancerului colic la actiunea oxidului nitric se soldeaza cu programarea decesului celulelor. În acest proces, un rol important il au genele p53, bcl-2 si c-myc.
Moartea celulelor prin apoptoza are caractersitici morfologice si biochimice. Caracteristicile morfologice includ agregarea cromatinei, condensarea nucleului si a citoplasmei si scindarea in vezicule a citoplasmei si a nucleului, vezicule invelite in membrana intacta, numite "corpi apoptotici" ("apoptotic bodies") care contin ribozomi, mitocondrii intacte morfologic si material nuclear. Corpii apoptotici sunt recunoscuti si fagocitati rapid de macrofage sau de celulele epiteliale adiacente, neexistand un raspuns inflamator.
Din punct de vedere biochimic,
apoptoza presupune fragmentarea ADN prin activarea si interventia
enzimelor, cu consum energetic, procesul fiind dependent de ATP. Apoptoza
determina moartea unei singure celule, care este ulterior fragmentata
de celulele adiacente sau de macrofage, fara raspuns inflamator.
Celulele sistemului imun, celulele citotoxice T (
Posibilitatea evidentierii modificarilor morfologice apoptotice au aratat ca apoptoza este direct proportionala cu gradul de diferentiere histologica a tumorii. Studiile au evidentiat ca celulele cu modificari apoptotice apar langa zonele de necroza ale tumorii, acolo unde exista ischemie.
Numarul celulelor apoptotice raportate la un numar de 100 de celule tumorale nonapoptotice constituie indicele apoptotic. Cancerul colorectal cu un indice apoptotic mare se asociaza cu un prognostic mai bun in subgrupele cu expresia bcl-2, in timp ce un indice apoptotic mic este un factor de progostic negativ. Apoptoza este redusa in tumorile cu un grad de diferentiere scazut.
La pacientii cu cancer colorectal si cu indice apoptotic scazut, supravietuirea la cinci ani se reduce la jumatate fata de cei la care indicele apoptotic este mare. Modificarea raportului dintre proliferarea epiteliala si apoptoza in mucoasa colonului se insoteste de un risc crescut de malignizare. În cancerul colonului, expresia crescuta a CD44 comparativ cu mucoasa normala favorizeaza transformarea maligna prin rezistenta la apoptoza. Concomitent sunt inregistrate alterari ale caspazei 9, caspazei 3, a bcl-x1, bak, ceea ce dovedeste ca rezistenta la apoptoza are loc pe cale mitocondriala.
Celulele cu leziuni cromozomiale sau mutatii ale ADN-ului sunt eliminate prin apoptoza. Astfel, p53 detecteaza leziunile ADN-ului si initiaza repararea sau apoptoza, daca nu are loc corectarea defectiunii.
Apoptoza poate suprima transformarea maligna prin eliminarea celulelor cu leziuni in genom. S-a dovedit ca inhibarea apoptozei in epiteliul colorectal se soldeaza cu transformarea maligna a acestuia. Deci, apoptoza previne dezvoltarea anomaliilor genetice care se asociaza cu dezvoltarea celulelor neoplazice si progresia cancerului. Tumorile in care apoptoza este crescuta au o evolutie indelungata si sunt mai putin agresive.
Agresiunea cancerului se
asociaza cu metastazarea, ca rezultat al proliferarii celulelor tumorale.
Apoptoza este mai putin frecventa in tumorile colorectale cu
metastaze limfatice sau cu invazie venoasa. Activarea proteinkinazei G (
Daca in celulele tumorale cu deficit in p53, asociate cu o frecventa crescuta a cancerelor colorectale, se transfera aceasta gena, creste apoptoza si tumora regreseaza. Absenta proteinei p53 produsa de gena p53 face ca celulele tumorale in neoplasmul colorectal sa devina rezistente la chimioterapie si radioterapie.
Tumorile in care apoptoza are loc sunt mai sensibile la chimioterapie si au un prognostic mai bun. Prezenta p53 in celulele carcinomului colic le face mai sensibile la adriamicina si radioterapie si mai putin sensibile la 5-fluorouracil. În raspunsul la 5-fluorouracil, p53 raspunde mai bine la defectele ARN, decat la defectele ADN. Administrarea preoperatorie de 5'-deoxy-5-fluorouridine (5'-DFUR) induce apoptoza in cancerul colorectal.
Medicamentele antiinflamatorii nesteroide (NSAID - non-steroidal anti-inflammatory drugs) inhiba carcinogeneza colorectala prin inducerea apoptozei in celulele tumorale colorectale. Medicamentele anti-inflamatorii nesteroide previn cresterea polipilor colici inainte de malignizare.
O descoperire a ultimilor 15
ani in biologia cancerului colorectal se refera la rolul
ciclooxigenazelor,
Expresia proteinelor antiapoptotice bcl-2 sau bcl-xl, prezente in aproape jumatate din cancere, poate fi antagonizata prin receptorii agonisti, precum cel retinoid si vitamina D. Recentele descoperiri referitoare la rolul apoptozei sunt folosite pentru dezvoltarea de noi tinte terapeutice, mai ales referitoare la ciclooxigenaze, receptorii tanatogeni, membrii familiei bcl-2 si proteinele inhibitoare ale apoptozei.
În
celulele tumorale, activarea unor gene oncogene poate duce la cresterea
apoptozei. Modificarile morfologice si biochimice observate in
celulele apoptotice sunt mediate de familia cistein-aspartazelor sau a
caspazelor (cysteine protease cleaving an aspartic acid residue). Aceasta
familie de 14 caspaze este constituita din proenzime care, prin proces
proteolitic, genereaza forme active. Proenzimele caspazelor pot fi
activate de catre
caspazele 1, 4 si 5 intervin in maturarea citokinelor, a interleukinei 1-B si a interleukinei 18 si au functie proinflamatorie.
Alti membri ai acestei familii cu actiune apoptotica, fie ca initiaza acest proces, cum sunt caspazele 2, 8, 9 si 10, fie ca il executa, cum sunt caspazele 3, 6 si 7.
În timpul apoptozei, caspazele 3, 6 si 7 cliveaza proteinele localizate in membrana, nucleu si in citoplasma. Caspaza 9 este capabila de activitate autocatalitica si actioneaza asupra caspazelor efectoare 3 si 7. Caspazele efectoare sunt responsabile de modificarile morfologice ale apoptozei, cum este condensarea cromatinei, scindarea citoplasmei si a nucleului in vezicule invelite in membrana intacta, degradarea ADN-ului. Procaspaza 9, legata de APAF-1 (apoptotic protease activating factor 1), formeaza cu citocromul c un complex proteic, numit apoptosom. Procaspaza 9 se activeaza prin clivaj autocatalitic si activeaza caspaza 3, declansand "cascada caspazelor". Activarea caspazelor se face pe doua cai: calea extrinseca si calea intrinseca.
Calea extrinseca este legata
de existenta receptorilor celulari de suprafataa, receptorii
tanatogeni (death receptors), cum sunt: CD95, TNF si TRAIL-TNF (TNF
related apoptosis inducing ligand; ligand inductor al apoptozei legat de TNF).
CD95 sau Fas sau
Pe membrana celulara se afla receptorii pentru citokinele TNF. Alterarea expresiei Fas sau FasL este confirmata in diverse cancere si este importanta in cancerul colorectal. Cand receptorul Fas nu se cupleaza cu ligandul Fas-L, apoptoza este indusa de genele DCC (deleted in colorectal cancer), dar blocheaza apoptoza cand moleculele Natrin-1 sunt cuplate. Genele DCC sunt un supresor tumoral, iar daca apar mutatii ale acestora, se dezvolta cancerul colorectal. Genele DCC codifica si receptorul pentru molecula Natrin-1. Existenta FasL induce cresterea apoptozei la nivelul limfocitelor citotoxice in infiltratul din jurul tumorii colice. Receptorul CD95 (Fas) si membrii familiei proapoptotice bcl-2 participa la actiunea lactoferinei, glicoproteina legata de fier, si contribuie la supresia efectelor dezvoltarii tumorii de colon.
Calea intrinseca presupune
alterarea membranei plasmatice, eliberarea proteinelor mitocondriale, a
citocromului c si a factorului ce induce apoptoza (
![]()
CALEA INTRINSECA CALEA EXTRINSECA
![]()
Figura. Amplificarea reciproca a celor doua cai
Activarea caspazelor poate
induce apoptoza pe cai independente de p53. Disfunctiile mitocondriale
pot induce apoptoza celulelor cancerului colorectal prin activarea caspazei 8,
cunoscuta si sub numele de FLICE, MACH sau MACH 5. Caracteristica
biochimica a apoptozei este reprezentata de fragmentarea ADN-ului,
eveniment ireversibil care are loc inaintea permeabilizarii
membranei (fragmentare prelitica a ADN). Fragmentarea ADN rezulta din
activarea endogena a ionilor de calciu si de magneziu, care este
dependenta de endonucleaza nucleara. Aceasta enzima
cliveaza ADN-ul intre situsurile unitatilor nucleosomale
(linker
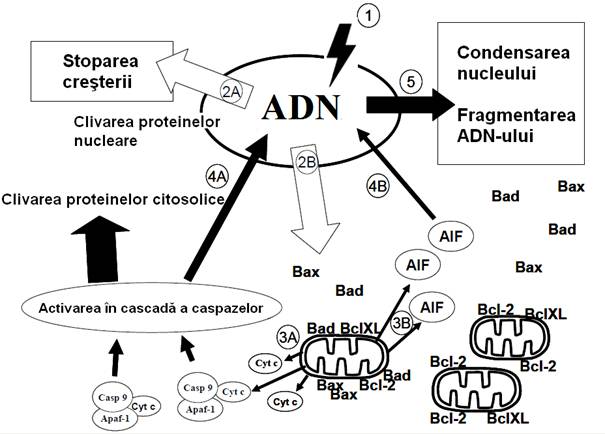
Figura. Mecanismul apoptozei.
Leziunile ADN (1) determina stoparea cresterii celulare (2A). Daca leziunile sunt severe, are loc activarea caii apoptotice intrinseci (2B), care implica eliberarea de proteine mitocondriale. În urma eliberarii de citocrom C (3A), aceasta proteina formeaza complexe cu caspaza-9 si Apaf-1 care determina activarea cascadei caspazelor, ce cliveaza multe proteine. Eliberarea unui factor inductor al apoptozei (AIF) din mitocondrii (3B) este urmata de translocarea sa in nucleu. Itrarea caspazelor (4A) si sau AIF (4B) in nucleu, determina condensarea si fragmentarea acestuia (5).
ASPECTE
Angiogeneza este esentiala pentru cresterea tumorala si pentru metastazare, densitatea microvasculara (MVD) fiind cunoscuta ca un factor de prognostic independent in numeroase entitati tumorale. MVD este un factor independent de varsta, sex, categoriile pT si pN. Supravietuirea generala la pacientii cu recediva tumorala este semnificativ mai scurta la cei cu densitate crescuta vasculara decat la cei cu densitate redusa.
Unul din factorii cei mai studiati cu importanta majora in angiogeneza din cancerul colo-rectal este factorul de crestere al endoteliului vascular (VEGF), o citochina multifunctionala al carui nivel este corelat cu stadiul tumoral progresia si metastazele tumorale. Concentratia VEGF in tesutul tumoral este semnificativ mai mare decat in mucoasa colica normala. Patternul de expresie al izoformelor este specific pentru transformarea de la adenom la carcinom in patologia colo-rectala.
VEGF find unul din cei mai bine caracterizati factori proangiogenici de crestere, multiple strategii au fost dezvoltate pentru a inhiba aceasta cale. Terapia anti-angiogenica acceptata astazi in cancerul colo-rectal utilizeaza combinatii care au ca tinta sistemul VEGF/VGFR asociat cu chimioterapia, scheme ce determina o crestere a supravietuirii pe termen mediu si lung.
Detectia si stadializarea angiogenezei in cancerul colorectal prin metode imagistice
Desi MRI reprezinta o tehnica imagistica recunoscuta pentru stadializarea cancerelor rectale, pana in prezent s-a acordat putina atentie utilizarii DCE-MRI pentru detectia si stadializarea bolii primare. Datele preliminare sugereaza ca CT de perfuzie poate imbunatati rata de detectie a cancerului la pacientii cu boala diverticulara. Pana la 30% din cacerele de colon coincid cu boala diverticulara, iar diferentierea acestora poate fi dificila pe bazele simptomelor si a CT morfologica. Parametrii vasculari, ca de exemplu, fluxul sangvin, volumul circulant si permeabilitatea, s-au dovedit diferite la pacientii cu cancer colorectal fata de cei cu diverticulita acuta. Atat fluxul sangvin cat si volumul sangvin au o sensibilitate de 80% si o specificitate de 75%, respectiv 70% in diferentierea cancerelor de diverticulita acuta.
Aceasta sensibilitate si specificitate sunt superioare celor obtinute pe baza criteriilor CT morfologice. Totusi, aceste date au nevoie sa fie validate prin studii suplimentare. Evaluarea vascularizatiei tumorii primare prin CT de perfuzie s-ar putea dovedi importanta in ceea ce priveste prognosticul bolii. Debitul bazal mediu tumoral este substantial mai mic in cazul pacientilor care vor dezvolta metastaze dupa o interventie chirurgicala aparent curativa, decat la restul pacientilor (urmarire medie de 39 luni, Goh V, date nepublicate).
BIBLIOGRAFIE
Jemal A, Siegel R, Ward E, et al. Cancer sta-tistics, 2007. CA Cancer J Clin 2007;57:43-66.
Macdonald JS. Adjuvant therapy of colon can-cer. CA Cancer J Clin 1999;49:202-219.
Zhang ZG, Harstrick A, Rustum YM. Mod-ulation of fluoropyrimidines: role of dose and sched-ule of leucovorin administration. Semin Oncol1992;19(Suppl 3):1015.
De Gramont A, Bosset JF, Milan C, et al.Randomized trial comparing monthly low-doseleucovorin and fluorouracil bolus with bimonthly -dose leucovorin and fluorouracil bolus pluscontinuous infusion for advanced colorectal can-cer: a French intergroup study. J Clin Oncol 1997:808-815.
Petrelli N, Douglass HO Jr, Herrera L, et al.The
modulation of fluorouracil with leucovorinin metastatic colorectal carcinoma: a
prospective randomized phase
Hoff PM, Ansari R, Batist G, etal. Comparisonof oral
capecitabine versus intravenous fluorouracilplus leucovorin as
first-line treatment in 605 patients with metastatic colorectal cancer: results of a
ran-domized phase
Douillard JY, Cunningham D, Roth AD, etal. inotecan combined with fluorouracil comparedfluorouracil alone as first-line treatment formetastatic colorectal cancer: a multicentre ran-domised trial. Lancet 2000;355:1041-1047.
Rothenberg ML, Oza AM, Bigelow RH, etal.Superiority of
oxaliplatin and fluorouracil-leucov-compared with either therapy alone in
patients with progressive colorectal
cancer after irinotecan and fluorouracil-leucovorin:
interim results of aphase
Giacchetti S, Perpoint B, Zidani R, etal. PhaseII multicenter randomized trial of oxaliplatin addedto chronomodulated fluorouracil-leucovorin asfirst-line treatment of metastatic colorectal cancer.J Clin Oncol 2000;18:136-147.
Hickish T, Boni C, Navarro M, et al. FOL-
Saltz L, Rubin M, Hochster H, etal. Cetuximab(
Kabbinavar F, Hurwitz HI, Fehrenbacher L,etal. Phase II, randomized trial comparing beva-cizumab plus fluorouracil (FU)/leucovorin (LV) with FU/LV alone in patients with metastatic col-orectal cancer. J Clin Oncol 2003;21:60-65.
Greene FL, Page DL, Fleming ID, etal., eds.AJCC Cancer Staging Handbook. 6th ed. NewYork, NY: Springer; 2002.
Greene FL, Stewart AK, Norton HJ. A newTNM staging
strategy for node-positive (stage
Greene FL, Stewart AK, Norton HJ.
Newtumor-node-metastasis staging strategy for node-positive (stage
Meyerhardt JA, Mayer RJ. Systemic therapy forcolorectal cancer. N Engl J Med 2005;352:476-487.
O'Connell JB, Maggard MA, Ko CY. Coloncancer survival rates with the new American JointCommittee on Cancer sixth edition staging. J NatlCancer Inst 2004;96:1420-1425.
Compton C, Fenoglio-Preiser CM, PettigrewN, Fielding LP. American Joint Committee onCancer Prognostic Factors Consensus Conference:Colorectal Working Group. Cancer 2000;88:
Krasna MJ, Flancbaum L, Cody RP, et al.Vascular and neural invasion in colorectal carcinoma. Incidence and prognostic significance. Cancer 1988;61:1018-1023.
Hampel H, Frankel WL, Martin E, et al. Screening for the Lynch syndrome (hereditary non-polyposis colorectal cancer). N Engl J Med
Shibata D, Reale MA, Lavin P, etal. The DCC protein and prognosis in colorectal cancer. N Engl J Med 1996;335:1727-1732.
Hodgson DC, Zhang W, Zaslavsky AM, etal. Relation of hospital volume to colostomy rates and survival for patients with rectal cancer. J Natl Cancer Inst 2003;95:708-716.
Wanebo HJ, Rao B, Pinsky CM, et al. Preoperative carcinoembryonic antigen level as a prognostic indicator in colorectal cancer. N Engl J Med
Wolmark N, Fisher B, Wieand HS, etal. The prognostic significance of preoperative carcinoembryonic antigen levels in colorectal cancer. Results from NSABP (National Surgical Adjuvant Breast and Bowel Project) clinical trials. Ann Surg 1984;
Moertel CG, Fleming TR, Macdonald JS, etal. Intergroup study of fluorouracil plus levamisole as adjuvant therapy for stage II/Dukes'B2 colon cancer. J Clin Oncol 1995;13:2936-2943.
Gryfe R, Kim H, Hsieh ET, et al. Tumor microsatellite instability and clinical outcome in young patients with colorectal cancer. N Engl J Med 2000;342:69-77.
Watanabe T, Wu TT, Catalano PJ, et al. Molecular predictors of survival after adjuvant chemotherapy for colon cancer. N Engl J Med
Popat S, Houlston RS. A systematic review and meta-analysis of the relationship between chromosome 18q genotype, DCC status and colorectal cancer prognosis. Eur J Cancer 2005;41:
Swanson RS, Compton CC, Stewart AK, Bland KI. The prognosis of T3N0 colon cancer is dependent on the number of lymph nodes examined. Ann Surg Oncol 2003;10:65-71.
Le Voyer TE, Sigurdson ER, Hanlon AL, etal. Colon cancer survival is associated with increasing number of lymph nodes analyzed: a secondary survey
of intergroup trial
Berger AC, Sigurdson ER, LeVoyer T, et al. Colon cancer survival is associated with decreasing ratio of metastatic to examined lymph nodes. J Clin Oncol 2005;23:8706-8712.
Stocchi L, Nelson H, Sargent DJ, etal. Impact of surgical and pathologic variables in rectal cancer:a United States community and cooperative group report. J Clin Oncol 2001;19:3895-3902.
Tepper JE, O'Connell MJ, Niedzwiecki D,etal. Impact of number of nodes retrieved on outcome in patients with rectal cancer. J Clin Oncol
Compton CC, Greene FL. The staging of colorectal cancer: 2004 and beyond. CA Cancer J Clin
Heald RJ, Moran BJ, Ryall RD, etal. Rectal cancer: the Basingstoke experience of total mesorectal excision, 1978-1997. Arch Surg 1998;133:894-899.
Kapiteijn E, Marijnen CA, Nagtegaal ID, etal. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med 2001;345:638-646.
Schrag D, Cramer LD, Bach PB, etal. Influence of hospital procedure volume on outcomes following surgery for colon cancer. JAMA 2000;284:3028-3035.
Meyerhardt JA, Tepper JE, Niedzwiecki D, etal. Impact of hospital procedure volume on surgical operation and long-term outcomes in high-risk curatively resected rectal cancer: findings from the Intergroup 0114 Study. J Clin Oncol 2004;22:166-174.
Sobrero A, Guglielmi A, Grossi F, et al. Mechanism of action of fluoropyrimidines: relevance to the new developments in colorectal cancer chemotherapy. Semin Oncol 2000;27(Suppl
Higgins GA, Humphrey E, Juler G, et al. Adjuvant chemotherapy in the surgical treatment of large bowel cancer. Cancer 1976;38:1461-1467.
Higgins GA, Donaldson RC, Humphrey EW, et al. Adjuvant therapy for large bowel cancer: update of Veterans Administration Surgical Oncology Group Trials. Surg Clin North Am 1981;
Grossi CE, Wolff WI, Nealon TF Jr, et al. Intraluminal fluorouracil chemotherapy adjunct to surgical procedures for respectable carcinoma of the colon and rectum. Surg Gynecol Obstet 1977;
Grage TB, Moss SE. Adjuvant chemotherapy in cancer of the colon and rectum: demonstration of effectiveness of prolonged 5-FU chemotherapy in a prospectively controlled, randomized trial. Surg Clin North Am 1981;61:1321-1329.
Buyse M, Zeleniuch-Jacquotte A, Chalmers TC. Adjuvant therapy of colorectal cancer. Why we still don't know. JAMA 1988;259:3571-3578.
Taylor I, Machin D, Mullee M, etal. A randomized controlled trial of adjuvant portal vein cytotoxic perfusion in colorectal cancer. Br J Surg
Wereldsma JC, Bruggink ED, Meijer WS, etal. Adjuvant portal liver infusion in colorectal cancer with 5-fluorouracil/heparin versus urokinase versus control. Results of a prospective randomized clinical trial (colorectal adenocarcinoma trial I). Cancer 1990;65:425-432.
Beart RW Jr, Moertel CG, Wieand HS, etal. Adjuvant therapy for resectable colorectal carcinoma with fluorouracil administered by portal vein infusion. A study of the Mayo Clinic and the North Central Cancer Treatment Group. Arch Surg
Wolmark N, Rockette H, Wickerham DL, etal. Adjuvant therapy of Dukes'A, B, and C adenocarcinoma of the colon with portal-vein fluorouracil hepatic infusion: preliminary results of National Surgical Adjuvant Breast and Bowel Project Protocol C-02. J Clin Oncol 1990;8:1466-1475.
Fielding LP, Hittinger R, Grace RH, Fry JS. Randomised controlled trial of adjuvant chemotherapy by portal vein perfusion after curative resection for colorectal adenocarcinoma. Lancet 1992;
Long-term results of single course of adjuvant intraportal chemotherapy for colorectal cancer. Swiss Group for Clinical Cancer Research (SAKK). Lancet 1995;345:349-353.
Portal vein chemotherapy for colorectal cancer: a meta-analysis of 4000 patients in 10 studies. Liver Infusion Meta-analysis Group. J Natl Cancer Inst 1997;89:497-505.
Bedikian AY, Valdivieso M, Mavligit GM, etal. Sequential chemoimmunotherapy of colorectal cancer: evaluation of methotrexate, Baker's Antifol and levamisole. Cancer 1978;42:2169-2176.
Buroker TR, Moertel CG, Fleming TR, etal. A controlled evaluation of recent approaches to biochemical modulation or enhancement of 5-fluorouracil therapy in colorectal carcinoma. J Clin Oncol 1985;3:1624-1631.
Windle R, Bell PR, Shaw D. Five year results of a randomized trial of adjuvant 5-fluorouracil Adjuvant Treatment of Colorectal Cancer
Copyright © 2025 - Toate drepturile rezervate