 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
DISTILARE SI RECTIFICARE
1. Consideratii generale.
Distilarea este operatia de separare a componentilor unui amestec omogen de lichide, pe baza diferentei de volatilitate a acestora. Distilarea se realizeaza printr-o evaporare a componentilor ajunsi la temperatura de fierbere urmata de o condensarea vaporilor rezultati.
In urma unui ciclul de evaporare condensare se pot separa satisfacator componentii amestecului a caror temperaturi de fierbere, in conditii de presiune data sunt foarte departate. In acest mod se realizeaza distilarea simpla.
Separarea componentilor cu volatilitati apropiate se poate sigura corect printr-o succesiune de operatii de evaporare condensare repetate, operatia repetata purtand numele de rectificare
Prin distilare si rectificare se pot separa amestecuri de lichide care contin doi componenti ( amestecuri binare), trei componenti ( amestecuri tenare), amestecuri multicomponente , numarul si participare procentuala fiind definite sau amestecuri complexe la care numarul si participarea procentuala a acestora este nedefinita
![]() Compozitia fazelor amestecurilor
binare Faza lichidǎ Faza gazoasǎ
Compozitia fazelor amestecurilor
binare Faza lichidǎ Faza gazoasǎ
Fractie molara : ![]() x y
x y
Fractie de masa : ![]()
![]()
![]()
Concentratia molara
relativa : ![]() X Y
X Y
Concentratie de masa relativa :
![]()
![]()
![]()
Concentratie molara
volumica : ![]() cx cy
cx cy
Concentratia de masa
volumica : ![]()
![]()
![]()
LEGI DE BAZA SI ECUATII DE ECHILIBRU IN OPERATIA DE DISTILARE
1. Legea lui RAOULTpi = xi Pi, in care
pi - presiunea partiala a componentului in faza gaz ; Pi - presiunea de vapori a componentului pur la temperatura de fierbere a amestecului ; Ci - fractia molara a componentului in faza lichid ;
2. Legea lui DALTON : p = ![]()
pi =p.y ; p = presiunea totala a amestecului de gaze ideale ; yi = fractia molara in faza de vapori.
1.
Ecuatia de echilibru lichid - vapori: Yi = ![]()
4. Compozitia lichidului si a vaporilor la echilibru
![]() ;
; ![]() xi =
1; x2 = 1 - x1; y2 = 1-y1
xi =
1; x2 = 1 - x1; y2 = 1-y1
5. Volatilitatea unui component dintr-un amestec lichid
i = ![]() ; pentru amestec ideal i =
; pentru amestec ideal i = ![]() =
= ![]() =Pi
=Pi
6. Volatilitatea relativa: i = ![]() pentru un amestec binar ideal 1,2
pentru un amestec binar ideal 1,2 ![]()
![]()
![]()
Ecuatia lui Fensteke : y= ![]()
Aceste legi de baza si ecuatii de echilibru sunt exprimate pentru amestecuri ideale.
Pentru amestecuri binare poate fi descris si cu ajutorul diagramelor de faza cu ecuatiile:
1. Ecuatia generala f(p, T, x) = 0
Diagrama presiune - compozitie la T = const.
F(p,x)T =0
2. Diagrama temperatura compozitie ( diagrama de fierbere) la p = const.
F( T, x, Y)p= o
3. Diagrama presiune temperatura la compozitie constanta:
f(p,T)x=0
2. Diagrama Y- x ( diagaram de echilibru) la presiune totala constanta p pentru temperaturi cuprinse intre cele de fierbere ale componentilor puri T1, T2).
f(x,y)p=o pentru TI(T1, T2)
3. Diagrama entalpie - concentratie ( Ponchon)
Ecuatia generala: h= f(x,y); f (h'x) =0 ; f( h'',y) =0 ;
Amestecurile ideale prezinta caracteristicile :
presiunea de vapori este o functie liniara de compozitia molara;
la amestecarea componentelor nu apar efecte termice sau de volum
toate proprietatile sunt aditive
curbele de echilibru izolare sau izoterme determinate experimental prezinta o variatie unidirectionala ( fara maxime sau minime).
Presiunile de vapori si temperaturile de fierbere variaza in limitele componentelor puse in intervalul de concentratie.
Amestecuri neideale :
Majoritatea amestecurilor nu sunt ideale si nu se supun legii lui Raoult. Pentru adaptarea realtiilor de echilibru se introduce un factor de corectie:
Coeficientul de activitate ti cu care se inmulteste presiunea Pi astfel ca avem ecuatiile de echilibru:
- presiunea partiala a unui component dintr-un amestec de lichide pi = ti . Pi . xi
- compozitia lichidului care fierbe la
presiunea p: Xi = ![]()
compozitia vaporilor
componentului yi : Yi = ![]() . xi
. xi
- Volatibilitatea relativa: ![]()
Amestecuri nemiscibile
Intr-un amestec format din doua componente lichide nemescibile, fiecare component se comporta din punct de vedere al volatilitatii ca si cand nu s-ar gasi in amestec. Sistemul este alcatuit din doua componente si trei faze si prin urmare are un grad de libertate. Presiunea partiala a fiecarui component depinde numai de temperatura si deci este independenta de proportia celor doua componente. Temperatura de fierbere amestecului este inferioara temperaturii de fierbere a componentelor pure.
In tot timpul fierberii Ta ramane constanta pana la disparitia unui component din faza lichida.
In tot timpul fierberii compozitia vaporilor ramane constanta ( indiferent de compozitia amestecului lichid), valoarea sa rezultand din: P1 = P1 = py1; p2 = P2= py2
![]()
![]()
![]()
Amestecuri multiple si complexe
Relatiile de echilibru pentru aceste sisteme formate din mai multe componente cu participare procentuala multipla sunt definite prin constanta de echilibru (constanta de distributie) care reprezinta raportul dintre concentratiile componentului 'i' in cele doua faze de echilibru.
![]()
Conditiile de echilibru sunt determinate si de coeficientul de rectificare definit ca un raport al constantelor de echilibru a doua componente din amestec.
![]()
![]()
![]()
Pentru a putea separa un component din amestec este necesar ca sa avem k si w supraunitare.
2. Metode de distilare
2.1 Distilarea integrala (in echilibru)
Distilarea integrala este procesul in care vaporii, formati prin vaporizarea brusca a unui amestec lichid raman in contact cu lichidul. Operatia presupune supraincalzirea lichidului urmata de o expandare intr-un vas in care se realizeaza separarea fazelor lichid si vapori. In fig.1 se prezinta schema operatiei de distilare.
1 - schimbǎtor de cǎldurǎ;
2 - vas de detentǎ;
3 - condensator;
4 - pompǎ;
5 - alimentare cu amestec initial;
6 - evacuare reziduu;
7 - evacuare distilat;
|
|
Fig.1 Schema instalatiei de distilare integralǎ
Elemente de calcul pentru distilarea in echilibru :
![]() ;
; ![]() ;
; ![]()
in care:
F - debit molar de alimentare, [mol / s]; L - debit reziduu separat, [mol / s] V - debit vapori [mol / s]; XF - fractia molara a componentului volatil din amestecul de alim. X, y - concentratiile in echilibru a celor doua faze ; R - gradul molar de distilare.
2.2 Distilarea simplǎ sau diferentiala este operatia de vaporizare treptata la presiune constanta a unui amestec de lichide urmata de condensarea vaporilor pe masura ce se formeaza. Distilarea simpla se poate realiza discontinuu sau continuu.
In fig.2 este prezentata schema
unei instalatii de distilare simpla discontinua, in care
sarja introdusa in blaza 1 este incalzita cu aburi de o
serpentina iar distilatul va fi colectat pe fractiuni in vasele 3
dupa condensarea in racitorul 2. Distilarea simpla continua
se realizeaza prin alimentare continua cu amestec initial si
evacuarea continua a distilatului si a reziduului.
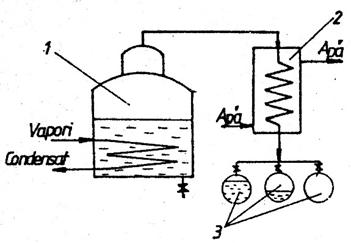
Fig.2 Schema instalatiei de distilare simplǎ discontinuǎ
Elemente de calcul pentru distilarea simpla discontinua
a) Date initiale de calcul
conditii initiale: concentratia (xi) si cantitatea (Li) amestecului; temperatura sau presiunea de fierbere
echilibrul lichid f (x,y)p =0
b) Elemente de calcul:
compozitia si cantitatea de distilat D, xD
compozitia si cantitatea de reziduu LF; xf
consumul de caldura
Ecuatia lui Raylegh
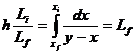
Li =D + Lf
Xi .Li =D.xD+Lf.xf;
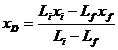
2.3. Antrenarea cu vapori, este operatia de distilare simpla in care vaporizarea amestecului de distilat se face prin introducerea directa in amestec a vaporilor de apa sau a unui gaz inert. Aceasta metoda se aplica pentru:
Separarea cantitatilor mici de substante volatile din cantitati mari de produs nevolatil;
Separarea componentilor nemiscibili cu punct de fierbere ridicat
Separarea unui produs instabil la temperaturi ridicate
In industria alimentara metoda este folosita la recuperarea solventului din miscela in faza finala, la dezodorizarea uleiului in faza de rafinare, in industria spirtului , la antrenarea unor componenti greu volatili etc.
Instalatia de separare a amestecurilor lichide prin antrenare cu vapori se compune din tr-un distilatorul care contine borhotul. Operatia consta in barbotarea aburului in masa amestecului, bulele de vapori la trecerea prin lichid se satureaza cu vaporii componentului de antrenat si impreuna trec printr-o conducta la condensator, in care fie ca are loc numai condensarea vaporilor de apa ( componentul de antrenat ramanand in stare de gaz) fie ca se condenseaza atat vaporii de apa cat si substanta antrenata, rezultand douǎ fae lichide care se separa prin stratificare intr-un decantor.
In esenta antrenarea cu vapori este o distilare simpla la care se adauga un al treilea component ca agent de antrenare.
Elemente de calcul la antrenare cu vapori in sistem continuu
1. Date de calcul
m - debitul de miscela, kg / h ;b1 - continut de benzina in miscela: 4%;
b2 - continut final de benzina in miscela: 0,2%;Masa moleculara a componentului greu M 220
Eficienta operatiei E =0,7
Regim de operare: presiunea totala p = 0,0054 M Pa (circa 40mg / H). se considera ca vaporii de benzina rezulta cu t = 102oC.
Masa moleculara medie a benzinei
MB 60 +
30tf + 0,001 ![]()
![]()
in care : tf - temperatura de fierbere oC
2. Marimi de calcul
debitul de ulei alimentat mu1 = ![]() [kg / u]
[kg / u]
debitul molar de component greu volatil la alimentare
![]() [kmol / h
[kmol / h
debitul molar de component usor volatil
(benzina) la evacuare A2 [kmol / h] ![]()
debit molar de component usor volatil la alimentare:
![]() [kmol / h]
[kmol / h]
in care: mb1 - debitul de benzina alimentata , kg / h
fractia
molara a benzinei initiale, xA : ![]()
componentul volatil din miscela: [moli / not. substanta nevolatila]
![]() la alimentare ;
la alimentare ; ![]() la evacuare
la evacuare
debit de abur necesar la antrenare V; [kmol / h];
![]()
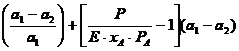 ; mV = V.MA
; mV = V.MA
![]()
PA - presiunea de vapori a benzinei la 1020C, MPa
2.4. Distilarea moleculara este o metoda de separare a substantelor, care nu suporta temperaturi mari , au o masa moleculara mare (pana la 1200) si se desfasoara in vid de 10-2 - 10-4 mm Hg. pentru ca drumul liber mediu al moleculelor depaseste distanta intre suprafata calda de evaporare si cea rece de condensare.
Distilarea moleculara este un proces pretentios, costisitor si nu permite obtinerea unor compusi puri la o singura operatie. Aceasta metoda este aplicata la obtinerea unor vitamine(A,D,E) acizi grasi, uleiuri vegetale, uleiuri volatile.
Principial un aparat de distilare moleculara este format din doua
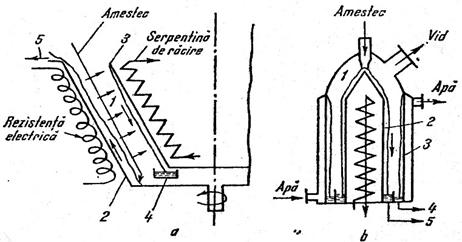
Fig.3 Principiul distilarii moleculare
a-aparat cu film ascendent, b - aparat cu film descendent
suprafete asezate concentric, din care una calda si una rece. Aparatele sunt construite in doua variante mai importante , dupa forma suprafetelor active :
primele avand forma cilindrica iar al doilea tip forma tronconica ( fig3 a). Spatiul 1 dintre cele doua suprafete , asezate concentric se conecteaza la o pompa de vid. Amestecul curge pe suprafata calda 2 , sub forma unui film subtire . Moleculele componentului mai volatil, evaporandu-sesi avand drumul liber mediu , mai mare decat distanta dintre cele doua suprafete, ajung la suprafata rece 3, unde condenseaza. Filmele de amestec si de condensat curg spre racordurile de evacuare, sub actiunea gravitatiei la paratele cu film descendent cu tobe cilindrice. (fig.3 b) si sub actiunea fortei centrifuge (ce actioneaza numai asupra amestecului) la cele tronconice ( fig.3a).
Lichidul rezultat prin condensarea vaporilor formeaza distilatul 4 iar cel ramas neevaporat rezidul 5.
CALCULUL APARATELOR DE DISTILARE
a) Bilantul de materiale
In majoritatea cazurilor in blaza se introduce abur saturat care barboteaza in plamada farmentata. Astfel se stabileste ecuatia de bilant total si partial:
F + Ab = D + W, [kg/h]
in care:
F - plamada (miscela) introdusa in blaza, kg
Ab - abur barbotat, kg
D - distilatul obtinut prin condensarea vaporilor, kg
W - reziduu (borhot la spirt; ulei brut - ind. ulei) in blaza, kg
Si ![]()
In faza lichida XF - concentratia compusilor usor volatili (% greutate) a plamezii initiale
XD - a distilatului obtinut
XW - a reziduului
b) Bilantul caloric se stabileste tinand seama de caracteristicile produselor care circula in coloana (sau in blaza)
Pentru coloana fara reflux
![]()
![]()
Pentru coloana cu reflux
![]()
R - reflux in coloana % (fata de distilatul D)
I'F - eutalpie plamezii la temperaturi de alimentare
I'F= CFtF [J / kg]
I'D - eutalpia vapori de component usor volatil j / kg
I'ab - eutalpia aburului saturat alimentat in coloana j / kg
I'D - eutalpia condensatului de component usor volatil la temperatura de condensare corespunzator deflegmatorului. J/ kg
I'W - eutalpia reziduului din coloana
c) Dimensionarea coloanelor
se considera amestecuri binare!
Diametrul coloanei: din relatia ![]() , m3 / s
, m3 / s
Unde W - viteza
medie ![]()
K - constanta ce depinde de compozitia vaporilor
![]() -densitatea lichidului (la
temperatura din coloana) ka / m3
-densitatea lichidului (la
temperatura din coloana) ka / m3
![]() - densitatea vaporilor
kg / m3
- densitatea vaporilor
kg / m3
Inaltimea coloanei: se stabileste cunoscand numarul de talere si distanta dintre ele.
|
Distanta Dintre talere (mm) |
Valori k |
|||
|
Inaltimea lichid deasupra clopote |
||||
|
12mm |
25mm |
50mm |
75mm |
|
|
150 300 450 600 750 |
0,006 - 0,012 0,027 - 0,033 0,045 0,056 0,060 |
0,021 - 0,027 0,043 0,053 0,056 |
0,015 - 0,021 0,037 0,049 0,055 |
0,027 0,048 0,053 |
La coloane confectionate din tronsoane se dau distante mici intre talere, nelasand loc pentru guri de vizitare.
La coloane dintr-un singur corp cilindric se vor lua distante mai mari intre talere pentru a se lasa loc pentru guri de vizitare.
3. RECTIFICAREA
Rectificarea sau fractionarea amestecurilor se realizeaza prin vaporizari si condensari succesive si repetate in aparate denumite coloane de rectificare.
Sectiunile in care se realizeaza procesul dublu de vaporizare - condensare sunt denumite trepte sau, constructiv, talere.
Coloanele de rectificare pot avea inaltimi diferite in functie de numarul de talere.
Pe fiecare taler se realizeaza concomitent vaporizarea componentului usor volatil din lichid, pe seama caldurii de condensare a vaporilor bogati in component greu volatil. Astfel pe fiecare taler vaporii se imbogatesc in component usor volatil iar lichidul in component greu volatil. La baza coloanei lichidul colectat formeaza reziduul iar produsul colectat la varful coloanei formeaza distilatul.
Elementele componente ale unei instalatii de rectificare sunt:
preincalzitorul pentru materia prima, de regula un schimbator de caldura multitubular, care recupereaza caldura de la reziduu, sau fractiunile de varf si de mijloc;
fierbatorul sau blaza, prevazut cu sistem de incalzire indirecta cu abur sau directa cu injectoare pentru combustibili lichizi sau gazosi;
coloana de rectificare, alcatuita din mai multe tronsoane cilindrice (talere), in fiecare circuland in contracurent, fazele lichide, respectiv vapori;
condensatorul sau deflegmatorul pentru condensarea fractiunilor de component greu volatil din vapori si care permite trecerea fara condensare a vaporilor ce vor forma distilatul;
condensatorul - racitor (racitorul final) pentru distilat;
vase colectoare pentru distilat si reziduu;
aparatura de masura, control si automatizare.
Lichidul in exces de pe fiecare taler deverseaza prin conducte la talerul inferior. Astfel pe intreaga inaltime a coloanei se realizeaza un curent de lichid care circula in contracurent cu vaporii si care formeaza refluxul intern.
Pentru ca vaporii care ies din coloana sa fie cat mai puri se introduce prin cadere libera sau prin pompare in varful coloanei o parte din lichidul obtinut in deflegmator sau in condensatorul pentru distilat, care formeaza refluxul extern.
Rectificarea se poate realiza:
la presiune atmosferica cand amestecul este lichid;
la presiune scazuta (rectificare in vid) pentru separarea amestecurilor cu punct de fierbere ridicat;
la presiuni ridicate, cand amestecul de distilat se afla in stare gazoasa la presiunea atmosferica.
Dupa modul de realizare a rectificarii se intalnesc procesele:
Rectificare discontinua, realizata pe sarje, care prezinta
dezavantajul unui consum suplimentar de caldura datorat
intermitentei operatiei. In figura se prezinta schema unei
instalatii de rectificare discontinue.
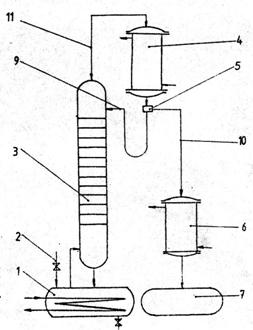
1 - blaza; 2 - racord alimentare materie primǎ; 3 - coloana de rectificare; 4 - condensator; 5 - distribuitor; 7 - vas collector pentru distilat; 8 - racord evacuare reziduu; 9 - reflux extern; 10 - distilat; 11 - vapori;
Fig. 4 Schema instalatiei de rectificare
periodicǎ
Rectificarea continua, este un proces care decurge in regim stationar. In instalatia prezentata schematic in figura 5, materia prima preincalzita pana la temperatura de fierbere se introduce in coloana pe unul din talere, pe care concentratia refluxului intern este egala cu a materiei prime, numi talerul de alimentare.
1 - alimentare cu amestec initial; 2 - preancǎlzitor; 3 - zona de epuizare din coloana de
rectificare; 4 - zona de concentrare; 5 - condensator; 6 - distribuitor; 7 - reflux extern; 8 - rǎcitor de disilat; 9 - vas colector distilat; 10 - vas colector reziduu;
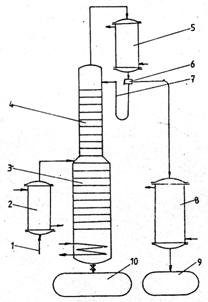
Fig. 4 Schema instalatiei de rectificare
continuǎ
Deasupra talerului de alimentare coloana prezinta portiunea de concentrare, iar sub acest nivel, portiunea e epuizare.Rectificarea continua a amestecurilor cu mai multi componenti nu se poate face intr-o singura coloana. In general daca amestecul are 'n' componenti, sunt necesare 'n-1' coloane de rectificare asezate in serie sau in paralel.
Clasificarea si descrierea coloanelor de rectificare
Din punct de vedere
constructiv, coloanele de rectificare se impart in coloane cu contact in trepte
si coloane cu contact diferential. Din cele cu contact in trepte fac
parte coloanele cu talere cu clopote si coloanele cu talere perforate (cu
sita), iar cele diferentiale sunt coloane cu umplutura, cu
talere rotative si cu film subtire. La coloanele cu contact in
trepte, vaporii barboteaza in lichid, iar la coloanele diferentiale
vaporii trec pe deasupra lichidului. Detaliul in coloane cu talere cu clopote este prezentatǎ in
figura 5 a.
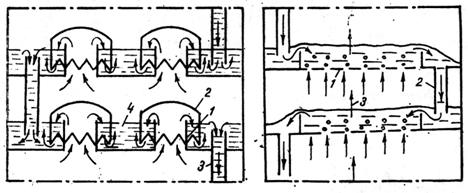
Fig.5 a) b)
1 - corpul coloanei; 2 - taler cu clopote; 3 - conducta de vapori ;4 - clopot ; 5 - teava de preaplin pentru circulatia lichidului.
Coloanele de rectificare cu talere cu clopote folosesc atat instalatii continue cat si discontinue. Pe toata inaltimea coloanei, in afara de blaza, sunt montate mai multe talere. Un taler se compune dintr-o serie de tuburi de vapori acoperite de un clopot cu margini crestate si unul cu mai multe tuburi deversoare care transmit lichidul dintr-un taler in altul. Vaporii de la un taler inferior intra prin tuburile de comunicatie cu interiorul clopotului de la talerul superior, barbotand lichidul, in care se va condensa componentul greu volatil si pe seama caldurii eliberate va evapora componentul usor volatil. Operatia se repeta pana la talerul superior. Tubul deversor are rolul de a mentine nivelul lichidului pe talere la cota dorita.
Coloane de rectificare cu talere perforate : au doar tuburi deversoare. Vaporii care urca de la talerul inferior prin orificiul talerului barboteaza lichidul, prezentate in fig 5 b. Viteza vaporilor trebuie sa atinga valori care sa nu permita scurgerea lichidului prin ochii talerului; faza lichidului poate trece doar prin tuburile deversoare. Coloanele cu talere perforate sunt mai simple constructiv, dar nu au siguranta in functionare, infundandu-se repede in cazul lichidului ce lasa depuneri.
Coloanele cu umplutura
Constau dintr-o coloana verticala prevazuta cu corpuri de umplere de tipul inelelor Raschig.
Inelele Raschig sunt cilindri cu diametru egal cu inaltimea (in general 10 50 mm) confectionati din tabla, portelan, folositi ca umplutura in coloane industriale de reactie; de rectificare sau de absorbtie. Sunt folosite pentru a mari suprafata de contact dintre coloana si lichid, vaporii sau gazele care circula in ac.
Inelele Raschig de portelan in care se includ diverse saruri sau catalizatori se pot folosi in camere de reactie in industria chimica sau industria alimentara. Sunt folosite si ca umplutura in filtre speciale pentru absorbtia prafului din gaze; in scrubbere etc.
Scrubberele sunt aparate de contact gaz - lichid, parcurse de ambele faze in flux continuu, servind fie la retinerea unor componenti ai gazului, fie la spalarea gazului de impuritati in suspensie ca pulberi sau picaturi, cu sau fara reactie chimica.
In coloanele de umplutura, lichidul, introdus la o anumita inaltime fata de blaza, curge pe suprafata umpluturii sub forma de filtru, in contracurent cu vaporii, contactul fazelor se face doar la suprafata filmului. Cu toate ca separarea este mai putin intensa ca si in cazul barbotarii, datorita suprafetelor de contact mai mari intre faze se asigura o compensare a performantei de rectificare.
coroziune.
In componenta coloanei de rectificare intra si blazele (fierbatoarele). Rolul lor este de a asigura sursa de caldura necesara incalzirii si evaporarii.
Distilarea extractiva (cu adaosuri auxiliare)
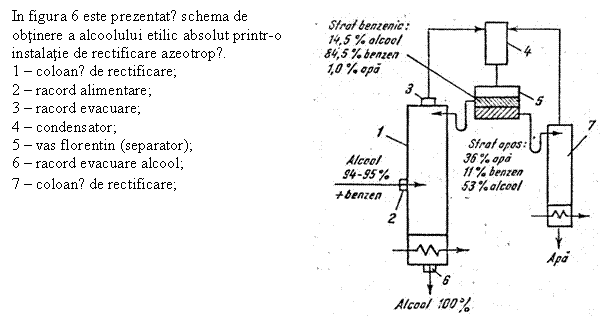
Fig. 6 Schema instalatiei de rectificare azeotropǎ pentru obtinerea alcoolului etilic absolut
Distilarea cu adaosuri auxiliare sau distilarea extractiva se aplica in cazul amestecurilor greu de separat prin distilare simpla, datorita diferentelor mai mici intre volatilitatea componentelor. Distilarea este extractiva cand componentul adaugat (dizolvantul) mareste de cateva ori volatilitatea relativa. In acest mod se obtine alcoolul etilic cu ajutorul benzenului: benzenul se introduce in coloanele de distilare impreuna cu alcoolul de 95 - 98% printr-un racord. Amestecul iese prin alt racord si trece in condensator, iar apoi in decantor, formand 2 straturi: unul apos si unul benzenic. Urmeaza evaluarea prin alt racord a alcoolului etilic 100%. In coloana se distila amestecul care formeaza stratul apos.
3.1. Rectificarea in coloane cu talere
Talerul teoretic. Metoda McCabe - Thiele de determinare a numarului de talere teoretice.
Talerul teoretic - unitate ideala de transfer pe care se realizeaza echilibrul termodinamic intre lichidul de se scurge de pe talerul superior si vaporii ce se ridica de pe talerul inferior.
Pe talerul 'n' pe care se mentine nivelul constant, se realizeaza contactul intre vaporii de compozitie (yn+1 cu tn+1) si lichidul de compozitie (xn-1 cu tn-1). Pentru ca tn+1 > tn-1, din fluxul de vapori va condensa componentul greu volatil si pe seama caldurii latente de condensare se va vaporiza o parte din componentul usor volatil, realizandu-se pe talerul 'n' vapori si lichid in echilibru, avand aceeasi temperatura > tn.
Un taler teoretic reprezinta mai multe talere reale construite, numarul lor fiind in functie de conditiile de operare.
Dimensionarea coloanelor se face prin 2 metode:
1. Metoda simplificata face abstractie de efectele termice de pe talere, avand la baza ipoteze:
caldurile molare latente de vaporizare ale componentelor sunt egale sau apropiate;
caldura de amestecare e neglijabila;
pierderi de caldura cu exteriorul, neglijabile;
temperatura amestecului de alimentare este egala cu temperatura de fierbere de pe talerul de alimentare;
vaporii rezultati la varful coloanei sunt condensati total fara subracire, astfel ca refluxul are temperatura egala cu temperatura vaporilor ce parasesc coloana.
Determinarea numarului de talere se bazeaza pe reprezentarea grafica a relatiei de echilibru si de bilant de materiale, de fapt a dreptelor de operare din cele 2 zone (de concentrare si de epuizare).
Procedeul:
se traseaza la scara curba de echilibru a amestecului binar ce trebuie separat.
Se fixeaza pe abscisa punctele Xw, XF, XD
Se traseaza linia de operare a zonei de concentrare
stiind ca aceasta intersecteaza diagonala in D, de abscisa
XD si are ordonata la origine: ![]()
![]() , unde R - cifra de
reflux ; D - debit de
distilat ; L - reflux ce are concentratia aceeasi cu distilatul.
, unde R - cifra de
reflux ; D - debit de
distilat ; L - reflux ce are concentratia aceeasi cu distilatul.
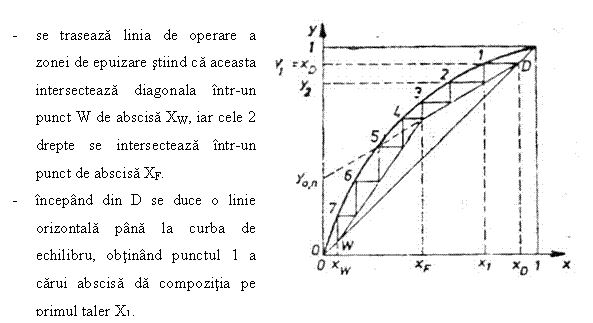
Fig.7 Metoda graficǎ McCabe-Thiele
Din 1 se coboara o verticala pana la linia de operare fixand punctul de coordonate (X2, Y2) care da compozitia fazelor intre primul si al doilea taler.
Se continua constructia in trepte in acest mod pana la depasirea punctului de abscisa X = XW.
Numarul punctelor de intersectie dintre liniile orizontale si curba de echilibru reprezinta numarul de talere teoretice ale coloanei 'n'. Numarul de talere real: nr = n / hT unde hT = (0,2 0,8) este randamentul total al coloanei.
Distanta intre talere variaza intre 0,1 0,6 in functie de parametrii hidrodinamici si proprietatile sistemelor de separat.
3.2.Tipuri de blaze - sunt prezentate in figura 8.
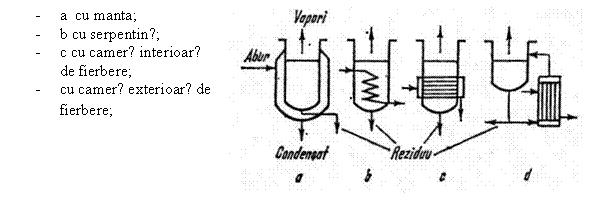
Fig.8 Tipuri de blaze
Copyright © 2024 - Toate drepturile rezervate