 | Aeronautica | Comunicatii | Constructii | Electronica | Navigatie | Pompieri |
| Tehnica mecanica |
VOLTAMETRIE CICLICA
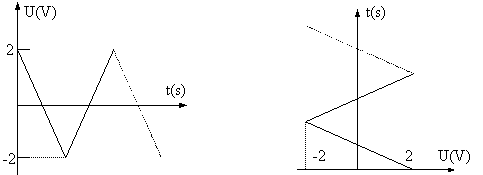
Intr-un
experiment de voltametrie ciclica, tensiunea aplicata la bornele
circuitului variaza intre doua potentiale, unul maxim pozitiv
si altul maxim negativ, cu un gradient de variatie constanta.
O variatie tipica de acest tip este ilustrata in Fig. 1 si Fig. 2:
Asa cum se poate obseva si
din figurile 1 si 2, este posibil ca variatia potentialului
intre valorile extreme ale acestuia sa se faca in mai mult de un
ciclu (doua sau mai multe cicluri). Acest lucru est util atunci cand se
aplica acest procedeu de voltametrie ciclica pentru a determina
prezenta speciilor chimice in reactii ireversibile.
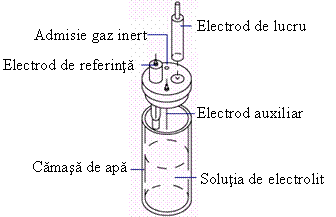
Celulele electrochimice folosite in voltametria ciclica (CV) au trei electrozi: electrodul de lucru, electrodul de referinta si electrodul auxiliar.
Speciile electroactive reactioneaza la suprafata electrodului de lucru. O seama de electrozi pot fi folositi pentru CV.
De
exemplu, un electrochimist va folosi un electrod de
platina sau un electrod sticlos de carbon intr-o solutie apoasa.
Electrozii cu film de mercur nu sunt utilizati prea mult, datorita
inconvenientului 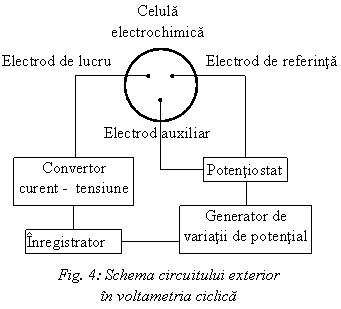 ca foarte usor se oxideaza
mercurul. Cei mai frecvent utilizati electrozi sunt electrodul standard de
calomel si electrodul de Ag/AgCl. Firul de
platina este cel mai utilizat electrod auxiliar. Electrodul auxiliar
furnizeaza suficient curent pentru electroliza. Un experiment de
voltametrie ciclica necesita o solutie libera de oxigen
daca potentialul folosit coboara sub potentialul de
reducere al oxigenului. Aceasta se realizeaza prin barbotarea unui gaz
inert in interiorul solutiei cu cateva minute inainte de efectuarea
experimentului. Uneori este de asemenea necesar ca sa se regleze
temperatura celulei de sticla prin circulatia unui flux de apa
prin camasa exterioara vasului cu solutia de analizat.
Cateva CV-uri necesita mai putin de 3 ml de solutie de
electrolit.
ca foarte usor se oxideaza
mercurul. Cei mai frecvent utilizati electrozi sunt electrodul standard de
calomel si electrodul de Ag/AgCl. Firul de
platina este cel mai utilizat electrod auxiliar. Electrodul auxiliar
furnizeaza suficient curent pentru electroliza. Un experiment de
voltametrie ciclica necesita o solutie libera de oxigen
daca potentialul folosit coboara sub potentialul de
reducere al oxigenului. Aceasta se realizeaza prin barbotarea unui gaz
inert in interiorul solutiei cu cateva minute inainte de efectuarea
experimentului. Uneori este de asemenea necesar ca sa se regleze
temperatura celulei de sticla prin circulatia unui flux de apa
prin camasa exterioara vasului cu solutia de analizat.
Cateva CV-uri necesita mai putin de 3 ml de solutie de
electrolit.
Un generator de oscilatii produce semnalul de potential aplicat. Semnalul intra in potentiostat, care aplica tensiunea intre electrodul de lucru si electrodul de referinta. Potentiostatul previne ca curentii mari sa treaca prin electrodul de referinta. Aceasta este foarte important, deoarece curentii mari produc o diferenta intre valoarea masurata si valoarea reala a electrodului de lucru. Electrozii auxiliar si de referinta sunt conectati la potentiostat in timp ce electrodul de lucru este conectat la convertorul de tensiune. Convertorul de tensiune converteste curentul masurat ce trece prin electrodul de lucru transformandu-l in tensiune, ce poate fi inregistrata. In Fig. 4 este redata schema unui astfel de circuit exterior celulei de voltametrie ciclica.
Fig. 5 arata reprezentarea unei voltamograme ciclice pentru o reactie reversibila de forma:
A
+ e- ![]() A- (1)
A- (1)
![]()
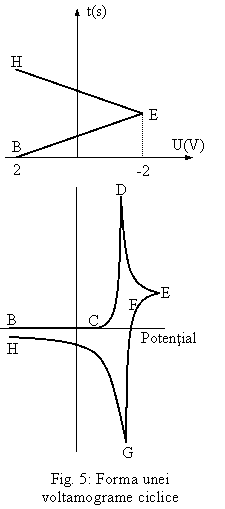 Din punctul de
potential initial B in punctul C, este un curent nul de raspuns,
deoarece tensiunea aplicata nu este suficient de negativa pentru a
reduce reactantul A. Curentul creste rapid dupa punctul C, punct in
care incepe reducerea lui A. Picul curentului atinge apoi valoarea sa
maxima in punctul D, cunoscut sub numele de pic catodic. Curentul
descreste intre D si E deoarece transportul speciilor electroactive catre electrodul de difuziune de
catre fenomenul de difuzie a golit de specii chimice de reactant A
vecinatatea electrodului. Dupa ce aplicarea potentialului
isi atinge valoarea maxima negativa, inca se mai reduc
molecule de reactant. Punctele de pe graficul tensiunii aplicate corespund cu
punctele de pe graficul voltagramei ciclice.
Din punctul de
potential initial B in punctul C, este un curent nul de raspuns,
deoarece tensiunea aplicata nu este suficient de negativa pentru a
reduce reactantul A. Curentul creste rapid dupa punctul C, punct in
care incepe reducerea lui A. Picul curentului atinge apoi valoarea sa
maxima in punctul D, cunoscut sub numele de pic catodic. Curentul
descreste intre D si E deoarece transportul speciilor electroactive catre electrodul de difuziune de
catre fenomenul de difuzie a golit de specii chimice de reactant A
vecinatatea electrodului. Dupa ce aplicarea potentialului
isi atinge valoarea maxima negativa, inca se mai reduc
molecule de reactant. Punctele de pe graficul tensiunii aplicate corespund cu
punctele de pe graficul voltagramei ciclice.
Difuzia este procesul de transfer al materiei de la un potential chimic ridicat la un potential chimic scazut datorita fortei cunoscuta sub numele de entropie. Deplasarea (difuzia) moleculelor in solutie este cauzata de coliziunea speciilor reduse cu moleculele de solvent. Un gradient de concentratie apare atunci cand concentratia speciilor variaza cu distanta.
Daca un potential se aplica la suprafata electrodului pentru a face ca sarcina electrodului sa fie negativa, atunci orice specie oxidata de interes (A) poate fi redusa pentru a forma (A-) daca aceasta intra in contact cu suprafata electrodului, conform reactiei (1).
![]()
 Totdeauna
va fi o concentratie ridicata a speciei reduse in vecinatatea
suprafetei electrodului. Odata cu scurgerea timpului,
concentratia speciei reduse de pe suprafata electrodului creste.
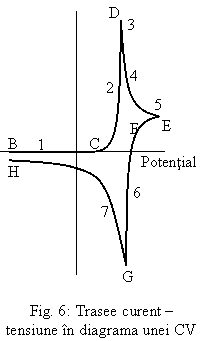
In Fig. 6 cu numere de la 1 la 7 sunt marcate traseele curent - tensiune intr-o
voltametrie ciclica. Acestea au urmatoarele semnificatii:
Totdeauna
va fi o concentratie ridicata a speciei reduse in vecinatatea
suprafetei electrodului. Odata cu scurgerea timpului,
concentratia speciei reduse de pe suprafata electrodului creste.
In Fig. 6 cu numere de la 1 la 7 sunt marcate traseele curent - tensiune intr-o
voltametrie ciclica. Acestea au urmatoarele semnificatii:
(1): concentratia speciei A este maxima datorita faptului ca tensiunea nu este suficient de negativa pentru a se produce reactia de reducere. Produsul A- este la concentratie 0.
(2): pe acest palier reducerea are loc deoarece tensiunea este suficient de negativa pentru a produce reducerea speciei A la A-; de retinut ca concentratia speciei A descreste in vecinatatea suprafetei electrodului deoarece este A este convertit in A-; produsul A- este generat la suprafata electrodului si concentratia sa ramane mica departe de electrod;
(3): specia A descreste in concentratie catre suprafata electrodului; de aceea, viitoare reduceri necesita difuzia lui A din masa de solutie catre suprafata electrodului.
(4): specia A este deja consumata in vecinatatea suprafetei electrodului; zona lipsita de A creste in grosime cat timp potentialul electrodului este suficient de negativ pentru a converti A la A-.
(5): in acest punct nu mai este curent anodic; tensiunea nu este destul de mare pentru a cauza oxidarea speciei A-; curentul catodic provine de la difuzia lui A catre electrod din masa de solutie si reducerea sa.
(6): de notat ca concentratia speciei A creste la suprafata electrodului si apoi descreste din nou inainte ca sa ajunga inapoi la valoarea sa maxima din masa de solutie; reactia de oxidare converteste pe A- inapoi la A, deoarece conversia lui A- la A abia a inceput, doar o portiune din zona saracita in A isi mareste concentratia.
(7): este portiunea pe care concentratiile speciilor A si A- incep sa revina la valorile initiale; acest fapt se petrece deoarece moleculele de produs sunt convertite inapoi in molecule de reactant la potentiale pozitive mult mai mari decat potentialele initiale pentru aceasta reactie.
O reactie electrochimica poate fi ireversibila la diferite viteze de variatie a potentialului aplicat. Daca viteza este mare, ea poate intra in competitie cu o reactie chimica omogena si astfel sa se previna consumarea speciei A‑ pentru formarea de B:
![]() (2)
(2)
In Fig. 7a este prezentata o voltamograma ciclica pentru o astfel de reactie, la o viteza de variatie mica (0.1V/s) iar in Fig. 7b este prezentata aceeasi reactie supusa voltametriei ciclice la o viteza mare (3.6V/s). Din alura curbelor se poate observa la viteza mare inhibarea procesului secundar nedorit A → B cu constanta de viteza de reactie komogen = 1:
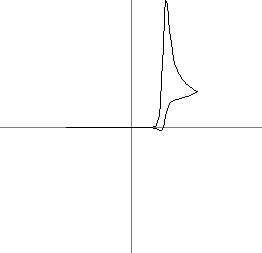
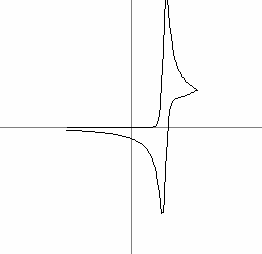
Fig. 7 (a si b): Voltamograme ciclice la diferite viteze de variatie a potentialului pentru (2) si (3)
Sunt situatii in care procesul cinetic controlat de potentialul aplicat la electrozi poate fi influentat si de alti factori.
Relatia care leaga curentul de sarcini de curentul de lucru si viteza de variatie a potentialului aplicat este data de relatia (3):
![]() , (3)
, (3)
unde ic este curentul de sarcini la descarcarea pe electrod, i curentul de lucru, = ΔV/Δt viteza de variatie a potentialului iar c concentratia speciei care se descarca la electrod. In Fig. 7 sunt reprezentate doua voltamograme ciclice pentru doua viteze diferite υa = 0.1V/s si υb = 3.5V/s.
Cand concentratia substantei de analizat este mica, un parametru foarte important de luat in considerare este contributia curentului de fond. Acest fond este compus dintr-un curent faradaic provocat de impuritatile din solutie si un curent nonfaradaic. Acesta din urma nu poate fi eliminat din experiment si rezulta din curentul de sarcini stabilit intre electrolit si electrod. In Fig. 7 a fost reprezentata aceasta influenta. Curentul faradaic produs de impuritatile din solutie este ilustrat calitativ in Fig. 8, pentru o viteza = 0.1V/s.
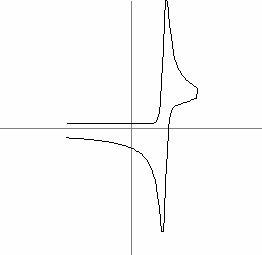
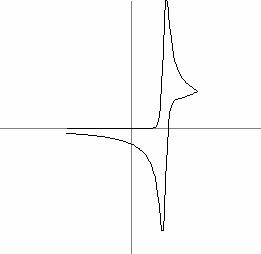
Fig. 8: Influenta impuritatilor asupra unei voltamograme ciclice: (a) cu, (b) fara impuritati
Simularea unei voltamograme ciclice
Pentru simularea unei voltamograme ciclice se va folosi un program software conceput in 1998 de un grup de cercetatori de la Universitatea Carolinei de Nord (pentru partea de algoritmica) si de la Universitatea din Massachusetts (pentru partea de implementare in Visual Basic).
Programul contine rutine pentru simularea reactiilor chimice reversibile de tipurile (4) si (5):
![]() (4)
(4)
![]() (5)
(5)
si a reactiilor chimice ireversibile de tipurile (6-9):
![]() (6)
(6)
![]() (7)
(7)
![]() (8)
(8)
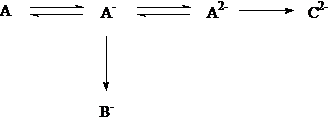 (9)
(9)
Mod de lucru
Se urmeaza pasii:
Se lanseaza programul in executie (Start/Programs/CyclicVoltSim);
Se intra in meniul aplicatiei;
Se acceseaza rutinele de simulare (Enter Cyclic VoltSim);
Pentru fiecare model (ecuatiile 4-9) se executa:
a. Se alege modelul (click pe icon-ul reactiei);
b. Se repeta:
i. Se aleg parametrii de semnal (fereastra de dialog afisata implicit);
ii. Se aleg parametrii celulei (click pe icon-ul signal options);
iii. Se ruleaza experimentul (click pe icon-ul Run Experiment);
c. Si se urmareste influenta parametrilor asupra voltamogramei ciclice;
d. Se noteaza concluziile referitoare la modelul ales;
Si se noteaza concluziile generale asupra simularii voltametriei ciclice.
Intrebari de verificare
Copyright © 2025 - Toate drepturile rezervate