 | Aeronautica | Comunicatii | Constructii | Electronica | Navigatie | Pompieri |
| Tehnica mecanica |
POSTULATELE LUI BOHR
Incercarile de perfectionare a modelului Bohr, facute in anii 1915-1925 au culminat cu construirea unei noi mecanici, mecanica cuantica, care sa imbratiseze toate fenomenele la scara atomica in mod unitar. Principala contributie a avut-o fizicianul A. Sommerfeld care a generalizat modul de cuantificare, incercand sa aplice modelul Bohr cazului mai general, de miscare pe orbite eliptice. In acest caz trebuia cuantificata miscarea care acum depindea de doua marimi variabile. Intr-o miscare circulara variaza doar pozitia electronului pe arcul de cerc, raza fiind constanta. In cazul miscarii electronului pe o orbita eliptica variaza atat pozitia electronului pe orbita (exprimata printr-o coordonata unghiulara (j)) cat si distanta electron-nucleu (r) (fig. de mai jos(2.9)). In figura sunt date toate distantele si punctele importante ale unei elipse. Elipsa din figura are o excentricitate e = 0,8.
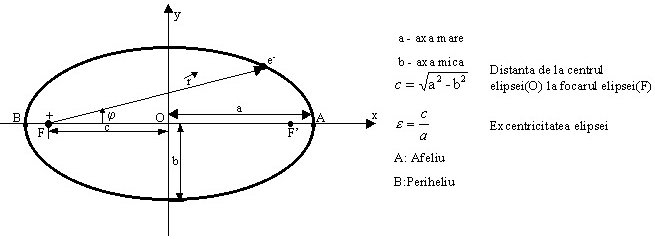
Mecanica arata ca in cazul miscarii pe o elipsa, centrul de forte (nucleul, Soarele) se gaseste nu in centrul elipsei (O), ci in unul din cele doua focare (F sau F'). Se spune de asemenea ca miscarea eliptica are doua grade de libertate. Sommerfeld a aratat ca la cuantificarea sistemelor cu mai multe grade de libertate vor aparea un numar corespunzator de numere cuantice. In conformitate cu regula de mai sus, se introduc doua numere cuantice nr si nf. Sommerfeld a calculat elementele geometrice ale orbitei eliptice (a, b,e) cat si energia orbitei (Wn) in functie de aceste numere cuantice, obtinand :
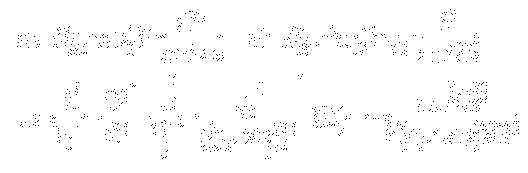
Concluziile ce rezulta de aici sunt urmatoarele:
1) energia pe traiectorie depinde doar de suma celor doua numere cuantice, din care motiv putem inlocui suma cu un nou numar cuantic
n = nr + nf
pe care introducandu-l in relatia de mai sus obtinem:
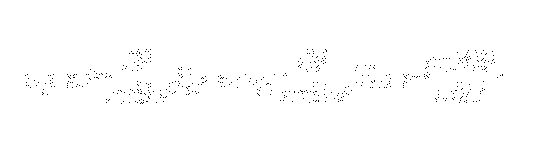 '*'
'*'
Introducerea lui n duce la obtinerea aceleiasi expresii pentru energie ca cea obtinuta de Bohr.
2) Forma traiectoriei eliptice depinde pe de alta parte de doua numere cuantice: nr si nf. Rezulta ca pentru o energie data a miscarii vor corespunde mai multe tipuri de traiectorii posibile. Cu alte cuvinte viteza, acceleratia, parametrii a si b ai orbitei pot sa difere fara ca energia totala a miscarii sa se modifice. Acest fenomen se numeste degenerare.
3) Din relatia ,,++' rezulta ca nf = n; n se numeste numar cuantic principal iar nf -numar cuantic azimutal. Prin definitie, numerele cuantice fiind intregi, rezulta ca nf poate lua valorile: nf = 1, 2, 3, 4, ., n. Valoarea nf = 0 se exclude, caci ea ar corespunde unei orbite cu b = 0, care ar presupune traversarea nucleului de catre electron, orbita eliptica transformandu-se intr-un segment de dreapta. Rezulta ca unei energii Wn , ii vor corespunde n orbite diferite, posibile, de miscare a electronului.
In tabelul de mai jos sunt exemplificate numeric o serie de orbite posibile, dandu-se parametrii corespuzatori. In figura V.2.10 sunt reprezentate grafic diversele orbite posibile, iar in fig. V.2.11 nivelele energetice posibile pentru atomul de hidogen pentru primele trei valori ale lui n.
|
N |
Wn |
nj |
a |
b |
Forma traiectoriei e |
Numarul de orbite |
|
|
|
a1 |
Cerc e=0 | |||
|
1/4W1 |
4 a1 |
a1 |
Elipsa e=0.96 | |||
|
4 a1 |
4a1 |
Cerc e=0 |
||||
|
1/9W1 |
9 a1 |
a1 |
Elipsa e=0.99 | |||
|
9 a1 |
4a1 |
Elipsa e=0.89 |
||||
|
9 a1 |
9a1 |
Cerc e=0 |
Din cauza rolului lor important in descrierea atomului, energia si raza (axa mare) primei orbite Bohr au fost folosite uneori ca unitate de energie si de lungime:
W = 2,1795 ? 10-18 J = 13,60 eV ; a1 = 5,2917 · 10-11m = 0,52917 L.
Miscarea pe o orbita eliptica se caracterizeaza si prin faptul ca viteza in lungul traiectoriei nu mai este constanta, ea fiind cu atat mai mare cu cat r se micsoreaza si inevrs. Deci viteza nu mai este cuantificata. Apare astfel ica o data in evidenta faptul ca, conditia de cuantificare nu se aplica lui r, f sau W, ci momentelor cinetice.
Dar Sommerfeld nu s-a oprit aici, ci a atacat problema si mai complicata, dar mai apropiata de realitate, a orbitelor atomice care pot avea diverse inclinatii in spatiu. Se stie ca miscarea eliptica (sau circulara) se petrece intr-un plan dat, fixat in spatiu (efect care in mecanica se numeste efect de giroscop). Dar asa cum a a considerat Sommerfeld, nu pare sa existe motive care sa impiedice orientari arbitrare ale planului orbital in spatiu. Altfel spus, electronul in miscarea lui pe orbita va trebui caracteriazat prin trei parametri (coordonate): r, j si a treia: q = unghiul pe care-l face normala la planul orbital cu o directie oarecare in spatiu, notata pentru concretizare cu Oz .
In conformitate cu cele spuse, electronul va poseda tei grade de libertate, deci vor trebui introduse trei numere cuantice, doua cunoscute (care nu se modifica) nr, , nj si un al treilea nq. Ce modificari aduce considerarea a trei numere cuantice? Sommerfeld a aratat ca energia va fi descrisa tot de relatia '*', in care insa numarul cuantic principal va fi:
n = nr + nj + nq
Degenerarea miscarii creste in acest fel, orbitele de diverse orientari spatiale avand aceeasi energie. Sa ne amintim ca momentul impulsului este un vector de marime | L| = r · mv, a carui directie este perpendiculara pe planul traiectoriei. Rezulta ca modificarea planului orbitei in spatiu va atrage modificarea proiectiei momentului pe directia Oz, aleasa fixa in spatiu. Marimea acestei proiectii este egala cu
Lz = |L| · cos q .
Deoarece momentul L este cuantificat, ne asteptam ca si Lz sa fie cuantificat, numarul cuantic corespunzator fiind nq :
Lz = nq · h => cos q = nq / n
Aceasta relatie, deosebit de importanta si de neasteptata, exprima cuantificarea spatiala, care arata ca sunt posibile numai anumite orientari spatiale pentru orbitele electronice. Deoarece |cos q|<= 1, rezulta pentru nq urmatoarele valori posibile:
nq = nj , nj - 1, ., 0, ., - nj +1, - nj,
deci 2 nj +1 valori. Este foarte important sa se remarce deosebirea intre numerele cuantice nr, nj , n pe de o parte si nq pe de alta parte: nq poate lua atat valori pozitive cat si negative.
Ultima problema pe care o vom discuta in acest context, este influenta variatiei masei cu viteza asupra miscarii electronului. Asupra orbitelor circulare, influenta variatiei masei cu viteza este destul de nesemnificativa, in sensul ca se produce o micsorare a razei orbitei ca urmare a cresterii masei cu viteza.
Daca luam cazul primei orbite Bohr, unde viteza este maxima raportul v / c= 0,73 × 10-2 si m / m0 are aproximativ valoarea 1, deci influenta este neglijabila. Daca insa luam in consideratie orbitele eliptice, atunci aceasta variatie aduce un efect nou, si anume, viteza va fi variabila pe traiectorie masa va varia pe traiectorie in mod coresponzator. Ea va duce la cresterea masei in B, ceea ce va determina o crestere a inertiei si ca urmare orbita urmatoare nu se va suprapune identic cu cea anterioara. Apare in acest fel o lenta deplasare in spatiu a axei mari a elipsei. Ca urmare a acestui efect, orbita nu va mai fi in realitate o elipsa ci un fel de rozeta. Fenomenul se numeste precesia periheliului. Cum diversele orbite se caracterizeaza prin diverse forme si precesia periheliului va fi diferita la ele. Inseamna ca o parte din energia miscarii se cheltuieste pe aceasta precesie fapt ce conduce la dependenta (foarte slaba) energiei orbitei, de forma ei, adica de nj . In acest fel introducerea corectiei relativiste micsoreaza gradul de degenerare, orbitele cu nj diferit, dar cu acelasi n, vor diferi putin unele de altele si ca energie. Acest rezultat se concretizeaza prin existenta structurii fine a liniilor spectrale. Spre exemplu cele doua orbite cu n = 2, (nj = 1 si nj = 2) se vor separa energetic una de alta, ca urmare tranzitia 2 -> 1 va consta din doua linii extrem de apropiate, dar separabile experimental. In acest fel modelul Bohr- Sommerfeld reflecta fenomenele atomice cu un mult mai mare grad de precizie.
Cu toate perfectionarile aduse modelului Bohr, cele mai importante fiind discutate anterior, modelul acesta nu a reusit sa explice o serie de fenomene.Cele mai serioase deficiente sunt urmatoarele:
Copyright © 2025 - Toate drepturile rezervate