 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
CAPITOLUL TERMODINAMICA
1)Care sunt fenomenele care dovedesc structura discontinua a substantei ?
Difuzia si miscarea browniana sunt fenomenele care dovedesc structura discontinua a substantei.
2)Sa se defineasca fenomenul de difuziune
Difuzia este fenomenul de patrundere a moleculelor unei substante prin moleculele altei substante.
3)Sa se trateze subiectul miscarea browniana.
Miscarea browniana este miscarea dezordonata, spontata si permanenta a unor particule aflate in suspensie intr-un fluid.
Particulele browniene sunt particule macroscopice, iar cauza miscarii lor are loc la nivelul moleculelor prin ciocnirea intre moleculele particulelor si moleculele fluidului.
4)Sa se defineasca masa atomica relativa.
Masa atomica relativa a unei substante reprezinta raportul dintre masa atomului si masa unui atom de (carbon) referinta ales prin conventie.
A=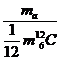
5)Sa se defineasca masa moleculara relativa.
Masa moleculara relativa a unei substante reprezinta
raportul dintre masa moleculelor si masa unui atom de referinta ales prin
conventie (![]() ).
).
![]()
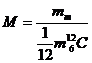
6)Sa se defineasca molul.
Molul este cantitatea de substanta a unui sistem care
contine atatea entitati elementare (molecula, atom, ioni, electroni) cati atomi
exista in
7)Care sunt proprietatile molului ?
1.Un mol de substanta, indiferent de natura ei, contine
acelasi numar de atomi sau molecule (![]() ).
).
2.Un mol de substanta contine in conditii normale de
temperatura si presiune (![]() sau T=273 k si
sau T=273 k si ![]() )
)
8)Care este semnificatia fizica a numarului lui Avogadro ?
Numarul lui Avogadro este numarul de molecule dintr-un mol de substanta, indiferent de natura ei si starea de agregare in care se afla substanta.
![]()
9)Sa se defineasca miscarea de agitatie termica.
Agitatia termica este miscarea dezordonata, spontata si permanenta a moleculelor si a particulelor submoleculare, miscare ce se intensifica la cresterea temperaturii.
10)Ce sunt fenomenele termice ?
Fenomenul termic este un fenom fizic legat de miscarea complet dezordonata a particulelor unui sistem fizic.
11)Care sunt metodele de studiu ale fenomenelor termice ?
Metodele de studiu ale fenomenelor termice sunt:
1.Termodinamica
2.Teoria cinetico-moleculara
12)Sa se defineasca notiunile de: sistem, stare, proces (transformare de stare), lucru mecanic, energia interna, caldura, temperatura.
Sistemul termodinamic este un corp sau un ansamblu bine precizat de corpuri format dintr-un numar foarte mare, dar finit de particule.
Se numeste starea sistemului termodinamic totalitatea proprietatilor lui la un moment dat.Aceste proprietati pot fi descrise cu ajutorul unor marimi fizice numite parametrii de stare.
Procesul (transformare de stare) reprezinta trecerea unui sistem termodinamic dintr-o stare de echilibru in alta stare de echilibru.
Lucrul mecanic (L) efectuat de un gaz ideal aflat intr-o
pompa cu piston este dat de relatia ![]() .
.
Energia interna (U) este suma energiilor cinetice ale tuturor constituientilor sistemului, a energiei potentiale intermoleculare, a energiei potentiale gravitationale la sistemul luat ca intreg pamant.Energia interna depinde de temperatura- este o functie de stare, caracterizeaza sistemul la un moment dat.
Caldura (Q) este o marime fizica scalara care masoara transferul de enrgie prin contact termic intre sistemele termodinamice in procesele care au loc intre ele.
Temperatura este un parametru de stare ce caracterizeaza echilibrul termic.
13)Sa se trateze subiectele: contact termic, echilibru termic.
Contactul termic reprezinta contactul intre 2 sau mai multe corpuri (sisteme) in care are loc schimbul de caldura fara a fi posibil schimbul de lucru mecanic.
Echilibrul termic este starea pe care o au mai multe corpuri care, aduse in contact termic, nu schimba caldura intre ele.
14)Sa se enunte principiul tranzivitatii echilibrului termic.
Daca sistemele A si B sunt in echilibru termic, iar sistemul B este in echilibru termic cu un al treilea sistem C, atunci si sitemul A si sistemul C sunt in echilibru termic.
15)Sa se enunte principiul zero al termodinamicii.
Exista un parametru termodinamic de stare de tip intensiv, numit temperatura empirica, avand aceeasi valoare pentru toate starile de echilibru termodinamic aflate in relatie de echilibru termic.
16)Ce este corpul termometric ?
Corpul termometric este suportul material utilizat pentru masurarea temperaturii.
El poate fi: -lichid
-gaz
-solid
17)Ce este proprietatea termometrica ?
Proprietatea termometrica sau marimea termometrica este proprietatea fizica a suportului material valabila cu temperatura.
18)Ce este termometrul ?
Termometrul este dispozitivul pentru masurarea temperaturii.
19)Cum se stabileste o scara de temperatura ?
A stabili o scara termometrica inseamna a stabili o dependenta intre valoarea marimii fizice ce caracterizeaza un termometru si temperatura acestuia.
Se aduce, pe rand, termometrul in contact termic cu un
sistem aflat in 2 stari termice distincte si perfect reproductibile carora li
se asociaza, in mod conventional, valori bine precizare ale temperaturii numite
temperatura de reper.Se noteaza pe o scala valorile acestora obtinandu-se un
interval de temperatura.Acest interval se imparte la un numar natural, ales
arbitrar si se obtine unitatea de temperatura in scara respectiva care se
numeste grad.(exceptie Kelvin ![]() )
)
20)Sa se trateze subiectul: dilatarea corpurilor solide.
Dilatarea = fenomenul de modificare a dimensiunilor geometrice a unui corp sub actiunea caldurii.
* Daca una din dimensiunile sistemului este mult mai mare decat celelalte doua, are loc o dilatare in lungime, fenomenul se desfasoara dupa legea:
![]()
l =lungimea la temperatura t
![]() =lungimea initiala a corpului
=lungimea initiala a corpului
![]() =coeficientul de dilatare termica liniara
=coeficientul de dilatare termica liniara
→Daca α > 0, corpul isi mareste dimensiunile odata cu cresterea temperaturii.
Daca α < 0, corpul isi micsoreaza dimensiunile odata cu cresterea temperaturii.
![]()
![]()
* Daca 2 din dimensiunile sistemului sunt mult mai mari decat a treia are loc o dilatare de suprafata.
![]()
S=aria la temperatura t
![]() =aria la temperatura initiala
=aria la temperatura initiala
* Daca cele 3 dimensiuni sunt comparabile, sub actiunea caldurii sistemul va suferi o dilatare in volum.
![]()
21)Sa se gaseasca legatura intre coeficientii de dilatare α, β, γ.
a) ![]()
![]()
![]() (
(![]() se neglijeaza)
se neglijeaza)
![]()
![]()
b) 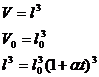
![]()
(![]() ;
;![]() - se neglijeaza)
- se neglijeaza)
![]()
![]()
22)Sa se deduca legea expresiei de variatie a densitatii corpurilor solide cu temperatura.
In toate situatiile in care au loc variatia volumului, se poate calcula modificarea densitatii corpurilor.
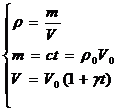
![]()
![]()
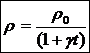
23)Sa se trateze subiectul: dilatarea lichidelor.
Lichidele se dilata in volum ![]()
Dilatarea aparenta a lichidelor este mai mica decat cea reala.
24)Sa se defineasca coeficientul de dilatare termica a unui lichid.
Coeficientul de dilatare termica a unui lichid este dat
de suma coeficientului de dilatare a lichidului (![]() ) si a coeficientului de dilatare al vasului in care se afla
lichidul.
) si a coeficientului de dilatare al vasului in care se afla
lichidul.
![]()
25)Sa se scrie expresia coeficientului de dilatare aparenta a unui lichid.
Dilatarea aparenta a lichidelor este mai mica decat cea reala.
![]()
![]() coeficientul de dilatare a lichidului
coeficientul de dilatare a lichidului
![]() coeficientul de dilatare a vasului
coeficientul de dilatare a vasului
26)Sa se deduca expresia legii de variatie a densitatii corpurilor lichide cu temperatura.
In toate situatiile in care au loc variatii de volum se poate calcula modificarea densitatii corpurilor.
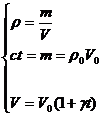
![]()
![]()
![]()
27)Sa se trateze subiectul anomalia dilatarii termice a apei.
Apa, pe intervalul de temperatura de la ![]() la
la ![]() , are coeficientul de dilatare negativ, micsorandu-si volumul
odata cu cresterea temperaturii.Peste
, are coeficientul de dilatare negativ, micsorandu-si volumul
odata cu cresterea temperaturii.Peste ![]() se comporta normal, ca
orice lichid, dilatandu-se la cresterea temperaturii.
se comporta normal, ca
orice lichid, dilatandu-se la cresterea temperaturii.
28)Sa se trateze subiectul: Fortele de dilatatie.
a)Daca exista o cantitate in corpul solid, volumul cantitatii creste ca si cum ar fi plina cu alt corp din acelasi material .Adica la dilatarea unui vas de sticla, nu creste doar volumul sticlei, ci si capacitatea lui.
![]()
F=forta care apare in bara
S=sectiunea barei
E=modulul lui Young
b)Fortele de adeziune si coeziune
1)![]() lichidul uda vasul
lichidul uda vasul
2)![]() lichidul nu uda vasul
lichidul nu uda vasul
2)
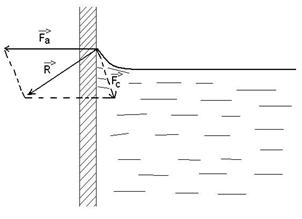
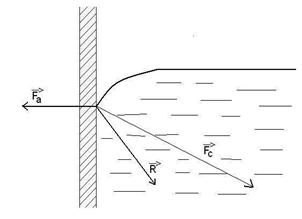
29)Sa se defineasca gazul ideal din punct de vedere al t.c.m.
Cel mai simplu model cinetico-molecular, folosit pentru gaze, este modelul gazului simplu.
Caracteristici principale ale acestui model sunt:
1.Gazul este format dintr-un numar mare de particule identice (molecule sau atomi).
2.Dimensiunile moleculelor sunt mici in comparatie cu distantele dintre ele, astfel ca ele pot fi considerate puncte materiale.
3.Moleculele se afla intr-o miscare haotica continua, miscarea fiecarei molecule, luata separat, se supune legilor mecanicii clasice.
4.Fortele intermoleculare se neglijeaza: moleculele se misca liber, traiectoriile lor fiind drepte.
5.Ciocnirile dintre molecule si peretii vasului sunt perfect elastice.
30)Sa se duca expresia formulei fundamentale a t.c.m.
Sa consideram o particula a gazului ideal de masa m ce deplaseaza intr-un recipient cubic.
![]()
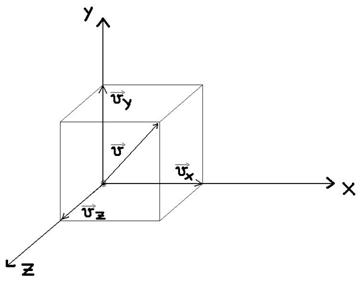
Impulsul pe OX
![]()
![]() , dupa ciocnirea perfect elastica cu peretele
, dupa ciocnirea perfect elastica cu peretele ![]() devine
devine
![]()
![]()
![]()
Potrivit principiului fundamental al dinamicii, ![]() (variatia impulsului)
e determinata de forta medie de reactiune din partea peretelui egala cu:
(variatia impulsului)
e determinata de forta medie de reactiune din partea peretelui egala cu: ![]()
Conform principiului actiunii si reactiunii, daca
peretele actioneaza asupra particulei cu o forta ![]() , atunci si particula actioneaza asupra peretelui cu o forta
egala si de semn contrar (
, atunci si particula actioneaza asupra peretelui cu o forta
egala si de semn contrar (![]() ) deci:
) deci:
![]() si
si ![]()
Forta cu care particula actioneaza asupra peretelui este:
![]()
Daca peretele este ciocnit in intervalul ![]() de
de ![]() particule, forta ce
actioneaza in acest interval de timp va fi de
particule, forta ce
actioneaza in acest interval de timp va fi de ![]() ori mai mare.
ori mai mare.
![]() iar
iar ![]() ;
; ![]()
![]()
![]()
![]()
Iar presiunea exercitata de aceasta particula va fi:
![]()
![]()
![]() ;
; ![]()
![]() au viteza
au viteza ![]() de componente (
de componente (![]() )
)
![]() au viteza
au viteza ![]() de componente (
de componente (![]() )
)
![]()
![]() au viteza
au viteza ![]() , de componente (
, de componente (![]() )
)
Unde: ![]()
In acest caz presiunile vor fi
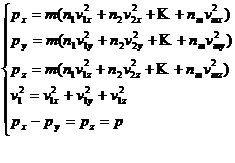
![]()
![]()
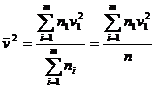
![]()
![]()
![]()
31)Sa se scrie expresia formulei fundamentale a t.c.m. dand semnificatia fizica a marimilor ce intervin si a unitatilor lor de masura.
Aceasta masura exprima legatura dintre presiunea exercitata de un gaz ideal si parametrii microscopici ce caracterizeaza gaze
![]() unde p-presiunea
exercitata de gazul ideal
unde p-presiunea
exercitata de gazul ideal
n-concentratia particulei ce compune gazul ideal, adica numarul de molecule din unitatea de volum
![]() =energia cinetica moleculara medie a unei molecule in miscare
de translatie
=energia cinetica moleculara medie a unei molecule in miscare
de translatie
32)Sa se trateze subiectul: viteza termica
![]()
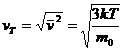
![]()
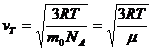
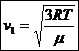
33)Care este interpretarea cinetico-moleculara a temperaturii ?
Energia cinetica moleculara medie (![]() ) depinde de temperatura gazului ideal la momentul respectiv
prin relatia:
) depinde de temperatura gazului ideal la momentul respectiv
prin relatia:
(![]() )
) ![]()
Unde: T-temperatura gazului
![]() -constanta Boltzman
-constanta Boltzman ![]()
34)Sa se trateze subiectul: ecuatia de stare termica si ecuatia de stare calorica.
![]()
![]()
Ecuatia termica de stare a gazului ideal sau ecuatia Clapeyron-Mendeleev
![]()
Energia interna ![]()
Energia cinetica medie de
translatie este ![]()
N=nV
![]()
Energia interna a unui gaz ideal este direct proportionala cu temperatura absoluta a gazului si cu cantitatea de gaz dar nu depinde nici de volumul ocupat de gaz si nici de presiune.
Pt ![]()
![]()
35)Care sunt transformarile particulare ale gazului ideal ?
Transformarile simple ale gazului ideal sunt:
-transformarea izoterma (Byle-Mariotte)
-transformarea izobara (Gay-Lussac)
-transformarea izocora (Charles)
-transformarea generala (Clapeyron-Mendeleev)
36)Sa se trateze subiectul: Transformarea izoterma.
Transformarea izoterma este transformarea in care
temperatura ramane constanta pe tot parcursul transformarii (procesului) ![]()
→Legea transformarii
izoterme: ![]()
→Dispozitivul experimental
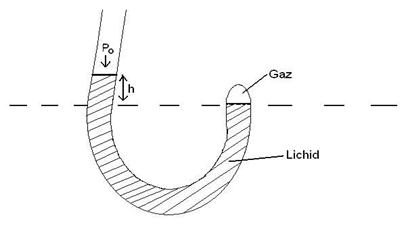
Starea initiala
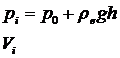
Starea finala
![]()
→Reprezentari grafice
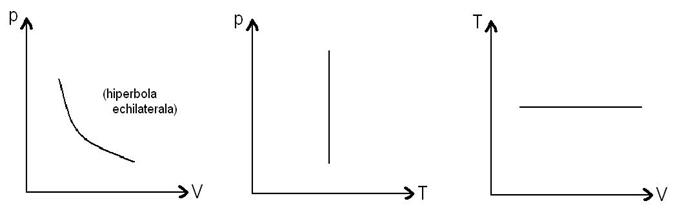
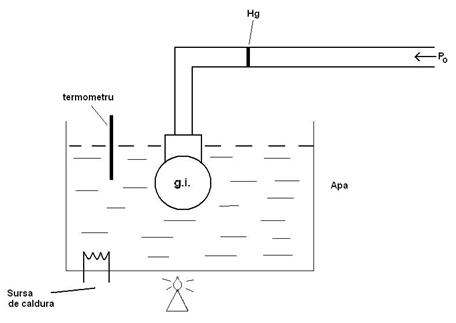
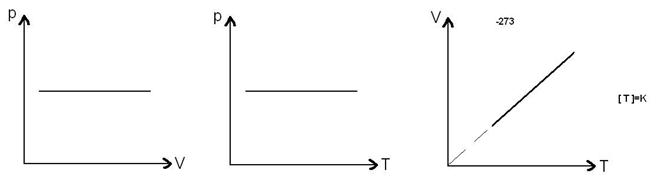
37)Sa se trateze subiectul: Transformare izobara.
Transformarea izobara este o transformare simpla a
gazului ideal in care presiunea se mentine constanta. ![]()
→Legea transformarii
izobare: ![]()
![]()
→Dispozitivul experimental
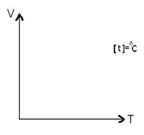
→Reprezentari grafice
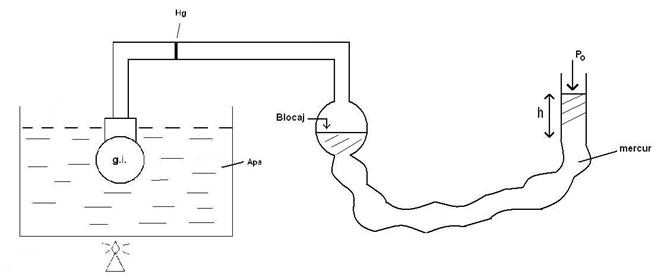
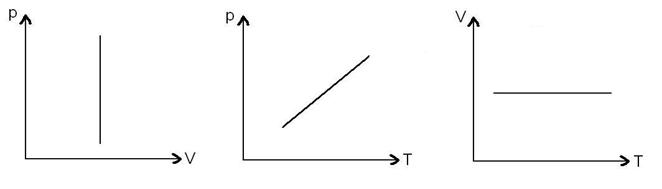
38)Sa se trateze subiectul: Transformarea izocora.
Transformarea izocora este o transformare simpla a unui
gaz ideal, in care volumul se mentine constant. ![]()
→Legea transformarii izocore:
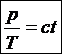
![]()
→Dispozitivul experimental
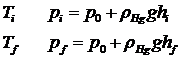
→reprezentari grafice
39)Ce sunt fortele de interactiune moleculara ?
Fortele de interactiune moleculara sunt fortele elecrostatice insemnate care actioneaza intre moleculele aflate la distante mici intre ele.
Fortele de interactie care asigura coeziunea moleculei unui lichid nu sunt de natura gravitationala ci electrica.
40)Sa se prezinte grafic fortele de interactie dintre molecule functie de distanta dintre ele.
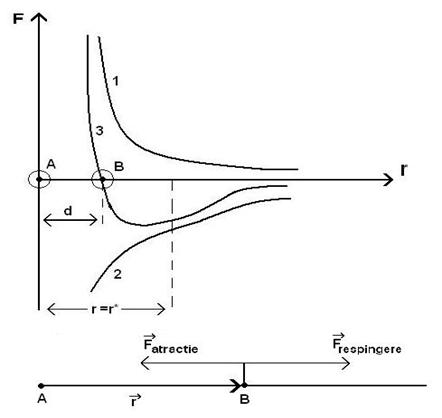
Deoarece moleculele contin
purtatori de sarcina electrica de semne diferite, intre ele actioneaza in
acelasi timp atat forte de atractie, cat si forte de de respingere.Modulul
fortei rezultante , egal in valoare cu fierenta dintre modulele celor doua
forte, poarta denumirea de forta intermoleculara.Valoarea ei este ![]() .
.
Se constata ca atat ![]() cat si
cat si ![]() depinde de distanta
dintre molecule, dar, numeric, variatia cu distanta a celor doua forte este
diferita.In figura e prezentata dependenta de distanta dintre molecule a fortei
de respingere (curba 1), a fortei de atractie (curba 2) si a fortei rezultante
sau intermoleculare (curba 3).
depinde de distanta
dintre molecule, dar, numeric, variatia cu distanta a celor doua forte este
diferita.In figura e prezentata dependenta de distanta dintre molecule a fortei
de respingere (curba 1), a fortei de atractie (curba 2) si a fortei rezultante
sau intermoleculare (curba 3).
41)Sa se prezinte grafic energia potentiala in functie de distanta intre molecule.
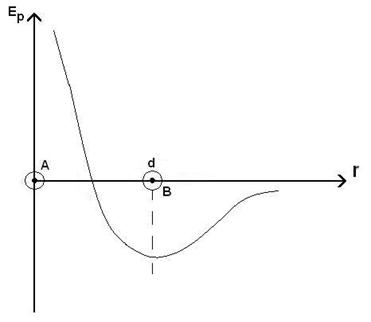
Pentru r > d (r =vectorul de pozitie si d =distanta dintre centrele moleculelor) moleculele se atrag (F<0) si de aceea Energia potentiala este negativa. Ea creste cand distanta dintre molecule se mareste.In punctul r = d, unde forta intermoleculara se anuleaza, energia potentiala trece printr-un minim.
Cand moleculele se aproprie astfel incat r < d, ele se resping (F < 0)si energia potentiala incepe sa creasca.
42)Sa se enunte primul principiu al termodinamicii
Intr-o transformare oarecare, variatia energiei interne a unui sistem termodinamic nu depinde de starile intermediare prin care trece sistemul si este egala cu suma algebrica dintre caldura si lucrul mecanic schimbate de sistem cu mediul exterior, in timpul transformarii.
![]()
43)Sa se trateze subiectul: Consecintele primului principiu al termidinamicii
![]()
a)Daca ![]()
![]()
![]()
![]()
→Daca un sistem termodinamic nu primeste caldura din exterior, el poate efectua un lucru mecanic asupra corpurilor din jur numai pe seama miscarii energiei interne.
b)Daca (corpurile) sistemul efectueaza o transformare ciclica, atunci
![]()
![]()
![]()
![]()
Daca
sistemul este izolat, adica nu schimba caldura si nici lucru mecanic cu
exteriorul, atunci ![]() , iar din relatia primului principiu rezulta
, iar din relatia primului principiu rezulta ![]() sau
sau ![]() , adica energia interna a unui sistem izolat se conserva.
, adica energia interna a unui sistem izolat se conserva.
44)Sa se defineasca coeficientii calorici.
Capacitatea calorica este o marime fizica numeric egala cu caldura necesara pentru a varia temperatura unui corp cu un grad.(C)
![]()
![]()
Caldura specifica (c) = caldura necesara pentru a varia temperatura unitatii de masa dintr-un corp cu un grad.
![]()
![]()
![]()
Caldura molara este marimea fizica numeric egala cu caldura necesara pentru a varia temperatura unui mol cu un grad.
![]()
![]()
![]()
45)Sa se deduca relatia lui Robert-Mayer
Consideram un kmol de gaz perfect ce absoarbe caldura Q.
Conform primului principiu al termodinamicii:
![]()
Daca gazul este incalzit
izocor (![]() ) deci L=0, atunci
) deci L=0, atunci ![]()
![]()
![]()
Daca gazul este incalzit
izobar, caldura molara izobara ![]() va fi:
va fi:
![]()
![]()
Pentru un kmol de
substanta din ecuatia de stare avem ![]()
![]()
![]()
![]()
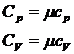
![]()
46)Sa se scrie relatia lui Robert-Mayer dand semnificatia fizica a masurilor ce intervin si a unitatilor lor de masura.
![]()
![]() =caldura molara izobara
=caldura molara izobara ![]()
![]() =caldura molara izocora
=caldura molara izocora ![]()
R=constanta gazelor ideale
![]()
![]()
47)Sa se trateze subiectul: Variatia energiei interne, caldura si lucrul mecanic in transformarile simple ale gazului ideal.
|
Tipul transformarii |
ΔU |
L |
Q |
|
Izocora |
|
|
|
|
Izobara |
|
|
|
|
Izoterma |
|
|
|
|
Adiabatica |
|
- | |
|
Politropa |
|
|
|
![]()
48)Sa se trateze subiectul: Lucrul mecanic intr-o transformare ciclica biterma.
O transformare in care sistemul schimba caldura cu doua termostate de temperaturi diferite se numeste transformare biterma.
![]()
![]() dar
dar ![]()
![]() > 0
> 0 ![]() >0 =caldura de la
termostatul de temperatura mai mare cedeaza caldura
>0 =caldura de la
termostatul de temperatura mai mare cedeaza caldura ![]() <0 termostatul de temperatura mai joasa.
<0 termostatul de temperatura mai joasa.
![]()
![]()
49)Sa se trateze subiectul: Ciclul Carnot
Ciclul Carnot este un ciclu format din 4 transformari cvasistatice (reversibile):
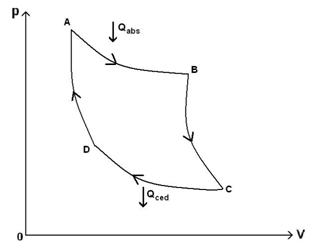
a)destindere izoterma
A→B ![]()
b)destindere adiabatica
B→C Q=0
c)comprimare izoterma
C→D ![]()
d)comprimare adiabatica
D→A Q=0
![]()
![]()
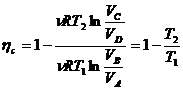
A→B ΔU=0
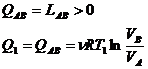
![]()
![]()
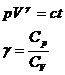
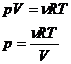
![]()
![]()
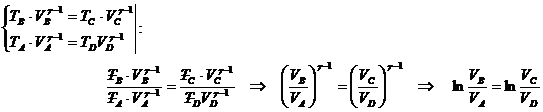
![]() temperatura maxima atinsa in ciclu
temperatura maxima atinsa in ciclu
![]() temperatura minima atinsa in ciclu
temperatura minima atinsa in ciclu
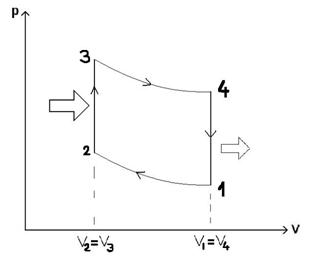
50)Sa se trateze subiectul: Ciclul Otto.
Ciclul Otto cuprinde: 2 adiabate si 2 izocore
![]()
![]()
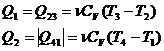
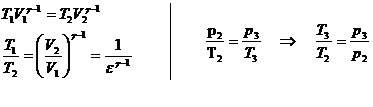
![]()
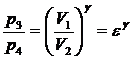
![]() ;
; ![]()
![]()
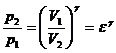
![]()
![]()
![]()
![]()
![]()
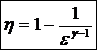
51)Sa se trateze subiectul: Ciclul Diesel.
Ciclul Diesel are: 2 adiabate, 1 izocora, 1 izobara.
![]()
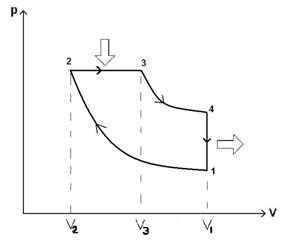
![]()
![]()
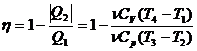
![]()
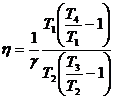
![]()
![]() ;
; ![]()
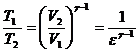
![]()
![]()
![]()
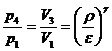
![]()
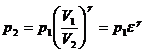
![]()
![]()
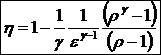
52)Sa se defineasca faza unei substante.
Faza unei substante reprezinta starea de agregare in care se afla substanta la un moment dat.
53)Sa se defineasca transformarea de faza.
Transformarea de faza reprezinta trecerea substantei dintr-o stare de agregare in alta.
54)Sa se defineasca echilibrul de faza.
Doua sau mai multe faze ale aceleasi substante sunt in echilibru de faza, daca masa fiecarei faze nu se mai modifica pe seama celeilalte, atunci cand fazele sunt in contact in aceleasi conditii de presiune si temperatura.
55)Sa se trateze subiectul: Izotermele lui Andrews.
Fizicianul Thomas Andrews a racit si comprimat
concomitent (![]() ), reusind sa-l transforme din stare gazoasa in stare
lichida.
), reusind sa-l transforme din stare gazoasa in stare
lichida.
Lichiefierea reprezinta procesul de trecere a unui sistem termodinamic din starea gazoasa in starea lichida.
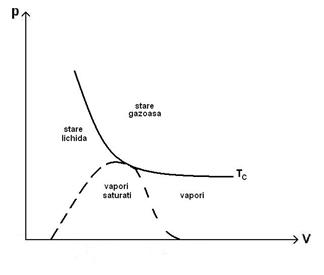 Savantul
a efectuat o serie de comprimari izoterme ale
Savantul
a efectuat o serie de comprimari izoterme ale ![]() si a constatat ca daca
temperatura gazului este mai mare de
si a constatat ca daca
temperatura gazului este mai mare de ![]() , atunci gazul respecta legea Boylle-Mariote.Daca temperatura
gazului este mai mica de
, atunci gazul respecta legea Boylle-Mariote.Daca temperatura
gazului este mai mica de ![]() , prin comprimarea acestuia, la un moment dat incep sa apara
picaturi de lichid, iar presiunea ramane aproximativ constanta, desi volumul se
micsoreaza.
, prin comprimarea acestuia, la un moment dat incep sa apara
picaturi de lichid, iar presiunea ramane aproximativ constanta, desi volumul se
micsoreaza.
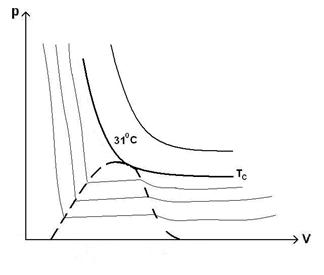
Urmarind
Urmarind izotermele lui Andrews se constata:
-Sub temperatura de ![]() , pentru
, pentru ![]() , izoterma prezinta un palier de lichefiere a carui lungime
este cu atat mai mica cu cat temperatura este mai mare.
, izoterma prezinta un palier de lichefiere a carui lungime
este cu atat mai mica cu cat temperatura este mai mare.
-Izoterma de ![]() nu prezinta palier, ci
un punct de inflexiune cu tangenta orizontala in punctul critic.
nu prezinta palier, ci
un punct de inflexiune cu tangenta orizontala in punctul critic.
-Peste ![]() nu se mai produce
lichefiere.
nu se mai produce
lichefiere.
-Lichefierea unui gaz nu este posibila decat daca
temperatura sa este inferioara temperaturii critice (![]() ) specifice gazului.Apare o presiune critica (
) specifice gazului.Apare o presiune critica (![]() ).Cu cat temperatura gazului este mai mica, cu atat presiunea
de lichefiere este mai mica si gazul este mai usot de lichefiat.
).Cu cat temperatura gazului este mai mica, cu atat presiunea
de lichefiere este mai mica si gazul este mai usot de lichefiat.
56)Sa se trateze subiectul: Vaporizarea in vid.
Vaporizarea in vid:
-este instantanee
-se face pana cand presiunea vaporilor obtinuti atinge o
valoare maxima ![]() .Vaporii in acest
.Vaporii in acest
caz
se numesc saturati, iar ![]() se numeste presiunea vaporilor saturati in conditiile date
de temperatura.
se numeste presiunea vaporilor saturati in conditiile date
de temperatura.
Presiunea vaporilor saturati verifica urmatoarele legi:
-presiunea vaporilor saturati nu depinde de masa lichidului si nici de masa vaporilor in contact.
-presiunea vaporilor saturati ramane constanta atata timp cat temperatura ramane constanta.
-la o temperatura data presiunea maxima a vaporilor depinde numai de natura lichidului din care
au provenit.
57)Sa se trateze subiectul: Vaporizarea in atmosfera gazoasa.
Vaporizarea in atmosfera gazoasa este lenta, presiunea maxima a vaporilor saturati ai unei substante intr-o atmosfera gazoasa este aceeasi ca si cum ar ocupa singuri intregul volum (ea este independenta de presiunea gazului).
Presiunea unui amestec de gaze si vapori saturat este egala cu suma presiunilor pe care le-ar avea fiecare component in parte daca ar ocupa singur intreg volumul la aceeasi temperatura.
58)Sa se trateze subiectul: Vaporizarea la suprafata (evaporarea).
Fenomenul prin care se realizeaza vaporizarea numai la suprafata libera se numeste evaporare.
Conditiile care trebuie indeplinite pentru a se produce evaporarea sunt:
-mediul
ambiant sa nu fie saturat cu vaporii lichidului, presiunea vaporilor existenti ![]() sa fie mai mare decat
presiunea de saturatie
sa fie mai mare decat
presiunea de saturatie ![]() la aceeasi temperatura.
la aceeasi temperatura.
-presiunea
atmosferica H la acel moment sa fie mai mare decat presiunea de saturatie (![]() ).
).
Masa de lichid se poate evapora intr-un timp mai lung sau mai scurt, in functie de viteza de evaporare.
59)Sa se scrie expresia vitezei de evaporare a unui lichid dand semnificatia fizica a marimilor ce intervin si a unitatilor lor de masura.
![]()
K= constanta de proportionalitate; depinde de natura substantei, de unitatile de masura alese si de alti factori specifici sistemului.
S= aria suprafetei libere a lichidului.
H= presiunea atmosferica.
![]() = presiunea vaporilor saturati ai lichidului respectiv la
temperatura la care se produce evaporarea.
= presiunea vaporilor saturati ai lichidului respectiv la
temperatura la care se produce evaporarea.
![]() = presiunea vaporilor lichidului respectiv in vecinatatea
suprafetei libre a lichidului.
= presiunea vaporilor lichidului respectiv in vecinatatea
suprafetei libre a lichidului.
60)Sa se trateze subiectul: vaporizarea in toata masa lichidului (fierberea).
Fierberea este procesul de vaporizarea in intreaga masa a lichidului, vaporii formandu-se oriunde in interiorul lichidului.
Cand un lichid fierbe, la presiune constanta temperatura vaporilor in imediata vecinitate a lichidului ramane constanta.Aceasta temperatura este cunoscuta sub numele de temperatura de fierbere, iar in conditii de presiune constanta depinde numai de natura lichidului.
Un lichid incepe sa fiarba atunci cand presiunea maxima a vaporilor sai este egala cu presiunea de deasupra lichidului.
61)Sa se trateze graficul dependentei temperatuii de
presiune ![]() la echilibrul de faza
gaz-lichid.
la echilibrul de faza
gaz-lichid.
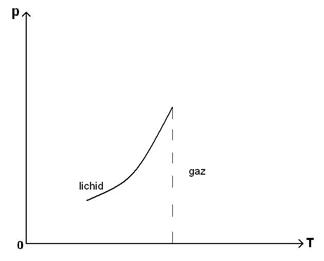
Aceasta curba separa planul in 2 parti:
-una, la stanga curbei, punctele din aceasta parte a planului reprezinta stari in care substanta este lichida.
-una, in dreapta curbei punctele
din aceasta parte a planului reprezinta stari in care substanta este sub forma
de vapori, pana la ![]() si sub forma de gaz
dincolo de
si sub forma de gaz
dincolo de ![]() .
.
Punctele de pe curba corespund starilor de echilibru de faze, in care coexista ambele faze ale substantei.
62)Sa se trateze subiectul: Topire-solidificare.
Topirea este fenomenul de trecere a unui corp din faza solida in faza lichida, iar solidificarea este transformarea inversa.
Din punct de vedere al modului cum are loc topirea distingem doua tipuri:
-topirea corpurilor amorfe-se produce printr-o inmuiere treptata a corpului pana se ajunge la faza lichida: sticla, ceara, smoala, etc.
-topirea corpurilor cristaline-se produce prin trecerea brusca in faza lichida la o temperatura bine precizata: metale, gheata, etc.
1.Temperatura de topire este influentata de presiunea la care este supusa substanta.
2.In timpul topirii, volumul substantei se modifica.Exista substante al caror volum scade in timpul topirii (apa,Hg), dar majoritatea substantelor isi maresc volumul prin topire.
3.Caldura acceptata de substanta in timpul topirii are aceeasi valoare cu cea cedata de aceeasi substanta in timpul solidificarii.
![]()
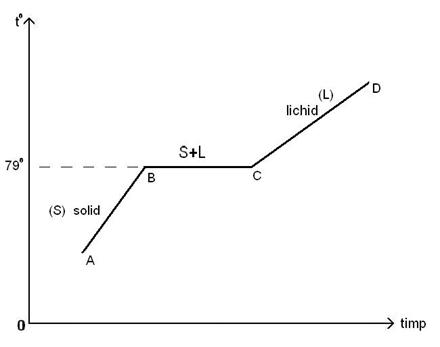 63)Sa se
traseze graficul dependentei temperaturii de timp in procesul de topire si
solidificare.
63)Sa se
traseze graficul dependentei temperaturii de timp in procesul de topire si
solidificare.
64)Sa se traseze graficul dependentei temperaturii de presiunela echilibrul de faza solid-lichid.
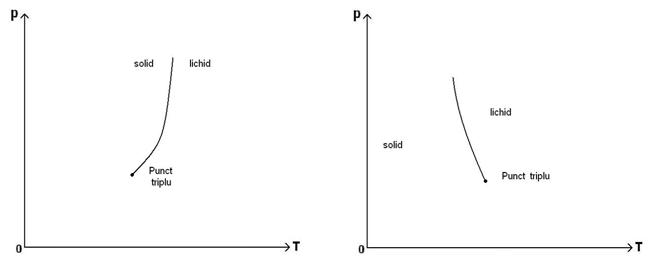
Pentru substanta care se dilata la topire Pentru substanta care se contracta la topire
65)Sa se trateze subiectul: Sublimare-desublimare.
Unele substante (sulf, naftalina, etc) pot trece din starea solida direct in starea gazoasa, fenomen numit sublimare.Procesul invers de trecere a substantelor din starea gazoasa in starea solida se numeste desublimare.
Caldura latenta este egala cu suma dintre caldura latenta de topire si caldura latenta de vapori.
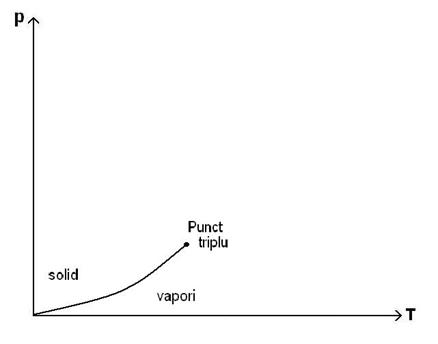
66)Sa se traseze graficul dependentei temperaturii de presiune la echilibru de faza solid-vapori.
Copyright © 2026 - Toate drepturile rezervate