 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Reactiile de oxido-reducere sau redox sunt extrem de numeroase si, de aceea, pot constitui pentru chimistul analist o sursa importanta pentru metodele de analiza.
Dupa cum stim, o reactie de oxido-reducere este aceea in care reactantii sufera schimbari in starea lor de oxidare. Castigul de electroni este un proces de reducere, in timp ce oxidarea reprezinta o pierdere de electroni . În reactii redox trebuie sa aiba loc ambele reactii. De asemenea, numarul total de electroni pierduti trebuie sa fie egal cu numarul total de electroni castigati. În general, titrarile redox se realizeaza in solutie cu tarie ionica ridicata si constanta, pentru ca modificarile de potential din vasul de titrare sa nu fie decat consecinta reactiei redox.
Curbele redox de titrare pun in evidenta modificarea potentialului solutiei unui reducator, sau al unui oxidant, in cursul titrarii cu un oxidant, respectiv cu un reducator.
În vederea calcularii curbelor de titrare ale reactiilor redox este necesar sa se cunoasca potentialele standard normale ale sistemelor redox implicate in reactia de titrare si raportul concentratiilor formei oxidate si formei reduse, conform formulei lui Nernst:
![]()
Valoarea potentialului redox se determina in raport cu un electrod etalon, care este electrodul normal de hidrogen si a carui potential, in mod conventional, se ia egal cu zero.
Se deosebesc doua cazuri:
a) titrarea unui reducator cu solutia unui oxidant si
b) titrarea unui oxidant cu solutia unui reducator.
a) Reactia redox pe care se bazeaza o astfel de titrare este de forma generala:
![]() D
D ![]()
Pana la punctul de echivalenta, potentialul se poate calcula considerand:
red D ox2 + m![]()
iar dupa punctul de echivalenta, considerand sistemul:
ox + p![]() D red1
D red1
Pana la punctul de echivalenta, potentialul se calculeaza deci cu ajutorul formulei:
![]() (1)
(1)
Potentialul sistemului la echivalenta devine:
![]() (2)
(2)
Dupa punctul de
echivalenta, potentialul se va calcula considerand
sistemul ox1 + p![]() D red1, cu ajutorul formulei:
D red1, cu ajutorul formulei:
![]() (3)
(3)
Calculul potentialului in cazul titrarii unui oxidant cu un reducator se efectueaza in mod similar (formulele vor corespunde invers: 3-momentul dinaintea echivalentei, 2-la echivalenta si 1-dupa echivalenta).
Titrarea unui amestec de
doi sau mai multi agenti reducatori cu un oxidant sau a unui amestec
de doi sau mai multi oxidanti cu un reducator va duce la mai
multe puncte de echivalenta, primele reducandu-se cele mai
reducatoare. De exemplu, la titrarea unui amestec de Sn2+, Fe2+
cu o solutie de Ce4+ ![]() . Întai se va oxida Sn2+ la Sn4+
deoarece cuplul redox
. Întai se va oxida Sn2+ la Sn4+
deoarece cuplul redox ![]() este mult mai reducator decat cuplul redox
este mult mai reducator decat cuplul redox ![]() .
.
Pe baza reactiilor de oxido-reducere s-au instituit numeroase metode de determinare volumetrica. Unele dintre cele mai importante si mai des folosite metode, clasificate dupa natura oxidantilor, respectiv a reducatorilor, sunt:
a) Dozarea reducatorilor cu solutii oxidante:
A - Permanganatometria;
B - Iodometria;
C - Bicromatometria;
D - Bromatometria;
E - Iodatometria;
F - Cerimetria;
b) Dozarea cu solutii reducatoare:
A - Titanometria;
B - Titrarea cu acid oxalic;
C - Titrarea cu arsenit de Na;
D - Titrarea cu sulfat feros;
E - Titrarea cu tiosulfat de sodiu;
F - Titrarea cu metiloranj (Heliontometria).
KMnO4 este un agent de oxidare puternic si multilateral. El are aplicatii specifice, in functie de cum este utilizat in solutii acide, neutre, sau alcaline, in care prezinta puteri de oxidare diferite:
a) ![]() ═
═ ![]() ; - mediu acid: E
=1,51 V la o concentratie de 1 M permanganat
; - mediu acid: E
=1,51 V la o concentratie de 1 M permanganat
b) ![]() ═
═ ![]() ;- mediu neutru: E
=1,23 V pentru concentratia de 1 M
;- mediu neutru: E
=1,23 V pentru concentratia de 1 M
c) ![]() ═
═ ![]() ; - mediu bazic: E
=0,54 V la concentratia de 1 M.
; - mediu bazic: E
=0,54 V la concentratia de 1 M.
Un alt motiv pentru utilizarea sa pe scara larga este faptul ca actioneaza si ca autoindicator. Primul exces de peste punctul de echivalenta provoaca o coloratie roza distincta.
Puterea oxidanta a KMnO4 scade mult odata cu scaderea concentratiei ionilor de H+.
Solutiile apoase de KMnO4 nu sunt stabile, fiind influentate de o serie de factori: lumina, substante solide pulverulente, dilutia, impuritati organice, temperatura, cresterea alcalinitatii sau aciditatii solutiei. Stabilitatea solutiilor de permanganat este maxima in solutie neutra la temperatura obisnuita, la intuneric si la concentratii ridicate de KMnO4. De aceea, se prepara solutii concentrate de KMnO4 care se pastreaza in sticle brune si se dilueaza inainte de folosire.
Din cauza instabilitatii, se recomanda ca titrul solutiei de KMnO4 sa se faca cat de des posibil (cel putin o data pe luna). Pentru aceasta se pot folosi diverse substante titrimetrice: H2C2O4 . 2H2O; Na2C2O4, sare Mohr (sulfat dublu de fier si amoniu: FeSO4 . (NH4)2SO4 . 6H2O), As2O3, solutie titrata de tiosulfat de Na: Na2S2O3.
Deoarece, asa dupa cum s-a aratat, permanganatul actioneaza diferit dupa pH-ul solutiei, dozarile cu aceasta solutie oxidanta se pot grupa in:
a) dozari in mediu puternic acid: pH < 1;
b) dozari in mediu neutru sau aproape neutru;
c) dozari in mediu puternic alcalin: pH > 13.
a) În aceasta
categorie intalnim: dozarea Fe2+,
acidului oxalic si oxalatilor, Ca2+,
H2O2, arsenitilor, Sb3+, ![]() , glucide reducatoare fata de Cu2+, MnO2,
, glucide reducatoare fata de Cu2+, MnO2, ![]() , etc.
, etc.
b) În aceasta categorie, metode cu KMnO4 sunt putine. Cele mai des intalnite sunt dozarea Mn2+ si Cr3+.
2Mn7+ + 3Mn2+ = 5Mn4+
Cr + Mn7+ = Cr6+ + Mn4+
c) În aceasta categorie de analize, KMnO4 se adauga in exces si dupa ce mediul de reactie este lasat un timp dat pentru a se realiza reactia dorita, se retitreaza excesul de KMnO4, fie cu o solutie de formiat de Na (HCOONa) in mediul alcalin, fie cu o solutie de H2C2O4 in mediu acid de H2SO4 si in prezenta de sulfat de mangan.
Iodul elementar este oxidant destul de bland si actioneaza dupa reactia:
I + 2![]() D 2I-
D 2I-
Iodul este greu solubil in apa iar solutia sa nu este stabila, de aceea, iodul se dizolva, de fapt, intr-o solutie de iodura de K sau NaI. Cantitatea de iodura este de doua ori mai mare decat cea de iod. Are loc reactia endoderma:
I + KI ═ K[I3]
Reactia redox in care se afla acest anion este:
![]() D
D ![]()
Iodul poate fi utilizat in:
Ø titrare directa ca titrant in cantitate stoichiometrica, de exemplu:
![]()
Ø titrare inversa: I2 este adaugat in exces, in proba reducatoare si apoi excesul titrat cu tiosulfat, obtinandu-se iod sub forma ionica si tetrationat:
![]()
Ø titrare indirecta: in reactia cu agentii oxidanti, iodul produs este titrat cu tiosulfat de Na standard:
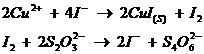
Desi cuplul ![]() existent in
solutia de iod nu implica ionul de hidrogen, utilizarea sa depinde de
pH. La un pH mai mare de 8, iodul prezinta o disproportie
usoara in favoarea I-
si
existent in
solutia de iod nu implica ionul de hidrogen, utilizarea sa depinde de
pH. La un pH mai mare de 8, iodul prezinta o disproportie
usoara in favoarea I-
si ![]() , in timp ce in solutii acide, ionul de iod
este oxidat de catre O2
la I2. Oxidarea este catalizata de lumina si
de cativa ioni metalici, de aceea, aciditatea si puritatea apei
ce se foloseste pentru solutie trebuie controlate cu grija.
, in timp ce in solutii acide, ionul de iod
este oxidat de catre O2
la I2. Oxidarea este catalizata de lumina si
de cativa ioni metalici, de aceea, aciditatea si puritatea apei
ce se foloseste pentru solutie trebuie controlate cu grija.
De asemenea, I2 este destul de volatil, astfel incat pierderile datorate evaporarii pot fi apreciabile (deci trebuie avut grija cum se pastreaza solutiile) si determinat factorul la intervale reduse de timp.
O solutie de iod diluata are o culoare galben-pal si aparitia acestei culori chiar in momentul in care iodul este in exces, poate fi folosita ca indicator pentru titrare, dar acest lucru necesita o practica indelungata. De aceea, pentru reactia cu iodul se foloseste curent amidonul care va suferi cu iodul o reactie ce duce, ca urmare, la producerea unui complex de culoare albastra-intens. Aceasta culoare este usor detectata, chiar la concentratii foarte mici si, de aceea, este de preferat ca indicator.
Iodometria este deosebit
de importanta prin numarul sau mare de aplicatii,
utilizandu-se la determinarea: arsenitilor, Sn2+, hidrogenului sulfurat, sulfuri, Cd, Zn,
Hg, H2SO3, ![]() , ditionitului
, ditionitului![]() , HCN, CN-, N2H4 (hidrazina),
CH2O, CH3-CO-CH3,
Mg, Sb, KMnO4, Me2CrO4, Me2Cr2O7, Ba, Sr, Pb,
, HCN, CN-, N2H4 (hidrazina),
CH2O, CH3-CO-CH3,
Mg, Sb, KMnO4, Me2CrO4, Me2Cr2O7, Ba, Sr, Pb,
![]() glucide, etc.
glucide, etc.
Copyright © 2026 - Toate drepturile rezervate