 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Termodinamica disocierii carbonatilor si oxizilor
Reactia chimica de disociere a unui compus poate fi reprezentata astfel:
I. ABs=As+Bg
AB poate fi: hidroxid, carbonat, oxid.
A- produsul disocierii in stare solida, de cele mai multe ori este MeO si poate fi si metal (Me) provenit in urma disocierii oxizilor metalelor nobile, exemplu Ag rezultat prin disocierea Ag2O.
B- celalalt component al disocierii, aflat in stare gazoasa poate fi CO2, O2 sau H2O(v).
In practica pentru disocierea oxizilor metalici ai metalelor cu mai multe valente, intereseaza disocierea oxizilor superiori, iar in final se obtin oxizi inferiori care ulterior se pot supune proceselor de reducere.
Pentru oxizii superiori disocierea respecta principiul transformarilor succesive, transformarile avand loc in diferite stadii corespunzatoare diagramei de echilibru Me-O. Din aceasta cauza oxizii superiori vor trece prin fazele intermediare ale oxizilor inferiori, teoretic putandu-se ajunge pana la faza metalica, conform schemelor.
CuO→Cu2O→Cu
Fe2O3 →Fe3O4→FeO →Fe
Oxid superior oxid.inf. metal
Din punct de vedere termodinamic in cazul reactiei I se pot pune in evidenta urmatoarele cazuri:
a) Substantele AB, A se pot afla in stare pura, sau se afla sub forma de solutii saturate.
In aceste conditii in conformitate cu legea lui Gibbs sistemul este univariant deoarece cuprinde trei faze (doua faze solide AB, A si faza gazoasa B).
Aplicand legea fazelor: v=n+2-f+2-3=1, sistem univariant.
In aceste conditii presiunea partiala a fazei gazoase rezultata in urma disocierii, va fi functie numai de temperatura, PB=f(T)
Constanta de echilibru este data de relatia:
![]()
unde: aA si aAB- reprezinta activitatile termodinamice ale substantelor A si AB;
PB - presiunea partiala de echilibru a gazului B (tensiunea de disociere).
Pentru substantele in stare pura sau in cazul solutiilor saturate activitatile componentilor sunt egale cu 1.
aA = aAB = 1
ka = PB
PB - se numeste tensiune de disociere a substantei AB sau presiune partiala a fazei B la temperatura T.
Variatia tensiunii de disociere cu temperatura poate fi exprimata cu ajutorul ecuatiei Van't Hoff.
![]()
In conditiile practice, deoarece reactiile chimice de
disociere sunt endoterme, (![]() 0) intotdeauna functia ln PB=f(T) va fi o
functie crescatoare, ceea ce inseamna ca odata cu
cresterea temperaturii se mareste tensiunea de disociere a
oxidului sau a carbonatului.
0) intotdeauna functia ln PB=f(T) va fi o
functie crescatoare, ceea ce inseamna ca odata cu
cresterea temperaturii se mareste tensiunea de disociere a
oxidului sau a carbonatului.
Pe de alta parte reactiile chimice de disociere avand loc cu cresterea de volum, in conformitate cu principiul Le Chatelier aceste reactii vor fi favorizate de micsorarea presiunii din sistem.
Influenta fazei gazoase in care se realizeaza procesul, asupra sensului reactiei de disociere poate fi apreciata cu ajutorul variatiei entalpiei libere a sistemului:
![]()
![]()
unde:
![]() - variatia entalpiei libere a procesului de disociere;
- variatia entalpiei libere a procesului de disociere;
![]() - variatia entalpiei libere standard;
- variatia entalpiei libere standard;
![]() - presiunea partiala initiala a gazului B
in faza gazoasa;
- presiunea partiala initiala a gazului B
in faza gazoasa;
PB - presiunea partiala a gazului B la echilibru (tensiune de disociere).
Daca in conditiile reale se realizeaza procesul de
disociere PB>![]() , pentru entalpia libera vor rezulta valori negative,
ceea ce inseamna ca reactia de disociere se
desfasoara energic de la stanga la dreapta.
, pentru entalpia libera vor rezulta valori negative,
ceea ce inseamna ca reactia de disociere se
desfasoara energic de la stanga la dreapta.
Daca tinem seama de aceasta schimbare energetica a procesului, intotdeauna in astfel de conditii, cu cat diferenta dintre cele doua presiuni partiale este mai mare cu atat disocierea se desfasoara mai energic de la stanga spre dreapta.
Daca PB<![]() , pentru entalpia libera o reactie de disociere
rezulta valori pozitive, deci in astfel de conditii nu este
posibila realizarea procesului de disociere, astfel ca reactia
chimica I se va desfasura de la dreapta la stanga.
, pentru entalpia libera o reactie de disociere
rezulta valori pozitive, deci in astfel de conditii nu este
posibila realizarea procesului de disociere, astfel ca reactia
chimica I se va desfasura de la dreapta la stanga.
b) In unele cazuri substantele AB si A au proprietatea de a forma solutii solide nesaturate (solutii de A in AB sau solutii de AB in A).
In asemenea conditii, in conformitate cu legea fazelor a lui Gibbs sistemul va fi bivalent (2 grade de libertate) v=2+2-2=2.
Din aceasta cauza constanta de echilibru a reactiei I va fi in functie de temperatura si de concentratie.
![]() sau
sau ![]()
![]()
![]()
Pentru solutiile ideale aA=NA; aAB
deci PB=![]()
Fractiile molare NAB si NA pot lua valori intre zero si unu, iar logaritmul tensiunii de disociere (lnPB) ia valori intre +∞ (cand NA→0) si - ∞ (cand NAB→0) si zero (cand PB→1).
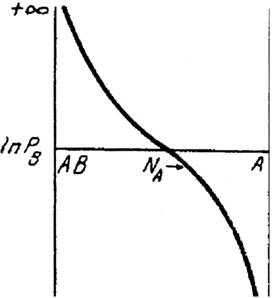
Fig. 5.1. Influenta formarii solutiilor cu solubilitate nelimitata a componentilor asupra tensiunii de disociere a carbonatilor si oxizilor
Cand substantele A si AB prezinta o solubilitate reciproca limitata, variatia logaritmului tensiunii de disociere (lnPB) in functie de compozitie, pune in evidenta trei domenii distincte (fig.5.2).
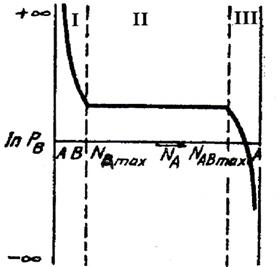
Fig.5.2. Influenta formarii solutiilor cu solubilitate reciproca limitata a componentilor, asupra tensiunii de disociere a carbonatilor si oxizilor
In domeniul I sau prezentat doua faze, sistemul este bivariat, deci kb=f(T,NA) unde NA este fractia molara a lui A in solutia nesaturata de A in AB.
Tensiunea de disociere scade pe masura ce creste concentratia lui A. Cand solutia se satureaza in raport cu A, limita de solubilitate a substantei A in substanta AB este NA(max). Din acest moment sistemul contine trei faze si devine univariat. In domeniul III are loc disocierea substantei AB dizolvata in A, sistemul contine doua faze si este bivariat, deci kb=f(T,NAB).
Odata cu cresterea cantitatii de substanta A, tensiunea de disociere scade treptat pana la valori care tind spre -∞.
c)In unele cazuri substanta AB sau A formeaza solutii solide nesaturate cu o a treia substanta C. In aceste cazuri sistemul cuprinde trei faze (doua faze solide si o faza gazoasa).
[AB]C=[A]C+B(g)
Aparitia acestor combinatii complexe, deseuri conduce la micsorarea tensiunii de disociere, impiedicandu-se realizarea procesului in conditii de temperatura date.
Cu cat solutia solida va contine o cantitate mai mica de substanta AB, cu atat disocierea lui AB se realizeaza mai greu.
Disocierea unui carbonat are loc conform reactiei:
MeCO3(s)=MeO(s)+CO2(g)
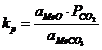
a) Cand MeO si MeCO3 sunt faze independente sau formeaza solutii saturate.
kp=![]() , deci aMeO=
, deci aMeO=![]()
b) In cazul unei solubilitati nelimitate intre MeO si MeCO3
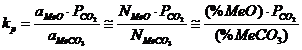
c) Pentru solubilitati limitate ale MeO in MeCO3 sau MeCO3 in MeO;
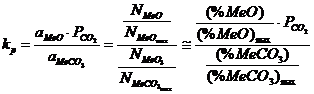
Disocierea unui oxid are la baza reactia chimica:
2MeO = 2Me + O2
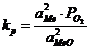
cand MeO si Me nu formeaza solutii solide sau lichide
activitatile Me ale MeO sunt egale cu unu, deci kp=![]() .
.
La echilibru, variatia entalpiei libere pentru disocierea oxidului se exprima prin relatia:
![]()
unde: ![]() - reprezinta tensiunea de disociere a MeO in anumite
conditii de temperatura si presiune.
- reprezinta tensiunea de disociere a MeO in anumite
conditii de temperatura si presiune.
Daca tinem seama de principiul II al termodinamicii:
![]()
si de relatia ln ![]() = -
= - ![]() , rezulta ln
, rezulta ln ![]()
Cu ajutorul acestei ecuatii se poate calcula la diferite
temperaturi, tensiunea de disociere a oxidului atunci cand se cunoaste
caldura de formare ![]() si entropia
ecuatiei
si entropia
ecuatiei ![]() .
.
De obicei in conditii reale, in mediu in care oxidul va fi supus
incalzirii, exista o anumita presiune partiala a
oxigenului (![]() ).
).
In conditiile in care ![]() , unde
, unde ![]() este tensiunea de disociere a oxidului, intotdeauna se va
realiza procesul de disociere. In aceste conditii nu va fi posibila
oxidarea metalului Me.
este tensiunea de disociere a oxidului, intotdeauna se va
realiza procesul de disociere. In aceste conditii nu va fi posibila
oxidarea metalului Me.
Daca ![]() se va realiza intotdeauna oxidarea metalului, disocierea
nefiind posibila.
se va realiza intotdeauna oxidarea metalului, disocierea
nefiind posibila.
Afinitatea metalelor fata de oxigen se exprima prin relatia:
![]()
Pe baza acestei relatii Richardson si Volski au calculat valorile:
trasand diagramele prezentate mai jos si care le poarta numele.
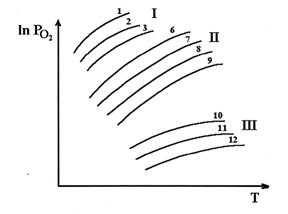
Fig.5.3. Variatia lui ![]() a oxizilor
functie de temperatura
a oxizilor
functie de temperatura
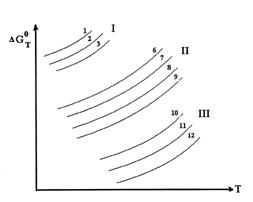
Fig.5.4. Variatia lui ![]() a oxizilor
functie de temperatura
a oxizilor
functie de temperatura
In diagramele din figurile 5.3, 5.4 ne arata afinitatea metalelor fata de O2. Primul grup de curbe (I) de la partea superioara reprezinta variatia tensiunii de disociere in functie de temperatura pentru oxizii cu stabilitate redusa, cum ar fi:
1-Ag2O; 2-CuO; 3-Fe2O3
Al doilea grup de curbe (II) corespund variatiei tensiunilor de disociere pentru oxizii inferiori, notati astfel:
6-Cu2O; 7-PbO; 8-FeO; 9-ZnO.
Grupul trei de curbe (III) corespunde oxizilor care au cea mai mare stabilitate la temperaturi ridicate.
10-Al2O3; 11-MgO; 12-CaO.
In grupul III sunt intotdeauna incadrati oxizii metalici care in conditii normale nu se pot disocia.
Fenomenele se reproduc in diagrama nr.2 unde in grupul de curbe I sunt indicate variatiile entalpiilor libere de formare a oxizilor cu stabilitatea cea mai mica.
In grupul III vor fi oxizi cu entalpiile libere cele mai negative (oxizi stabili).
Pe baza celor doua diagrame de mai sus se pot trage concluziile:
Stabilitatea oxizilor metalici in functie de temperatura descreste de la CaO spre Ag2O.
Oxizii superiori si oxizii mai putin stabili sunt plasati in partea superioara a diagramei. Daca tinem seama de tensiunea de disociere si de entalpiile libere de formare a acestor oxizi, in conditiile industriale reducerea oxizilor respectivi va putea fi realizata fara prea mari dificultati.
Oxizii
plasati in grupul II, in functie de ![]() si
si ![]() prezinta o
oarecare stabilitate la temperatura de prelucrare si din aceasta
cauza reducerea lor necesita o atmosfera puternic
reducatoare. Aceasta atmosfera reducatoare deseori se
bazeaza pe prezenta unei cantitati suplimentare de C
si pe o atmosfera bogata in CO.
prezinta o
oarecare stabilitate la temperatura de prelucrare si din aceasta
cauza reducerea lor necesita o atmosfera puternic
reducatoare. Aceasta atmosfera reducatoare deseori se
bazeaza pe prezenta unei cantitati suplimentare de C
si pe o atmosfera bogata in CO.
Oxizii plasati in partea inferioara a diagramelor prezinta cea mai mare stabilitate, din aceasta cauza in conditii industriale reducerea lor necesita o atmosfera foarte puternic reducatoare, deseori reducerea putand avea loc numai pe baza de C si la temperaturi foarte ridicate, adesea aceste reactii nu pot fi realizate in agregatele normale metalurgice.
Oxizii superiori ai unui metal care prezinta mai multe grade de valenta, sunt foarte instabili la cresterea temperaturii.
Intotdeauna sunt plasati in partea superioara diagramelor Richardson-Volski; reducerea acestor oxizi se realizeaza la concentratii foarte mici de CO din faza gazoasa.
Intotdeauna disocierea acestor oxizi respectiv principiul transformarii succesive in prima etapa formandu-se oxidul inferior si ulterior faza metalica.
De regula reactiile chimice care au loc la formarea sau disocierea carbonatilor sau a oxizilor sunt reactii topochimice. Aceste procese se desfasoara cu ridicarea temperaturii, vitezele lor fiind proportionale cu suprafata de reactie.
Asemenea reactii topochimice sunt:
reactii de formare si disociere a sulfatilor;
reactiile chimice de reducere a oxizilor cu CO, H2.
Studiile privind cinetica reactiilor topochimice pentru carbonati au la baza formarea componentului AB.
A(s) + B(g)=AB(s)
Unde:
A- poate fi un metal Me sau MeO
B- poate fi O2 sau CO2.
Cinetica reactiilor topochimice de formare a compusului (carborantului) exprimata cu ajutorul urmatoarelor diagrame:
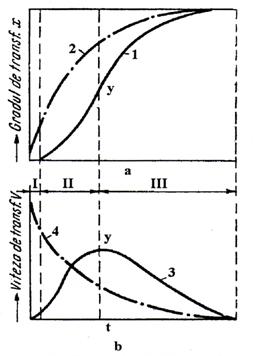
Fig. 5.5. Cinetica reactiilor topochimice:
a- variatia gradului de transformare functie de timp; b-variatia vitezei de transformare in functie de timp.
Studiile cinetice efectuate in legatura cu acst proces au pus in evidenta urmatoarele perioade.
In aceasta perioada viteza de reactie este foarte redusa moleculele de O2 adsorbite (moleculele gazului B) vor intra in reactie cu centrele active existente la suprafata substantei A (Me); centrele active (centrele TAZLOR)corespund punctelor care sunt mai slab legate de centrele cristaline de la suprafata A, formand primii germeni ai noii faze cristaline - AB.
In aceasta perioada viteza de reactie creste foarte mult ajungand la valoarea maxima (y). Cresterea vitezei de reactie se explica pe baza formarii si dezvoltarii suprafetei interfazice A/AB (Me/MeO), suprafata care accelereaza reactia chimica specifica.
In aceasta perioada se constata micsorarea vitezei procesului deoarece zonele de reactie aparute la diversi centri se contopesc in una singura, a carei suprafata se micsoreaza continuu pe masura ce se desfasoara procesul. Procesul de crestere a noii faze este prezentat in fig. 5.6. prin semicercuri cu raze din ce in ce mai mari. Cand se produce contopirea tuturor fronturilor de reactie, viteza de reactie atinge valoarea maxima iar perioada autocatalitica inceteaza.
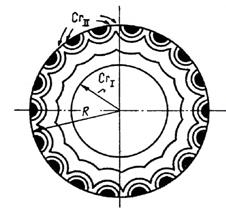
Fig. 5.6. Schema dezvoltarii unei reactii topochimice:
Cr1 - substanta cristalina initiala; CrII- produsul cristalin al reactiei.
Cinetica proceselor care au la baza reactii topochimice se determina prin variatia vitezei (v) si a gradului de transformare (x), in functie de timp.
Variatia vitezei de transformare in functie de timp (curba
nr.3) se obtine prin derivarea gradului de transformare (x) in
functie de timp (curba 1), deoarece ![]() .
.
Valorile pozitive ale celei de-a doua derivate ![]() arata
cresterea vitezei de reactie (portiunea concava a curbei
nr.1 pana la atingerea punctului y).
arata
cresterea vitezei de reactie (portiunea concava a curbei
nr.1 pana la atingerea punctului y).
Valorile negative ale celei de-a doua derivate arata micsorarea
vitezei de reactie portiunea convexa a curbei 1 la dreapta
punctului (y) punct care indica pe curba 3 valoarea maxima a vitezei
de transformare, iar pe curba 1 punctul de inflexiune ce pune in
evidenta schimbarea de semn a celei de-a doua derivate ![]() .
.
Curbele 2 si 4 caracterizeaza cinetica procesului cand perioadele de incubatie si autocatalitica sunt foarte mici.
Un asemenea fenomen se realizeaza intotdeauna in domeniul temperaturilor foarte ridicate.
In conditiile curbelor 2 si 4 apare un numar foarte mare de centri activi (centri Taylor), vitezele de reactie luand valori aproape maxime inca de la fazele initiale ale procesului.
Prin urmare daca tinem seama de aspectele cinetice descrise mai sus in zona temperaturilor foarte ridicate, intotdeauna procesul de formare sau de disociere se va realiza cu viteze foarte mari desfasurate pe baza unei reactii de ordinul I.
Ecuatia generala a cineticii proceselor topochimice se prezinta sub forma:
![]()
unde: ![]() - reprezinta cantitatea de substanta care a
reactionat in timpul (t);
- reprezinta cantitatea de substanta care a
reactionat in timpul (t);
k - constanta vitezei de reactie;
n- coeficient a carei valoare variaza in functie de caracterul cinetic al procesului;
Cand n=1 centrii activi se formeaza simultan pe intreaga suprafata a compusului, procesul fiind descris de curbele 2 si 4.
In conditii reale prezenta unei substante gazoase, altele decat substanta B poate influenta pozitiv sau negativ cinetica procesului de formare sau de disociere.
Disocierea incepe intotdeauna in locurile defecte ale suprafetei cristalelor adica in punctele de deformare maxima a retelei cristaline.
Procesul de disociere a curbelor cupinde urmatoarele etape:
a) Descompunerea anionului ![]() cu formarea anionului
O2- si a moleculei adsorbite de CO2.
cu formarea anionului
O2- si a moleculei adsorbite de CO2.
![]() →O2-+[CO2]
→O2-+[CO2]
[CO2]→(CO2)ads
b) Desorbtia moleculelor CO2
Odata cu disocierea carbonatului, cu descompunerea ![]() se produce si
indepartarea CO2 in faza gazoasa.
se produce si
indepartarea CO2 in faza gazoasa.
Aceasta desorbtie se realizeaza cu viteza mare cand
se produce in locurile defecte ale suprafetei si mai lent cand CO2
paraseste straturile adanci ale cristalului, deoarece face
posibil formarea ![]() .
.
c) Rearanjarea (reconstructia) retelei cristaline a carbonatului in reteaua produsului de disociere.
Aceasta etapa determina in general cinetica procesului de disociere a carbonatilor.
Schema procesului de disociere a carbonatilor se poate prezenta astfel:
MeCO3(s)![]() MeO(s). (CO2)ads
MeO(s). (CO2)ads
MeO(s).(CO2)ads![]() MeO(s)+CO
MeO(s)+CO
MeO format se prezinta sub forma unei substante poroase, foarte ramificate iar transformarea MeCO3 in MeO are loc cu micsorarea de volum a substantei cristaline, de 2,2 ÷2,4 ori.
Cinetica procesului de disociere a carbonatilor depinde de
stabilirea anionului ![]() , de suprasaturarea chimica, de diferenta dintre
tensiunea de disociere a carbonatului si presiunea partiala a CO2
din sistem, de temperatura, de activitatea substantei cristaline
initiale etc.
, de suprasaturarea chimica, de diferenta dintre
tensiunea de disociere a carbonatului si presiunea partiala a CO2
din sistem, de temperatura, de activitatea substantei cristaline
initiale etc.
La descompunerea oxidului sau carbonului, in faza initiala, datorita variatiilor mici de densitate si concentratie din sistem (fluctuatii omogene), se formeaza o solutie de Me in MeO (sau de MeO in MeCO3).
In etapa urmatoare a procesului cand au loc variatii mari de densitate si concentratie, (fluctuatie heterofazica) si sistemul poate trece de la o stare fazica la alta.
Prpbabilitatea aparitiei ambelor tipuri de fluctuatii P este data de reactia:
P = A![]()
In care:
K - constanta lui Boltzman;
A - coeficientul de proportionalitate;
![]() - variatia entalpiei libere a sistemului datorita
fluctuatiei heterofazice.
- variatia entalpiei libere a sistemului datorita
fluctuatiei heterofazice.
![]()
unde:
n- numarul de moli de substanta care se afla in noua stare;
![]() -tensiunea superficiala;
-tensiunea superficiala;
2- potential chimic al substantei in faza pura (sau solutie saturata de Me in MeO respectiv MeO in MeCO3.
1- potential chimic al Me in solutie cu MeO respectiv MeO in solutie cu MeCO3).
![]() - factorul numeric in expresia S=
- factorul numeric in expresia S=![]() n2/3, care depinde de forma geometrica a
fluctuatiei aparute;
n2/3, care depinde de forma geometrica a
fluctuatiei aparute;
S- suprafata de separare interfazica.
Egaland cu zero prima derivata a lui ![]() in raport cu n, se
afla ncritic:
in raport cu n, se
afla ncritic:
![]() rezulta
rezulta
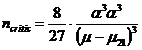
Energia de activare a procesului de formare a noii faze este determinata de lucrul necesar crearii germenilor critici conform relatiei:
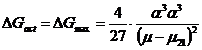
pentru ca particulele sa treaca peste limita inferioara
(dintr-o faza in alta v![]() →n) au nevoie de un exces de energie E. frecventa
trecerilor (
→n) au nevoie de un exces de energie E. frecventa
trecerilor (![]() ) este data de relatia:
) este data de relatia:
![]()
unde:
h- constanta lui Planck;
K- Constanta lui Boltzman
Marimea E poate fi considerata aproximativ egala cu asa numita energie de activare intalnita in relatia ce exprima dependenta de temperatura a coeficientului de difuzie a substantei II dizolvata in substanta I.
D = D0 ![]()
Constanta vitezei de formare a germenilor critici sau a centrelor de cristalizare a noii faze este proportionala cu produsul dintre Pmin. si D.
![]()
unde:
K- constanta vitezei de formare a germenilor
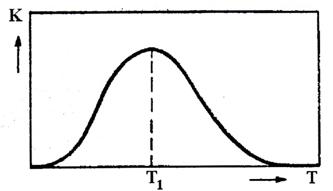
Din aspectul curbei rezulta ca exista o perioada cand germenii noi formati au o viteza mica de trecere din faza veche in cea noua, dupa care viteza creste, atinge un maxim (T1→kmax.) apoi constanta vitezei scade tinzand la zero.
In conditii reale oxidarea metalelor poate fi realizata cu participarea fazelor solide sau lichide.
Efectul caloric de la reactiile de oxidare a metalelor depinde de starea de agregare a metalului (Me) si a oxidului (MeO). Cand metalul (Me) se gaseste in stare topita, efectul caloric al reactiei de oxidare este mai mare decat in cazul aceluiasi metal in stare solida. Diferenta dintre cele doua efecte calorice este egala cu valoarea caldurii de topire a metalului.
a)Oxidarea metalului in stare solida
La temperaturi obisnuite, oxidarea metalelor se realizeaza cu viteze foarte mici.
Procesul de oxidare se accelereaza in prezenta catalizatorilor, a vaporilor de apa si odata cu cresterea temperaturii.
In principiu procesul de oxidare este influentat de numerosi factori:
natura metalului supus oxidarii;
durata procesului;
presiunea si concentratia agentului oxidant;
temperatura;
viteza de deplasare a mediului gazos in raport cu suprafata supusa oxidarii;
viteza de difuzie a agentului oxidant prin stratul de oxizi de la suprafata metalului.
Din punct de vedere cinetic, oxidarea Me in stare solida, va fi conditionata de urmatoarele etape:
difuzia oxigenului din atmosfera catre suprafata de interfata, de separarea dintre faze;
adsorbtia moleculelor de pe suprafata de reactie;
difuzia O2 si a particulelor elementare de Me prin stratul oxidat;
transformarile cristalo-chimice legate de variatia compozitiei si a structurii retelei fazei solide.
In conditii reale oxidarea metalelor se poate realiza in regim cinetic sau de difuzie.
In aceste conditii oxidarea metalului se realizeaza la temperaturi joase, intotdeauna stratul de oxid format are o grosime mica.
In conditiile regimului cinetic, viteza de oxidare este determinata de transformarile cristalo-chimice ale substantei respective.
In regimul cinetic procesul de oxidare poate fi exprimat cu relatia:
![]()
unde:
![]() - reprezinta cresterea greutatii
metalului supus oxidarii pe unitatea de suprafata;
- reprezinta cresterea greutatii
metalului supus oxidarii pe unitatea de suprafata;
k1- constanta vitezei reactiei de oxidare;
![]() - presiunea partiala a O2 din atmosfera
in care se desfasoara reactia chimica;
- presiunea partiala a O2 din atmosfera
in care se desfasoara reactia chimica;
t- timpul.
In aceste conditii procesul de oxidare se realizeaza in mare masura din cauza cresterii temperaturii.
Din aceasta situatie stratul de oxid format are o grosime mare, viteza de oxidare fiind conditionata de difizia agentului oxidant la zona de reactie.
Nu este exclus ca in regimul de difuzie, cinetica procesului de oxidare sa fie conditionat de difuzia atomilor metalului la zona de reactie.
Oxidarea in regim de difuzie poate fi exprimata cu relatia:
![]()
unde:
![]() - cresterea in greutate pe unitatea de
suprafata a probei supuse oxidarii;
- cresterea in greutate pe unitatea de
suprafata a probei supuse oxidarii;
k2- constanta vitezei reactiei de oxidare;
![]() - presiunea partiala a O2.
- presiunea partiala a O2.
t- timpul.
In conditii reale, deseori in timpul oxidarii metalului se poate intalni doua cazuri:
VMeO>VMe (I)
Unde:
VMeO- volumul oxidului, MeO, format in timpul incalzirii;
VMe- volumul metalului consumat pentru formarea MeO.
Intotdeauna aceasta conditie se realizeaza in regimul de difuzie al procesului de oxidare a metalelor.
Principalele metale care respecta aceasta inegalitate a I-a sunt date in tabelul 5.1:
Tabelul 5.1.
Metal |
Cd |
Al |
Pb |
Sn |
Zn |
Ni |
|
Oxid |
CdO |
Al2O3 |
PbO |
SnO2 |
ZnO |
NiO |
|
VMe/VMeO |
Intotdeauna in cazul acestor metale, ca rezultat al procesului de oxidare se formeaza un strat compact de oxizi.
VMeO<VMe (II)
In aceste conditii oxidarea se realizeaza usor, stratul de oxid fiind foarte poros.
Aparitia fisurilor in stratul de oxizi va accelera procesul de oxidare predominand in ansamblul regimului cinetic.
Principalele metale care respecta inegalitatea (II) sunt redate in tabelul 5.2:
Tabelul 5.2.
|
metal |
K |
Na |
Ca |
Mg |
|
Oxid |
K2O |
Na2O |
CaO |
MgO |
|
VMe/VMeO |
c) Oxidarea metalelor in stare lichida
In conditii reale metalele in stare lichida se oxideaza mult mai intens decat in stare solida deoarece in stare lichida se constata o mai mare mobilitate a atomilor metalelor, atomii care pot veni in contact cu O2 dizolvat in topitura metalului.
Studiile cinetice in aceste procese au scos in evidenta ca in ansamblu oxidarea va fi conditionata de doi factori:
viteza de formare a MeO;
viteza de difuzie in baia metalica, reprezentata de metalul topit.
O serie de metale au proprietatea de a dizolva fara dificultate oxizii lor.
Exemplu: Cu dizolva usor Cu2O si Fe dizolva FeO.
Dizolvarea acestor oxizi in topituri, contribuie in mare masura la rafinarea oxidata topiturii metalice, deoarece elementele insotitoare au afinitate mai mare fata de O2 decat metalul, si ca urmare acestea se pot oxida trecand in zgura sau partial in faza gazoasa.
In conditii reale se pot intalni deseori trei cazuri importante in care intervin procese de disociere a oxizilor, cu participarea fazei lichide.
In acest caz se pune problema cum se comporta MeO in topitura si in ce conditii acest MeO poate fi eliminat pentru a nu provoca o serie de modificari in ceea ce priveste proprietatile fizice si tehnologice ale metalului Me.
II. Cand Me'O si Me' se gasesc dizolvti in topitura metalica Me.
In conditii reale se urmareste modul de comportare a impactului Me' si a oxidului Me'O in procesul de elaborare a metalului Me.
Pe aceasta baza va fi necesar sa se stabileasca conditiile de echilibru a MeO, respectiv limita pana la care poate fi eliminat Me' din topitura Me.
III. Cand MeO se gaseste dizolvat in zgura sub forma unor combinatii chimice complexe (MeO.RO).
In acest caz se urmareste adesea scoaterea MeO din zgura in vederea cresterii randamentului de elaborare a Me, care constituie componentul de baza a topiturii metalice.
Pentru toate cele trei cazuri intereseaza variatiile entalpiilor libere a reactiilor de dizolvare a oxizilor in topituri, corelate cu tensiunile de disociere si cu potentialul de oxigen al MeO.
In cazul sistemelor complexe stabilitatea acesteia va fi conditionata de corelatia dintre tensiunea de disociere si entalpiile libere de formare. Pentru sistemele complexe intereseaza in mod deosebit sistemul de oxigen al oxizilor.
Prin definitie, potentialului de oxigen reprezinta
variatia potentialului chimic al oxigenului in conditii
izoterme, la trecerea unui mol de oxigen, dintr-o stare corespunzatoare
unei presiuni partiale a O2 egala cu o atmosfera, la
o alta stare corespunzatoare presiunii ![]() .
.
Expresia matematica pentru potentialul de O2 in raport cu definitia de mai sus este:
П0=![]()
In aceste conditii potentialul de oxigen este egal cu
variatia entalpiei libere ![]() corespunzatoare reactiei de formare a oxidului in
raport cu un mol de O2, reactia fiind considerata pentru
conditiile standard.
corespunzatoare reactiei de formare a oxidului in
raport cu un mol de O2, reactia fiind considerata pentru
conditiile standard.
Pentru un metal bivalent relatiile matematice care permit calcularea potentialului de oxigen, au la baza reactia chimica de formare a MeO:
2Me+O2=2MeO
![]() =RTlnk=-RTln
=RTlnk=-RTln![]()
Pe baza relatiei de mai sus potentialul de oxigen a oxidului MeO se poate exprima cu relatia:
![]()
unde:
![]() Σ(
Σ(![]() )- entalpiile libere corespunzatoare
transformarilor de faza ale Me sau MeO.
)- entalpiile libere corespunzatoare
transformarilor de faza ale Me sau MeO.
In raport cu ultima relatie valorile potentialului de oxigen vor determina stabilitatea sau instabilitatea MeO.
In relatia de mai sus ![]() reprezinta entalpia libera standard de formare a
MeO in raport cu un mol de O2.
reprezinta entalpia libera standard de formare a
MeO in raport cu un mol de O2.
Pe baza acestei relatii se pot desprinde urmatoarele concluzii pentru stabilitatea oxizilor:
a) Daca MeO se gaseste sub forma de solutii nesaturate in sistemul considerat (aMeO<1), potentialul de oxigen scade si din aceasta cauza oxidul din solutie va fi intotdeauna mai stabil. Reducerea sa din solutii necesita concentratii mari de CO adica atmosfere puternic reducatoare.
Aceasta situatie se intalneste in practica cand Me se dizolva fara dificultate in zguri.
Un asemenea fenomen se intalneste intotdeauna la elaborarea fontelor de prima fuziune, in metalurgia Pb, Ni, Zn.
In cadrul acestor procese, oxizii respectivi: FeO, ZnO, PbO, niO trec foarte usor in zguri, reducerea lor in vederea cresterii randamentului de elaborare, necesita o atmosfera puternic reducatoare in comparatie cu reducerea lor normala (cand ei au forma sisteme monocomponente).
b) Daca Me formeaza solutii lichide sau solide nesaturate (aMe<1) potentialul de oxigen creste si implicit stabilitatea va fi mai mica.
Un asemenea fenomen se intalneste in practica, cand impuritatile se dezvolta in stare metalica in metalul brut Me.
Exemplu: - Procesele de afinare a metalelor, cand urmeaza sa se elimine elementele (impuritatile) cu potential de oxigen mai mic decat potentialul de oxigen a Me, oxidarea fiind realizata prin insuflare de O2 sau de aer.
In principiu in toate aceste cazuri, stabilitatea oxizilor impuritatilor se micsoreaza din cauza dizolvarii lor si ca atare impuritatile respective nu pot fi eliminate peste o anumita limita, deoarece potentialul de oxigen al impuritatilor poate deveni mai mare decat potentialul de oxigen al oxidului metalului.
Tensiunea de disociere a oxizilor aflati in solutie sau sub forma de combinatii chimice.
Se urmaresc urmatoarele cazuri:
Tensiunea de disociere a MeO dizolvat in Me topit;
Tensiunea de disociere a Me'O format in urma oxidarii Me'(impuritate) dizolvat in Me;
Tensiunea de disociere cand MeO se gaseste in zgura sau in combinatii complexe
I. Tensiunea de disociere a MeO dizolvat in Me topit;
In conditii industriale deseori in topitura metalica Me se insufla aer sau oxigen tehnic in vederea eliminarii impuritatilor sau pentru corectarea compozitiei chimice.
In conformitate cu legea actiunii maselor, deoarece metalul Me predomina in topitura, el va fi primul element care se va oxida la MeO.
Reactia chimica de formare a MeO este:
2[Me]+O2=2[MeO]
Pentru o serie de metale uzate oxizii de forma meO se dizolva foarte usor in baia metalica formata din metalul Me.
Acest fenomen-prezinta un mare avantaj in procesele de afinare deoarece acesti oxizi vor transmite oxigenul impuritatilor care urmeaza sa fie eliminate.
In asemenea cazuri variatia entalpiei libere in procesul de formare a MeO se exprima prin relatia:
![]() =RTln
=RTln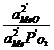 =-RTln
=-RTln![]()
Unde:
![]() - reprezinta presiunea partiala
initiala a O2 deasupra sistemului;
- reprezinta presiunea partiala
initiala a O2 deasupra sistemului;
![]() - presiunea partiala la echilibru sau tensiunea de
disociere;
- presiunea partiala la echilibru sau tensiunea de
disociere;
![]() - reprezinta activitatile initiale ale Me
si MeO;
- reprezinta activitatile initiale ale Me
si MeO;
aMe, aMeO- activitatea de echilibru.
Daca consideram concentratiile sau
activitatile initiale ale Me si MeO egale cu 1; ![]() egala cu 1, primul termen va fi zero si in aceste
conditii entalpia libera standard a Me pentru O2 se
calculeaza cu relatia:
egala cu 1, primul termen va fi zero si in aceste
conditii entalpia libera standard a Me pentru O2 se
calculeaza cu relatia:
![]() =RTln
=RTln![]() =-RTlnk
=-RTlnk
Aceasta este relatia fundamentala pe baza careia se pot calcula tendintele de oxidare a metalelor in anumite conditii de temperatura si presiune.
Prin influenta O2 se va modifica concentratia Me in topitura simultan cu modificarea concentratiei oxidului MeO.
O2→[Me]→[MeO]
↓ ↓ t1
[Me]1→[MeO]1
↓ ↓ t2
[Me]2→[MeO]2![]() [MeO]max
[MeO]max
Tensiunea de disociere a MeO in conformitate cu relatia de mai sus poate fi exprimata cu relatia:
![]()
![]()
Dupa un anumit timp de insuflare a O2 in topitura concentratia oxidului MeO va fi [MeO]1.
Pentru aceasta concentratie tensiunea de disociere a MeO se calculeaza cu ajutorul relatiei:
![]()
![]()
In relatia de mai sus s-au
inlocuit activitatile cu concentratiile, cu deosebirea ca ![]() reprezinta
tensiunea de disociere a MeO aflat in topitura de metal Me, la
concentratia [MeO]1.
reprezinta
tensiunea de disociere a MeO aflat in topitura de metal Me, la
concentratia [MeO]1.
La continuarea procesului de oxidare, se formeaza o alta concentratie a oxidului dizolvat in baia metalica respectiv [MeO]2. Pentru aceasta concentratie tensiunea de disociere a oxidului se exprima prin relatia:
(2) ![]()
![]()
[MeO]2 - reprezinta concentratia oxidului din topitura in conditiile in care metalul topit dizolva oxidul metalului dupa timpul (t2) de insuflare a oxigenului in baia metalica.
Influenta continua a oxigenului in topitura va creste concentratia MeO pana ce topitura va ajunge la saturatie.
Prin impartirea relatiei 1 cu relatia 2 se obtine
![]()
![]()
In conditiile in care topitura devine saturata in MeO
concentratia ![]() .
.
[MeO]max - reprezinta concentratia maxima de oxid ce poate fi dizolvata de topitura Me la temperatura la care are loc procesul.
Acestei concentratii maxime
ii corespunde o tensiune de disociere ![]() maxima. In
conditiile industriale concentratia de MeO dizolvata in mod
obisnuit nu modifica in mare masura compozitia Me
si din aceasta cauza
maxima. In
conditiile industriale concentratia de MeO dizolvata in mod
obisnuit nu modifica in mare masura compozitia Me
si din aceasta cauza ![]() se considera egal
cu unu.
se considera egal
cu unu.
Prin urmare se obtine relatia:
![]() =
=![]()
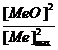
Pentru un metal trivalent reactia de oxidare a metalului este:
2[Me]+3/2O2=[Me2O3]
![]() =
=![]()
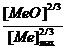
unde: ![]() - reprezinta tensiunea de disociere a MeO dizolvat in
topitura metalica Me la un moment dat [MeO].
- reprezinta tensiunea de disociere a MeO dizolvat in
topitura metalica Me la un moment dat [MeO].
![]() - reprezinta tensiunea de disociere a MeO aflat in
topitura metalica Me la concentratie maxima, care este
egala cu tensiunea de disociere a oxidului in stare libera. La
concentratia maxima a MeO in Me topit, cand topitura este
saturata in MeO, se poate considera ca MeO este o faza
independenta.
- reprezinta tensiunea de disociere a MeO aflat in
topitura metalica Me la concentratie maxima, care este
egala cu tensiunea de disociere a oxidului in stare libera. La
concentratia maxima a MeO in Me topit, cand topitura este
saturata in MeO, se poate considera ca MeO este o faza
independenta.
[MeO] - reprezinta concentratia oxidului dizolvat la un moment dat in Me.
Reprezentarea grafica a
![]() =f(%MeO)
=f(%MeO)
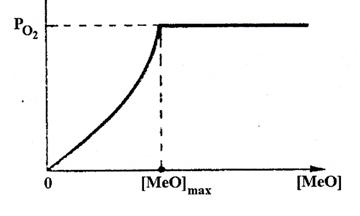
Fig.5.8. Tensiunea de disociere a oxidului MeO in solutie functie de concentratie.
Pe baza graficului de mai sus se pot enumera urmatoarele concluzii:
a) tensiunea de disociere a MeO aflat in solutia lichida sau solida va fi intotdeauna mai mica decat tensiunea de disociere a oxidului in stare libera;
b) Cu cat concentratia oxidului in solutie va fi mai mica fata de concentratia de saturatie, tensiunea de disociere se micsoreaza iar stabilitatea MeO dizolvat este mai mare;
c) Tensiunea de disociere a MeO devine infinit de mica cand continutul de MeO→0. In aceste conditii stabilitatea oxidului este atat de mare incat nu mai permite disocierea sau reducerea sa din topitura chiar la concentratii mari de CO.
In conditii industriale asemenea situatii se intalnesc in procesul de rafinare oxidanta a metalelor si a aliajelor neferoase care dizolva oxidul lor in topitura metalica, in procesul de elaborare a otelurilor deoarece fierul dizolva FeO
Copyright © 2025 - Toate drepturile rezervate