 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
MODELE ATOMICE
Crearea de modele pentru descrierea unor structuri materiale din natura reprezinta o componenta importanta a efortului uman de intelegere si explicare a fenomenelor din lumea inconjuratoare.
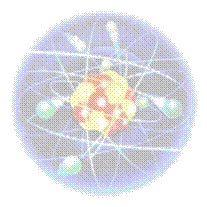
Grecii din antichitate si-au imaginat lumea ca fiind construita din mici particule, indivizibile si imuabile, numite de ei drept atomi. Dupa descoperirea electronului (in 1895), Thomson a propus (in 1904) un model care descria atomul ca o sfera incarcata pozitiv in care erau scufundate mici bilute incarcate negativ (electroni). Acest model, numit 'modelul cozonacului cu stafide', a fost apreciat ca fiind 'corect', pana cand experimentele efectuate de Rutherford si colaboratorii sai au evidentiat deficientele sale.
De aceea, Rutherford a propus modelul planetar al atomului, in care atomul era considerat ca fiind format dintr-un nucleu incarcat cu o sarcina pozitiva in jurul caruia se misca electronii, precum planetele in jurul Soarelui. Si acest model a fost apreciat ca fiind 'corect', pana cand au fost observate deficientele sale. Atunci Bohr a propus modelul sau in care electronii se misca pe orbite circulare stationare in jurul nucleului, fara a pierde energie. Ulterior, Sommerfeld a modificat modelul lui Bohr afirmand ca electronii se pot misca nu numai pe orbite circulare ci si pe orbite eliptice.
In 1926, modelul lui Bohr a fost si el inlocuit, fiind propus un model al atomului bazat pe legile mecanicii cuantice. In acest ultim model, electronii erau imaginati ca avand forma unor nori ('nori electronici') in jurul nucleului central.
Evolutii similare (succesiuni de modele) pot fi regasite in toate capitolele fizicii.
Din toate acestea este important sa realizam faptul ca fizicienii, ca si ceilalti oameni de stiinta, fac eforturi continue pentru o mai buna cunoastere si intelegere a fenomenelor din natura. In cursul acestui proces ei realizeaza modele mai bune atunci cand constata ca modelul anterior nu este atat de bun pe cat il credeau pana atunci. Ei au inteles treptat faptul ca cel mai nou model la un moment dat s-ar putea sa nu fie 'raspunsul final' la problema respectiva; ca va fi si el, probabil, abandonat si inlocuit in viitor cu unul mai bun.
Oamenilor de stiinta le face realmente placere acest proces de 'inventariere' a unor modele mereu mai complexe, capabile de a da raspunsuri unui numar mereu mai mare de intrebari. Aceasta nu inseamna ca succedarea modelelor este un joc. Cascada modelelor in stiinta ne arata ca stiinta are un caracter deschis, ca aceasta nu da niciodata 'raspunsuri finale', ca ceea ce astazi e apreciat ca fiind 'corect', maine s-ar putea sa fie considerat 'insuficient'.
Conceptia atomista despre substante a fost formulata, pe cale pur speculativa, in antichitate, de filozofii greci Leucid si Democrit (secolele V-IV i.Hr.). Aceasta conceptie pornea de la ipoteza ca substanta are o structura discreta, fiind constituita din particule indivizibile, invariabile si eterne, numite atomi (numele provine din limba greaca: atomos - care nu poate fi divizat).
Fizica atomica propriu-zisa, ca stiinta a structurii atomilor si a modului in care structura determina proprietatile fizice ale acestora, s-a dezvoltat practic numai in secolul XX (modelul Thomson - 1904, modelul planetar al lui Ruherford - 1911, modelul Bohr - 1913, mecanica cuantica - 1926).
Pentru determinarea masei atomilor se foloseste spectometrul de masa, iar unitatea de masura este unitatea atomica de masa.

O serie de fenomene si procese din fizica electricitatii demonstreaza ca atomilor trebuie sa li se atribuie proprietatea de a accepta si de a ceda electroni. Astfel de fenomene sunt: efectul fotoelectric, emisia termoelectrica.
 Electronul este o particula elementara avand
sarcina electrica qe =
-e = -1,6*10-19 C, masa sa fiind foarte mica: de fapt, ea este
mult mai mica decat masa unui atom.
Electronul este o particula elementara avand
sarcina electrica qe =
-e = -1,6*10-19 C, masa sa fiind foarte mica: de fapt, ea este
mult mai mica decat masa unui atom.
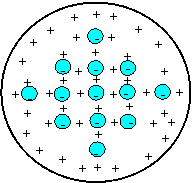 Primul model de atom a fost cel al lui Thomson, in
care electronii sunt fixati elastic in interiorul unei sfere umplute
uniform cu sarcini pozitive. Dar acest model nu poate explica cum stau
sarcinile pozitive, uniform distribuite, fara sa se
respinga intre ele si nu poate explica satisfacator nici
emisia radiatiei luminoase. In principiu, sarcinile din interiorul
atomului nu pot fi distribuite decat in doua moduri: grupate in locuri
diferite spatial sau in aceeasi regiune spatiala
restransa. Bombardand atomii cu un fascicul paralel de particule
incarcate, in primul caz ele vor interactiona cu sarcini de un fel
sau de altul si vor fi puternic deviate (imprastiate), pe cand
in cazul al doilea, sarcinile fiind foarte strans unite, campul electric creat
de ele va fi extrem de slab, interactiunea va fi foarte slaba, deci
particulele practic nu vor fi deviate. Rutherford, bombardand atomii cu
particule incarcate electric, a observat ca ele sunt puternic
deviate, deci a dovedit astfel ca sarcinile din atom sunt separate
spatial, deci modelul Thomson a fost abandonat.
Primul model de atom a fost cel al lui Thomson, in
care electronii sunt fixati elastic in interiorul unei sfere umplute
uniform cu sarcini pozitive. Dar acest model nu poate explica cum stau
sarcinile pozitive, uniform distribuite, fara sa se
respinga intre ele si nu poate explica satisfacator nici
emisia radiatiei luminoase. In principiu, sarcinile din interiorul
atomului nu pot fi distribuite decat in doua moduri: grupate in locuri
diferite spatial sau in aceeasi regiune spatiala
restransa. Bombardand atomii cu un fascicul paralel de particule
incarcate, in primul caz ele vor interactiona cu sarcini de un fel
sau de altul si vor fi puternic deviate (imprastiate), pe cand
in cazul al doilea, sarcinile fiind foarte strans unite, campul electric creat
de ele va fi extrem de slab, interactiunea va fi foarte slaba, deci
particulele practic nu vor fi deviate. Rutherford, bombardand atomii cu
particule incarcate electric, a observat ca ele sunt puternic
deviate, deci a dovedit astfel ca sarcinile din atom sunt separate
spatial, deci modelul Thomson a fost abandonat.
 Un model atomic bazat pe echilibrul dinamic
al sarcinilor este analog sistemului solar in care fortele centrifuge
echilibreaza fortele de atractie gravitationala.
Atomul are o parte centrala numita nucleu, incarcati
pozitiv, in jurul careia se rotesc electronii. Deci sarcinile sunt
separate spatial. Concordanta modelului planetar atomic cu
experianta este foarte buna. E. Rutherford a fost capabil sa
calculeze care va fi numarul de particule α deviate sub un unghi dat
si a dedus din datele experimentale ca partea centrala pozitiva
se intinde pe o zona cu dimensiunea de 10-13 - 10-12
cm. Comparand cu dimensiunea unui atom 10-8 cm, tragem concluzia ca
el este mai mult gol decat plin. In acest fel, modelul planetar propus
inca din 1901 de J. Perrin, a fost definitiv acceptat ca urmare a
experientelor lui E. Rutherford. Ca si in cazul modelului Thomson
ramane de explicat motivul pentru care sarcinile pozitive din nucleu nu se
desfac.
Un model atomic bazat pe echilibrul dinamic
al sarcinilor este analog sistemului solar in care fortele centrifuge
echilibreaza fortele de atractie gravitationala.
Atomul are o parte centrala numita nucleu, incarcati
pozitiv, in jurul careia se rotesc electronii. Deci sarcinile sunt
separate spatial. Concordanta modelului planetar atomic cu
experianta este foarte buna. E. Rutherford a fost capabil sa
calculeze care va fi numarul de particule α deviate sub un unghi dat
si a dedus din datele experimentale ca partea centrala pozitiva
se intinde pe o zona cu dimensiunea de 10-13 - 10-12
cm. Comparand cu dimensiunea unui atom 10-8 cm, tragem concluzia ca
el este mai mult gol decat plin. In acest fel, modelul planetar propus
inca din 1901 de J. Perrin, a fost definitiv acceptat ca urmare a
experientelor lui E. Rutherford. Ca si in cazul modelului Thomson
ramane de explicat motivul pentru care sarcinile pozitive din nucleu nu se
desfac.
Cercetarile experimentale efectuate de E. Rutherford au condus la urmatoarele rezultate:
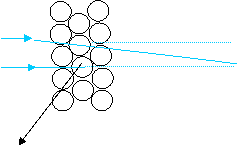
a. in mod obisnuit se observa doar deviatii mici ale particulelor α de la directia traiectoriei initiale (unghiuri de deviatie mai mici de 30);
b. la aproximativ 8.000 de particule α slab deviate revine in medie o particula care sufera o deviatie puternica (unghiuri de deviatie 900 . 1800);
 Rutherford a interpretat aceste rezultate
elaborand, in anul 1911, un nou model atomic, modelul planetar al atomului, cu trei caracteristici definitorii.
Rutherford a interpretat aceste rezultate
elaborand, in anul 1911, un nou model atomic, modelul planetar al atomului, cu trei caracteristici definitorii.
a. Aproape toata masa atomului este concentrata intr-un volum foarte mic care constituie nucleul atomic. Nucleul atomului are un diametru de 10-14 - 10-15 m, mult mai mic decat diametrul atomului (10-9 - 10-10 m).
b. Nucleul este incarcat pozitiv. El este inconjurat de un invelis de electroni, numarul acestora fiind astfel incat atomul este neutru din punct de vedere electric.
c. Electronii se invart in jurul nucleului pe traiectorii circulare. Nucleul exercita asupra electronilor forte de atractie electrostatica care joaca rol de forte centripete.
Observatii
1. Modelul atomic al lui Rutherford a fost denumit modelul planetar al atomului datorita analogiei imaginii sale cu imaginea sistemului solar.
2. Prin modelul atomic imaginat de Rutherford a fost introdusa in fizica, pentru prima oara, notiunea de nucleu atomic.

 Modelul atomic planetar al lui Rutherford are
o serie intrega de deficiente constatate de Niels Bohr. Acesta
modifica conceptiile teoretice clasice, folosind
cunostintele pe care descoperirile epocii sale i le puneau la indemana:
cuantele de energie si observatia lui A.W.Conway (1907) ca
emisia luminii nu este un proces continuu, fiecare linie spectrala fiind
efectul insumarii radiatiilor emise de diversi atomi la diverse
momente. Pe baza lor el trage concluzia ca atomul nu trebuie sa
emita sau sa absoarba continuu, ci numai in anumite cazuri
speciale, procesul avand un caracter discontinuu.
Modelul atomic planetar al lui Rutherford are
o serie intrega de deficiente constatate de Niels Bohr. Acesta
modifica conceptiile teoretice clasice, folosind
cunostintele pe care descoperirile epocii sale i le puneau la indemana:
cuantele de energie si observatia lui A.W.Conway (1907) ca
emisia luminii nu este un proces continuu, fiecare linie spectrala fiind
efectul insumarii radiatiilor emise de diversi atomi la diverse
momente. Pe baza lor el trage concluzia ca atomul nu trebuie sa
emita sau sa absoarba continuu, ci numai in anumite cazuri
speciale, procesul avand un caracter discontinuu.
Dificultatile care apar in rationamentele privind energia pornind de la modelul atomic planetar al lui Rutherford, l-au determinat pe N. Bohr sa formuleze doua ipoteze restrictive care trebuie luate in considerare cand se studiaza starea energetica a unui electron in jurul nucleului si, respectiv, emisia si absorbtia radiatiilor electromagnetice de catre atom. Aceste ipoteze restrictive au fost numite postulatele lui Bohr.
Electronul se poate misca in atom, fara sa emita radiatii, numai pe anumite orbite. Aceste orbite se numesc stationare. Miscarea electronilor pe orbitele stationare se face fara emisie sau absorbtie de energie. Starile corespunzatoare ale atomului se numesc stari stationare. Intr-o stare stationara energia atomului este constanta in timp.
Atomul poate sa emita sau sa absoarba energie radianta (sau de alta natura) numai la trecerea (tranzitia) de pe o orbita (stare) stationara pe alta, iar energia emisa sau absorbita sa fie cuantificata.
Primul postulat afirma ca electronii se misca in jurul nucleului numai pe anumite orbite numite orbite stationare.
Al doilea postulat al lui Bohr afirma ca la tranzitia unui electron de pe o orbita stationara se emite o cantitate de energie, numita cuanta de energie.

Modelul Bohr-Sommerfeld
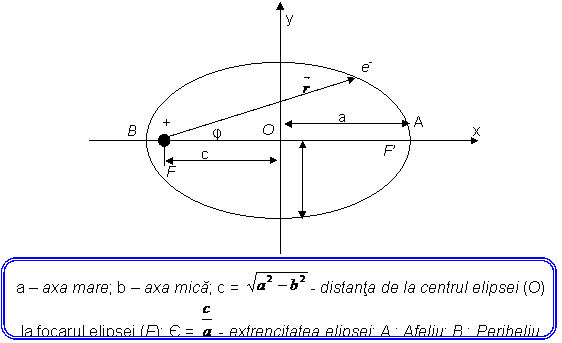
Incercarile de perfectionare a modelului Bohr, facute intre anii 1915 - 1925 au culminat cu construirea unei noi mecanici, mecanica cuantica, care sa imbratiseze toate fenomenele la scara atomica in mod unitar. Principala contribusie a avut-o fizicianul A. Sommerfeld care a generalizat modul de cuantificare, incercand sa aplice modelul Bohr cazului mai general, de miscare pe orbite eliptice. In acest caz trebuia cuantificata miscarea care acum depindea de doua marimi variabile. Intr-o miscare circulara variaza doar pozitia electronului pe arcul de cerc, raza fiind constanta. In cazul miscarii electronului pe o orbita eliptica variaza atat pozitia electronului pe orbita (exprimata printr-o coordonata unghiulara (φ) cat si distanta electron - nucleu (r). In figura sunt date toate distantele si punctele importante ale unei elipse. Elipsa din figura are o extrencitate ε = 0,8. Mecanica arata ca in cazul miscarii pe o elipsa, centrul de forte (nucleul, Soarele) se gaseste nu in centrul elipsei (O), ci in unul din cele doua focare (F sau F'). Se spune de asemenea ca miscarea eliptica are doua grade de libertate. Sommerfeld a aratat ca la cuantificarea sistemelor cu mai multe grade de libertate vor aparea un numar corespunzator de numere cuantice.
![]()
Bibliografie:
Constantin Mantea, Fizica, manual pentru clasa a IX-a, 2000
Cristian Constantinescu, Compendiu de fizica pentru admiterea in invatamantul superior, 1971
Copyright © 2025 - Toate drepturile rezervate