 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
UNIVERSITATEA DE NORD BAIA MARE
FACULTATEA DE STIINTE
SPECIALIZAREA: METODE DE ANALIZA UTILIZATE IN CONTROLUL CALITATII MEDIULUI SI PRODUSELOR ALIMENTARE
DISCIPLINA: METODE CROMATOGRAFICE
METODE DE DETERMINARE ELECTROCHIMICE DE ANALIZA
IN INDUSTRIA ALIMENTARA
METODE ELECTROCHIMICE DE ANALIZA
Metodele electrochimice de analiza se bazeaza pe utilizarea curentului electric si a proprietatilor acestuia, pentru determinarea cantitatii unui component dintr-o proba.
Metodele de analiza cele mai des utilizate sub denumirea de metode electrochimice, sunt:
metoda conductometrica;
metoda potentiometrica;
metoda polarografica;
metoda electrogravimetrica;
electroforeza.
METODA CONDUCTOMETRICA DE ANALIZA
Analiza conductometrica reprezinta metoda de analiza electro-analitica bazata pe determinarea conductantei electrice ale solutiilor. Conductanta electrica a corpurilor este legata de migrarea sarcinilor electrice sub influenta unui camp electric. In cazul conductorilor metalici, se deplaseaza electronii, iar in solutiile si topiturile de electroliti, ionii. Conductanta unei coloane de electrolit delungime l si sectiune A, aflata intre doi electrozi este definita ca inversul rezistentei Ra ectrolitului:
![]() (1)
(1)
si are valoarea:
![]() (2)
(2)
ρ - rezistenta in cazul in care A si l sunt numeric egali, denumita rezistenta specifica, [Ω·cm];
x = l/ρ - conductanta specifica sau conductivitate, [Ω·cm];
Conductanta electrolitului depinde de natura si concentratia acestuia. In solutiile foarte diluate, conductivitatea variaza liniar cu concentratia (Figura nr.1). In practica analitica, este mai convenabil exprimarea normalizata a conductivitatii la 1 echivalent - gram.
Conductanta echivalenta a unui electrolit, Λ [Ω-1·cm2], este conductanta specifica a unei solutii care contine un echivalent-gram intr-un cm3.
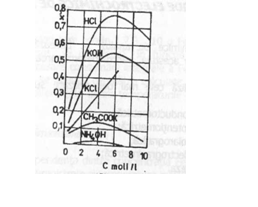
Variatia conductantei specifice a
unor electroliti in functie de concentratie
In aceste conditii, ea va fi data de relatia:
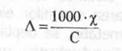 (3)
(3)
C - concentratia normala a solutiei (echivalenti-gram la 1000 cm3 solutie).
Considerand ca:
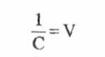 (4)
(4)
In care:
V- volumul solutiei, [cm3]
Se obtine:
![]() (5)
(5)
inlocuind valoarea lui X din relatia (3.) in relatia (2.), obtinem:
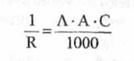 (6)
(6)
Valoarea
efectiva a raportului l/A se numeste
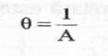 (7)
(7)
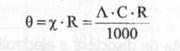 (8)
(8)
Din relatiile (2.) si (3.), rezulta:
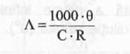 (9)
(9)
Respectiv:
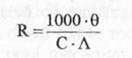 (10)
(10)
In cazurile ideale, conductanta echivalenta a solutiilor de electroliti este independenta de concentratie. Practic insa, A descreste cu concentratia (Figura 2).
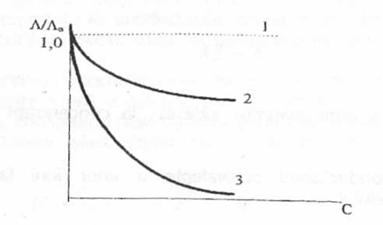
Figura 2. Variapa conductivitatii echivalente a electroliplor cu concentratia; 1 - electrolit ideal; 2 - electrolip tari; 3 - electroliti slabi; A0 - consductanta echivalenta pentru concentratie zero (dilutia infinita)
In cazul electrolitilor tari si la concentratii nu prea mari, variatia conductantei echivalente cu concentratia se poate reda prin ecuatia:
![]() (11)
(11)
Pentru electrolitii slabi, relatia similara este redata prin legea dilutiei:
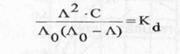 (12)
(12)
unde:
Kd
-
Conductanta echivalenta a dilutie infinita este proportionala cu surra mobilitatilor ionice relative la dilutie infinita (u°). In cazul unui electrolit binar, vom avea:
![]() (13)
(13)
Unde:
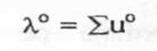 (14)
(14)
este coductanta echivalenta ionica la dilutie infinita.
In general:
![]() (15)
(15)
respectiv:
![]() (16)
(16)
unde:
X si A sunt marimile indicate, la concentratii finite mai mari decat dilutia infinita.
Valoarea conductantei echivalente a unor ioni la dilutie infinita estt prezentata in Tabelul de mai jos:
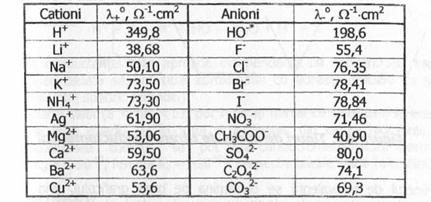
Din datele prezentate, se observa ca mobilitatea relativa a ionilor, respectiv curentul transportat de fiecare ion, difera foarte mult ionii de hidrogen si hidroxil, au mobilitati foarte mari, datorita unui mecanism specific de transport al lor in solutii apoase.
inlocuind relatia (14) in relatia (10) se obtine expresia:
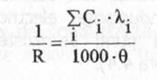 (17)
(17)
cea ce indica, existenta unei relatii liniare intre concentratia unui ion din solutie si contributia ionului respectiv, la conductanta totala a solutiei. Din acest motiv, metoda conductometrica se poate folosi la determinarea concentratiilor unor ioni din solutii.
Relatia liniara dintre concentratia unui ion dintr-o solutie si contributia ionului respectiv la conductanta totala a solutiei, permite urmarirea reactiilor chimice pe cale conductometrica, constituind baza titrarilor conductometrice.
Consideram titrarea electrolitului AB cu titrantul CD, pe baza ecuatiei chimice:
B+ + A + C+ + D' -> BD + C+ + A
Produsul BD este o substanta putin disociata, o combinatie complexa sau un precipitat. La inceputul titrarii, in solutie sunt prezenti numai ionii B+ si A', iar in cursul titrarii, concentratia ionilor B+ scade in favoarea formarii ionilor C+ . Variatia conductantei pe parcursul titrarii si deci forma curbei de titrare, va depinde de diferenta dintre mobilitatea ionilor B+ fata de cea a ionilor C+ care isi schimba locul pe parcursul titrarii. inaintea punctului de echivalenta (titrarea .icizilor tari si a bazelor tari) conductibilitatea poate sa scada , sa inmana neschimbata (titrarea prin precipitare), sau poate sa creasca (titrarea acizilor si a bazelor slabe). Dupa atingerea punctului de echivalenta in general, conductanta solutiei creste, sau ramane constanta.
Titrari conductometrice acido-bazice
Metoda are la baza reactia de neutralizare a unui acid cu o baza:
H+ + X- + M+ + HO--> H2O + M+ + X-
Variatia conductantei este aproape independenta de concentratia solutiilor folosite: solutiile diluate se pot titra aproximativ cu aceeasi precizie ca si cele mai concentrate (avantaj specific metodei).
Acizii foarte slabi (8 < pKa <10) pot fi titrati numai cu baze tari, la inceputul titrarii variatia fiind liniara, iar in jurul echivalentei, din cauza hidrolizei, va fi curbata. In asemenea conditii, se pot titra conductometric acizii foarte slabi (acidul boric Ka = 610-10, fenolul Ka =10-10), respectiv bazele slabe (alcaloizii).
Aparatura si reactivi
celula de conductivitate;
conductometru;
acizi tari, acizi slabi;
baze tari, baze slabe.
Modul de lucru
Se introduce in celula de conductanta acidul (sau baza) si se urmareste variatia conductantei electrice a solutiei, in functie de volumul de titrant adaugat (baza sau acid).
Prelucrarea datelor experimentale
Se reprezinta grafic, conductanta electrica in functie de volumul de titrant adaugat, pentru titrari diferite:
acid tare - baza tare;
acid tare - baza slaba;
acid slab - baza tare;
acid slab - baza slaba;
iar de pe graficele obtinute, se determina punctele de echivalenta.
De asemenea, se pot titra cu baze, amestecuri de acizi tari cu acizi slabi, respectiv, se pot titra cu acizi, amestecuri de baze tari cu baze slabe.
Bibliografie
https://www.referatele.com/
https://www.scritub.com/stiinta/arhitectura-constructii/index.php
https://library.utm.md/lucrari/Tipografia/53/3_DS.pdf
https://www.referatele.com/
Lucrari practice de analiza intrumentala; Dr. Vatca Gheorghe. Editura risoprint cluj napoca 2002.
Copyright © 2025 - Toate drepturile rezervate