 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Legǎtura de hidrogen
O legǎrurǎ de hidrogen este un tip special de legǎturǎ intermolecularǎ de tip dipol-dipol, mai bogatǎ in energie decat fortele van der Waals, care apare doar in cazul existentei in respectiva moleculǎ a unui atom de hidrogen legat covalent de un atom puternic electronegativ (F, O, N etc). Legǎtura se stabileste intre atomul de hidrogen legat si un alt atom electronegativ al unei molecule invecinate (in acest caz vorbim de legǎturǎ de hidrogen intermolecularǎ) sau intre hidrogenul legat si un alt atom electronegativ invecinat din aceeasi moleculǎ (legǎturǎ intramolecularǎ). Un exemplu este legǎtura de hidrogen intermolecularǎ dintre moleculele apei care este prezentatǎ schematic pe fig. 3.17. Aceastǎ legǎturǎ determinǎ ca moleculele sǎ se atragǎ reciproc si sǎ aparǎ o orientare particularǎ intre moleculele apei.
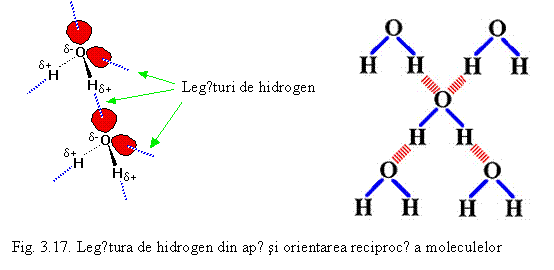
In general legǎtura de hidrogen este mai puternicǎ decat fortele van der Waals dar mai slabǎ decat legǎturile covalente, ionice sau metalice amintite. Legǎtura de hidrogen este responsabilǎ pentru punctul de fierbere ridicat al apei (100oC) comparativ cu cel al celorlalte hidruri din grupa 16. Cauza este realizarea unor mase moleculare mai mari decat par in conformitate cu formula chimicǎ datoritǎ „asocierii” mai multor molecule. Acest tip de legaturǎ stǎ la baza structurilor tridimensionale ale proteinelor si acizilor nucleici precum si specificitǎtii efectelor acestora.
Atomul de hidrogen legat de un atom puternic electronegativ (F, O, N) este un „donor de legǎturǎ de hidrogen”. Atomul electronegativ al unei molecule sau structuri invecinate este „acceptorul de legǎturǎ de hidrogen”, indiferent dacǎ acesta este sau nu legat de un alt atom de hidrogen. Exemple de legaturi de hidrogen sunt cele dintre moleculele apei, alcoolului etilic sau amoniacului. In toate aceste cazuri acceptorul de legǎturǎ de hidrogen este legat si el de un atom de hidrogen. Existǎ insǎ si o legǎturǎ de hidrogen la care participǎ carbonul doar atunci cand acesta este legat si de alti atomi electronegativi. Este cazul cloroformului (CHCl3) unde atomul de hidrogen, partial dezgolit de electroni, poate intra in interactiune cu atomi electronegativi (posesori de nori electronici negativi) apartinand unor alte molecule aflate in aceeasi solutie.
Legatura de hidrogen este adesea descrisǎ ca o interactiune electrostaticǎ dipol-dipol. Totusi are unele caracteristici ale legǎturii covalente fiind directionatǎ, puternicǎ si produce o distantǎ interatomicǎ mai scurtǎ decat fortele van der Waals. Astfel intr-o legǎturǎ de hidrogen X-HY unde X si Y sunt atomi electronegativi distanta X-H este ~1,1 Å pe cand distantǎ HY este de 1,6 – 2 Å. Implicand un numǎr limitat de parteneri in legǎturǎ aceasta se manifestǎ ca un fel de valentǎ. Lichidele in care se manifestǎ legǎturi de hidrogen se denumesc “lichide asociate”. Exemple de astfel de lichide sunt apa, alcoolii, amoniacul si aminele, acidul fluorhidric sau diversele amestecuri ale acestora cu substante continand atomi electronegativi legati sau nelegati de un atom de hidrogen.
Copyright © 2024 - Toate drepturile rezervate