 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
NOTIUNI DE CINETICA CHIMICA
CINETICA CHIMICA reprezinta partea din chimie care studiaza vitezele cu care se produc reactiile chimice, precum si factorii care influenteaza viteza reactiilor chimice.
Dupa viteza lor de desfasurare, reactiile chimice se clasifica in:
reactii rapide, de exemplu: descompunerea trinitrotoluenului (dinamita), reactiile de neutralizare (reactii intre acizi si baze), reactii de precipitare in solutii apoase (reactii cu formare de substante insolubile in apa);
reactii lente, de exemplu: fermentatia alcoolica (obtinerea alcoolului din glucoza), fermentatia acetica (otetirea vinului).
I. VITEZA DE REACTIE
Viteza unui fenomen (fizic sau chimic) este masurata prin modificarea care apare intr-un anumit interval de timp. De exemplu, viteza de deplasare a unui corp se exprima prin distanta pe care acesta o parcurge, in unitatea de timp: v=d/∆t.
In general, fenomenele care se petrec in timp, se caracterizeaza prin viteza de desfasurare.
Viteza de reactie reprezinta variatia concentratiei reactantilor sau produsilor de reactie in unitatea de timp.
In general, pentru un proces chimic se defineste viteza medie de reactie ca fiind:
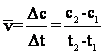 ,
,
unde C este concentratia molara (mol/L) a reactantului sau produsului de reactie.
Pentru un proces chimic de forma
![]() Reactanti Produsi,
Reactanti Produsi,
notand cu CR concentratia molara (mol/L) a reactantilor si cu CP concentratia molara (mol/L) a produsilor de reactie, expresia de calcul pentru viteza medie de reactie este se determina astfel:
R(reactant) P(produs de reactie)
initial: t1 cR cP
final: t2 cR cP
cR > cR cP < cP unde:
cR =concentratia molara a reactantului la momentul t1
cR =concentratia molara a reactantului la momentul t2
cP =concentratia molara a reactantului la momentul t1
cP =concentratia molara a reactantului la momentul t1.
![]() , deci:
, deci: ![]() , cR > cR =>
, cR > cR => ![]() si
viteza medie de reactie in functie de concentratia reactantilor va avea
urmatoarea expresie:
si
viteza medie de reactie in functie de concentratia reactantilor va avea
urmatoarea expresie: ![]()
![]() , deci:
, deci: ![]() cP < cP =>
cP < cP =>
![]() si
si ![]() .
.
Exemplu: reactia de descompunere a dioxidului de diazot
2NO2 = 2NO + O2
Aceasta reactie are loc la temperaturi de cca. 360°C, intr-un balon de sticla; se masoara concentratiile dioxidului de diazot (NO2), ale monoxidului de monoazot (NO) si ale oxigenului (O2) la anumite intervale de timp. Rezultatele experimentale sunt:
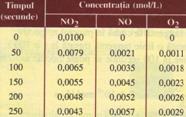
Analizand tabelul de mai sus si graficul ce urmeaza, se observa ca: concentratia reactantilor scade in timp; concentratia produsilor de reactie creste in timp.
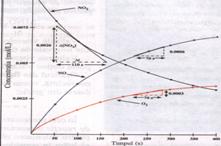
Astfel, viteza medie de reactie in cazul descompunerii dioxidului de diazot, se poate scrie:
![]()
Se poate calcula, de exemplu, viteza medie a procesului, dupa 50 s, utilizand datele din tabel:
![]() , deci
, deci ![]() .
.
Observatie: viteza de reactie se exprima in mol/L∙s = mol∙L-1∙s-1.
Valoarea vitezei la un moment dat se poate determina si pe baza graficului (viteza instantanee), prin trasarea unei tangente la curba in punctul respectiv.
Deoarece valorile vitezei scad in timp si pentru ca vitezele pot fi diferite pentru reactanti si produsii de reactie (in functie de coeficientii de reactie), trebuie luata in calcul specificitatea fiecarei reactii atunci cand se urmareste descrierea vitezei unei reactii chimice.
Pentru o reactie de forma: aA + bB = cC + dD, se verifica valorile matematice:
![]() sau
sau ![]()
unde ![]() sunt vitezele medii ale componentilor, iar a, b, c, d sunt
coeficientii stoechiometrici.
sunt vitezele medii ale componentilor, iar a, b, c, d sunt
coeficientii stoechiometrici.
II. LEGEA VITEZEI DE REACTIE
ÿ Pentru o reactie simpla, de forma
aA + bB = Produsi,
legea vitezei de reactie are expresia:
v = k[A]a[B]b
unde:
a, b - coeficientii stoechiometrici pentru reactiile simple;
k - constanta de viteza (depinde de natura reactantilor, temperatura, presiune, catalizatori)
ÿ Pentru o reactie complexa, de forma:
aA + bB = cC + dD
legea vitezei de reactie este:
v = k[A]na[B]nb
unde: na si nb se numesc ordine partiale de reactie (care se determina pe cale experimentala)
Scrie expresia legii vitezei de reactie pentru urmatoarele procese chimice:
a) C2H5Br = C2H4 + HBr
b) C2H4 + H2 = C2H6
c) CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
Stabileste unitatile de masura pentru constanta de viteza a fiecarui proces chimic de la punctul 1.
Timpul de injumatatire (t1/2) reprezinta timpul in care a reactionat jumatate din cantitatea initiala de reactant. Pentru o reactie de ordinul I, t1/2=(ln2)/k=0,693/k.
III. TEORIA CIOCNIRILOR. ENERGIE DE ACTIVARE. COMPLEX ACTIVAT
In general, o reactie chimica presupune ruperea unor legaturi intre particulele reactantilor (proces endoterm) si formarea de noi legaturi, in produsii de reacie (proces exoterm). Conform teoriei cinetico-moleculare, particulele constituente ale materiei sunt intr-o continua miscare, avand energii diferite. In lumina acestei teorii, redistribuirea legaturilor chimice are loc in urma ciocnirii dintre particulele reactante. Nu toate ciocnirile dintre particulele reactante sunt eficace, astfel incat sa conduca la produsii finali de reactie. Particulele care se ciocnesc trebuie sa aibe deasemenea o orientare favorabila formarii prosusilor de reactie, deci favorabila redistribuirii legaturilor chimice.
Daca energia particulelor care se ciocnesc depasesc o anumita valoare a energiei - numita energie de activare, Ea - reactia se produce, iar particulele care satisfac aceasta conditie sunt activate. In urma ciocnirilor acestor particule activate de reactant, se formeaza o asociatie temporara bogata in energie, denumta complex activat.
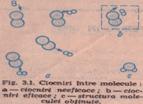

Particulele care se ciocnesc prezinta o anumita energie cinetica. Prin ciocnire, o parte din energia cinetica se transforma in energie potentiala a complexului activat. Daca moleculele care se ciocnesc au o energie scazuta, legaturile existente nu se pot scinda, dupa ciocnire, particulele separandu-se fara o modificare a structurii acestora (reactia chimica nu a avut loc). Atunci cand particulele au energie suficient de mare, pentru a se produce ruperea legaturilor existente si formarea altora noi, au loc reactii chimice. Aceasta energie minima a particulelor, necesara formarii complexului activat, se numeste energie de activare.
Fie o reactie de forma: A2 + B2 = 2AB. In momentul ciocnirii particulelor de tip A2 cu cele de tip B2, acestea pot avea o orientare nefavorabila formarii complexului activat sau o orientare nefavorabila. Daca este satisfacuta aceasta conditie de orientare, reactia va avea loc doar in cazul in care moleculele au o energie suficient de mare pentru a forma un complex activat, cu o energie potentiala mai mare decat a reactantilor si a produsilor.
Conform teoriei complexului activat, pentru ca o reactie sa aibe loc, particulele reactante trebuie sa se ciocneasca, dar nu toate ciocnirile sunt eficace, ci doar acelea care satisfac conditia geometrica (de orientare) si energetica.
De exemplu, cazul reactiei de sinteza a acidului iodhidric, HI. Prin ciocnirea a doua molecule (ciocnire bimoleculara), cu orientare favorabila, se va forma un complex activat cu o energie suficient de mare pentru a se produce o redistribuire a legaturilor, conducand la formarea de noi legaturi H - I.

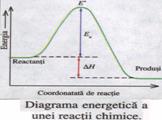
![]() Pentru cazul general: Reactanti Produsi, in cazul tuturor reactiilor - exoterme sau endoterme -
complexul activat este starea cu energia cea mai mare, atat fata de reactanti,
cat si fata de produsii de reactie.
Pentru cazul general: Reactanti Produsi, in cazul tuturor reactiilor - exoterme sau endoterme -
complexul activat este starea cu energia cea mai mare, atat fata de reactanti,
cat si fata de produsii de reactie.
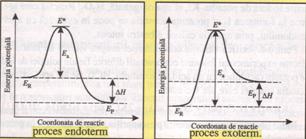
Energia de activare a reactiei este egala cu difereanta dintre energia complexului activat (E*) si energia reactantilor (ER): Ea = E* - ER. Conform diagramei energetice, entalpia de reactie, ∆H, este independenta de viteza de reactie si de energia de activare. Variatia de entalpie depinde numai de energia reactantilor (energia starii initiale) si energia produsilor de reactie (energia starii finale): ∆H = EP - ER.
IV. FACTORI CARE INFLUENTEAZA VITEZA DE REACTIE
Influenta concentratiei
Conform teoriei ciocnirilor, reactia se produce cand intre particule au loc ciocniri eficiente. Astfel, un numar mai mare de particule reactante in unitatea de volum va determina un numar mai mare de ciocniri in unitatea de timp. Prin urmare, marirea concentratiei reactantilor determina cresterea vitezei de reactie.
Variatia direct proportionala a vitezei de reactie cu concentratia reactantilor este evidentiata si de legea vitezei: v = k[A]na[B]nb
Influenta temperaturii. Ecuatia lui Arrhenius
In general, viteza reactiilor chimice se modifica in mod considerabil sub influenta temperaturii. Cea mai mare parte a reactiilor chimice au loc cu viteze mai mari la cresterea temperaturii.
Efectul temperaturii asupra unor procese chimice se poate observa in viata de zi cu zi: frigiderul este utilizat pentru elementele perisabile (care la temperaturi ridicate sufera reactii de degradare), arderea lemnului se produce cu viteze considerabile, la temperaturi ridicate etc.
Conform teoriei cinetico-moleculare, cresterea temperaturii determina cresterea vitezei particulelor, deci creste energia lor cinetica, numarul ciocnirilor in unitatea de timp crescand.
Prin studiile sale, Svante Arrhenius a aratat ca, pentru cele mai multe reactii chimice, viteza de reactie creste cu temperatura.

Dependenta vitezei de reactie, de temperatura este redata prin ecuatia lui Arrhenius, unde se observa o dependenta exponentiala a constantei de viteza k, de temperatura T:
k = Ae-Ea/RT (1)
unde:
A - o constanta caracteristica fiecarei reactii (da informatii despre frecventa ciocnirilor)
Ea - energia de activare
R - constanta gazelor ideale (R = 8,314 J/mol∙K sau R = 0,082 L∙atm/mol∙K)
T - temperatura absoluta (kelvin)
Utilizand ecuatia lui Arrhenius, se poate evalua energia de activare Ea:
![]() (2) si
relatia devine
(2) si
relatia devine
![]() (3)
(3)
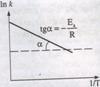
Aceasta relatia este o functie liniara prin reprezentarea careia se obtine o dreapta de forma y = a - bx, unde x = 1/T, y = lnk, a = lnA si b = - Ea/RT. Astfel, reprezentand grafic lnk in functie de 1/T, se obtine o dreapta din panta careia se poate evalua grafic valoarea energiei de activare, intr-ucat tgα = - Ea/RT:
Energia de activare se poate determina si prin calcul (utilizand relatia 3):
![]() (4) si
(4) si ![]() (5)
(5)
Efectuand diferenta dintre relatiile (4) si (5) si utilizan proprietatile logaritmilor, se obtine:
![]() (6), respectiv
(6), respectiv ![]() (7).
(7).
Din relatia (7) se determina formula matematica pentru calcularea energiei de activare, Ea:
![]() (8).
(8).
Influenta catalizatorilor
Catalizatorii sunt substante care maresc viteza unor reactii ce au loc si in absenta acestora, dar cu viteza mai mica.
Peste 90% din procesele chimice industriale au loc in prezenta catalizatorilor. Termenul de cataliza a fost introdus de chimistul suedez J.J. Berzelius (1836), care a studiat acest fenomen.
In general, catalizatorii se adauga in procesele chimice, in cantitati mici. Catalizatorii maresc viteza de reactie fara a se consuma pe parcursul acesteia; la finalul procesului ei se gasesc in cantitate nemodificata.
Catalizatorii se intalnesc frecvent intr-o mare varietate de reactii: procese chimice industriale, reactii chimice din atmosfera si din apa oceanelor; cele mai multe procese biochimice din organismul uman si din toate organismele vii sunt catalizate de enzime.
Reactiile chimice pot avea loc in:
cataliza omogena - reactantii si catalizatorul sunt intr-o singura faza, de regula lichid-lichid sau gaz-gaz
cataliza eterogena - reactantii si catalizatorii se gasesc in faze diferite, de obicei catalizatorul solid si reactantii lichizi sau gazosi; in astfel de reactii, un rol important il prezinta suportul de catalizator, care imbunatateste rezistenta mecanica a catalizatorului
Unele substante, adaugate procesului chimic au proprietatea de a mari/micsora activitatea catalizatorilor, respectiv viteza de reactie. Astfel, se disting:
![]() promotorii: substante care maresc considerabil activitatea catalizatorilor
(in lipsa catalizatorilor, promotorii nu maresc viteza de reactie);
promotorii: substante care maresc considerabil activitatea catalizatorilor
(in lipsa catalizatorilor, promotorii nu maresc viteza de reactie);
![]() otravurile: substante care au capacitatea de a reduce sau de a anula
activitatea catalizatorilor;
otravurile: substante care au capacitatea de a reduce sau de a anula
activitatea catalizatorilor;
![]() inhibitorii: substante care micsoreaza viteza de reactie, actionand asupra
reactantilor si nu asupra catelizatorilor; de exemplu: innegrirea legumelor si
fructelor este cauzata de reactii de oxidare in aer, dar acidul ascorbic
(vitamina C) impiedica reactia de oxidare, actionand ca inhibitor.
inhibitorii: substante care micsoreaza viteza de reactie, actionand asupra
reactantilor si nu asupra catelizatorilor; de exemplu: innegrirea legumelor si
fructelor este cauzata de reactii de oxidare in aer, dar acidul ascorbic
(vitamina C) impiedica reactia de oxidare, actionand ca inhibitor.
O caracteristica importanta a catalizatorilor este selectivitatea manifestata prin faptul ca au capacitatea de a favoriza numai o anumita reactie, din mai multe posibile. De exemplu, etanolul (alcoolul etilic) poate forma compusi diferiti, in functie de catalizatorul utilizat:
![]()
![]()
![]()
![]()

![]()
Procese catalitice cu importanta practica:
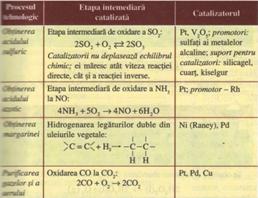
Enzimele - sunt biocatalizatorii proceselor biochimice din organismele vii. Au rol determinant in metabolism si contribuie in mod esential la reglarea acestuia. Enzimele au o mare specificitate, intr-ucat o enzima catalizeaza o singura reactie.
Enzimele care confera specificitate reactiilor pe care le catalizeaza sunt proteine; ele actioneaza independent (enzime proteice) sau impreuna cu coenzime (neproteice).
Multe enzime au fost denumite prin adaugarea sufixului aza/aze la numele substratului sau la numele procesului pe care il catalizeaza (oxireductaze, hidrolaze, liaze, izomeraze).
Procesele chimice catalizate de enzime sunt de 108 pana la 1020 ori mai rapide decat cele necatalizate.
V. Aplicatii
Pentru reactia in faza gazoasa dintre monoxidul de azot si brom la 273°C:
2NO(g) + Br2(g) = 2NOBr(g)
au fost obtinute urmatoarele informatii
|
Nr. crt. |
Concentratii mol/L |
Viteza initiala de formare a NOBr (mol/L s) |
|
|
[NO] |
[Br2] |
||
|
|
|||
Determina:
a) Legea vitezei pentru reactia indicata
b) valoarea constantei de viteza
c) relatia dintre viteza de formare a NOBr si viteza de transformare a Br2
d) viteza de formare a NOBr cand [NO] = 0,15 mol/L si [Br2] = 0,25 mol/L.
O reactie fiziologica importanta cu expresia legii vitezei de reactie v=k[A] are energia de activare de 45 kJ/mol, la temperatura corpului (37°C). In absenta catalizatorilor, constanta de viteza a reactiei este de 5∙10-4 s-1. Pentru a fi eficienta in corpul uman, unde reactia este catalizata de enzime, constanta de viteza trebuie sa aiba valoarea minima de 2∙10-2 s-1. Daca energia de activare este singurul factor afectat de prezenta enzimei, determinati cu cat trebuie sa scada energia de activare pentru a se ajunge la viteza dorita.
Reactia de sinteza a
acidului iodhidric este H2(g) + I2(g) = 2HI(g).
Expresia vitezei de reactie este ![]() si constantele de
viteza au valorile:
si constantele de
viteza au valorile:
k1=2,45∙10-4 L∙mol-1s-1, la t1=302°C si k2=0,95 L∙mol-1s-1, la t1=508°C.
a) calculati valoarea energiei de activare Ea si a constantei A pentru reactia data;
b) valoarea constantei de viteza k, la 375°C.
a) stabileste in ce relatie se afla viteza de descompunere a ozonului si cea de formare a oxigenului din urmatoarea reactie: 2O3(g) = 3O2(g).
b) daca viteza de formare a oxigenului, ∆[O2] ∆t, este 6∙10-5 L∙mol-1s-1 la un moment dat, calculati viteza de descompunere a ozonului, ∆[O3] ∆t, la acelasi moment.
Viteza unei reactii intre doi reactanti A si B a fost masurata pentru diferite concentratii, conform tabelului:
|
Nr. crt. |
Concentratii mol/L |
Viteza (mol/L s) |
|
|
[A] |
[B] |
||
Determina:
a) legea vitezei de reactie
b) valoarea constantei de viteza
c) viteza de reactie daca [A]=0,05 mol/L si [B]=0,1 mol/L.
Se supun dehidrohalogenarii 500 mL de solutie in care s-au dizolvat 12,9 g de cloroetan. Stiind ca dupa 291 s s-a consumat jumatate din cantitatea de cloroetan si ca volumul solutiei nu se modifica, sa se calculeze viteza medie de reactie si masa de produs organic rezultata din reactie.
O proba de carbonat de calciu (CaCO3) introdusa intr-un pahar, este tratata cu 20 mL de solutie diluata de acid sulfuric (H2SO4). Prin cantarire, s-a determinat ca masa paharului a scazut cu 0,264 g in 4 minute. Considerand ca volumul solutiei ramane constant, calculati viteza de reactie in raport cu acidul sulfuric (exprimata in mol/L s).
Pentru o reactie de forma nA = produsi de reactie, cu constanta de viteza k=3,5∙10-4 L∙mol-1s-1, se cunoaste ca , daca se dubleaza concentratia reactantului A, viteza de reactie creste de 4 ori. Determinati ordinul de reactie.
Pentru
o reactie de forma nA = produsi, unei cresteri de 5 ori a concentratiei
reactantului ii corespunde o crestere a vitezei de reactie, de acelasi numar de
ori. Determinati ordinul de reactie;
Copyright © 2025 - Toate drepturile rezervate