 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Sinteza si caracterizarea unor combinatii complexe ale Cu(II), Fe(III) si Mn(III) cu ligandul rezultat prin condensarea trietilenteraminei cu acid barbituric si formaldehida
Introducere
Enzimele de tip superoxid dismutaza (SOD) controleaza formarea produsilor toxici rezultati in procesul de respiratie al organismelor aerobe. Cu toate acestea, superproductia anionilor superoxid este asociata cu infarctul, cu aparitia si mentinerea bolilor inflamatorii de tipul artritelor si joaca un rol important in initierea problemelor neurologice de tipul bolii Parkinson. In plus s-a observat ca anionii superoxid joaca un rol important in degradarea tesutului sub actiunea radiatiilor, in promovarea unor tumori precum si in procesele de degenerare celulara promovate de SIDA [1].
S-au efectuat numeroase studii referitoare la sinteza unor combinatii complexe care sa prezinte activitate de tip SOD deoarece astfel de specii cu masa moleculara mica se pot utiliza ca medicamente pentru prevenirea sau tratarea bolilor asociate cu excesul de anioni superoxid. Pentru obtinerea unor astfel de specii s-a utilizat o mare varietate de liganzi polifunctionali neciclici, heterociclici sau macrociclici, cu oxigen sau azot ca atomi donori. S-au studiat din acest punct de vedere combinatii complexe mono- sau polinucleare ale fierului, manganului, cuprului si mai putin ale nichelului si cobaltului. In cazul combinatiilor cuprului (II) s-a urmarit reproducerea inconjurarii coordinative a Cu(II) din enzimele de origine mamifera pentru care studiile cu raze X au indicat o coordinare la patru grupari de tip histidina cu o stereochimie de piramida patrata. Unele dintre aceste specii se pot considera analogi sintetici ai superoxid dismutazei bovine deoarece au capacitatea de a reactiona cu superoxidul si de a cataliza disproportionarea acestuia prezentand aproape aceeasi activitate catalitica ca si enzima.[2]
Pentru a fi un bun model pentru SOD, o combinatie complexa a cuprului trebuie sa prezinte urmatoarele caracteristici: (1) solubilitate in apa; (2) stabilitate termodinamica si cinetica mare pentru a evita disocierea in mediu acid; (3) liganzi flexibili si cu tarie donoare medie, pentru a favoriza atacul O2ˉ si a facilita reducerea si acomodarea Cu(I) care prefera stereochimia tetraedrica sau lineara; (4) un potential redox corespunzator pentru a cataliza disproportionare superoxidului; (5) pozitii coordinative vacante sau liganzi care se pot usor substitui usor asa cum sunt molecule de apa si (6) o activitate buna in domeniul de pH 6-8. [3] Pentru a putea prezenta o buna activitate in vivo un astfel de compus trebuie de asemenea sa aiba capacitatea de a ajunge atat in regiunea lipofilica cat si in cea hidrofoba a celulei, o toxicitate scazuta, o biodistributie optima si de asemenea o stabilitate metabolica mare.
Pentru a modela inconjurarea proteica a cuprului din BESOD ne-am concentrat atentia asupra unor liganzi polidentati cu atomi donori azot obtinuti prin condensarea trietilentetraminei cu formaldehida si acid barbituric. Astfel de liganzi indeplinesc cel putin doua din caracteristicile necesare si anume flexibilitate si atomi donori cu o tarie medie. Cu toate ca pentru multe combinatii complexe ale Mn(II sau III) si Fe(II sau III) cu liganzi de acest tip s-a evidentiat capacitatea de a cataliza disproportionarea superoxidului, in cazul Cu(II) putine combinatii complexe au fost studiate din acest punct de vedere. [4]
In acesta lucrare prezentam combinatii complexe noi ale Cu(II), Fe(III) si Mn(III) cu ligandul rezultat prin condensarea trietilentetraminei cu acid barbituric (AB) si formaldehida. Procesele de condensarea au fost realizate in mediu acid. Combinatiile complexe au fost formulate pe baza datelor analizei chimice elementale, analizei termice, a spectrelor IR si electronice. [5]
Rezultate si discutii
Combinatiile complexe au fost sintetizate prin metoda "one-pot" care consta in refluxarea masei de reactie care contine clorura sau percloratul de Cu(II), Fe(III) sau Mn(II), trietilentetramina si acid barbituric pentru raportul molar de 1:1:2. S-a lucrat in exces de formaldehida. Procesul chimic este reprezentat prin intermediul schemei de reactie 1.
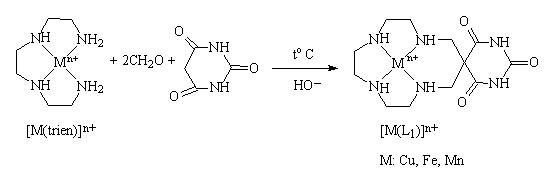
Schema 1.
Alegerea acidului barbituric pentru procesul de condensare a avut in vedere pe de o parte prezenta gruparilor metilenice active care pot fi implicate in procesul de condensare cu formaldehida dar si prezenta gruparilor functionale de tip amida suplimentare care pot stabili interactii prin legaturi de hidrogen, interactii importante in cazul sistemelor care prezinta interes din punct de vedere biochimic.
Masa de reactie, in etanol a fost refuxata timp de 24 ore si combinatiile complexe s-au izolat sub forma de compusi greu solubili de culoare albastru-verzui cu un randament de cuprinse intre 38 si 42 %.
Compusii obtinuti au fost analizati pentru stabilirea formulei chimice, datele obtinute fiind prezentate in tabelul 1.
Tabelul 1. Datele analizei chimice elementale
|
Combinatia |
% Cu |
% Cl |
||
|
calc. |
exp. |
calc. |
exp. |
|
|
[CuLCl2]∙H2O (1) | ||||
|
[CuL(OClO3)2]∙H2O (2) | ||||
|
[FeLCl2]Cl∙2H2O (3) | ||||
|
[FeL(OClO3)2](ClO4)∙H2O (4) | ||||
|
[MnLCl2]Cl∙1,5H2O (5) | ||||
|
[MnL(OClO3)2](ClO4)∙H2O (6) | ||||
Calculele teoretice au fost facute pentru speciile de tipul CuLCl2·6H2O (1) si CuL(ClO4)2 (2) pentru care s-a propus aceasta formulare prin corelarea datelor furnizate de analiza chimica elementara cu spectroscopia IR si electronica.
Tabelul 2. Datele comportarii termice (in aer sintetic) pentru combinatiile complexe
Combinatia complexa |
Etapa |
Efectul termic |
Intervalul de temperatura / ºC |
Dmexp / % |
Dmcalc / % |
Procesul chimic |
Endoterm |
Pierdere H2O |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Exoterm |
Pierdere anion Cl- |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Exoterm |
Degradare oxidativa L.organic |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Rezidiu (CuO) |
Endoterm |
Pierdere H2O |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Exoterm |
Pierdere anion Cl- |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Exoterm |
Degradare oxidativa L.organic |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Rezidiu (Fe2O3) | |
Endoterm |
Pierdere H2O |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Exoterm |
Pierdere anion Cl- |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Exoterm |
Degradare oxidativa L.organic |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Rezidiu (Mn3O4) |
Se observa o buna concordanta intre formulele propuse pentru combinatii pe baza analizei chimice si datele obtinute din analiza termica. Combinatiile complexe sunt solubile in DMF, DMSO si alcool etilic. Spectre IRPentru confirmarea faptului ca a avut loc procesul de condensare s-au inregistrat spectrele IR ale combinatiilor complexe si s-au comparat cu spectrul IR al acidului barbituric (fig 2) In spectrele IR ale combinatiilor complexe (figura 3 si 4) se remarca absenta benzilor caracteristice gruparilor amina primara si aparitia unei singure benzi largi in domeniul 3200-3400 cm-1 care se poate atribui modurilor de vibratie n(NH) [6].
Fig. 2. Spectrul IR al acidului barbituric
Fig. 3. Spectrul IR al combinatiei complexe (1)
Fig. 4. Spectrul IR al combinatiei complexe (2) Tabelul 3. Maxime de absorbtie (cm-1) si atribuiri pentru ATR si combinatiile complexe ale Cu(II) (1) si (2)
In spectru sunt prezente benzi de absorbtie care pot fi atribuite gruparilor de tip amida secundara functionale provenite de la acidul barbituric Benzile din domeniul 760 si 850 cm-1 pot fi asociate cu gruparile etilenice provenite de la trietilentetramina, pozitia lor in spectru fiind in acord cu o configuratie trans a fragmentului provenit de la acest intermediar. Banda intensa din domeniul 3390-3450 cm-1 poate fi asociata cu prezenta moleculelor de apa din componenta combinatilor complexe [7]. In domeniile caracteristice modurilor de vibratie pentru perclorat apar un numar mare de benzi in acord cu prezenta acestui anion ca ligand monodentat pentru toate combinatiile complexe[8]. Pentru speciile (4) si (5) numarul mare de componentele din domeniul caracteristic benzii υ3 a percloratului indica prezenta acestuia si in sfera de ionizare. Spectre electronice Spectrul electronic al combinatiilor complexe ale cuprului (fig. 5) prezinta o singura banda nesimetrica la 507/483 nm cu umar la lungimi de unda mai mici. Acest aspect al spectrului este caracteristic combinatiilor complexe octaedrice distorsate prin alungire.
Fig. 5. Spectrele electronice ale combinatiilor [CuLCl2]·H2O (1) si [CuL(OClO3)2]·H2O (2)
Fig. 6. Spectrele electronice ale combinatiilor complexe ale fierului (stanga) si manganului (dreapta) Asa cum se observa din spectrele speciilor fierului apare o banda intensa la aproximativ 350 nm atribuita transferului de sarcina si una de intensitate mai redusa la 924/946 nm caracteristica combinatiilor octaedrice ale Fe(III). Spectrele combinatiilor manganului contin o banda larga, pe tot domeniul vizibil fiind caracteristice speciilor octaedrice ale Mn(III). Avand in vedere datele prezentate mai sus s-a propus pentru combinatiile complexe o formulare mononucleara, cu ionul metalic coordinat la 4 atomi de azot ai ligandului macrociclic format in reactia de condensare, hexacoordinarea fiind completata fie de doi anioni clorura fie de doi anioni perclorat asa cum se observa in figura 7.
Fig. 7. Coordinarea propusa pentru combinatiile complexe Metode de analiza si tehnici de lucruPentru determinarea cantitativa a elementelor componente din combinatia complexa, s-au efectuat urmatoarele analize chimice : cuprul s-a determinat volumetric utilizand metoda cu tiosulfat; fierul si manganul s-au determinat gravimetric ca oxizi analiza termogravimetrica s-a efectuat cu un derivatograf Setaram Labsys 1200 in curent de aer sintetic cu un debit 16,67 ml/min. S-au utilizat creuzete de alumina si incalzirea s-a efectuat cu 10 C/min. spectrul electronic a fost inregistrat la temperatura camerei, la un spectrofotometru Jasco V 670, prin tehnica reflexiei difuze, utilizand ca referinta MgO; spectrele IR au fost inregistrate in domeniul 400- 4000 cm-1 la un spectrofotometru Bruker Tensor 37 folosind tehnica pastilarii cu KBr. ConcluziiAu fost sintetizate combinatii complexe noi ale Cu(II), Fe(III) si Mn(III) prin reactia prin condensare one pot" a trietilentetraminei cu acidul barbituric si formaldehida. Combinatiile complexe au fost formulate pe baza datelor furnizate de analiza chimica elementala si analiza termogravimetrica. Condensarea si modul de coordinare al liganzilor a fost stabilit pe baza spectrelor IR. Stereochimia adoptata de ionul metalic a fost determinata indirect din spectrele electronice. Bibliografie F Saczewski E D Borys, J.Bednarski, R Grunet M Gdaniec P Tabin, J Inorog Biochem 100 (2006) 1389-1398 A Barik, B Mishra, A Kunwar, RM. Kadamb, L Shen, S Dutta, S Padhye, A Satpati, K. I Priyadarsini, Eur Jour of MedChem 42 (2007) 431-439 M Devereux, D O'Shea, , H Grehan, G Connor, G Rosair, F Lyng, A Kellett, M Walsh, DEgan, B Thati Polyhedron 26 (2007) 4073-4084 S Dutta, S Padhye, F Ahmed, F Sarkar, Inorganica Chimica Acta F Cisnetti , G Pelosi , C Policar Inorganica Chimica Acta 360 (2007) 557-562 T. Balaban, M. Banciu si I. I. Pogany, "Aplicatii ale metodelor fizice in chimia organica", Ed. Stiintifica si enciclopedica, Bucuresti, 1983. K. Nakamoto, Infrared and Raman Spectra of Inorganic and Coordination Compounds, Wiley, New York, 1986, 205, 234. B.J. Hathaway, Comprehensive Coordination Chemistry, G. Wilkinson, R.D. Gillard, J.A. McCleverty, Eds.; Pergamon Press:Oxford, U.K., 1987; Vol. 2, p. 420. A.B.P. Lever, Inorganic Electronic Spectroscopy, Elsevier, Amsterdam, London, New York, 1986, p. 554. Copyright © 2024 - Toate drepturile rezervate | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||