 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
Superoxid dismutaza (SOD)
In 1969, McCord si Fridovich au raportat pentru prima data faptul ca o proteina izolata din eritrocite functioneaza ca enzima de tip superoxid dismutaza De atunci s-au publicat sute de lucrari despre formarea O2¯ in diferitele reactii chimice sau de efectul inhibitorilor produs prin simpla adaugare a SOD in mediul de reactie.(24, 89).
In general, exista trei tipuri de superoxid dismutaze, fiecare avand un ion metalic diferit in situsul catalitic. Astfel, cele mai intalnite forme ale enzimei sunt superoxid dismutaza ce contine cupru si zinc (Cu,Zn-SOD)(se gaseste intracitoplasmatic), superoxid dismutaza ce contine mangan (Mn-SOD) (care se afla in matricea mitocondriala) si superoxid dismutaza ce contine fier (Fe-SOD) (care se gaseste la bacterii si plante). Recent a fost descoperita si o forma a enzimei cu nichel (Ni-SOD) in Streptomyces griseus.
Toate mamiferele consuma oxigen ca suport al respiratiei, dar o cantitate considerabila din acest oxigen este metabolizata ca superoxid. Organismele aerobe contin o cantitate mare de SOD care asigura protectia celulei fata de acest agent toxic rezultat din procesul de respiratie. Superoxidul poate suferi o disproportionare spontana cu formare de apa oxigenata si oxigen (reactia 1), mecanismul fiind dependent de pH, dar efectul catalizei de catre SOD este remarcabil (reactia 2).
2HO2 → O2 + H2O2 (1)
HO2 + O2¯ + H+→ O2 + H2O2 (2)
Superoxid dismutaza poate accelera foarte mult acest proces. La pH fiziologic, viteza reactiei catalizate de Cu, Zn-SOD are o viteza mult mai mare (k=1,6 x109 M-1·s-1) comparativ cu cea necatalizata (9,7 x 107 M-1s-1). Reactia catalizata de Mn SOD decurge cu o viteza de k=1,8x 10 9 M-1·s-1.
Aceasta valoare este apropiata de limita de
difuzie si prezinta o energie de activare foarte mica; constanta scade prin
cresterea viscozitatii solventului. CuZn - SOD este inhibata de CN¯ avand o constanta de inhibare I50 =
Mecanismul de disproportionare al superoxidului poate fi separat in doua etape, prima implica oxidarea O2¯ de catre forma oxidata a enzimei cu generarea O2 (reactia 3) si a doua consta din reducerea O2¯ de forma redusa a enzimei cu formarea apei (reactia 4).
O2¯ + enzimaox → O2 + enzimared (3)
O2¯ + 2 H+ + enzimared → H2O2 + enzimaox (4)
SOD a fost cunoscuta mai mult ca o cuproproteina (in functie de localizarea tisulara, eritrocitara, hepatica si cerebrala), crezandu-se ca serveste la depozitarea cuprului. De-abia in ultimii ani SOD a fost recunoscuta ca cea mai importanta enzima a vietii aerobe, depasind in acest sens citocrom oxidaza, enzima finala in respiratia tisulara.
Este prima enzima din lantul enzimatic de aparare fata de toxicitatea O2 si numai prin aparitia ei acum 3 miliarde de ani viata aeroba a putut sa se afirme. Necesitatea aparitiei SOD provine din cauza structurii electronice a O2, reactie de spin, favorizand calea universala de reducere a O2 cu formare intermediara a O2¯. Aceasta reactie interzisa de spin se poate realiza prin reactii in care O2 se combina cu un ion al unui metal tranzitional (Cu2+ sau Fe2+ ) mai ales complexat. De aceea toate enzimele implicate in reactii directe cu O2 au drept grupare prostetica unul din acesti ioni.
Odata cu aparitia O2 pe pamant, bacteriile anaerobe existente au trebuit sa dezvolte unele sisteme de aparare contra produsilor rezultati din reactiile:
O¯·2 + O¯·2 + 2H+ ![]() H2O2 + O2 (x)
H2O2 + O2 (x)
O¯·2 + H2O2 → OH- + OH· + O2 (x)
specii rective cu efecte nocive structurilor organice. Aceste sisteme de aparare au avut ca punct de plecare reactia:
O¯·2 + Mn+ → O2 + M(n-1)+
Se pare ca la inceput a fost preferat Fe2+ asa cum au aratat studiile intreprinse de Halliwell, Fee, McCord si Day []:
O + Fe2+ - EDTA + 2H+ → H2O2 + Fe3+ - EDTA (x)
O¯·2 + citocrom c ( Fe3+ ) → O2 ( triplet) + citocrom c ( Fe2+)(x)
Ca dovada s-a observat ca peroxidaza si catalaza au oarecare activitate dismutazica, iar Yost si Fridovich au izolat de la Escherichia coli o SOD ce contine un atom de Fe3+ in molecula (101). Recent, Gregory si More (33) au aratat ca toleranta mare a bacteriilor anaerobe fata de O2 se datoreaza unui continut variabil de SOD, mai bogate fiind speciile Bacteroides. Descoperirea de catre Keele (44) tot in E. coli a unei SOD ce contine mangan sugereaza o selectie in alegerea unui ion metalic potrivit. Asa se explica existenta SOD cu mangan la primele forme de viata aerobe.
Atat SOD ce contine fier cat sic cea cu mangan nu au oferit vietii aerobe in curs de dezvoltare o protectie suficienta, incat s-a impus SOD ce contine Cu si Zn. Studiile lui Fee (24) au aratat ca ionii de Cu2+ au activitate dismutazica mica care creste prin complexare la proteina. Zn2+ nu participa direct la mecanismul catalitic dar potenteaza capacitatea dismutazica a Cu2+.
Experiente
interesante s-au efectuat (27) asupra tolerantei la O2 a organismelor
anaerobe. Astfel, Lactobacillus plantarum,
anaerob ce nu contine SOD este aerotolerant, dar nu poate utiliza O2.
Expunerea unor microorganisme facultativ aerobe ca Streptococcus faecalis, E.
coli, si Saccharomyces cerevisiae
la O2 in concentratii crescande determina acumularea unor nivele
ridicate de SOD intracelular si o toleranta crescuta
Antibiotice
ca streptonigrin, mitomicina-C si porfiromicina sunt mult mai lente in prezenta
O2, deoarece determina un ciclu de reactii redox cu producere de O¯·2
, care in vitro produce scindari in molecula de ADN. Microorganisme ca E. coli , B sau K12, cu un continut mare
in SOD sunt rezistente la actiunea acestor antibiotice. In alte experimente
s-au selectat mutanti de E.coli K12
pe baza intolerantei
In timp ce valorile normale in sange pe scara animala variaza foarte mult pentru catalaza si glutatio peroxidaza, in cazul SOD sunt grupate intre 1200-1400 unit/gr hemoglobina (52). La nou nascuti, nivelul SOD este foarte mic, crescand rapid pana in ziua a 20-a cand atinge concentratia corespunzatoare adultului; la batrani se gasesc valori scazute fata de tineri (65). Valori crescute de SOD in hematii se intalnesc in trisomia 21, iar un nivel scazut s-a gasit in anemia Fanconi (9) si in sindromul Dubin-Johnson (77). Nu s-a gasit in general o relatie intre variatiile SOD si ale celorlalte enzime implicate in protectia fata de toxicitatea oxigenului.
1. Superoxid dismutaza cu cupru si zinc
Superoxid dismutaza cu cupru si zinc (CuZn-SOD) este prezenta in aproate toate celulele eucariote si la multe dintre procariote.
CuZnSOD a fost izolata din citoplasma celulelor eucariotoce, de la drojdii, fungi, plante superioare, hematii si ficatul de mamifere. FeSOD si MnSOD au fost izolate de la bacterii, alge albastre si verzi si, in mod surprinzator, din mitocondriile de mamifere (27). Aceasta descoperire a furnizat baza unei ipoteze emise de Weisiger (99) dupa care formatiile subcelulare au o origine simbiotica provenind din bacterii fotosintetice, care prin dobandirea unui sistem enzimatic pentru scindarea H2O au creat o fotosinteza oxigenata asemanatoare celei existente astazi la plante. Aceasta capacitate de utilizare a O2 presupune o legatura functionala si filogenica intre mitocondrie si cloroplaste, care prin reactia catalizata de SOD vor produce H2O2. In timp ce FeSOD si MnSOD nu sunt inhibate de cianuri, CuZn-SOD este sensibila la acestea (4). Totusi, celulele eucariote, contin in general CuZn-SOD in citosol si Mn-SOD in mitocondrii. Cele doua forme sunt usor de deosebit, deoarece CuZn-SOD este inhibata de CN¯ si este stabila la tratare cu un amestec etanol - cloroform. Desigur ca s-au gasit si exceptii cum ar fi Mn-SOD izolata din inima de bou, ce are o masa moleculara de 86.000 Da, fiind formata din 4 subunitati legate ionic si contine 2 Mn pe molecula (53). Trebuie amintit ca MnSOD din mitocondrii si MnSOD extrasa din bacterii au secvente de aminoacizi unele asemanatoare si altele semnificativ diferite de cea a apoproteinei CuZn-SOD (59).
1.1 Structura Cu, Zn-SOD
Un amplu studiu despre aceasta enzima a fost realizat de Fee (24) care a aratat ca Cu,Zn-SOD prezinta o structura tridimensionala aparte. SOD izolata din hematiile bovine are o greutate moleculara de 31.500 Da, contine doi atomi de cupru si zinc si consta din doua subunitati polipeptidice identice formate din 151 resturi de aminoacizi.
Studiile de difractie de raze X au aratat ca fiecare subunitate apare ca un cilindru cu structura β inauntrul caruia se gasesc centrii activi (80). Cele doua subunitati sunt legate prin legaturi hidrofobe, iar cei doi centrii activi, situati in pozitii opuse par sa actioneze independent. O fata a pozitiei cuprului este expusa solventului, pe cand zincul este situat in interiorul proteinei.
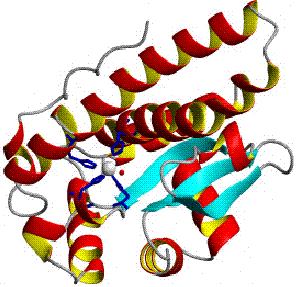
Figura 1..
Situsul in care se coordineaza ionii metalici este format din sase resturi de histidina si unul de aspartat (fig. 2).
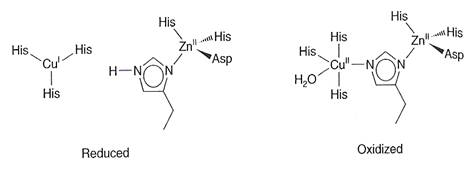
Fig. 2. Situsul activ al Cu,Zn-SOD in forma redusa si oxidata
Din punct de vedere al structurii
proteice, majoritatea stucturilor formelor oxidate si reduse ale enzimei sunt
extrem de asemanatoare; diferentele semnificative sunt localizate intr-o
regiune situata in apropierea ionului de cupru, reprezentata de trei legaturi
coordinative in CuIZn-SOD respectiv cinci legaturi coordinative in
CuIIZn-SOD. In
CuIZn-SOD, Cu(I) este legat de trei grupari imidazolice de la
resturi histidinice intr-o stereochimie plan-trigonala
in timp ce Zn(II) este legat de trei grupari imidazolice de la resturi
histidinice si la o grupare carboxilat de la un rest de Asp. In CuIIZnSOD
aproape intreaga structura proteica, ca si situsul zincului si pozitia celor trei molecule de
His coordinate la cupru difera foarte putin de forma redusa a enzimei. Difrentele
semnificative de structura apar in vecinatatea ionului de cupru si anume:
(1) Cu(II) din Cu IIZnSOD se gaseste la ~1Å distanta de situsul zincului;
(2) His63 unul dintre liganzii zincului, este deprotonata si se leaga si la Cu (II), functionand ca ligand in punte
(3) o molecula de apa se coordineaza la Cu(II).
O caracteristica structurala extrem de importanta, atat in forma redusa cat si in cea oxidata, este «canalul» de acces catre ionul de cupru sub forma de palnie. Acesta are diametrul de 24 Å la suprafata proteinei si devine progresiv mai ingust pana la 4 Å deasupra ionului de cupru. Ingustarea lui la baza are efectul de a limita liganzii care se pot lega la Cu2+ in forma oxidata a enzimei, la anioni mici, similari ca dimensiuni si valenta cu superoxidul cum ar fi cianura, azida, fluorura, facand ca enzima sa aiba o specificitate foarte mare pentru anionul superoxid.
Canalul situsului activ contine de asemenea o molecula de arginina la o distanta de aproximativ 6 Å deasupra ionului de cupru ce joaca un rol important in generarea campului electrostatic ce atrage superoxidul in dreptul deschiderii canalului situsului activ. In plus, gruparea guanidil, a restului de Arg incarcata pozitiv, este considerata a fi bine pozitionata pentru a ajuta la ghidarea anionului superoxid in interiorul canalului si la formarea de legaturi de hidrogen cu acesta pe masura ce se apropie de cupru, atat ia forma oxidata cat si ia cea redusa. Canalul situsului activ contine de asemenea un lant de molecule de apa cu numar mare de legaturi de hidrogen care probabil joaca un rol in mecanismul de reactie prin interactia cu superoxidul si traverseaza canalul comportandu-se ca un donor de protoni in timpul reducerii superoxidului la peroxid.
Un model al mecanismului reactiei superoxidului cataliyate de CuZn-SOD, bazat pe numeroase structuri cristaline ale CuZn/SOD si pe date cinetice si spectoscopice este prezentat in figura
2.1.1 Oxidarea superoxidului de CuIIZn/SOD
Anioni ca azidaa (N3¯), cianura(CN¯) si florura (F¯) se leaga direct de Cu(II) in CuIIZn-SOD, si apoi cei doi liganzi secundari se schimba rapid. De aceea este posibil ca superoxidul sa se coordineze la Cu(II), formand o combinatie complexa CuII(O2¯) inaintea transferului de electroni ce formeaza produsii CuIZnSOD si O2. Este posibil ca O2¯ sa intre in canalul sitului activ a CuIIZn-SOD, sa interactioneze cu lantul de molecule de apa si Arg din apropierea situsului activ pe care le intalneste in cale, in final dezlocuind ligandul apa de la Cu(II) din situsul activ. Ulterior se produce transferul de electroni si O2 format (reactia 3) este eliberat si difuzeaza in afara canalului. In acelasi timp puntea imidazolica este rupta si His63 protonata (fig 3, dreapta).
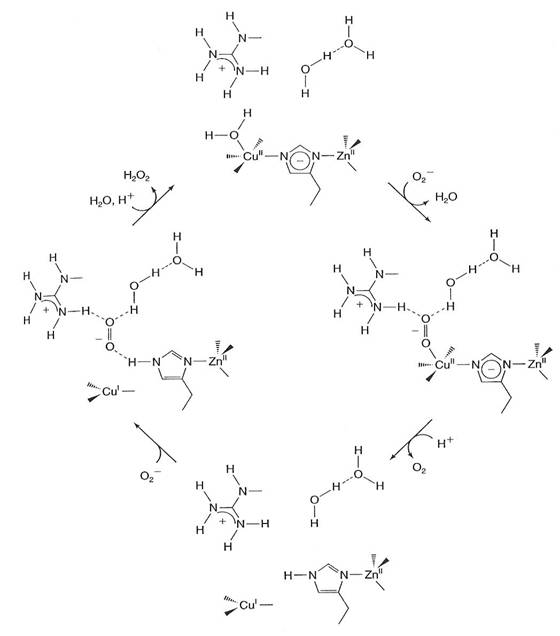
Fig. 2. Reprezentarea schematica a ciclului catalitic pentru Cu,Zn-SOD
2.1.2 Reducerea superoxidului de Cu IZnSOD
Reducerea superoxidului de catre Cu IZnSOD pare a fi precedata de un mecanism de tip sfera exterioara. Situsul acitv al CuIZn/SOD leaga anioni mici, dar aparent nu de Cu(I) in sine. Aceasta constare nu este surprinzatoare deoarece este de asteptat ca centrul plan-trigoanal Cu(His)3 sa aiba o afinitate scazuta pentru legarea celui de-al patrulea ligand, pe baza comparatiilor facute cu combinatii complexe model ale cuprului(I). Un studiu privind legarea ionului azida atat la forma oxidata cat si la cea redusa a CuZn-SOD ce a folosit specroscopia IR cu transformata Fourier ( FTIR) a dus la concluzia ca azida se leaga la Cu (II) in forma oxidata a enzimei dar se lega in alt loc in forma redusa si la fel si in enzima fara cupru, probabil la gruparea guanidil a restului de Arg din canalul situsui activ si probabil interactioneaza cu lantul de molecule de apa si gruparea H-N din His63
Pentru ca superoxidul sa fie redus rapid de Cu IZn-SOD trebuie se existe un proton strans legat de O2¯ si acesta sa accepte un electron pentru a deveni peroxid. Probabil protonul His63 joaca rolul de donor de protoni si produsul este anionul hidroperoxid. Acest oxianion probabil formeaza o combinatie complexa cu Cu2+, daca se formeaza in aceasta etapa a reactiei (reactia 4). Dupa acesta urmraza protonarea si pierderea de H2O2.
Alternativ, HOO-, poate accepta un proton de la lantul de molecule de apa pentru a forma H2O2 direct, fara formarea combinatiei complexe Cu(II)-hidroperoxid.
Ciclul
imidazolic al His63 se leaga numai de Zn(II) din CuIZn-SOD, unde
este deprotonat si formeaza imidazol, care uneste Cu(II) si Zn(II) din CuIIZn-SOD.
Zn(II)-imidazolatul cu siguranta joaca un rol important in mecanismul CuZn-SOD,
devreme ce indepartarea zincului din structura enzimei face ca activitatea
acesteia se fie dependenta de pH. Studiile despre activitatea SOD Zn-deficitara
prin radioliza in puls au stabilit ca reducerea Cu(II) de catre supeoxid mediata de aceasta forma a
enzimei ramane rapida si independenta de pH. De aceea, se poate concluziona ca
oxidarea de catrea superoxid a Cu(I) din
enzima Zn-deficitara determina viteza reactiei si este pH dependenta. Aceste
observatii sugereaza ca gruparea Zn2+-imidazolat joaca un rol
important determinand viteza reducerii superoxidului de catre CuIZnSOD
si lipsa dependentei de pH. S-a postulat ca, coordinarea Zn2+-imidazolatului
la Cu(II), cu formarea puntii imidazolice, previne legarea puternica a
anionului hidroperoxid la cupru prin directionarea lui catre o pozitie de
coordinare axiala
Factorii implicati in reglarea nivelului de SOD sunt complecsi :
=> O2 are un efect inductiv asupra SOD, demonstrat clar la bacterii aerobe; continutul ridicat in SOD determina radiorezistenta la bacteria Micrococcus radiodurans;
=> tumorile localizate la nivelul unor organe interne si supuse tratamentului cu antibiotice antraciclinice isi maresc continutul in CuZnSOD, deoarece aceste medicamente actioneaza prin eliberarea de O2¯ si H2O2 ;
=> incarcarea cu Cu, induce cresterea activitatii Cu-Zn-SOD si scaderea nivelului de glutation peroxidaza; in plus, cresterea continutului de Cu in ficat determina si cresterea peroxidarii lipidelor.
Pe baza acestor date si observatii s-a inceput si experimentarea clinica a utilizarii terapeutice a SOD purificate in conditii patologice foarte variate; cataracta, displazie bronhopulmonara, intoxicatii chimice, artrita reumatoida, efecte secundare ale tratamentului radioterapeutic sau cu citostatice.
Copyright © 2025 - Toate drepturile rezervate