 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
Semnificatia si determinarea KM si Vmax
Semnificatia
lui ![]() si V max este unica pentru fiecare enzima in
parte. Daca in ecuatie M-M se
inlocuieste v cu
si V max este unica pentru fiecare enzima in
parte. Daca in ecuatie M-M se
inlocuieste v cu ![]()
ec
M-M:![]() è
è ![]()
![]()
In situatia in care
viteza reactiei enzimatice este ![]() at.
at.![]() =
concentratia substratului. Pentru majoritatea reactiilor enzimatice,
=
concentratia substratului. Pentru majoritatea reactiilor enzimatice,![]() variaza
intre concentratii
variaza
intre concentratii ![]() M(mol).
M(mol).![]() desi nu este o
constanta veritabila de disociere a complexului enzima substrat permite
determinarea afinitatii. O valoare mare a
desi nu este o
constanta veritabila de disociere a complexului enzima substrat permite
determinarea afinitatii. O valoare mare a![]() indica o afinitate mica enzima-substrat, iar o
valoare mica indica o afinitate mare. Acesta semnificatie are o importanta
biologica si fiziologica deosebita. Reactia de fosforilare a glucozei este
catalizata de glucochinaza si hexochinaza.
indica o afinitate mica enzima-substrat, iar o
valoare mica indica o afinitate mare. Acesta semnificatie are o importanta
biologica si fiziologica deosebita. Reactia de fosforilare a glucozei este
catalizata de glucochinaza si hexochinaza.![]() hexochinaza c= 0,15 mM
fct cu
hexochinaza c= 0,15 mM
fct cu ![]() la toate concentratiile glucozei
in sange.
la toate concentratiile glucozei
in sange.
![]() glucochinaza c=0.1 mM
actioneaza cu Vmax/2 in concentratia
glicemiei fiziologice si are o viteza de reactie suficient de mare numai la
concentatii mari de glucoza. Acest fenomen are loc numai in sangele venos
portal.
glucochinaza c=0.1 mM
actioneaza cu Vmax/2 in concentratia
glicemiei fiziologice si are o viteza de reactie suficient de mare numai la
concentatii mari de glucoza. Acest fenomen are loc numai in sangele venos
portal.
![]() variaza foarte mult de la o
enzima la alta:
variaza foarte mult de la o
enzima la alta: ![]() si
si![]() se determina masurand viteza reactie la
diferite concentratii ale substratului.
se determina masurand viteza reactie la
diferite concentratii ale substratului.
COMPLEXE MULTIENZIMATICE
In caile metabolice se remarca prezenta
complexelor multienzimatice ce constau din din enzime diferite. Aceste complexe
catalizeaza reactii successive din calea metabolica, respectiva. Eficenta este
realizata prin transformarea rapida a produsilor de reactie al primei reactii
la centrul catalitic, pt care devine substrat.![]()
![]()
![]()
Exemple de complexe multienzimatice
piruvat dehidrogenaza
acid gras sintetaza
IZOENZIME forme
multiple ale unei enzime care catalizeaza aceeasi reactie. Ele difera prin
secvente de -AA si prin urmatoarele proprietati :
- afinitate pt substrat
ct "M"
viteza maxima de reactie
proprietati reglatorii
pH izoelectric
Specificitate fata de cofactor
Au rol important in diferentierea celulara si reprezinta o modalitate de adaptare la conditiile metabolice. Sunt enzime oligomere: alcatuiti din protomeri diferentiati aflati in raport bine determinat si specitic.
LACTATDEHIDROGENAZA(LDH)
Exista cinci izoenzime LDH care sunt tetrameri ce contin 2 tipuri de protomeri (H, M)
Izoenzimele ![]()
J ![]() si
si ![]() sunt caracteristice
muschiului cardiac
sunt caracteristice
muschiului cardiac
J ![]() si
si ![]() sunt caracteristice
tesutului osos (schelet)
sunt caracteristice
tesutului osos (schelet)
J ![]() sunt caracteristice tesutului
hepatic
sunt caracteristice tesutului
hepatic
Toate cele cinci enzime catalizeaza aceeasi reactie dar cu eficenta catalitica diferita
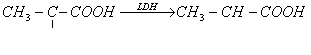
![]() (H ) transfera mai usor acidul lactic in acid piruvic
(H ) transfera mai usor acidul lactic in acid piruvic
KM are o valoare mai mare
Vmax are o valoare mai mica
Enzima predomina in muschiul cardiac.
![]() caracteristica
transformarii acidului piruvic in lactic. KM are valoare mica, Vmax are valoare mare, este mai
abundenta in ficat.
caracteristica
transformarii acidului piruvic in lactic. KM are valoare mica, Vmax are valoare mare, este mai
abundenta in ficat.
Proprietatile diferite reflecta deosebirile de matabolism oxidativ intens si aerob de anaerob.
Separarea si identificare izoenzimelor are o importanta deosebita in diagnosticul diferential si sunt deosebit de utile in biochimia clinica.
Factorii care influenteaza viteza de reactie(activitatea enzimatica )
Influenta pH-ului fiecare enzima este caracterizata de un pH optim, la care viteza de reactie este maxima.
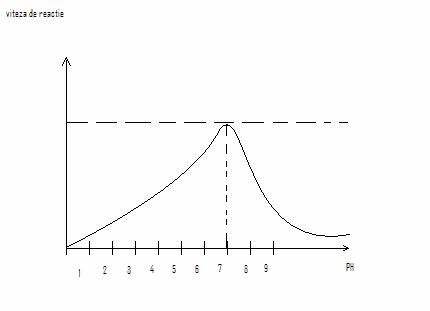
Panta abrupta relva sensibilitatea enzimei fata de pH. Datorita modificarii gradului de ionizare a resturilor de ά-AA din centrul catalitic al enzimei. pH-ul modifica gradul de ionizare al substratului si al resturilor de ά-AA, precum si conf.enzimei. pH-urile extreme inactiveaza enzima prin denaturarea proteinei. pH-ul optim reflecta mediul celular.
-pepsina = 2(pH) corespunde sucului gastric
-fosfataza alcalina= 10(pH)
-fosfataza acida = 5(pH)
Majoritatea enzimelor au pH optim = 7
Influenta temperaturii
Mai multe enzime sunt termolabile.
Viteza
creste cu temperatura si devine maxima la temperatura optima de (37° C) 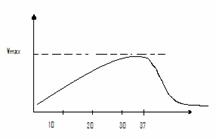
La temperatura mari sau scazute. Viteza de reactie scade brusc. prin denaturarea proteinei din enzima. Raportul cu care se modifica viteza reactiilor enzimatice intr-un interval de 10 grade se numeste coeficient de temperatura.
NOTIUNI GENERALE DE BIOENERGETICA
Metabolismul energetic
Existenta organismelor vii este conditionata de aportul continuu de materie si de energie din exterior.Transformarile sunt rapide datorita transformarii continue sinteza-degradare a constituentilor celulari. Metabolismul reprezinta totalitatea reactiilor si proceselor ce se desfasoara in organismele vii si include transformarile chimice pripriu-zis si energetice si nu reprezinta o suma de reactii individuale. Este alcatuita din secvente de reactii metabolice ce prezinta succesiuni liniare si ciclice si ramificate de reactii. In aceste secvente matabolice, produsul unei reactiii devine substrat, iar produsii succesivi ai reactiilor biochimice sunt cunoscuti sub numele de metaboliti: Ciclul Kreps
Metabolismul are 2 aspecte:
catabolismul : totalitatea proceselor de degradare a constatelor celulare in substante mai simple
anabolismul : totalitatea proceselor de biosinteza
Calea de sinteza si degradare nu este aceeasi, iar secventele metabolice diverse sunt segregate spatial(degradarea glucozei: mitocondrie, sinteza glucozei citosol). Intr-o celula pot avea loc simultan procese opuse si pot functiona mecanisme de control. independente.
Reactiile metabolice se desfasoara coordinativ, fiind supuse unui control metabolic imediat si sunt asociate cu schimburi energetice. Incercarile de exprimare a proceselor energetice au evidentiat modul particular de actiune a legii termodinamicii fapt ce a contribuit la aparitia unei stiinte( Bioenergetica), ce studiaza schimburile ce insotesc reactiile si modul in care are loc mobilizarea, transformarea si consumul de energie.
Radiatia solara este sursa primordiala de energie pentru toate organismele vii. Dupa modul in care recepteaza energia si in functie de forma sub care preiau carbonul, organismele vii se impart in:
autotrofe: lumea vegetala+
microorganisme sursa de carbon este bioxid de carbon, din care prin fotosinteza
isi sintetizeaza molecule organice complexe prin intermediul glucozei.![]()
heterotrofe: organismele animale care isi procura energia si C sunt forma de compusi organici complexi: glucide, lipide, proteine sintetizate de organismele autotrofe si de alte heterotrofe. Catabolismul acestor compusi sub forma de CO si apa se realizeaza in conditii aerobe si este insotit de eliberare de energieà este utilizata pentru procese anabolice si pentru sustinerea a numeroase procese consumatoare de energie: Excitatie nervoasa, contractie musculara etc.
Eliberarea energiei se face in trepte si in functie de necesitati si este controlata hormonal de catre hormonii tiroidieni. Principiile generale care guverneaza schimburile energetice.
Din punct de vedere energertic, organismele vii functioneaza pe baza acelorasi legi ca lumea nevie:
principiul I conserverea energiei in orice proces energia se conseva
Orice transformare libera se poate face in acelasi directie cresterii entropiei ansamblului.
Entropia este gradul de dezordine al unui sistem(transformarile spontane decurg in sensul cresterii dezordinei).
Starea ce corespunde valorii maxime a entropiei este starea de echilibru. In momentul in care este atinsa starea de echilibru (S.E.) in cazul sistemelor biologice (deschise), in care transformarile au loc la T, P, v sunt constante.
Deoarece reactiile au loc in solutii modificarile valorice pot fi neglijate.
Energia libera(G) este parametrul termodinamic cel mai util pentru aprecierea din punct de vedere energeric a sistemelor vii si reprezinta acea parte din energia termodinamica (ET) a sistemului care este capabila sa efectueze un Lucru Mecanic asupra mediului in conditii constante de temperatura si energie.
ET=G + T*S
T-temperatura abs
S-entropia
In termodinamica nu se opereaza cu valori absolute ci cu variatii ce continue energeric ale sistemelor atunci cand acesta sufera o transformare.
ΔE=ΔG+ T*ΔS
ΔG=ΔE-T*ΔS
Termenul de T*ΔS (energie legata)
Avantajul energiei libere este ca depinde de cantitatea de substanta si este o marime aditiva, adica energia libera a sistemului este egala cu suma energiilor libere ale compusilor.
ΔG total = ΔG1+ ΔG2+ΔG3
Energia libera a sistemului depinde numai de starea initiala si finala si nu depinde de starile intermediare .
Dupa valoare pe care le poate avea ΔG, reactiile chimice pot fi :
J-ΔG<0 reactii exoterme(cu degajare de Q evolueaza spontan de la stanga la drapta si poate efectua lucru mecanic)
J- ΔG>0 rectii endoterme (cu absotrie de Q, nu pot efectua lucru mecanic, necesita energie din exterior iar ΔG=0 è rectia este la echilibru si nu evolueaza spontan.
In organismele vii, majoritatea reactiilor biochimice fac parte din cai metabolice care constau din secvente de reactii.
ΔGt = insumarea ΔG pe fiecare secventa.
ΔG<0 calcularea metabolismului: exergonica
ΔG>0 calcularea metabolismului: endergonica
Caile exergonice sunt cai metabolice catabolice
Caile endergonice sunt cai de biosinteza anabolice
Moleculele complexe din organismele vii sunt degradate pe cai catabolice: sustin reactiile anabolice cu ΔG>0.
Copyright © 2025 - Toate drepturile rezervate