 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
Transportorul de oxigen din eritrocite este hemoglobina.
Hemoglobina vertebratelor consta din patru unitati polipeptidice: doua de un tip si doua de un altul.
Cele patru subunitati (protomeri) sunt mentinute laolalta prin interactii necovalente.
Fiecare protomer contine cate o grupare hem si cate un situs de legare pentru o molecula de oxigen.
La omul adult principalul tip de hemoglobina este hemoglobina A alcatuita din doi protomeri α si doi protomeri β.
La embrioni si fetusi structura hemoglobinei difera datorita mediului de viata diferit. Hemoglobina adulta si cea fetala au afinitati diferite pentru molecula de oxigen.
Structura hemoglobinei a fost descrisa de Max Perutz prin studii de difractie de raze X, in urma unei munci de un sfert de secol.
Subunitatile hemoglobinei au structuri tridimensionale similare cu cele ale mioglobinei.
Cele opt subunitati α helix ale lantului polipeptidic sunt similare cu cele ale mioglobinei. Aceasta mare asemanare de pliere a lantului polipeptidic ar putea parea neasteptata datorita secventei de aminoacizi a lantului mult diferita de a mioglobinei (aceste lanturi prezinta asemanari numai in 24 din cele 141 de pozitii).
Exista un model structural numit impachetare tip globina comun tuturor moleculelor de hemoglobina si mioglobina din organismul vertebratelor.
Aceasta impachetare constituie design-ul fundamental al oricarei molecule cu rol de transportor de oxigen: ea plaseaza gruparea hem intr-o vecinatate care o face capabila sa lege intr-un mod reversibil oxigen molecular.
Genele codificand mioglobina si subunitatile α si β ale hemoglobinei sunt variatii ale unei teme fundamentale. Aceasta familie de gene provine, cu siguranta, dintr-o gena ancestrala prin duplicare si diversificare.
Desi secventele lanturilor subunitatilor α si β provenind de la specii animale diferite sunt mult deosebite, exista totusi noua pozitii comune majoritatii, importante pentru functia biologica a hemoglobinei (Tabelul 1).
Tabelul 1. Pozitii conservate in secventa lanturilor de hemoglobina in cursul evolutiei.
|
Pozitia |
Aminoacid |
Rol biochimic |
|
F8 |
His |
Histidina proximala |
|
E7 |
His |
Histidina distala |
|
CD 1 |
Phe |
Contact cu hemul |
|
F4 |
Leu |
Contact cu hemul |
|
B6 |
Gly |
Permite apropierea stransa a zonelor a helicate B si E |
|
C2 |
Pro |
Rupe helixul la capatul unitatii C |
|
HC2 |
Tyr |
incrucisare a helixurilor H si F |
|
C4 |
Thr |
Nesigur |
|
H10 |
Lys |
Nesigur |
Secventa de aminoacizi a catenei polipeptidice din protomerii hemoglobinei variaza mult, dar caracterul radicalilor arninoacizilor (polar, nepolar) nu se modifica. Caracterul nepolar al interiorului moleculei se pastreaza neschimbat in scopul fixarii gruparii hem si al stabilizarii structurii tridimensionale.
Caracterul radicalilor de pe fata externa variaza mult.
Modul de legare al oxigenului de catre molecula de hemoglobina este cooperativ.La fel ca si in cazul mioglobinei, la legarea moleculelor de oxigen de catre hemoglobina se produc modificari conformationale importante.
Legarea oxigenului este insotita de ruperea legaturilor electrostatice dintre gruparile carboxilat din toate cele patru unitati polimere si gruparile amino ale argininei si lizinei din lanturile polipeptidice.
Aceasta afecteaza profund structura tertiara si cuaternara a hemoglobinei: o pereche de subunitati αβ se roteste fata de cealalta pereche, compactand tetramerul si crescandu-i afinitatea fata de oxigen.
Molecula de hemoglobina la fat si in viata postnatala este compusa din 4 lanturi de polipeptide: 2 lanturi α si doua lanturi non-alfa, care se combina pentru a forma o proteina globulara globina. Fiecare lant de globina este asociat cu o singura grupare hem care se poate lega reversibil de oxigen. Cea mai mare parte din hemoglobina, la adultul normal, este denumita hemoglobina A1(HbA1), care contine doua lanturi α si doua lanturi β. Formula hemoglobinei A1 este α2β2. La adult este prezenta si hemoglobina A2(α2δ2) in procent de 1,5-3,5 cat si cea fetala(F) in procent de 1 si care este alcalino-rezistenta.
HbA1-95,5-97,5%
HbA2-1,5-3,5%
HbF-1%
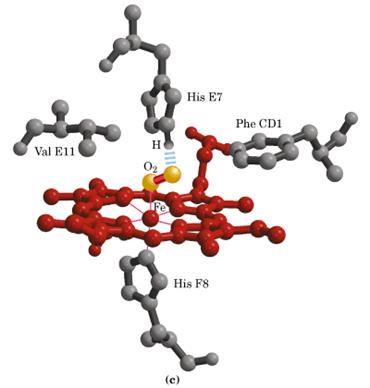
Fig. 9. Structura hemoglobinei
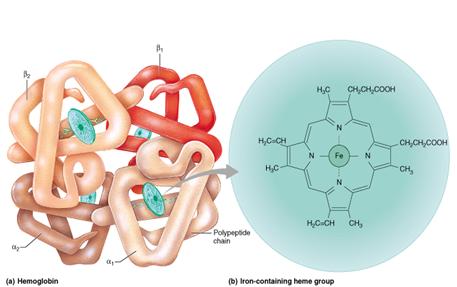

Fig. 10. Structura hemului
În cazul unei maladii genetice numita anemie falciforma, care afecteaza cu predilectie populatiile de culoare s-a observat modificarea moleculelor de hemoglobina.
În aceasta boala, eritrocitele au o forma de secera, sunt mult mai fragile si au o viata mai scurta decat cele normale ceea ce conduce la simptome de anemie severa.
Subiectii care exprima clinic boala sunt homozigoti pentru o gena mutanta localizata pe un cromozom autozomal. Heterozigotii sunt sanatosi clinic.
Hemoglobina bolnavilor in forma neoxigenata este anormal de solubila in apa, ea formand un precipitat fibros care deformeaza eritrocitele (hemoglobina S).
Între hemoglobina normala (HbA) si hemoglobina S (HbS) exista diferente din punct de vedere izoelectric si de numar si tip de grupari ionizabile. HbS are intre doua si patru grupari ionizate pozitiv in plus fata de HbA, expuse pe fata exterioara.Bolile genetice in care apar astfel de forme patologice de hemoglobine se numesc talasemii.
Copyright © 2025 - Toate drepturile rezervate