 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
ANATOMIA ONCOLOGICA A GLANDEI MAMARE
EMBRIOLOGIA GLANDEI MAMARE
Dezvoltarea glandei mamare incepe in embriogeneza precoce in ziua 16-a de evolutie a sarcinii, genele aflate pe cromozomul X de la mama sau de la tata sunt inactivate randomizat pentru fiecare celula in parte si acest eveniment stabileste mostenirea descendentilor acestei celule si sexul genetic [91].
Glanda mamara este o glanda sudoripara exocrina, cu origine ectodermica care are ca secretie laptele matern. Probabil ca originea embriologica apropiata a glandelor salivare, sudoripare si a glandei mamare explica frecventa similitudine morfologica si imunofenotipica a tumorilor ce se dezvolta in aceasta locatie [92].
In timpul embriogenezei umane glada mamara se dezvolta in saptamana a-6-a de gestatie de la nivelul mugurelui mamar situat in grosimea ectodermului si se extinde postero-anterior pe fata ventrala a fetusului. In saptamana a-9-a sunt definite pliurile mamare de mugure in aria toracica anterioara si penetreaza in profunzime mezenchimul subjacent formand sistemul ramificat ductal rudimentar [93].
Doar la om, glanda mamara normala se dezvolta in aria pectorala, dar sunt intalnite si 2 tipuri de glanda mamara ectopica:
prima - glanda mamara supranumerara care a fost observata in interiorul ganglionilor limfatici axilari la fel ca si de-a lungul liniei laptelui de la axila pana in regiunea inghinala. Cele mai comune situsuri in aceasta situatie sunt peretele toracic si vulva.
a doua - tesutul mamar aberant se gaseste la distanta de extensia anatomica a tesutului mamar normal. Glanda mamara nu este perfect demarcata ca organ pentru ca lobulii mamari pot sa apara si in afara limitelor anatomice standard ale parenchimului mamar, cum ar fi areola mamara sau axila. Aceasta explica prezenta situsului primar al cancerului mamar in regiunea areolara si in regiunea axilara [92].
Parenchimul mamar ectopic este subiectul modificarilor lactationale atat fiziologice cat si patologice implicate in dezvoltarea tumorilor maligne si benigne. Tesutul mamar are un caracter particular prin faptul ca glanda mamara apare cu morfologia definitiva in timpul perioadei embrionare si isi mentine arhitectura initiala pana la pubertate cand sanul sufera modificari considerabile sub influenta prolactinelor, estrogenilor si progesteronului.
Baietii pot avea si ei experienta cresterii tranzitorii a glandei mamare la pubertate, acesta fiind un proces normal de proportii reduse iar glanda mamara ramane rudimentara.
La femei glanda mamara are un maximum de dezvoltare in jurul varstei de 20 de ani si se mentine toata perioada reproductiva. Estrogenii promoveaza diferentierea mamara la nivelul sistemului ductal, iar progesteronul este important in dezvoltarea sistemului lobular.
Modificarile atrofice incep in jurul varstei de 40 de ani si sunt mai accelerate la menopauza, procesul de involutie este caracterizat de moartea celulelor prin apoptoza si remodelare tisulara [94].
Glanda mamara la om si la alte mamifere este un organ dinamic marcat de modificari semnificative in cursul vietii, mai ales in etapele pubertate, sarcina si lactatie. Cercetarile ultimelor decenii au ajutat la elucidarea cailor de reglare ale cresterii celulare, diferentierii si apoptozei [95]. Relatiile stromal-epiteliale sunt modulate prin intermediul interactiunilor celula-celula, interactiunilor dintre matricea extracelulara si matricea celulara, factorii de crestere locali, hormonii circulanti si alte elemente ale micromediului. Exista dovezi bine argumentate care arata ca in aparitia cancerului mamar sunt implicate mutatii care perturba reglarea normala a celulelor stem si a progenitorilor precoce [96].
Sistemul ramificat ductal rudimentar ramane inactiv din perioada embrionara pana la pubertate cand stimularea hormonala duce la cresterea rapida si dezvoltarea retelei ramificate ducto-alveolare. In acest stadiu de dezvoltare este general acceptat ca activitatea celulelor stem este gasita la capatul mugurelui terminal prin asa zisele "celule de acoperire " [97]. Aceaste celule sufera o diviziune simetrica generand 2 celule fiica identice dar si o diviziune asimetrica generand celule tranzitorii precoce. Din celulele tranzitorii se formeaza o masa celulara compacta care cuprinde in interior precursorii celulelor diferentiate epiteliale si la exterior precursorii celulelor diferentiate contractile. Lumenul ductal se constituie in centrul masei celulare prin apoptoza celulelor diferentiate epiteliale luminale. Astfel, este constituit ductul mamar cu lumen si perete propriu structurat pe 2 straturi :
la exterior, stratul bazal constituit din celule mioepiteliale contractile;
la interior stratul luminal constituit din celule epiteliale specializate.



matrice exracelulara Celule mioepiteliale
diferentiate celulele intrate in apoptotoza genereaza spatiu lumenului
ductal![]()
![]()
![]()
![]()
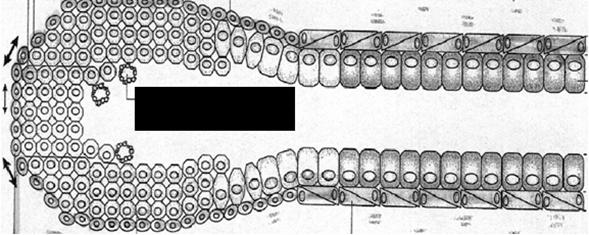
|
Mugurele terminal al celulei stem |
Fig. 3
Reprezentarea schematica a dezvoltarii arborelui mamar de la celula stem pana la obtinerea structurilor diferentiate luminale si mioepiteliale [98]
Ductul mamar se dezvolta generand ramuri si ramificatii prin tesutul adipos de acoperire. Proliferarea celulara intensa este contracarata de apoptoza si de remanierea realizata de enzimele de degradare din matricea extracelulara. Astfel apare imaginea unei miscari de inaintare care genereza morfologia glandei mamare inactive [97]. Glanda mamara sufera procesul de diferentiere terminala in timpul sarcinii si lactatiei, formand numeroasele structuri lobulo-acinare ce contin celule alveolare secretante de lapte. Prin apoptoza si remodelare tisulara, dupa incheierea perioadei de lactatie, glanda revine la forma anterioara. Unitatea de baza structurala si functionala in glanda mamara adulta este unitatea terminala ducto-lobulara (TDLU) de la nivelul careia iau nastere si majoritatea carcinoamelor mamare [99]. Astfel, acest compartiment al celulelor cu potential proliferativ crescut si abilitate de diferentiere marcata care sustine numeroasele sarcini in timpul vietii, corespunde definitiei compartimentului celulelor stem si progenitorilor ei precoce [100,101 ].
REglarea creSterii glandei mamare
Diferentierea totala a glandei mamare este un proces gradual ce se desfasoara de-a lungul vietii si devine completa doar la femeile ce alapteaza. Morfologia primara a glandei mamare din perioada embrionara cu sistemul ramificat ductal rudimentar se mentine pana la pubertate [102].
Primele semne ale modificarilor glandei mamare incep la pubertate si continua pana la maturitatea sexuala. Pubertatea este considerata punctul de initiere al functionarii ovarelor dependent de hormonii gonadotropi pituitari, FSH-ul (Hormonul foliculo stimulant) si LH-ul (Hormonul luteinizant) pentru care exista receptori in ovare. Dezvoltarea glandei mamare este astfel riguros controlata de ovar si la acest moment sunt definiti o multitudine de parametri anatomici si fiziologici: aria totala a glandei, volumul, gradul de ramificatie intraglandulara, gradul de diferentiere a structurilor proprii, ducte, lobuli si alveole [103]. Elongatia ductala si ramificarea intraglandulara debuteaza in timpul pubertatii, dar formarea definitiva a lobulilor apare la 1- 2 ani de la debutul menstrei.
Glanda mamara la adult este compusa din structuri specifice, ductele epiteliale lactifere ce se termina in alveolele secretorii sustinute in tesutul stromal fibroadipos.
La femeile nulipare predomina structurile nediferentiate (Lobul 1), iar la femeile care au avut cel putin o sarcina dusa la termen(pare) predomina structurile bine diferentiate (tip lobul 2 si 3) [fig 4]
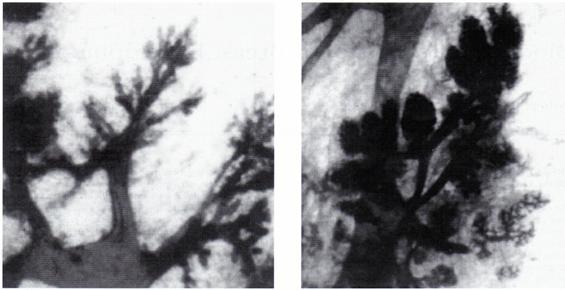
LOBUL 1- femeie 18 ani nulipara LOBUL 2-femeie 24 ani nulipara
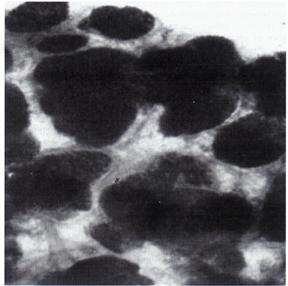
LOBUL 3 - femeie 35 ani multipara
Fig.4
Tesut mamar prelucrare completa cu Albastru de Toluidina x 25 [104]
Studii recente au identificat in tesutul mamar normal mai multe tipuri de lobuli in care densitatea ductelor creste progresiv fara a modifica dimensiunea lobulilor. Astfel, au fost evidentiati 3 tipuri de lobuli : -lobul 1 cu aprox 10 ductule
-lobul 2 cu aprox 50 ductule
-lobul 3 cu aprox 80 ductule
La femeile tinere predomina lobulii de tip 1 si se constata un grad de proliferare crescut cu diferentiere progresiva spre lobulii de tip 2 si 3 sub influenta hormonala menstruala. In timpul sarcinii se produce diferentierea finala cand este definit lobulul de tip 4, iar activitatea proliferativa este foarte redusa. Relatia intre diferentierea lobulara, proliferarea celulara si raspunsul hormonal al epiteliului mamar este in curs de a fi definita. Studiile au aratat ca structurile ductale si lobulare au o rata de proliferare mai crescuta comparativ cu structurile mioepiteliale din stroma inter- si intra lobulara [105].
Cresterea normala a sanului este reglata extrinsec de interactiunea complexa a mai multor factori care cuprind hormoni (estrogen, progesteron, hormonul tiroidian), factori de crestere (EGF- epidermal growth factor, FGF- fibroblast growth factor, TGF- transforming growth factor si IGF- insulin growth factor) si intrinsec, de celulele mamare, care au functie autocrina impreuna cu celulele stromale ce exercita functie paracrina [103,105].
Glanda mamara este de origine ectodermica si este continuta intr-o capsula fibroasa provenita din aponevroza clavi-coraco-pecto-axilara fiind inconjurata de un tesut celulo-adipos si tegument la exterior. Tesutul celulo-adipos inconjura glanda mamara in totalitate cu exceptia zonei areolo-mamare si este dispus intr-un strat anterior si unul posterior, retromamar.
Stratul premamar este format din lobuli adiposi situati in fosetele delimitate de ligamentele lui Cooper ce pornesc de pe proeminentele fibro-glandulare numite crestele Duret.
Structura glandei cuprinde doua componente principale : tesutul glandular si cel conjunctiv (stroma).
Tesutul glandular este alcatuit din lobuli si acestia din acini. In profunzimea glandei, canalele galactofore se ramifica, se anastomozeaza interlobular si se continua cu canalele intralobulare la capatul carora se gaseste acinul. Canalele intralobulare impreuna cu lobulul glandular constituie unitatea terminala ducto-lobulara de la nivelul careia iau nastere majoritatea carcinoamelor mamare.[8]
Dupa origine, carcinoamele mamare pot fi ductale (70%) si lobulare (30%).
La baza mamelonului se concentreaza 15-20 canale galactofore principale la nivelul unei dilatatii fusiforme numita sinus galactofor.
Stroma este formata din tesut conjunctiv vascular ce compartimenteaza parenchimul epitelial al glandei in acini, lobuli si lobi.
Acini
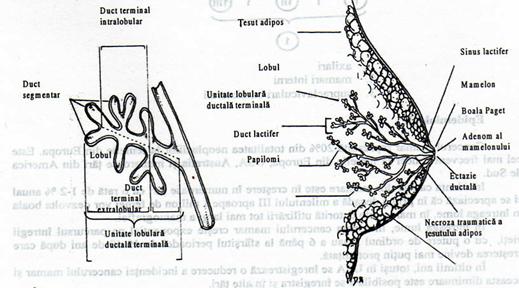
Fig.5
Unitatea morfostructurala a glandei mamare [8]
Circulatia venoasa este dispusa in doua retele: una superficiala si alta profunda.
Reteaua venoasa profunda colecteaza sangele prin urmatoarele cai:
a) calea venelor perforante spre mamara interna
b) calea venelor axilare si a venei subclaviculare si a trunchiului brahio-cefalic spre cava superioara
c) calea venelor intercostale ce se anastomozeaza cu venele vertebrale si ajung in vena azygos si de aici in cava superioara.
Celulele tumorale pe calea acestor cai, trec din sistemul cav in inima dreapta si ajung in primul filtru pulmonar.
Sistemul limfatic dreneaza limfa centrifug pe doua cai principale:
-calea mamara interna (din cadranele interne si centrale)
-calea principala axilara (din intregul san) si alte cai accesorii: transpectorala, retropectorala, presternala, retrosternala si calea epigastrica (Gerota).
Ganglionii principali ai sanului cuprind:
ganglioni axilari (mamari externi, scapulari, axilari centrali, ai venei axilare si subclaviculari)
ganglioni mamari interni si cei supraclaviculari.[11]
4. MECANISMELE CARCINOGENEZEI GLANDEI MAMARE
Cercetarile ultimilor decenii au ajutat la elucidarea cailor de reglare a cresterii celulare, diferentierii si apoptozei. Interactiunea factorilor de crestere, citokine, hormoni cu receptorii membranari specifici constituie elementul declansator al cascadei semnalizarii biochimice intracelulare rezultand activarea sau supresia variatelor seturi de gene. Acesti factori ce regleaza dezvoltarea celulelor mamare normale sunt intalniti si la nivelul celulelor tumorale mamare [106].
Anomaliile genetice ce apar in caile de semnalizare ale acestor factori de crestere si inhibitorii lor sunt responsabile de o multitudine de boli cronice printre care si cancerul [107,108].
Lumen vascular![]()
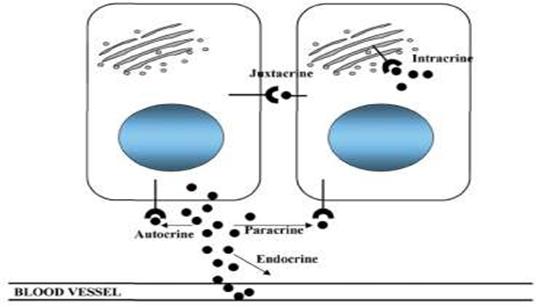
Fig.6
Moduri de actiune a factorilor de crestere
Celulele maligne apar ca rezultat al acumularilor progresive in evenimente genetice incluzand in special supraexpresia factorilor de crestere si ai cailor de semnalizare adiacente. Studiile recente arata ca celulele canceroase mamare sub control hormonal sintezeaza si secreta factori de crestere ce pot autostimula celule canceroase precum si celule stromale prin mecanism autocrin si paracrin [110].
Cancerul mamar este considerat o malignitate hormono-dependenta. Incepand cu studiile lui Beatson (1896) si pana in prezent intelegerea curenta a genezei cancerului si implicarea hormonala are la baza peste 100 de ani de cercetare. Studiile sustin ca celulele canceroase mamare sub influenta estrogenica controleaza sinteza si secretia factorilor de crestere ce sunt capabili sa autostimuleze celulele transformate sau celulele adiacente stromale prin mecanism autocrin sau paracrin [110].
Potentialii factori de crestere autocrini/paracrini includ EGF, TGF alfa, IGF1, IGF2, FGF, PDGF (factorul de crestere derivat din plachete) si au fost identificati prin prezenta expresiei in culturile de celule maligne si mostrele tisulare de tesut mamar tumoral [111,112,113]. Acestea manifesta potential mitogen pentru componentele epiteliului tumoral [114,115].
Rolul biologic al estrogenilor este mediat prin afinitatea mare de legare a liganzilor (hormoni steroizi, tiroidieni si vitamine) ce induc stimularea receptorilor nucleari [116,117].
Cel mai cunoscut peptid cu activitate inhibitorie autocrina este TGF beta ce inhiba proliferarea celulelor epiteliale si stimuleaza proliferarea celulelor stromale . Studiile moleculare sugereaza ca celulele tumorale mamare cu ER negativi sunt mai sensibile la TGF beta, comparativ cu cele cu ER pozitivi [118].
Potentialul malign al celulelor mamare transformate este dependent de balanta dintre stimulatorii cresterii si inhibitorii produsi de tumora. Atat celulele epiteliale cat si celulele stromale tumorale secreta enzime: proteaze, stromelizina, catepsina, urokinaze , ce participa la invazia tumorala si metastazare [119,120].
In celulele tumorale cu ER pozitivi expresia si secretia factorilor de crestere autocrin este mediata prin intermediul estrogenilor ce stimuleaza AND-ul, ARN-ul, sinteza proteica si activitatea enzimelor reglatoare cheie ale ciclului celular [121,122].
Studii de kinetica celulara arata ca antiestrogenii incetinesc tranzitia celulelor in ciclul celular si blocarea acestora in faza G1 [123].
In mod normal oncogenele functioneaza ca reglatori ai celulelor normale in organism iar cand sunt supreexpimate induc sau promoveaza fenotipul malign in organism [124,125]. Produsii oncogenelor sunt factori de crestere sau receptori ai acestora. Oncogenele supraexprimate in celulele mamare maligne sunt: cMYC, RAS, int-2, ERB 2, HER 2, HER3, HER4. Supraexpresia sau mutatiile acestora, constituie stimulul de activare aberanta al receptorilor (in absenta semnalizarii date de liganzii specifici) avand ca efect cresterea necontrolata a celulelor [126,127]. Supraexpresia acestor oncogene implicate in dinamica ciclului celular contribuie la initierea si intretinerea fenotipului malign [128,129,130].
Cuantificarea expresiei acestor gene in celulele tumorale ofera informatii asupra agresivitatii tumorale, prognosticului si posibila sensibilitate la terapie [131,132,133,134,135].
Una din cele mai studiate gene in cancerul mamar este BCL2 a carei supraexpresie este asociata cu cresterea agresivitatii tumorale si scaderea raspunsului la tratament [136,137,138].
Un rol important in carcinogeneza mamara il joaca si genele supresoare tumorale dintre care cele mai cunoscute sunt p53 si gena retinoblastomului RB identificate si in alte tumori solide [139,140,141,142,143,144,145,146,147]. In ultimele decenii au fost studiate 2 gene BRCA1 si BRCA2 ce functioneaza ca gene supresoare tumorale in conditii normale, dar prin inactivare sau supresie asociaza un risc crescut de cancer mamar familial [149,150,151].
In lumina acestor noi descoperiri s-a emis ipoteza unor strategii noi terapeutice ce pot sa influenteze fenotipul malign introducand copii ale genelor normale sau proteine supresoare normale [152,153].
5. CANCERUL MAMAR - BOALA SISTEMICA DE LA DIAGNOSTIC
Informatii provenind din variate surse ale studiilor actuale arata ca multe dintre pacientele cu cancer mamar diagnosticate in stadii precoce prezinta boala diseminata inca de la momentul diagnosticului. Astfel nu este surprinzator ca tumori avand diametrul de 1 cm (dimensiunea minima pentru a fi diagnosticata in stadiul precoce) au progresat deja spre boala metastatica [279].
Datele de supravietuire arata ca in cancerele "potential curabile" (diagnosticate si tratate corect in stadii precoce) procentul de supravietuire la 10 ani este variabil, astfel apare evidenta dogma polimorfismului tumorilor mamare si a diseminarii precoce indiferent de stadiu.
Tratamentele standard (chirurgia radicala, chimioterapia, radiaterapia, hormonoterapia) nu au reusit pana in prezent sa duca la eradicarea completa a celulelor tumorale. Dovezile actuale evidentiaza ca biologia celulei stem ofera o noua perspectiva in biologia cancerului si explica reaparitia bolii dupa tratamentele radicale. In particular, relatia intre celula stem si celulele tumorale s-a focalizat pe trei aspecte:
primul, similaritatea intre mecanismele de reglare a reinnoirii proprii intre celulele tumorale si celulele stem normale;
al doilea, posibilitatea ca celulele tumorale sa apara dintr-o celula stem normala; si
al treilea, notiunea de tumora sa contina si "celula stem canceroasa" - celule rare care genereaza si intretin cresterea si dezvoltarea tumorala [ 89,94,289].
` Studii experimentele de transplantare a tesutului tumoral mamar au descoperit ca doar o minoritate de celule canceroase au avut abilitatea de-a forma o noua tumora si s-au putut distinge initiatorii de tumora de celulele nontumorigenice pe baza expresiei markerilor celulari de suprafata CD44 ( molecula de adeziune care leaga hialuronidaza ) si CD 24 ( molecula de adeziune care leaga P-selectina ). S-au identificat si izolat celule tumorigene cu fenotip comun CD44+ / CD24 -low care au fost capabile sa formeze tumora [5,34]. Subsetul celulelor tumorigenice definit ca celula stem canceroasa reprezinta o minoritate, dar separarea lor de populatia netumorigena va permite caracterizarea lor moleculara diferentiala pentru a elucida caile care duc la dobandirea potentialului tumorigen. De asemenea se deschide calea pentru elaborarea unor metode de diagnostic in depistarea celulelor tumorigene metastazante cu semnificatie prognostica pentru pacientele cu cancer de san tinand cont ca 30% dintre acestea au micrometastaze la momentul diagnosticului si aproximativ jumatate dintre acestea din urma vor dezvolta metastaze clinic manifeste intr-un interval minim de 5 ani [ 89 ].
In concluzie, studiile au dovedit ca celula stem somatica mamara exista si este situata intr-o locatie speciala - nisa celulei stem - aflata in sectorul suprabazal luminal, in vecinatatea imediata a stratului mioepitelial, neavand contact cu membrana bazala sau cu lumenul. Nisa celulelor stem este reprezentata de o pozitie speciala la nivelul tesutului mamar care are abilitatea de-a fi suportul functional al celulelor stem. Este definita prin prezenta unor celule de suport cu functie de semnalizare specializata si care in asociatie cu semnalele matricii extracelulare intretin functionarea optima a celulelor stem. Morfologic, este o celula mica cu citoplasma clara, nediferentiata sau putin diferentiata, exprimand markeri epiteliali luminali, mioepiteliali sau combinatii ale acestora [289].
S-a dovedit ca la nivelul nisei pot fi create celule stem din celule fiica apropiate atunci cand compartimentul celulelor stem este depletizat. Puterea inductiva a celulelor stem pare a fi importanta in cancer prin semnalizarea defectuoasa a nisei celulelor stem si inductia improprie a celulelor stem-like din celule fiica putand rezulta populatii aberante tumorale [65].
Caracteristicile comune ale celulei stem somatice si celulei stem canceroase evidentiate prin studiile prezentate sunt: abilitatea de reinnoire, capacitatea de diferentiere, viata lunga sau imortalizarea, rezistenta la agentii de distrugere, abilitatea de migrare si ancorare. Aceasta a dus la ipoteza originii celulei stem canceroase dintr-o celula stem normala [363].
Dovezile experimentale sustin ipoteza ca celula stem somatica mamara poate fi prima tinta in tumorigeneza glandei mamare si va genera populatia celulelor stem tumorale [289,385].
Un numar important de cercetari sugereaza ca celula stem reprezinta o tinta importanta pentru mutatiile inductoare ale transformarii [321]. Celula stem avand o viata lunga si o diviziune lenta este expusa foarte usor agentilor perturbatori si evenimentelor mutationale, acumularea de mutatii succesive producand transformarea ei. Mai importante s-au dovedit a fi evenimentele acumulate in timpul adolescentei tardive pentru ca in aceasta perioada glanda mamara contine un numar crescut de celule stem. Studiile retroprospective au aratat ca adolescentele expuse la radiatiile bombei atomice de la Hiroshima si Nagasaki au avut o incidenta crescuta a cancerului de san la 30 de ani dupa expunerea radioactiva [ 222].
O alta situatie in care potentialul proliferativ al glandei si celulei stem sunt utilizate maximal, este sarcina si de aici observatia ca riscul de cancer este mult diminuat in timpul sarcinii prin cresterea diferentierii terminale [363]. Sanul nulipar este mai expus cancerizarii datorita faptului ca nu a utilizat capacitatea proliferativa a celulelor stem, de asemenea si sanul care o utilizeaza tardiv ( peste 35 ani ). Celula stem, neutilizata o perioada lunga de timp, va acumula mutatii.
Avand o viata lunga si rata lenta de diviziune celula stem tumorala este rezistenta la chimioterapia traditionala si are abilitate de supravietuire chiar daca tumora primara este distrusa in totalitate. De asemenea va genera celule tranzitorii care pot relua dezvoltarea tumorii independent de chimioterapia urmata iar mecanismele de rezistenta ale celulei stem vor fi transmise celulelor progenitoare [289].
6. ANATOMOPATOLOGIA GLANDEI MAMARE
Cea mai folosita clasificare a cancerului mamar invaziv este cea a Organizatiei Mondiale a Sanatatii (OMS), care se bazeaza pe modul de crestere si pe aspectele citologice ale celulelor tumorale invazive.[324]
|
Carcinom noninvaziv |
|
Carcinom Ductal in situ |
|
Carcinom Lobular in situ |
|
Carcinom invaziv |
|
Carcinom Ductal Invaziv |
|
Carcinom Lobular Invaziv |
|
Carcinom Mucinos |
|
Carcinom Medular |
|
Carcinom Papilar |
|
Carcinom Tubular |
|
Carcinom Adenoid Cistic |
|
Carcinom Secretor (juvenile) |
|
Carcinom Apocrin |
|
Carcinom cu metaplazie (carcinoma metaplastic) |
|
Carcinom inflamator |
|
Altele |
|
Boala Paget mamelonara |
Tabel nr.5
Clasificarea OMS a carcinoamelor mamare [83]
Leziunile benigne ale sanului sunt proliferative sau nonproliferative acestea din urma nefiind asociate cu cresterea riscului de cancer mamar. Leziunile proliferative sunt divizate in 2 variante :
Hiperplazia fara atipie - asociaza o crestere a riscului de cancer de 2 ori
Hiperplazia cu atipie - asociaza o crestere a riscului de cancer mamar de 4 pana la 5 ori. Daca la aceasta se adauga si istoricul familial la rude de gradul I, riscul creste de 11ori prin asocierea factorilor.[80]
6.1. Leziunile premaligne ale sAnului
Carcinomul in situ este definit prin prezenta celulelor epiteliale maligne ce prolifereaza si umple ductele si acinii lobulari dar raman limitate fara a invada membrana bazala.
Carcinomul in situ este subdivizat in 2 forme:
o carcinomul in situ intraductal (DCIS)
o carcinomul in situ lobular (LCIS)
definite astfel in raport cu spatiul anatomic in care se dezvolta fiecare.
DCIS este cea mai comuna modificare detectata prin examenul de screening mamografic in absenta modificarilor la examenul clinic. Caracteristica mamografica este prezenta microcalcificarilor.
LCIS prezinta foarte rar manifestari mamografice si este detectat in mod accidental prin biopsie realizata pentru alte afectiuni. LCIS este considerat un marker pentru cresterea riscului de dezvoltare a cancerului mamar invaziv, pe cand DCIS este considerat un cancer non-invaziv.[9,399,402,410]
6. CARCINOAME INVAZIVE
1.Carcinomul ductal infiltrativ.
-reprezinta cea mai larga categorie de cancere de san invazive, procentual incidenta variind intre 65% pana la 80% din totalul cancerelor mamare. Se prezinta adesea sub forma unei mase palpabile sau a unei anomalii mamografice. Rar, boala se poate asocia cu boala Paget mamelonara.
Aspect macroscopic:
Clasic, sub forma de carcinom schiros, o masa ferma, dura, de culoare alb‑gri pe sectiune. Majoritatea tumorilor au un contur neregulat, stelat, dar exista si leziuni cu margini rotunde, uneori bine circumscrise.
Aspect
microscopic: 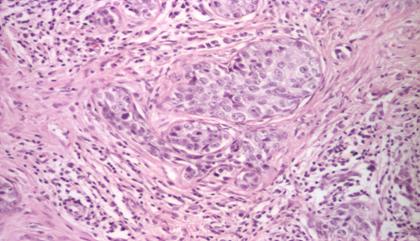
Fig.8
.Carcinom ductal invazivcoloratie HE10X[CAZ6]
Aspect heterogen. Celulele tumorale pot fi dispuse sub forma de placarde, cuiburi, cordoane, glande sau izolati intr-o stroma fibrosa. Stroma abundenta determina duritatea leziunii. Citologic, celulele tumorale difera putin de celulele mamare normale, pana la diferente foarte mari (pleomorfism si atipii nucleare). Activitatea mitotica poate fi si ea imperceptibila sau foarte crescuta. Si displazia glandei poate varia, in unele cazuri celulele tumorale constituie doar o componenta minora a tumorii. Marginile pot fi infiltrative, compresive, circumscrise sau mixte. Cea mai folosita metoda pentru a subclasifica carcinoamele ductale se bazeaza pe aspectele nucleare sau pe o combinatie intre caracteristicile nucleare si cele arhitecturale, astfel nucleul celulelor tumorale este comparat cu nucleul celulelor epiteliale normale ale sanului. Nucleii pot fi bine diferentiati, mediu diferentiati si slab diferentiati.[369]
In clasificarea histlogica se tine cont de: formare tubulara, polimorfismul nuclear si activitatea mitotica.
‑ gradarea histologica (Elston & Ellis):
Bine diferentiat: 3‑5 puncte
Moderat diferentiat: 6‑7 puncte
Slab diferentiat: 8‑9 puncte
componentele gradarii:
‑ tubii ‑ peste 75% din tumora compusa din tubi: 1 punct
‑ 10‑75% din tumora compusa din tubi: 2 puncte
‑ sub 10% din tumora compusa din tubi: 3 puncte
‑ nucleii: ‑ mici si uniformi: 1 punct.
‑ variatii moderate de forma si marime: 2 puncte.
‑ polimorfism marcat: 3 puncte.
rata mitotica: dependenta de aria microscopica examinata: 1‑3 puncte.
Tumorile pentru care suma componentelor gradarii este:
3‑5 = gradul I (bine diferentiate)
6‑7 = gradul II (moderat diferentiate)
8‑9 = gradul III (slab diferentiate)
Carcinomul lobular invaziv (infiltrativ)
‑ reprezinta 5‑10 % din totalul carcinoamelor invazive. Se dezvolta frecvent bilateral comparativ cu celelalte carcinoame mamare invazive, iar in majoritatea cazurilor, carcinomul lobular in situ coexista cu carcinomul lobular invaziv.
Apect macroscopic:
Tumora de consistenta ferma, nisipoasa, culoare gri‑alb. In unele cazuri, tumora nu se evidentiaza macroscopic si tesutul mamar poate avea doar o consistenta de guma.
Aspect microscopic:
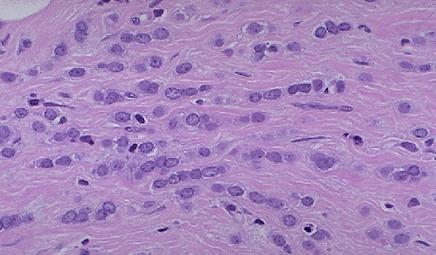
Fig. 9.
Carcinomul lobular invaziv.coloratie HE20X[16]
In forma clasica este caracterizat printr-o proliferare de celule tumorale lipsite de coezivitate asezate intr‑un asa‑zis "sir indian"sau adesea sunt aranjate concentric in jurul structurilor ductale normale-aspect "targetoid" invadand stroma. Ulterior pot invada si tesutul adipos intr‑o maniera insidioasa, nedeterminand reactie stromala displazica. Celulele sunt mici, au citoplasma redusa, nucleii sunt polimorfi si hipercromi, si de obicei excentrici, fara nucleoli evidenti, cu putine figuri mitotice. Pot exista vacuole intracitoplasmatice de sialomucina cand cantitatea este considerabila iau aspectul de "inel cu pecete". Absenta coeziunii intercelulare este efectul unor mutatii genetice in urma carora celulele isi pierd moleculele de adeziune E‑cadherine. Acest aspect diferentiaza carcinomul lobular de cel ductal. In variantele solida, alveolara si tubulolobulara, [369]celulele care compun leziunea au caracteristicile formei clasice, diferind doar prin modul de crestere al tumorii.
In forma solida, celulele cresc in paturi confluente, fara participarea stromei. In forma alveolara, celulele sunt organizate in grupuri de cate aproximativ 20 de celule fiecare, care cresc. Aceste agregate celulare sunt separate de o stroma fina, fibrovasculara. In varianta tubulolobulara, celulele tumorale invadeaza in plaje lineare, caracteristice formei clasice, in timp ce altele formeaza tubi mici cu contururi rotunde sau ovoide. Acestia sunt mai mici si mai putin angulati decat cei din carcinomul tubular. In varianta polimorfa, celulele tumorale sunt mai mari si dezvolta mai multe variatii nucleare decat cele din forma clasica.
Caracteristicile particulare ale carcinoamelor ductale :
datorita limitelor imprecise lumpectomia cu margini de siguranta este imposibil de realizat
invazia ganglionara poate fi confirmata prin imunohistochimie mai precis decat prin examenul histologic clasic
este asociat mai frecvent cu riscul de cancer mamar bilateral
paternul de metastazare mai frecvent cel osos, iar ca situsuri particulare diseminarea peritoneala si cea meningeala
3.Carcinomul invaziv cu componenta ductala si lobulara
‑ reprezinta doar o mica proportie (4 %) din cancerele de san invazive si sumeaza caracterele celor doua forme distincte.
4.Carcinomul medular
‑ reprezinta mai putin 5‑7 % din totalul cancerelor mamare. Are un prognostic bun, in ciuda agresivitatii histologice aparente prin prezenta unui infiltrat inflamator abundent.
Aspect macroscopic:
Leziunea este bine delimitata, de consistenta moale, culoare maro‑gri pe sectiune. Pot fi prezente arii hemoragice, necrotice sau chistice. Necroza importanta apare de obicei in tumorile de dimensiuni mari.
Aspect microscopic:
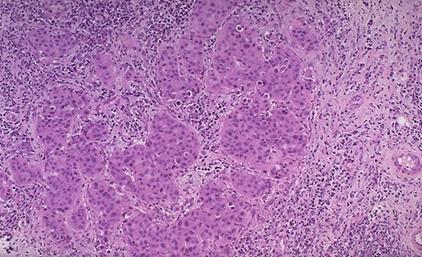
Fig.10
Carcinomul medular coloratie HE 4X[16]
Cresterea celulara se realizeaza in sincitiu, atingand mai mult de 75 % din tumora. Particularitatea histologica este prezenta unui infiltrat limfoplasmocitar abundent, iar absenta diferentierii glandulare si gradul nuclear 2 si 3 sunt caracteristice carcinomului medular atipic.
Poate fi asociat cu un carcinom ductal in situ, cu hemoragii, necroza tumorala, metaplazii celulare (scuamoase). Receptorii pentru estrogeni si progesteron sunt in cantitate mai scazuta, iar expresia variata de markeri tumorali (HER-2new, p53) ii confera agresivitatea[137]
5.Carcinomul mucinos (coloid)
‑ are incidenta de pana la 5% cu tendinta de aparitie la varste tinere. Are un prognostic relativ favorabil si o rata redusa de diseminare ganglionara .
Aspect macroscopic:
Tumorile au aproximativ 3 cm in dimensiuni, sunt bine circumscrise, de constistenta moale, gelatinoasa, cu o suprafata de sectiune tot de aspect gelatinos. Leziunile cu o cantitate mai crescuta de fibre in stroma au o consistenta mai ferma.
Aspect microscopic:
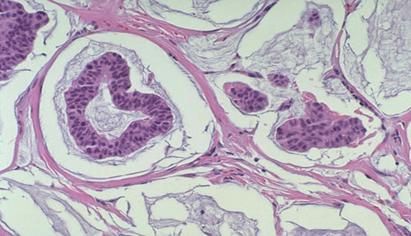
Fig.11
Carcinomul mucinos coloratie HE10X[25]
Se constata prezenta unui material gelatinos abundent, in care plutesc liber celule mici tumorale. Insulele extracelulare de mucina reprezinta 90% din tumora. Gradul de diferentiere nucleara este moderat sau slab, iar in citoplasma se gasesc granule argirofile. Expresia markerilor tumorali nu asociaza tabloul unei agresivitati crescute si ii confera acestui tip de carcinom mamar un prognostic favorabil. [254]
6.Carcinomul tubular
‑ este asociat cu un potential metastatic limitat si cu un prognostic foarte bun, reprezentand 1‑4 % din totalul cancerelor de san,incidenta lui a crescut in era depistarilor mamografice.
Aspect macroscopic:
Sunt carcinoame mici, cu diametrul de 1 cm, ferme, care nu se diferentiaza macroscopic de carcinomul ductal infiltrativ.
Aspect microscopic:
Este cea mai diferentiata dintre formele de carcinom invaziv. Se caracterizeaza printr-o proliferare glandulara dintr‑un singur strat de celule, fara componenta mioepiteliala. Glandele sunt ovoide, cu contur angulat, cu cozi subtiri, celulele prezinta diferentieri nucleare slabe, iar in citoplasma apicala apar zone alungite Stroma este displazica, uneori cu fibre elastice abundente. Tubii (glandele) trebuie sa predomine in proportie de 75‑100 %. Majoritatea carcinoamelor tubulare au asociat si un carcinom ductal in situ (DCIS), cu diferentiere nucleara scazuta, si care nu cuprinde o parte importanta din tumora. Frecventa multifocalitatii si a multicentricitatii este greu de determinat. Se poate face un diagnostic diferential, in acest caz, cu o adenozita scleroasa, cicatrici radiare, leziuni scleroase complexe, o adenita microglandulara.
7.Carcinomul invaziv cribriform
‑ este un tip de carcinom bine diferentiat, cu trasaturi morfologice asemanatoare cu carcinomul tubular si are un prognostic bun.
Aspect macroscopic:
Nu prezinta particularitati macroscopice.
Aspect microscopic:
Invazia stromei are loc intr‑o maniera "fenestrata", dar si sub forma de alte aspecte (de exemplu de carcinom tubular). Celulele tumorale cresc in cuiburi "fenestrate", asemanator cu DCIS forma cribriforma, diferentierea nucleara este slaba sau moderata. Cele mai invazive carcinoame medulare sunt asociate cu DCIS forma cribriforma. Tumorile au o histologie mixta si variaza ca diametru intre 3,1 si 4,2 cm. Atat receptorii pentru estrogeni, cat si cei pentru progesteron in forma cribriforma sunt prezenti in mod frecvent.[137]
8.Carcinomul invaziv papilar
‑ reprezinta 1‑2 % din carcinoamele mamare invazive si apare mai frecvent la pacientele de culoare
Aspect macroscopic:
In doua treimi din cazuri tumora este delimitata macroscopic.
Aspect microscopic:
Poate avea caracter intraductal-noninvaziv sau invaziv. Celulele tumorale se organizeaza in jurul cordoanelor fibro‑vasculare, au citoplasma amfofila, dar pot aparea si aspecte apocrine. Nucleii sunt intermediar diferentiati, iar din punct de vedere histologic, majoritatea tumorilor au gradul Stroma tumorala nu este abundenta, pot aparea calcificari, mai ales cand se asociaza cu DCIS (prezent in peste 75 % din cazuri, cu componenta papilara). In o treime din cazuri exista invazie limfatica. Receptorii estrogenici si progesteronici sunt prezenti in proportie ridicata , p53 si HER‑2/neu nu sint supraexprimate in mod curent.[254]
9.Carcinomul invaziv micropapilar
‑ reprezinta aproximativ 2,7% din carcinoamele mamare, apare de obicei in jurul varstei de 54‑62 de ani si este o entitate mai recent descrisa asemanator cu carcinomul papilar ovarian, care se caracterizeaza prin structuri micropapilare care cresc in spatii goale
Aspect macroscopic:
Nu are particularitati macroscopice , iar diametrul variaza intre 0,8‑3 cm.
Aspect microscopic:
Se evidentiaza cuiburi de celule intr‑un aranjament micropapilar sau tubulo‑alveolar, suspendate intr‑un lichid clar, mucinos sau apos. Separarea cuiburilor se face prin tesut fibro‑vascular. Gradul de diferentiere nucleara poate fi slab sau intermediar.[137]
6.3.. FORME RARE
1.Carcinomul metaplazic
‑ reprezinta 1% din carcinoamele mamare si consta intr‑o transformare celulara in celule neepiteliale sau in celule mezenchimale.
Asociat frecvent cu o crestere rapida in timp scurt cu fixarea la piele si la tesuturile profunde. Mamografic, leziunile sunt slab delimitate, aparent benigne. Metastazarea este similara cu cea din celelalte tipuri de cancer de san. Prognsticul nu difera semnificativ de cel al celorlaltor tipuri de cancer mamar, de un prognostic mai bun beneficiind carcinomul adenoscuamos cu grad slab de diferentiere nucleara.
Aspect macroscopic:
Tumorile pot fi atat bine delimitate, cat si cu margini neregulate. In general, dimensiunile tumorale sunt crescute, intre 1,2 si 10 cm.
Aspect microscopic;
Se evidentiaza prezenta de celule scuamoase sau de celule din alte tesuturi: cartilaginos, osos, muscular, adipos, chiar melanocite.
Carcinoamele pot fi:
‑ scuamoase: bine sau slab diferentiate
‑ cu celule fusiforme
‑ carcinosarcoame
‑ producatoare de matrice extracelulara
‑ cu celule gigante, asemanatoare osteoclastelor
Un subtip mai aparte este carcinomul adenoscuamos (slab diferentiat), mai mic ca dimensiuni (0,5‑8,6 cm).2 Pe suprafata de sectiune el are culoare galbena, consistenta ferma si margini neregulate. Tumora este bine diferentiata, contine o stroma colagenizata, lamelata. Exista locuri de diferentiere glandulara si scuamoasa. Nucleii sunt slab diferentiati. Glandele au lumene alungite, comprimate. Poate fi prezenta si keratina, dezvoltand o imunoreactivitate pentru aceasta proteina. Agresivitatea, insa, este mai mult locala, iar prognosticul bun. Receptorii pentru estrogeni si progesteron sunt absenti, iar in 61 % din cazuri apare secretie de p53. Componenta mezenchimala a acestor leziuni deriva din mutatii de la nivelul componentei epiteliale.
Carcinomul invaziv cu diferentiere neuroendocrina
Evolutia clinica este asemanatoare cu cea din celelalte carcinoame invazive de san. Carcinomul neuroendocrin cu celule mici este un tip tumoral rar, cu un grad crescut de malignitate, identic din punct de vedere citologic cu malignitati similare, cu alte localizari. Are o localizare predominant subareolara.
Aspect macroscopic:
Nu are un aspect macroscopic caracteristic, poate fi intalnit mai frecvent in zona subareolara
Aspect microscopic:
Se evidentiaza prezenta unor celule argirofile, avand granule argirofile citoplasmatice, cu imunoreactivitate pentru unul sau mai multi markeri specifici neuroendocrini. Receptorii estrogenici si progesteronici sunt prezenti in 75‑95% din cazuri.
3.Carcinomul chistic adenoid
‑ este un tip de carcinom mamar identic histologic cu cel al glandelor salivare explicabil prin originea embriologica comuna.[NW] Apare in proportie de 0,1% din totalul carcinoamelor mamare si beneficiaza de un prognostic excelent, apare in jurul varstei de 60‑70 de ani, sub forma unei mase palpabile, de obicei localizata in regiunea submamelonara sau centrala. Mamografic, se deceleaza mase lobulate bine definite. Pot de asemenea aparea microcalcificari. Are un prognostic foarte bun, insa s‑au descris recurente dupa excizie caracteristica si altor localizari.
Aspect macroscopic:
Tumora are o marime de aproximativ 2 cm in diametru, este bine delimitata, de consistenta nodulara.
Aspect microscopic:
Este un aspect asemanator cu cel din carcinoamele adenoide chistice ale glandelor salivare, avand celule epiteliale cu grade diferite de diferentiere glandulara, scuamoasa, sebacee si acumulari caracteristice de material din membrana bazala. Invazia vaselor limfatice se produce rar. Nu prezinta receptori pentru estrogen si progesteron.
4.Carcinomul invaziv apocrin
‑ a atras de curand atentia patologilor datorita similaritatilor dintre o preoteina caracteristica epiteliului apocrin si o proteina indusa sub actiunea prolactinei. Poate aparea in 21 % din cazuri si interesarea pielii. Mamografia evidentiaza o masa tumorala cu margini neregulate. Evolutia clinica si prognosticul sunt similare cu cele din celelalte carcinoame invazive.
Aspect macroscopic:
Este similar cu aspectul din carcinoamele invazive nediferentiate.
Aspect microscopic:
Se observa o citoplasma abundenta, eozinofila, uneori cu granulatii intracitoplasmatice, nucleii prezinta nucleoli. De obicei, aceasta forma de carcinom mamar asociaza si un DCIS.
5.Carcinomul secretor (juvenil ‑ este singurul tip bine documentat de carcinom mamar care poate aparea atat la copii, cat si la adulti, de ambele sexe, si apare intr‑o proportie mai mica de 0,01%. Poate aparea si la barbati (ginecomastie), si se prezinta sub forma unei mase palpabile, fara o localizare predilecta. Aspectul echografic releva leziuni uneori hipoecogene, cu con de umbra posterior, asemanatoare cu cele din fibroadenom. Este un tip de carcinom mamar cu o evolutie lenta, de obicei detectat in stadiul I; s‑au semnalat recurente dupa tratament, atat locale, cat si cu localizare la peretele toracic.
Aspect macroscopic:
Tumora este bine delimitata, dimensiunea medie fiind in jur de 3 cm.
Aspect microscopic:
Are loc proliferarea unor celule cu grad scazut de diferentiere celulara, care formeaza structuri glandulare si de asemenea se mai remarca existenta unor spatii microchistice umplute cu o secretie vacuolata, slab eozinofila de alfa-lactalbumina. De obicei se asociaza si un DCIS. In o treime din cazuri receptorii estrogenici sunt prezenti, iar cei progesteronici in trei patrimi din cazuri.
6 Chistosarcomul filod -tumora filoda maligna mamara
Este o tumora mixta mamara caracterizata de pierderea relatiei dintre ductele dilatate si stroma hipercelulara. Ductele sunt hipertrofiate si mult dilatate chistic cu celule stratificate fara semne de atipie. Componenta neoplazica este cea stromala formata din celule tumorale cu atipie marcata, mitoze atipice si celule cu aspect bizar-gigante multinucleate.[367]
7.Carcinom invaziv cu celule gigante osteoclast‑like (celule gigantice, care seamana din punct de vedere morfologic cu osteoclastele si au aspecte fenotipice ale histiocitelor la analiza imunohistochimica si ultrastructurala).
8.Carcinom invaziv cu aspecte coriocarcinomatoase: produce gonadotropina corionica umana.
9.Carcinomul bogat in glicogen este asociat de obicei unui DCIS.
10.Metastazele provenind din alte cancere, localizate la nivelul sanului - sunt multiple, bilaterale, si au margini bine delimitate. Pot proveni dintr‑un melanom malign, carcinom pulmonar, carcinom prostatic, carcinom ovarian, carcinom gastric, renal sau tiroidian.
1Limfoamele sanului si.Sarcoamele sanului sunt forme rar intilnite in care se regasesc caracteristicile si prognosticul general al limfoamelor si sarcoamelor.
Copyright © 2025 - Toate drepturile rezervate