 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Temperatura absoluta
Experienta de zi cu zi ne permite sa generalizam o serie de observatii, sub denumirea de principiul ZERO al termodinamicii, sau principiul tranzitivitatii echilibrului termic: daca sistemele A si B sunt in echilibru termic intre ele, iar daca sistemul B este in echilibru termodinamic cu sistemul C, atunci schimbul de energie termica de la sine intre A si C nu se produce.
Schimbul de energie termica intre doua sisteme fizice implica transferul de energie de la atomii unui corp catre atomii altuia. Dar acest schimb microscopic de energie intre perechi de atomi apartinand celor doua corpuri poate avea loc, la un moment dat, atat de la un corp la al doilea (pentru o pereche de atomi) cat si in sens opus (pentru o alta pereche de atomi).
Notam faptul ca, la suprafata de contact dintre doua corpuri exista un numar imens de perechi de atomi care, la un moment dat fac schimb de energie termica.
Daca energia transferata intr-un sens este egala cu cea transferata in sens opus, pe ansamblu energia termica transferata este ZERO.
Daca energia transferata intr-un sens este mai mare decat cea transferata in sens opus, pe ansamblu energia termica transferata va fi NENULA si vom spune ca sistemele fac schimb de energie.
Acest transfer se efectueaza prin transmiterea de energie cinetica de la atomii unui corp la atomii celuilalt. Numarul extrem de mare de perechi de atomi implicati in aceste procese microscopice impun ca metodele de studiu ale fenomenelor de acest tip sa fie metode cu caracter statistic.
In cadrul prezentului material, vom presupune ca toate moleculele au aceeasi viteza, ipoteza care va simplifica mult rationamentele si (mai ales) calculele ce le vom efectua.
Pentru a caracteriza starea de incalzire a unui corp, vom introduce un parametru de stare numit temperatura absoluta notat T , definit ca o masura a gradului de agitatie moleculara, deci proportional cu energia cinetica MEDIE a moleculelor :
ε ~ T , in care am notat energia cinetica medie a unei molecule:
![]() , in care am notat cu m0 masa UNEI molecule.
, in care am notat cu m0 masa UNEI molecule.
O exprimare matematica poate fi urmatoarea:
![]() , sau:
, sau:
![]() , in care marimea:
, in care marimea:
k = 1,38 · 10-23 J/K se numeste constanta lui Boltzmann.
Sa o definim.
Din relatia (5.3) deducem:
![]() , care poate fi
considerata ca relatie de definitie. Prima consecinta
este aceea ca unitatea de masura este:
, care poate fi
considerata ca relatie de definitie. Prima consecinta
este aceea ca unitatea de masura este:
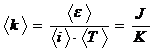 , deoarece numarul
gradelor de libertate este adimensional.
, deoarece numarul
gradelor de libertate este adimensional.
Pentru a defini in cuvinte marimea k, vom utiliza, ca de obicei, metoda reducerii la unitate. Vom impune, in relatia (5.6) conditiile:
Daca
i = 1 si T = 1K, deducem:
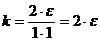 .
.
In cuvinte, relatia (5.9) impreuna cu conditiile (5.8) se exprima dupa cum urmeaza: constanta Boltzmann este o marime fizica scalara, numeric egala cu DUBLUL energiei cinetice medii a unei molecule, pe fiecare grad de libertate. Sau, deoarece din (5.9) rezulta:
![]() : la temperatura T = 1 K, pe fiecare grad de
libertate se distribuie o energie egala cu DUBLUL constantei lui Boltzmann
: la temperatura T = 1 K, pe fiecare grad de
libertate se distribuie o energie egala cu DUBLUL constantei lui Boltzmann
Aceasta din urma afirmatie reprezinta una din formularile a ceea ce in literatura de specialitate se cunoaste sub numele de TEOREMA ECHIPARTITIEI ENERGIEI PE GRADE DE LIBERTATE. Notam ca nu am demonstrat aceasta teorema.
Obs Amplificand ambii membri ai relatiei (5.4) cu dublul numarului lui Avogadro (NA), obtinem succesiv:
![]() , in care notam:
, in care notam:
![]() , masa unui kilomol si:
, masa unui kilomol si:
![]() .
.
Aceasta din urma marime este cunoscuta ca si constanta generala a gazelor, a carei valoare este:
![]() .
.
Din relatia (5.4) rezulta ca temperatura (ca si presiunea) este un parametru de stare care are un caracter statistic, deoarece temperatura absoluta este proportionala cu media energiilor unui numar foarte mare de molecule, ceea ce inseamna ca notiunea de temperatura nu are sens pentru un numar mic de molecule.
De asemenea, temperatura absoluta este o masura a intensitatii miscarii de agitatie a moleculelor. Pentru temperatura de 00 K (zero absolut) miscarea moleculelor AR inceta (conditionalul !!!).
Se arata, pe de o parte, ca in natura nu poate fi atinsa niciodata temperatura de zero absolut, iar, pe de alta parte, la temperaturi joase, miscarea moleculelor nu mai este descrisa de legile mecanicii clasice.
Copyright © 2025 - Toate drepturile rezervate