 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Stariile de agregare ale materiei
Materia poate exista in natura in 3 stari de agregare: solida, lichida si gazoasa. O stare de agregare este o forma de organizare a materiei caracterizata prin uniformitate in consistenta si rezistenta, proprietati care o diferentiaza de celelalte stari in care substanta respectiva se poate gasi. O substanta in stare solida are o forma bine definita si este rigida, una in stare lichida nu are o forma stabila, dar are volum fix, iar in cazul starii gazoase nu putem vorbi nici de forma, nici de volum fixe, substanta aflata in aceasta stare de agregare luand forma si dimensiunile containerului in care se gaseste.
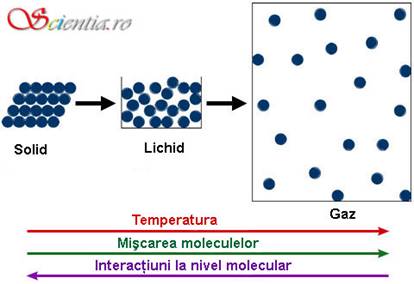
Diagrama de mai sus prezinta diferentele de proprietati fizice si aranjament al particulelor intre substantele aflate in cele trei stari de agregare. Intr-un solid, particulele sunt dispuse aglomerat intr-o configuratie rigida, ceea ce confera substantei forma si dimensiuni fixe. Intr-un lichid, particulele sunt dispuse aproape unele de altele, dar au libertate de miscare, ceea ce se traduce prin volum fix si forma specifica fluidelor, deci forma containerului in care sunt asezate. In cazul gazelor particulele pot ocupa intregul volum al containerului, astfel ca atat forma, cat si volumul lor sunt definite de container.
Una dintre diferentele majore dintre cele trei stari de agregare, ilustrata in figura de mai sus, este data de numarul de interactiuni intre moleculele din compozitia substantei. Particulele unui solid interactioneaza cu toate particulele vecine, intr-un lichid doar cu unii dintre vecini, iar intr-un gaz, cel putin in mod ideal, nu exista interactiuni intre particule. Prin ruperea sau formarea legaturilor intermoleculare, o substanta poate trece dintr-o stare de agregare in alta. De exemplu, moleculele din compozitia unui gaz condenseaza dand nastere unui lichid datorita prezentei fortelor de atractie intermoleculare. Cu cat fortele de atractie devin mai puternice, cu atat mai stabil este lichidul (fapt care se traduce in cresterea punctului de fierbere). Transformarile intre diversele stari de agregare ale unei substante sunt ilustrate in figura de mai jos.
Diagrama de mai jos arata numele transformarilor de stare intre lichide, solide si gaze. Sageata din dreapta indica faptul ca cele trei stari de agregare sunt caracterizate prin valori diferite ale entalpiei sistemului. Entalpia da masura potentialului termodinamic al unui sistem si este calculata insumand energia interna a sistemului (o suma a tuturor formelor microscopice de energie a unui sistem fizic sau chimic, oricare ar fi aceasta - mecanica, electrica, magnetica etc.) cu lucrul mecanic de dezlocuire a volumului substantei efectuat la o presiune egala cu presiunea la care se gaseste respectiva substanta. Gazele au cea mai mare entalpie, urmate de lichide si de solide. De aici rezulta ca fiecare transformare a starii de agregare este insotita si de o modificare a entalpiei substantei care sufera trecerea dintr-o stare in alta.
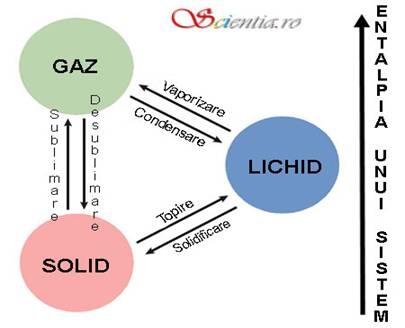
Transformarile de stare sunt un tip special de reactii chimice. Reactiile chimice, conform celor invatate in liceu la orele de chimie, presupuneau de obicei ruperea unor legaturi in interiorul moleculelor, pe cand in cazul transformarilor de faza avem de-a face cu ruperea sau formarea de legaturi intermoleculare (interactii intre moleculele aceleiasi substante). Ca in cazul oricarei reactii chimice trebuie studiat ce presupune transformarea de stare din punct de vedere energetic, ce cantitate de energie este absorbita sau cedata pe parcursul ruperii, respectiv formarii legaturilor intermoleculare.
Trecerile dintr-o stare de agregare in alta care presupun ruperea unor legaturi intre molecule (topirea, vaporizarea si sublimarea) necesita un input energetic pentru invingerea atractiilor intermoleculare intre particulele substantelor (reactii endotermice). Celelalte transformari (condensarea, solidificarea si desublimarea) sunt insotite de eliberarea de energie pentru ca particulele adopta o configuratie cu o entalpie inferioara (reactii exotermice).
Desi cea mai rar intalnita pe Terra, plasma, considerata de multe ori a patra stare de agregare a materie, este cel mai des intalnita la scara Universului, fiind starea in care se gaseste materia care intra in compozitia stelelor. Este de fapt un gaz ionizat, din care cauza nu toate textele o consacra ca fiind o stare separata de agregare a materiei.
Copyright © 2026 - Toate drepturile rezervate