 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
STRUCTURA MATERIALELOR
Proprietatile materialelor utilizate in industria electronica si in IT sunt determinate de structura si compozitia lor interna. Substantele sunt alcatuite din atomi. Acestia contin un nucleu format din protoni si neutroni si dintr-un invelis electronic. Electronii au energii discrete in interiorul atomului si sunt plasati pe orbite discrete. Nivelul energetic pe care se poate afla un electron este determinat de 4 numere cuantice:
numar cunatic principal, n =1, 2, 3, . corespunzator paturilor electronice
numarul cuantic orbital, l, care caracterizeaza momentul cinetic al electronului aflat in miscare de rotatie pe orbita, el poate lua valorile l=0,1,2, si n-1 sau literele s,p,d,f .
numarul
cuantic magnetic ml = 0,![]() 1,
1,![]() 2,
2,![]() 3, ,
3, ,![]() l care indica
orientarea in spatiu a momentului magnetic
l care indica
orientarea in spatiu a momentului magnetic
numarul
cunatic de spin cu
doua valori posibile ![]() 1/2, corespunzator sensului de relatie proprie a
electronului.
1/2, corespunzator sensului de relatie proprie a
electronului.
Pe baza structurii atomice a fost alcatuit tabloul periodic al elementelor in care acestea sunt plasate in perioade, in ordine crescatoare a masei atomice.
Valenta unei substante este o proprietate importanta determinata de numarul de electroni care se gasesc pe nivelele periferice s si p. Ea caracterizeaza capacitatea unui atom de a intra in combinatie cu alte elemente (atomi), in scopul formarii unei combinatii stabile de electroni pe aceste ultime straturi (2 electroni pentru prima perioada care cuprinde He in grupa a-8-a si 8 electroni pentru celelalte perioade).
Valenta elementelor chimice poate avea valori diferite si in functie de conditiile de desfasurare a reactiei chimice. De exemplu, fosforul are valenta 5 cand se combina cu oxigenul sau 3 cand se combina cu hidrogenul.
Stabilitatea atomica. Daca un atom are valenta nula, nu exista electroni care sa intre in reactie si acesta este "inert" sau stabil. Astfel sunt gazele inerte He, Ne, Pr, Kr, Xe, toate din grupa a-8-a.
In general atomii au tendinta:
fie de a-si ocupa ultimele nivele, s si p, pentru ca acestea sa fie complete;
fie de a-si pierde acesti electroni pentru ca nivelele sa fie goale.
Elementele cele mai reactive (agresive) sunt cele din grupa I: Na, K, Cs care pot ceda foarte usor un electron, precum si cele din grupa a-7-a (Cl, F, Br) care pot capta usor un electron pentru a-si completa ultimul invelis electronic.
Pentru aceste substante sunt specifice legaturile ionice.
Pentru elementele din centrul tabelului (grupele III, IV si V) sunt specifice legaturile covalente.
1.1 Starile structurale ale substantei
In natura substantele se gasesc in 3 stari de agregare.
Starea gazoasa este starea in care atomii (grupati eventual in molecule) se afla la distante mari, nu manifesta forte de atracte (coeziune) intre ei, ocupa tot spatiul disponibil si au densitate mica. Atomii se afla intr-o permanenta agitatie termica si exercita presiune asupra peretilor incintei in care se afla. Un caz particular al starii gazoase este plasma formata din ionizarea gazelor, fie ca urmare a incalzirii la temperaturi foarte mari, fie prin ionizare in urma bombardarii cu radiatii nucleare. Plasma are proprietati conductive electrice si se comporta diamagnetic.
Starea lichida este starea in care fortele intermoleculare sunt suficient de puternice pentru a mentine ineractia dintre atomi (volumul substantei), dar insuficiente de a pastra si forma proprie.
Starea solida este starea in care interactiile dintre atomi sau molecule sunt foarte puternice, atomii avand pozitii fixe, iar substata este rigida. Starile de agregare se formeaza si se metin in anumite conditii de temperatura si presiune si se pot schimba la schimbarea acestor conditii.
Structura materialelor solide
Corpurile solide pot fi rigide, elastice sau plastice in functie de fortele de legatura dintre atomi. Aceste forte determina o anumita ordine in asezarea atomilor (sau moleculelor) in corpul solid.
Starea cristalina reprezinta o asezare periodica in spatiu a atomilor, fie ca sunt identici (de exemplu la Fe), fie ca sunt diferiti (ca la NaCl). Corpurile cu structura cristalina pot fi :
monocristaline - asezare perfect ordonata a atomilor in tot volumul materialului
policristaline - in care exista mai multe structuri cristaline diferite separate prin zone, de obicei, necristaline. Corpurile policristaline au, in general, o comportare izotropa.
Starea necristalina prezinta o dispunere neordonata a atomilor si are proprietati fizice caracteristice, de exemplu:
trecerea de la starea solida la cea lichida se face treptat, prin inmuiere (nu au punct precis de topire);
volumul unei substante necristaline este mai mare datorita dezordinii interioare.
Cand dezordinea este totala, vorbim de starea amorfa . In aceasta stare substantele sunt izotrope. Starea de izotropie caracterizeaza materialele din punct de vedere al omogernitatii lor. Un material este izotrop daca proprietatile sale fizice si caracteristicile de material nu depind de directia in care sunt evaluate in masa de material.
Starea mezomorfa (cristal lichid) este o stare intermediara intre starea solida si starea lichida pe care o prezinta unele substante organice, cand se gasesc intr-o anumita plaja termica. Moleculele acestor substante au o forma alungita si ele pot fi:
aliniate paralel in intreaga masa - cristale lichide nematice;
aliniate in straturi (cristale lichide colesterice sau smectice).
Structura acestor materiale este puternic influentata de parametrii externi (temperatura, presiune, camp electric) si prezinta aplicatii utile tehnologia informatiei.
Starea monocristalina se datoreaza legaturilor din atomi sub actiunea unor forte de natura electrica sau magnetica, de atragere sau de respingere. Aceste legaturi pot fi:
legaturi tari: ionice, covalente, metalice;
legaturi slabe: moleculare, de hidrogen, Van der Waals.
O legatura ionica tipica este la clorura de sodiu (NaCl). In reteaua cristalina a NaCl, atomii de Cl alterneaza cu cei de Na. Deoarece Na are valenta +1, cedeaza un electron si devine ion Na +, iar clorul are valenta -1 si accepta un electron, devenind Cl -. Astfel intre cei doi ioni apar forte de atractie electrostatica.
O legatura covalenta tipica este la siliciu (Si) sau carbon (C) care au cate 4 electroni pe ultimul strat. Cate 2 atomi vecini isi pun in comun cei 4 electroni formand un octet, care graviteaza in jurul celor 2 atomi pe care ii tine legati.
Legatura metalica apare exclusiv in metale unde elecronii de valenta sunt liberi, apartin intregului cristal si au rol de "ciment" comun de coeziune. Existenta electronilor liberi explica conductivitatea electrica ridicata a metalelor. Pe de alta parte, existenta atomilor ionizati pozitiv intre care apar forte de respingere electrostatica, explica proprietatile de plasticitate, maleablitate si ductubilitate ale metalelor. Metalele sunt opace, deoarece electronii liberi pot absorbi usor radiatia electromagnetica ( inclusiv optica).
Vibratia atomilor. Fononi
Atomii dintr-o retea a unui corp solid, desi au pozitii determinate, nu sunt stationari. Ei executa miscari de oscilatie simple in jurul pozitiei de echilibru, antrenand in miscarea lor si atomii vecini. Miscarea fiecarui atom nu este aleatoare. Chiar daca a fost initiata de un singur atom, ea se propaga in tot volumul sub forma unor oscilatii, dupa modelul unui resort elastic. Vibratiile cristaline pot fi transversale sau longitudinale. Cuantele de vibratie mecanica se numesc fononi si reprezinta un model util pentru descrierea proprietatilor unui solid. Un fonon se poate descrie prin mai multi parametrii:
lungimea de unda, l unde l>a, a fiind distanta interatomica (constanta de structura);
momentul
mecanic asociat oscilatiei p=![]() , unde h este constanta lui Plank;
, unde h este constanta lui Plank;
numarul de unda p=![]() (cu valoarea maxima
(cu valoarea maxima ![]() ).
).
Un cristal cu fononi va avea mai multa energie interna (cinetica si potentiala) decat in cazul in care nu exista fononi. Energia unui fonon este de ordinul fractiuni de eV. Electron-voltul (eV) este o unitate de masura a energiei, egala numeric cu energia necesara deplasarii unei sarcini electrice de un electron (1,6 10 -19C) intre doua puncte din spatiu intre care se afla o diferenta de potentia electric de 1volt. Este o unitate de masura uzuala pentru energiile implicate in procese fizice si chimice interatomice.
Teoria fononilor explica unele fenomene intalnite in corpul solid, cum ar fi absorbtia si generarea radiatiei electromagnetice, inclusiv a luminii, modulatia optica, modulatia acusto-optica, interactiile electron-fonon, interactiunea fonon-fonon, etc.
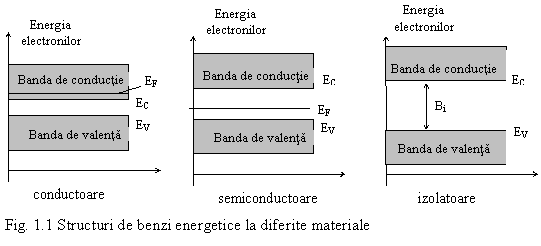
Electroni in corpul solid
Conform teoriei cuantice, energiile electronilor au valori discrete in interiorul unui atom liber. In cazul solidelor, datorita distantei interatomice mici si a interactiunii atomice, nivelele energetice degenereaza in benzi energetice permise, separate prin benzi interzise. Din punct de vedere al proprietatilor de conductie, intereseaza ultimile doua benzi permise: banda de valenta si banda de conductie, separate intre ele printr-o banda interzisa. Gradul de populare cu electroni a celor doua benzi permise precum si marimea benzii interzise dintre ele, impart materiale in conductoare, semiconductoare sau izolatoare. Primind energii suplimentare prin diverse procedee (termic, mecanic, bombardare cu radiatii ionizante, camp electric intens, etc), electronii pot sa-si modifice energia proprie, sarind dintr-o banda in alta, inclusiv sa paraseasca corpul solid. La temperatura obisnuita (300 K), energia termica a electronilor este Eter = KT = eV (K = 1,38*10-23 J/K este constanta lui Boltzman).
Concentratiile de electroni liberi la temperatura obisnuita sunt de ordinul:
1029 m-3 la metale ;
1016 m-3 la semiconductoare ;
<108 m-3 la izolatoare.
Distributia energiei electronilor in interiorul corpului solid este data de legea Fermi-Dirac. Aceasta spune ca probabilitatea ca un electron sa aiba energia E (in eV) este:
f(E) = 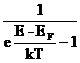
unde EF este energia Fermi, k este constanta lui Boltzman si T temperatura absoluta.
Energia Fermi, EF, reprezinta acel nivel energetic pentru care probabilitatea de a fi ocupat de un electron este egala cu probabilitatea de a nu fi ocupat si anume 0,5.
Din relatia (1.1) se observa ca la T 0K, probabilitatea ca un electron sa aiba energia E este nula.
Concentratia de purtatori care au energia E este:
n(E) N(E) f(E)
Analizand relatia (1.1) se observa ca:
a) la energii mari E+ >> EF astfel ca ![]()
![]() f(E+)
f(E+)![]() 0 (1.3)
0 (1.3)
adica este prea putin probabil sa existe electroni in aceasta energie.
b) la energii mici E- <<
EF astfel ca ![]() <<1 f(E-)
<<1 f(E-) ![]() 1 (1.4)
1 (1.4)
adica probabilitatea de ocupare a nivelului energetic este foarte mare.
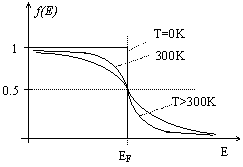
Fig. 1.2. Distributia Fermi-Dirac
1.2 Proprietatile materialelor
Proprietati electrice ale materialelor
O proprietate electrica foarte importanta este conductivitatea electrica, reprezentand capacitatea acestora de a conduce curentul electric. Intr-un material liniar, omogen si izotrop, conductivitatea electrica este o marime scalara constanta:
s = ![]() sau
sau ![]()
![]() (1.5)
(1.5)
unde J este densitatea de curent [ A/m2], s W m-1] este conductivitatea electrica si
![]() este intensitatea campului electric [V/m].
este intensitatea campului electric [V/m].
In relatia (1.5) A este suprafata prin care trece sarcina electrica dq in intervalul de timp elementar dt.
Pentru materialele anizotrope, conductivitatea
este un tensor de ordinul 2 (![]()
Capacitatea de polarizare a materialelor dielectrice este caracterizata de permitivitatea dielectrica. Un material dielectric aflat intr-un camp electric sufera un proces de polarizare electrica:
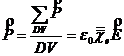
![]() (1.6)
(1.6)
unde DV este unitatea de volum, ![]() este polarizatia
egala cu suma momentelor dipolare C/m] create de campul E
in unitatea de volum, er este permitivitatrea relativa a
matrerialului,
este polarizatia
egala cu suma momentelor dipolare C/m] create de campul E
in unitatea de volum, er este permitivitatrea relativa a
matrerialului,![]() permitivitatea
vidului, iar D[C/m2] este inductia electrica in
material.
permitivitatea
vidului, iar D[C/m2] este inductia electrica in
material.
In general, permitivitatea dielectrica este un tensor de ordinul 2 deoarece, datorita structurii cristaline si anizotrpiei, polarizarea nu este coliniara cu campul electric.
Proprietati optice ale materialelor
Radiatia electromagnetica din gama optica (aproximativ 0,01 l mm), sau in frecventa 1012 1016 Hz, poate fi privita si analizata si ca unda magnetica si ca fascicol de fotoni (dualismul unda-corpuscul). Ca urmare, se poate defini intensitatea radiatiei optice ca un flux energetic determinat de fotonii care traverseaza unitatea de arie in unitatea de timp:
![]() (1.7)
(1.7)
Energia asociata fiecarui foton este:
![]() sau
sau ![]() (1.8)
(1.8)
Unde:
![]() - constanta lui Planck
- constanta lui Planck
![]() - viteza luminii in
vid
- viteza luminii in
vid
![]() - lungimea de
unda in vid
- lungimea de
unda in vid
Exemple numerice:
Pentru ![]() ,
, ![]()
![]() ,
, ![]()
Un flux de fotoni care transporta o putere de
1W la ![]() necesita un
numar de
necesita un
numar de ![]() fotoni/sec.
fotoni/sec.
Materialele pot absorbi, reflecta sau transmite o radiatie optica incidenta.
Interactiunea dintre campul optic si material se poate exprima cantitativ prin 2 marimi.
indicele de refractie n
constanta de absorbtie k
Indicele de refractie:
![]() (1.9)
(1.9)
El poate fi estimat prin unghiurile de incidenta si refractie, conform legii lui Snell:
![]() (1.10)
(1.10)
daca
![]()
Constanta de absorbtie (de atenuare) k reprezinta rata de scadere a intensitatii optice pe unitatea de lungime:
![]() (1.11)
(1.11)
Este o marime adimensionala, dependenta de material si de frecventa campului optic.
Pentru majoritatea materialelor, indicele de refractie este o marime complexa:
![]() (1.12)
(1.12)
unde j este unitatea imaginara
Atenuarea radiatiei care patrunde in material se poate caracteriza si prin coeficient de absorbtie care reprezinta atenuarea radiatiei pe unitatea de lungime:
![]() (1.13)
(1.13)
Din (1.10) si (1.11) rezulta:
![]() sau
sau ![]() (1.14)
(1.14)
Scaderea intensitatii radiatiei optice pe masura patrunderii in material se poate exprima astfel:
![]() (1.15)
(1.15)
Adancimea de patrundere a luminii sau in material se defineste ca acea distanta, masurata de la suprafata de incidenta, la care intensitatea radiatiei optice scade de e ori. Din (1.15) rezulta ca:
![]() (1.16)
(1.16)
unde ![]() este baza
legaturilor neperieni (naturali).
este baza
legaturilor neperieni (naturali).
Proprietatile termice ale materialelor
Conductivitatea termica exprima rata de transfer a cantitatii de caldura Q in timpul t si prin aria A intre 2 puncte situate la distanta x, intre care exista o diferenta de temperatura T2-T1:
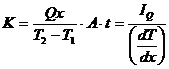 (1.17)
(1.17)
unde IQ este fluxul termic, iar dT/dx este gradientul de temperatura.
Caldura specifica, Cm, a unui material reprezinta cantitatea de caldura necesara pentru a creste cu un grad temperatura unui kg de material:
![]() (1.18)
(1.18)
Capacitatea calorica este caldura specifica a unei mase m de material:
![]()
Capacitatea calorica depinde de numarul de atomi ai probei
si se exprima prin Legea Dulong-Petit. Capacitatea calorica
molara a solidelor are valoarea uzuala ![]() . Aceasta poate fi estimata considerand ca fiecare
atom al unui material are energia KT corespunzatoare fiecarui grad de
libertate. Deci:
. Aceasta poate fi estimata considerand ca fiecare
atom al unui material are energia KT corespunzatoare fiecarui grad de
libertate. Deci:
![]()
unde ![]() este numarul lui Avogadro iar
este numarul lui Avogadro iar ![]()
Tot in unele materiale solide apar doua efecte cu materiale interesante, cum ar fi:
Efectul Peltier se refera la producerea unei diferente de temperatura in urma trecerii unui curent electric printr-o jonctiune de doua metale.
Efectul Seebeck, opus efectului Peltier, consta in producerea unui curent ca urmare a unei diferente de temperatura.
Observatie: A nu se confunda efectul Peltier cu efectul Joule care consta in producerea de caldura in urma trecerii curentului, ca urmare a rezistentei electrice a materialului.
Proprietati magnetice ale materialelor
Un material magnetic este definit generic ca avand stare de magnetizatie. Aceasta este o stare a materiei (o proprietate) caracterizata de existenta momentului magnetic nenul al unitatii de volum. Aceasta, la randul ei, este suma vectoriala a momentelor magnetice elementare. Momentul magnetic elementar poate fi spontan sau indus de un camp magnetic extern.
Proprietatile magnetice ale unui material sunt deschise in primul rand de permeabilitatea magnetica, definita ca raportul dintre inductia magnetica B[T] si campul magnetic H[A/m] care a produs-o:
![]() sau
sau ![]() (1.19)
(1.19)
unde ![]() este permeabilitatea
vidului (constanta universala)
este permeabilitatea
vidului (constanta universala)
Starea de magnetizatie M apare in urma aplicarii unui camp magnetic H:
![]() (1.20)
(1.20)
unde ![]() se numeste susceptibilitatea magnetica,
marime adimensionala.
se numeste susceptibilitatea magnetica,
marime adimensionala.
Relatiile dintre inductia magnetica, magnetizatie si campul magnetic sunt:
![]() (1.21)
(1.21)
deci ![]() si
si ![]() (1.22)
(1.22)
In medii anizotrope, permeabilitatea si susceptibilitatea sunt marimi tensoriale de ordinul II (cu 9 componente).
In functie de susceptibilitatea magnetica, materialele pot fi:
diamagnetice
![]() si de ordinul
si de ordinul ![]()
paramagnetice
![]() si de ordinul
si de ordinul ![]()
feromagnetice
![]() (sute, mii)
(sute, mii)
Materialele feromagnetice sunt neliniare din punct de vedere al dependentei inductiei magnetice (magnetizatia) de intensitatea campului magnetic. Ele au asa-numitul ciclu de histerezis, prezentand o inductie permanenta si fenomenul de saturatie la campuri magnetice mari. Ele au multe aplicatii in electronica si electrotehnica.
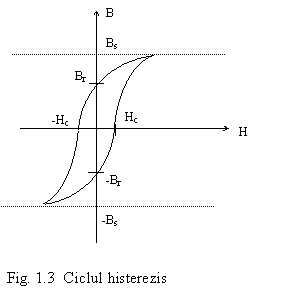
Un material feromagnetic poate deveni prin incalzire la o temperatura numita temperatura Curie material paromagnetic, adica isi pierde capacitatea de magnetizare puternica.
In afara materialelor feromagnetice capabile de magnetizari puternice, mai exista doua tipuri de materiale, deasemeni capabile de magnetizare puternica. Ele sunt diferite prin modul de orientare a magnetizarii pe domenii invecinate (domenii Weiss) si prin valoarea momentelor magnetice pe aceste domenii. Ele sunt materiale ferimagnetice si materiale antiferomagnetice.
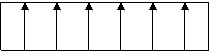
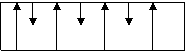
Fig. 1.4. Domenii fero, feri si antiferomagnetice.
1.3 Materiale solide cristaline
Mare parte dintre materialele simple sau compuse utilizate in electronica au structura cristalina. Aceasta presupune o aranjare ordonata a atomilor in volumul substantei. In cele mai multe cazuri este vorba de o entitate structurala elementara denumita baza (formata dintre atomi sau un grup de atomi) care se repeta periodic in spatiu. Aceasta structura periodica se afla in asa numitele noduri ale retelei. O retea cristalina (monocristal) se obtine prin translatarea (repetarea) periodica a structurii elementare. Lungimile si directiile (unghiurile) a 3 translatii elementare definesc complet o retea si cuprind 6 parametrii: 3 distante si 3 unghiuri.
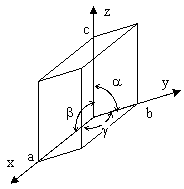
Fig. 1.4. Metrica unei celule elementare
a b c; a b g
Vectorii ![]() sunt factorii fundamentali ai retelei si
marimea lor reprezinta constantele retelei . Nodurile
retelei au vectorii de pozitie:
sunt factorii fundamentali ai retelei si
marimea lor reprezinta constantele retelei . Nodurile
retelei au vectorii de pozitie:
![]() (1.23)
(1.23)
unde m, n,si p sunt numere intregi.
Cea mai mica structura regulata (poliedru regulat) defineste celula elementara (CE) . Prin translatia celulei elementare se obtine intreaga retea cristalina. O CE nu poate fi definita unic, deoarece pot exista mai multe variante. Cea mai simpla varianta care are atomi doar in varfurile sale se numeste celula primitiva (CP) .
Simetria spatiala este o proprietate fundamentala a structurii cristaline. Ea presupune ca in urma unei transformari simetrice (rotatia, reflexia, translatia), corpul cristalin coincide cu el insusi.
Orice operatie de simetrie aplicata unui cristal are ca rezultat aducerea sa intr-o pozitie identica cu cea initiala. Elementele de simetrie punctuala sunt: axe, plane de simetrie si centre de simetrie, carora le corespund operatiile de simetrie rotatia, reflexia (oglindirea) si inversia.
In continuare se
detaliaza unele aspecte legate de axele de simetrie. O axa de ordinul n este o dreapta ce trece
prin cristal in jurul caruia rotind cristalul cu unghiul ![]() , acesta se suprapune cu el insusi.
, acesta se suprapune cu el insusi.
Diferitele cristale pot avea una sau mai multe axe de ordine diferite.
Simetria geometrica a cristalelor este foarte importanta deoarece ea determina simetria proprietatilor fizice si comportarea la diferiti stimuli sau perturbatii. Exista 3 categorii de simetrii, fiecare cu unul sau mai multe sisteme.
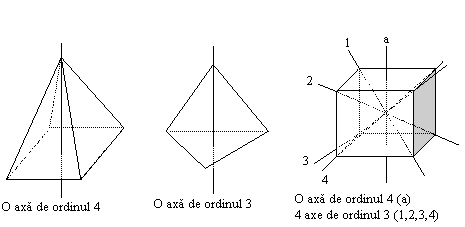
Fig.1.5. Axe de simetrie in diferite structuri cristaline
Categoria inferioara cu 3 sisteme: triclinic, monoclinic si ortorombic
Categoria medie cu 3 sisteme: tetragonal, hexagonal si trigonal
Categoria superioara cu un singur sistem, cubic
Parametrii acestor structuri sunt astfel:
triclinic: ![]() si
si ![]()
monoclinic:
![]() si
si ![]()
rombic:
![]() si
si ![]()
tetragonal:
![]() si
si ![]()
hexagonal:
![]() si
si ![]() ;
; ![]()
trigonal:
![]() si
si ![]()
cubic:
![]() si
si ![]()
La randul lor, aceste clase si categorii se pot prezenta in mai multe variante. Spre exemplificare, sistemul monoclinic (prisma dreapta) cu paralelograme la baza, poate avea diferite forme:
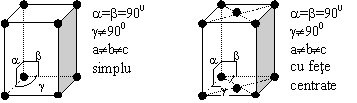
Fig.1.6. Variante ale sistemului monoclinic
La fel, sistemul cubic poate fi:
simplu - atomi in varful cubului
cu fete centrate - atomi in varfuri si in centrele fetelor
cu volum centrat - atomi in varfuri si in centrul cubului
Exemple de structuri cristaline:
cub cu volum centrat: Li, Na, K, Rb, Cs, Nb, Te, Ta, Mo, W,
cub cu fete centrate: Cu, Ag, Au, Pb, Fe, Na Cl, Pb S, Mg O, K Cl
Directii in cristale
Anumite directii in celula elementara cu o importanta particulara pentru procesele tehnologice sau aplicatiile la care este supus materialul. In general, aceste proprietati depind de directia in care au fost masurate.
Directiile in cristal se descriu cu ajutorul indicilor lui Miller. Modul de determinare al lor este descris in [1]
Defecte in cristale
Toate materialele monocristaline contin imperfectiuni la aranjamentul atomic, cu consecinte negative asupra proprietatilor acestuia. Controlul si mentinerea defectelor in limite acceptabile permite obtinerea unor materiale performante.
Exista 4 tipuri de imperfectiuni de baza:
defecte punctuale
defecte liniare (dislocatii)
defecte de suprafata
defecte de volum (tridimensionale)
In general, defectele de structura pot fi eliminate (reduse) prin tratamente termice si tehnologii specifice. In plus, mai exista defecte punctuale: atomi interstitiali, impuritati.
Defectele de suprafata sau defectele tridimensionale apar la limita de separatie a doua regiuni din cristal cu aceeasi structura dar cu orientari diferite.
Determinarea structurii cristalelor se face de regula prin analiza cu raze X. O radiatie electromagnetica cu lungimea de unda compatibila cu dimensiunile planurilor sau defectelor cristaline este reflectata de aceste zone. Razele X sunt cele mai potrivite. Razele X trec prin cristal iar cele ultraviolete sau vizibile sunt reflectate la suprafata acestuia.
Reprezentarea matematica a proprietatilor unui material
In caracterizarea materialelor este foarte importanta sa se poata studia (determina) raspunsul (efectul) produs ca urmare a unui stimul (cauza) care actioneaza asupra acestuia.
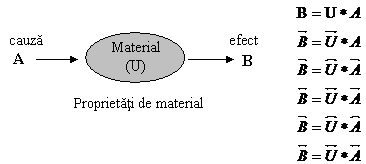
Fig. 1.7. Relatii posibile cauza - efect in materiale.
Marimile cauza, efect cat si proprietatea de material pot fi:
Un vector in planul tridimensional este caracterizat de trei marimi scalare (coordonate). El poate fi considerat un tensor de ordinul unu.
Un tensor de ordinul 2 este caracterizat de un set de 32 9 marimi.
Un tensor de ordinul 3 este caracterizat de un set de 33 27 marimi etc.
In general, o proprietate de material se poate descrie complet de un numar mare de parametrii care trebuie masurati sau determinati individual. O relatie de forma:
![]()
este o relatie scalara, in care cauza A si efectul B sunt scalari. O relatie de forma:
![]()
este o relatie vectoriala in care ![]() si
si ![]() sunt vectori cu cate 3
componente, iar A este scalar. O relatie de forma:
sunt vectori cu cate 3
componente, iar A este scalar. O relatie de forma:
![]() este o relatie
tensoriala in care
este o relatie
tensoriala in care ![]() este un vector,
este un vector, ![]() un tensor de ordinul 2 si
un tensor de ordinul 2 si ![]() un tensor de ordinul 3
cu 27 de componente.
un tensor de ordinul 3
cu 27 de componente.
Copyright © 2025 - Toate drepturile rezervate