 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Clasificarea metodelor optice de analiza
![]() Domeniile spectrale ale radiatiei electromagnetice:
Domeniile spectrale ale radiatiei electromagnetice:
metode de emisie si absorbtie atomica
metode de emisie, absorbtie si difuzie moleculara
metode bazate pe interactiuni neabsorbtive (difuzie, polarizare , refractie, difractie
![]() Modul de interactie a radiatiei cu substanta:
Modul de interactie a radiatiei cu substanta:
metode ale spectrometriei optice
metode refractometrice si interferometrie de analiza
metode polarimetrice de analiza
metode de analiza prin difractia razelor x
Metodele spectrometriei optice, implica emisia si absorbtia radiatiilor de catre atomi sau molecule. Din acest grup fac parte si metodele nefelometrice si turbidimetrice.
Radiatia electromagnetica este o unda care se propaga singura in spatiu, avand o componenta electrica si una magnetica, care oscileaza in faza perpendicular una pe cealalta, in directia de propagare a energiei.
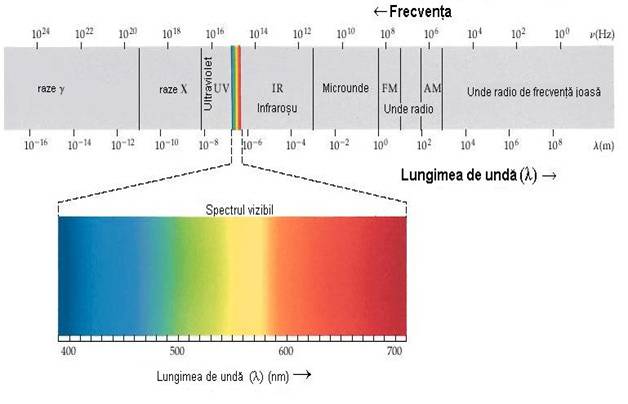
5.1 Clasificarea radiatiei electromagnetice se realizeaza in functie de frecventa lungimii de unda:
-unde radio
-microunde
-radiatie infrarosie
-lumina vizibila
-radiatia ultravioleta
-radiatiile x
-radiatiile gamma.
Dintre acestea radiatiile radio au cea mai mare lungime de unda, iar radiatiile gamma au cea mai mica lungime de unda.
Din motive de ordin practic domeniul ultraviolet si infrarosu se impart in subdomenii.
Domeniul ultraviolet este subimpartit in ultraviolet indepartat (10-200nm) si ultraviolet apropiat (200-400nm).
Domeniul infrarosu se subdivide in infrarosu indepartat (200-10 cm-1), mediu (4000-200 cm-1) si apropiat (12500-4000cm-1).
In domeniul infrarosu se prefera numarul de unda ν (cm-1) in locul lungimii de unda. Doar o mica parte din aceste lungimi de unda este perceputa de ochiul uman, si se numeste spectrul vizibil.
Metodele optice de analiza au la baza interactia radiatiei electromagnetice cu substanta. Studii asupra luminii au fost realizate in sec al XVII de Isaac Newton, care a emis teoria corpusculara, iar alti cercetatori ca C. Huygens, A.J. Fresnel si T. Young au emis toeria ondulatorie a luminii.
Huygens a demonstrat ca un corp care emite lumina imprima un impuls particulelor unui mediu ipotetic numit eter, particule care la randul lor transmit starea de miscare altor particule, lumina propagandu-se ondulatoriu.
Huygens emite principiul: orice punct de pe suprafata de unda este centrul unei noi unde elementare, astfel incat infasurarea tuturor undelor elementare, va fi o suprafata de unda la un moment ulterior.
Fresnel completeaza acest principiu aratand ca excitatia luminoasa intr-un punct oarecare P, poate fi considerat un rezultat al interferentei tuturor undelor elementare emise de o suprafata de unda.
Conform principiului lui Huygens-Fresnel, oscilatiile luminoase sunt oscilatii longitudinale ale eterului, asemanatoare sunetului. O serie de fenomene ca polarizarea sau dubla refractie a luminii contrazic aceasta ipoteza.
In 1873, J.C.Maxwell, a dedus din ecuatiile stabilite pentru campul electromagnetic ca deplasand o sarcina electrica inainte si inapoi in mod alternativ, pot fi produse unde electromagnetice, care au aceleasi proprietati ca lumina.
Teoria lui Maxwell arata si, experientele lui H.Hertz confirma ca, intr-o unda electromagnetica, vectorul electric E si vectorul magnetic B oscileaza in faza in plane perpendiculare intre ele si perpendiculare pe directia de propagare a undei.
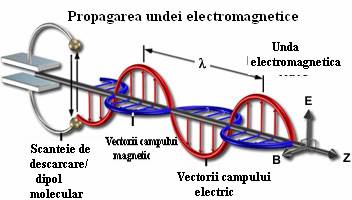
Daca undele se propaga cu viteza c (m.s-1) frecventa undelor, notata cu ν este ν=c/λ.
Frecventa reprezinta numarul de unde care trec in unitatea de timp(secunda) printr-un anumit punct, iar lungimea de unda reprezinta distanta intre doua maxime ele undei.
Teoria electromagnetica a luminii nu poate explica modul in care corpurile incandescente emit lumina si distributia energiei luminoase dupa lungimile de unda in spectrul emis de aceste corpuri incandescente.
Aceste fenomene sunt explicate prin caracterul corpuscular al luminii, Max Plank elaborand in anul 1900, teoria cunatica a luminii.
Conform acestei teorii lumina este emisa sub forma de cuante de energie luminoasa sau fotoni, numiti corpusculi. Fiecare foton contine o cantitate de energie determinata de frecventa luminii.
Ecuatia care coreleaza energia cu lungimea de unda este:
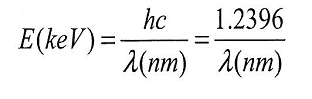
h=constanta lui Plank=6.626 J x s
c=viteza luminii = 299,792,458 m/s
Din aceasta ecuatie rezulta ca un foton cu frecventa mica, respectiv lungime de unda mare are energie mai mica decat un foton cu frecventa mare, respectic lungime de unda mica.
Din cele prezentate mai sus se poate concluziona faptul ca lumina este de natura electromagnetica si are caracter dual unda-corpuscul.
Daca radiatiile unui fascicul luminos au aceeasi frecventa, respectiv lungime de unda, avem de-aface cu o radiatie monocromatica.
Lumina in care toti vectorii electrici si magnetici se afla in acelasi plan se numeste lumina total polarizata sau liniar polarizata.
Lumina in care vectorii electrici sau magnetici ating maximul sau minimul in acelasi timp se numeste coerenta.
5.2.Emisie optica si absorbtie de radiatie
a) Emisia atomica:
In urma fenomenului de emisie atomica in domeniul vizibil si ultraviolet se obtin spectrele liniilor atomilor in stare gazoasa.
Aspectul acestor spectre este strans legat de structura electronica a atomilor diferitelor elemente si in mod deosebit de numarul si de asezarea electronilor in invelisul exterior.
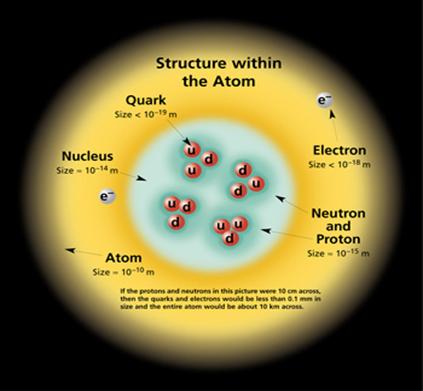
Fiecare atom este constituit dintr-un nucleu cu masa atomica A, care are Z sarcini pozitive si Z electroni. Numarul de protoni plus numarul de neutroni din nucleu este egal cu numarul de masa al atomului, A.
Electronii din atom por exista numai pe anumite nivele de energie, numite nivele de energie cuantificate.
Pentru fiecare nivel de energie exista mai multi orbitali. Un orbital reprezinta o regiune din jurul nucleului unde este cel mai probabil sa se gaseasca electronul.
Nivelul cu energia cea mai mica E0 se numeste nivelul fundamental sau starea fundamentala. La temperatura obisnuita, toti atomii in stare libera sunt in starea fundamentala. Celelalte nivele se numesc nivele excitate ( E1, E2, E3, En ). Trecera unui atom din starea fundamentala in starea excitata se face prin absorbtie de enrgie. Fiecare nivel este caracterizat de o anumita energie exprimata in electron - volt (eV).
De exemplu nivelul E1 al atomului de sodiu este situat la 2,102 eV, al potasiului la 1,610 eV, al calciului la 2,2932 eV. Aceste nivele sunt reprezentate prin diagrame (diagrama Grotian), unde fiecare nivel este reprezentat printr-o linie orizontala, iar pe ordonata este energia.
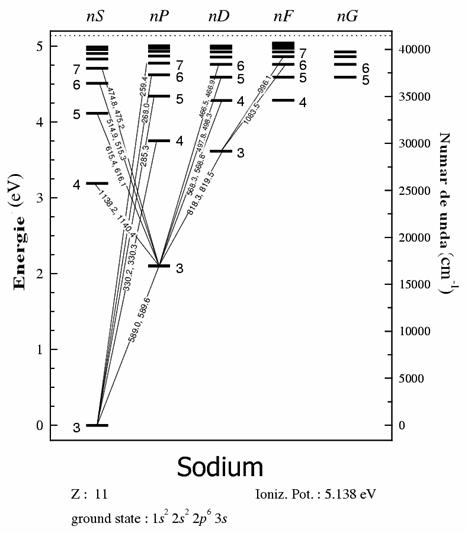
Diagrama nivelelor de energie a sodiului
In aceasta diagrama in dreptul fiecarui nivel de energie sunt trecute numerele cuantice principale 3,4,5 etc., in partea de sus literele S,P,D,F corespund L= 0,1,2 si 3. cifra din stanga sus corespunde sumei 2S+1 numita multiplicitatea liniei spectrale, iar cea din dreapta jos este valoarea lui j. Liniile oblice reprezinta tranzitiile permise.
Diagrama mai cuprinde lungimile de unda ale radiatiilor in nm, numarul de unda ν masurat in cm-1 si potentialul eV.
Mai multi atomi ai aceluiasi element in urma excitarii, pot trece in diverse stari de energie E1, E2, En , pe masura ce fiecare atom trece la un nivel mai scazut de energie sau revine la starea fundamentala, prin intermediul tranzitiilor permise emite o radiatie de o anumita frecventa, specifica tranzitiei respective.
Totalitatea acestor frecvente constituie spectrul de emisie al elementului supus excitarii. Deoarece fiecare element poseda anumite stari energetice caracteristice si radiatia emisa, respectiv spectrul de emisie va fi caracteristic.
Daca se foloseste un aparat spectral care are ca sistem de receptie placa spectrala, spectrul de emisie are forma unor linii inguste, de aici provenind denumirea de spectrul de linii.
Structura atomului:
Parametrii de stare:
-Numarul cuantic principal n, caracterizeaza nivelul energetic al electronilor si poate lua valori intregi si pozitive: n=1,2,3,4, el definind stratul electronic. Pentru fiecare nivel de energie exista n2 orbitali.
-Numarul cuantic orbital (secundar), l , indica substratul energetic pe care se afla electronul dintr-un strat.
Acesta poate lua valorile 0,1,.. n-1 si se noteaza simbolic s,p,d,f.
-Numarul cunatic magnetic, m, determina starea electronului, cand atomul se gaseste intr-un camp magnetic exterior.
Poate lua valorile -l,..,-3,-2,-1,0,1,2,3,,l.
-Numarul cuantic de spin, ms , care arata rotatia proprie a electronului si are valoarea:
ms = + 1/2
Intr-un atom nu pot exista doi electroni cu aceleasi valori pentru toate cele patru numere cuantice, electronii trebuie sa difere cel putin prin numarul cuantic (principiul lui Pauli).
Consecinta acestui principiu: un orbital nu poate fi ocupat decat de maxim doi electroni cu spin opus.
Electronul poseda moment cinetic orbital, moment cinetic de spin, moment magnetic orbital si moment magnetic de spin.
Aceste momente interactioneaza intre ele vectorial si au ca rezultat un moment cinetic (magnetic) total al electronului, caracterizat de un numar cuantic intern j, rezultanta compuneriii vectoriale a lui l cu s este j=l + s.
In cazul atomilor care contin mai multi electroni in invelisul atomului, compunerea vectoriala a momentelor cinetice (magnetice) ale tuturor electronilor unui atom, conduc la momentul cinetic (magnetic) total al atomului.
Astfel starea energetica a atomului este caracterizata de numerele cuantice totale L,S si J. L este numarul cuantic secundar (orbital) total, corespunzator momentului cinetic orbital total al atomului, S este numarul cuantic de spin total corespunzator momentului cinetic de spin total al atomului si J este numarul cuantic intern total corespunzator momentului cinetic al atomului.
Pentru un strat complet (2n2 electroni) momentul cinetic rezultant este egal cu zero.
Momentul cinetic total al electronilor se reduce la acela al electronilor care nu fac parte dintr-un strat complet. Acesti electroni se numesc electroni optici si in majoritatea cazurilor sunt electroni de valenta.
Numarul cunatic J este un numar intreg pentru atomii care au un numar par de electroni si un numar intreg plus ½ pentru ceilalti atomi.
Diferitele valori ale lui J determina scindarea nivelelor energetice ale atomului, aceste nivele au energii diferite si se numesc termeni spectrali.
Spectrele nu se obtin in urma tranzitiilor intre toate nivelele electronice datorita regurilor de selectie :
Δ L = + l si ΔJ= 0, +l.
Energia de tranzitie ΔE dintre cele doua nivele intre care are loc tranzitia este data de relatia ΔE= E1- E0.
Se va obtine o linie spectrala cu frecventa data de relatia
ν= (E1- E0)/ h= ΔE/h si lungimea de unda λ= hc/E
Mai multi atomi ai aceluiasi element in urma excitarii, pot trece in diverse stari de enrgie E1, E2, En.
Pe masura ce fiecare atom trece la un nivel mai scazut de energie sau revine la starea fundamentala, prin intermediul tranzitiior permise emite o radiatie de o anumita frecventa, specifica tranzitiei respective.
Totalitatea acestor frecvente constituie spectrul de emisie al elementului supus excitarii. Deoarece fiecare element poseda anumite stari energetice caracteristice si radiatia emisa, respectiv spectrul de emisie va fi caracteristic.
Liniile inguste corespund radiatiilor monocromatice ce compun lumina provenita de la proba.
Atomii metalelor alcaline, care poarta un numar mic de electroni in stratul exterior dau spectre sarace in linii, spre deosebire de atomii metalelor cu mai multi electroni in stratul exterior care dau spectre bogate in linii.
Liniile spectrale ale diferitelor elemente sunt cataloagate in atlase spectrale, aceste atlase fiind folosite pentru identificarea diferitelor elemente in cazul analizei calitative.
Intensitatea liniei spectrale in cazul unui numar mare de atomi identici care provin dintr-o proba aflata intr-o sursa de excitare care este dependenta de numarul de atomi in stare excitata si de spectrul tranzitiei energetice.
Numarul atomilor aflati intr-o anumita stare energetica se poate calcula cu ajutorul relatiei de distributie a lui Maxwell- Blotzmann:
N0= N0 gn/g0 x e - ( En- E0)/KT
Nn este numarul de atomi in starea de energie En
N0 este populatia starii fundamentale
gn si g0 sunt ponderile statistice ale nivelelor energetice individuale
En - E0 = E este energia de excitare
K= este constanta lui Boltzmann
T este temperatura absoluta
Pentru o teperatura data raportul Nn/ N0 este dependent de diferenta intre nivelele energetice apropiate.
Daca En - E0 >> KT, atunci starea fundamentala este mult mai populata si Nn<< N0 .
Cresterea temperaturii duce la cresterea raportului Nn/ N0 deci va creste si intensitatea liniilor spectrale, odata cu cresterea temperaturii creste si ionizarea, fenomen nedorit in spectrometria de emisie atomica.
Inseamna ca pentru fiecare elemenent va exista o temperatura optima la care intensitatea liniei spectrale este maxima si ionizarea minima.
Rezulta ca la o anumita temperatura intensitatea liniei spectrale va depinde de concentratia elementului de analizat.
Analiza cantitativa in spectrometria de emisie atomica are la baza aceasta dependenta.
b) Absorbtie de radiatie
Absorbtie atomica in vizibil si ultraviolet:
Legea emisa de Kichoff in anul 1859:
Orice substanta chimica poate sa absoarba radiatiile pe care le va emite in conditii determinate, sta la baza absorbtiei atomice in vizibil si ultraviolet. Proprietatile de emisie si de absorbtie sunt complementare.
Exista totusi o diferenta pentru ca sa aiba loc emisia unei radiatii, trebuie sa fie suficienti atomi in stari excitate.
Acest lucru se realizeaza prin utilizarea unor surse de excitare ce produc temperaturi mari, cum sunt arcul, scanteia si plasma.
Din contra, pentru ca sa existe absorbtie atomii probei probei trebuie sa se gaseasca in stare energetica fundamentala, cu energie E0.
Energia sursei de excitare termica (flacara) sau energia termoelectrica (cuptorul Massmann sau L'vov) este suficienta pentru aducerea probei in stare de atomi.
La trecerea unei radiatii electromagnetice monocromatice de frecventa ν, printr-un strat de atomi de grosime l, o parte din radiatie va fi absorbita in conformitate cu legile absorbtiei radiatiilor.
I = I0 x e -Kνl
I= intensitatea radiatiei transmise
I0= intensitatea radiatiei incidente
l este grosimea stratului de vapori atomici
Kν este coeficientul de absorbtie atomica
Coeficientul de absorbtie atomica este o marime ce nu depinde de I0 si de l, fiind dependend de frecventa ν si de proprietatile mediului.
Reprezentarea grafica a coeficientului de absorbtie Kν functie de frecventa radiatiei ν (sau lungimea de unda), da profilul liniei de absorbtie si a intensitatii radiatiei functie de frecventa (sau de lungimea de unda), da profilul liniei de emisie.
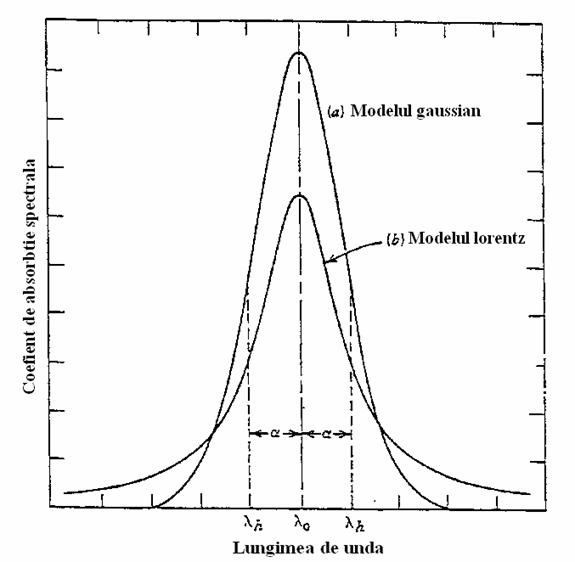
Profilul unei linii spectral de absorbtie si de emisie
Liniile spectrale nu au o largime infinit de mica, nu sunt perfect monocromatice. Ele au forma unui clopot, reprezentand un maxim pentru o anumita frecventa ν0 (lungime de unda λ0).
Pentru a caracteriza largimea liniei spectrale, se defineste largimea (Δν1/2 sau Δλ1/2) la jumatatea intensitatii maxime sau a coeficientului de absorbtie maxim.
Liniile de emisie au semi-largimea foarte mica de ordinul 0,001 nm. Liniile de absorbtie ai o semilargime cava mai mare de ordinul 0,005 nm.
Forma si largimea liniei spectrale, de emisie sau de absorbtie sunt determinate de:
- largirea naturala
- largirea prin efect Doppler
- largirea prin presiune (efect Lorentz)
Largirea naturala .
Acest efect este o consecinta a duratei de viata limitate a nivelelor de energie, corelat cu principiul lui Heisenberg.:
fiecare nivel acopera un domeniu mic de energie.
Linia rezultata prin combinarea a doua nivele prezinta o incertitudine asupra pozitiei sale. Acest efect este foarte slab si neglijabil in conditiile obisnuite de lucru.
Largirea prin efect Doppler .
Acest efect este o consecinta a deplasarii atomilor gazului care emite sau absoarbe radiatia electro-magnetica.
Daca un atom efectueaza o tranzitie cu lungimea de unda λ si se misca cu viteza v in raport cu un observator, acesta constata ca lungimea de unda λ este diferita de λ0 .
Deplasarea este data de relatia :
ν
λ - λ0 = − x λ0 c=viteza luminii in vid
c
Se demonstreaza ca valoarea coeficientului de absorbtie este dependent de lungimea de uda prin relatia:
Kλ= K0 x e -[ (λ - λ0 ) / Δ λ1/2 x 2 √ ln 2] 2
Unde largimea la jumatate coeficientului de absorbtie maxim Δ λ 1/2 este data de relatia:
Δ λ 1/2 = 7,16 x 10 -7 x λ0 √ T/A
T este temperatura absoluta
A este masa atomica
Largirea prin efect Doppler este de ordinul zecilor de mili-angstromi.
Largire prin presiune (efect Lorentz)
Efectul Lorentz este datorat ciocnirilor dintre atomi si moleculele unui alt gaz. Aceste ciocniri au ca efect, schimbarea starii de excitare a atomilor, prin aceasta diminuindu-se durata de viata in stare excitata.
Rezulta o largire asemanatoare cu largirea naturala, dar cu valori mult mai mari.
Coeficientul de absorbtie in cazul largirii prin efect Lorentz este dat de relatia:
K0
Kλ = −−−−−−−−−−−−−
2( λ - λ0)
l + [ −−−−−−− ]
Δ λ 1/2
K0 este coeficientul de absorbtie maxim (pentru λ = λ0 )
Δ λ 1/2 este largimea la semiinaltime
Largirea liniei prin efect Lorentz este de acelasi ordin de marime ca largirea prin efect Doppler.
In absorbtia atomica forma liniilor de absorbtie depinde atat de efectul Lorentz cat si de efectul Doppler.
Trebuie remarcat faptul ca aceste fenomene de largire nu deplaseaza linia, maximul se situeaza intotdeauna la λ = λ0 .
Acest fenomen este utilizat in practica spectrometriei de absorbite atomica.
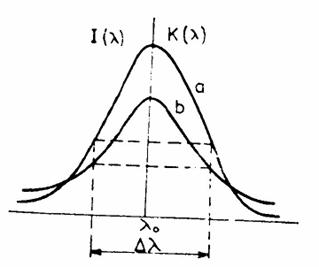
Variatia intensitatii si a coeficientulului de absorbitie cu lungimea de unda
a) Linie largita prin efect Doppler
b) Linie largita prin efect Lorentz
c) Interactia radiatiei cu substanta:
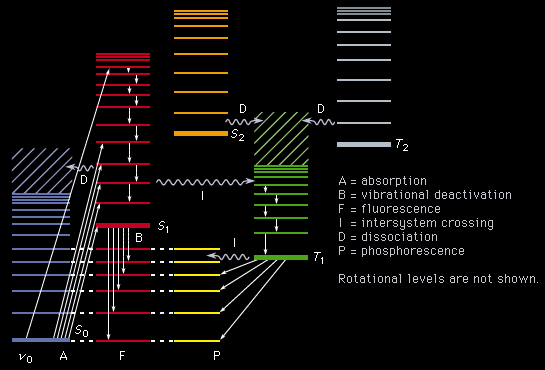
La interactia radiatiei electromagnetice cu materia au loc tranzitii diferite in functie de domeniul din care provine radiatia.
Radiatia gama va produce tranzitii energetice la nivel nuclear. Razele x vor produce tranzitii electronice, la nivelul straturilor interioare ale atomului K,L,M. Radiatiile ultraviolete si cele din domeniul vizibil produc tranzitii la nivelul straturilor de valenta. Radiatiile din domeniul infrarosu apropiat si mediu produc schimbari de vibratie si rotatiwe ale moleculelor, iar cele din domeniul infrarosu indepartat si din domeniul microundelor produc numai tranzitii de rotatie.
Aducerea unui sistem format din atomi sau molecule intr-o stare de energie superioara, numita stare de excitatie se face prin absorbtie de energie. Energia poate fi primita sub forma de lumina, caldura sau energia unei particule accelerate.
La revenirea sistemului din starea de energie superioara la starea de energie inferioara se emite energie.
Daca energia schimbata de sistemcu mediu se face sub forma de radiatie electromagnetica, tranzitia respectiva este o tranzitie radiativa.
Tranzitiile pot fi radiative dar si neradiative.
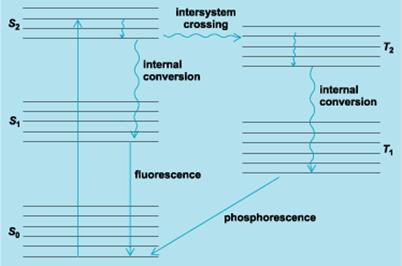
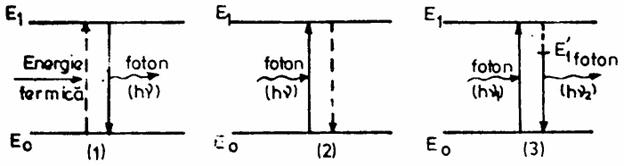
In cazul tranzitiilor neradiative transferul de energie realizandu-se prin ciocniri cu molecule, ioni, electroni liberi.
Intr-un caz sistemului i se furnizeaza energie termica, pentru al aduce in starea excitata E1, tranzitia fiind neradiativa.
Din starea excitata sistemul revine in starea fundamentala, prin tranzitie radiativa.
Energia pierduta de sistem:
ΔE= E1- E0= hν
Se gaseste sub forma unui foton de frecventa ν, care transporta energia hν.
Acest tip de tranzitie sta la baza spectrometriei de emisie.
In cazul al doilea sistemul trece in starea excitata E1 prin tranzitie radiativa , absorbind un foton cu energia hν, iar revenirea la nivelul E0 se face prin tranzitii neradiative.
E0 + hν= E1
ν= (E1-E0)/h= ΔE/h
Aceasta relatie este identica cu cea de la emisie ΔE= E1- E0 si arata ca un sistem nu poate sa absoarba decat radiatiile pe care este capabil sa le emita. Acest tip de tranzitii sta la baza spectrometriei de absorbtie.
La diagrama tranzitiei pentru fluorescenta sistemul trece in stare excitata E1 prin tranzitie radiativa, de unde pierde o parte din energie prin tranzitie neradiativa, ramanand instare excitata pe un nivel cu energie mai mica E1. De aici prin tranzitie radiativa revine pe nivelul E0.
Frecventa radiatiei emise, numita fluorescenta este mai mica decat frecventa radiatiei absorbite ν1 ( ν2 < ν1 ). Acest tip de tranzitii se intalnesc in fluorimetrie.
Metodele de emisie si absorbtie atomica sau moleculara sunt folosite pentru analiza cantitative si calitative.
Frecventa sau lungimea de unda a radiatiilor contine informatii calitative asupra naturii substantei, iar intensitatea radiatiilor emise sau absorbite contine informatii cantitative.
Radiatia electromagnetica este folosita si in cazul metodelor optice de analiza:
-refractometria
-polarimetria
-turbidimetria
-nefelometrie
-difractie de raze x
In cazul acestor metode interactia cu substanta nu are loc prin tranzitii radiative si nu se face cuantificat.
Copyright © 2025 - Toate drepturile rezervate