 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Cinetica reactiilor in conditii dinamice
Investigatiile cinetice (k, n) pentru aflarea constantei de viteza si ordinelor de reactie, se relizeaza de obicei in sistem static. Reactantii sunt introdusi in vasul de reactie si urmarindu-se concentratia in timp.Aceasta metoda permite insa numai studiul reactiilor lente.
Investigatiile cinetice pentru sisteme rapide se relizeaza cu ajutorul metodei dinamice intr-un vas de reactie in care se introduce continuu reactant si se evacueaza continuu amestecul de reactie, numit reactor. Reactiile in conditii dinamice pot fi clasificate dupa modul in care se realizeaza conditiile din reactor.
Cazurile extreme sunt: -reactorul cu deplasare ideala (reactorul tubular)
-reactorul cu amestecare ideala (reactorul cu agiatre perfecta)
1. Reactorul tubular
Reactorul tubular cu deplasare ideala este un tub cu lungimea mult mai mare decat diametrul in care se considera ca nu are loc amestecare longitudinala sau laterala in curentul de gaz ce reactioneaza.

fig 4.1 schema de principiu a unui reactor cu deplasare perfecta
Fig 4.1
ilustreaza fluxul de substanta intr-un reactor tubular in care are loc o reactie in sistemul aflat in curgere. Amestecul de reactie este trecut prin
reactor cu un debit volumetric u exprimat de obicei ( m![]() /s). Se
considera un element de volum dV din reactor si se presupune ca
viteza de reactie depinde de concentratia unui singur reactant c
si ca este de ordinul n in raport cu acesta:
/s). Se
considera un element de volum dV din reactor si se presupune ca
viteza de reactie depinde de concentratia unui singur reactant c
si ca este de ordinul n in raport cu acesta:
v=-![]() =kc
=kc![]()
Viteza de
disparitie a reactantului (exprimata in mol/s) in volumul dV este astfel
kc![]() dV. Dupa un
timp de la intrarea in reactor se realizeaza in sistem o stare
stationara, adica nu mai are loc o modificare in timp a
concentratiei reactantului in elementul de volum datorita terminarii
reactiei. Ecuatia starii stationare se obtine din bilantul
dintre numarul de moli de reactant ce intra in elementul de volum ( prin fata din stanga fig 4.1 ucdt), numarul de moli de
reactant ce parasesc elementul de volum(prin fata din
dreapta fig 4.1 u(c+dc)dt) si numarul de moli ce dispar prin
reactia chimica in timpul dt in elementul de volum dV (kc
dV. Dupa un
timp de la intrarea in reactor se realizeaza in sistem o stare
stationara, adica nu mai are loc o modificare in timp a
concentratiei reactantului in elementul de volum datorita terminarii
reactiei. Ecuatia starii stationare se obtine din bilantul
dintre numarul de moli de reactant ce intra in elementul de volum ( prin fata din stanga fig 4.1 ucdt), numarul de moli de
reactant ce parasesc elementul de volum(prin fata din
dreapta fig 4.1 u(c+dc)dt) si numarul de moli ce dispar prin
reactia chimica in timpul dt in elementul de volum dV (kc![]() dV dt.):
dV dt.):
ucdt = u(c+dc)dt+kcn dVdt (2)
Din (2) rezulta (3)
-![]() (3)
(3)
Se integreaza (3) pe tot volumul reactorului Vf. La intrare in reactor (V=0) concentratia reactantului este ci (concentratia initiala), iar la iesirea din reactor (V=Vf )
concentratia reactantului este cf (concentratia finala).
Pentru n=1 se obtine:
-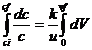 ln
ln![]() (4)
(4)
sau cf =ci e![]()
![]()
![]() (5)
(5)
Comparand relatia (5) cu ecuatia cinetica pentru o reactie de ordin 1 in sistem static
(c =c0e-kt) se observa ca ![]() inlocuieste
timpul t. Acest raport se numeste timp de contact, fiind timpul necesar ca
moleculele sa treaca prin reactor pentru a
reactiona. Ecuatia (5) poate fi testata variind raportul
inlocuieste
timpul t. Acest raport se numeste timp de contact, fiind timpul necesar ca
moleculele sa treaca prin reactor pentru a
reactiona. Ecuatia (5) poate fi testata variind raportul ![]() , adica pentru diferiti timpi de contact, asa
cum in sistemele statice se modifica timpul.
, adica pentru diferiti timpi de contact, asa
cum in sistemele statice se modifica timpul.
Reactiile prea rapide pentru a se putea studia static se pot studia in sistem dinamic micsorand timpul de contact printr-o viteza de curgere mare(U) si reducand volumul/ lungimea tubului reactorului. Pentru reactii de ordin n≠1, solutia ecuatiei (3) este (6)
![]()
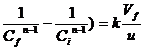 (6)
(6)
In deducerea ecuatiilor (5) si (6) s-a presupus ca reactia nu conduce la modificarea volumului; in caz contrar se produce o modificare a vitezei de curgere prin reactor care trebuie luata in considerare si care complica ecuatiile.
Din ecuatiile (3) sau dupa efectuarea integrarii (4) si (6) se vede ca pentru un debit de alimentare dat si la o anumita compozitie de alimentare data Ci (temperatura constanta), concentratia finala Cf este functie doar de volumul reactorului Vf. Invers , daca se urmareste o anumita conversie, la o viteza de alimentare data si la un amestec initial dat,acesta determina volumul reactorului Vf ce trebuie folosit. Astfel ecuatia (3) sta la baza dimensionarii reactoarelor tubulare.
2. Reactorul cu amestecare ideala
Reactorul cu amestecare ideala asigura mentinerea unei concentratii identice a reactantilor in orice punct al reactorului, egale cu cea de la iesirea din reactor, ca rezultat al unei amestecari puternice.
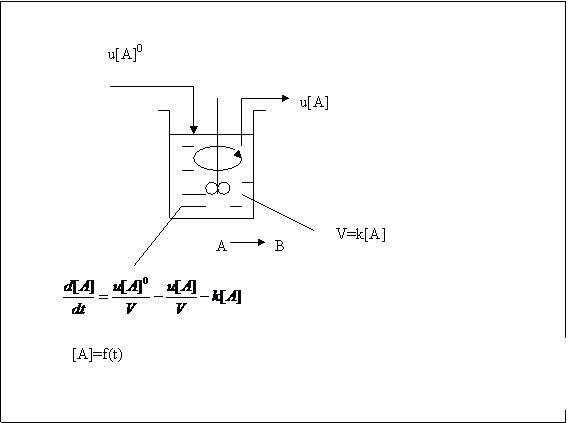
fig 4.2 Schema de principiu a unui reactor cu amestecare ideala
Reactorul cu amestecare ideala este prevazut cu manta pentru incalzire sau captusit in interior cu un strat de catalizator.
Reactorul cu agitare perfecta
In acest reactor, reprezentati schematic in figura 4.2 se considera ca exista o agitare foarte eficace care conduce la o amestecare ideala. Aceasta asigura o concentratie a reactantilor in orice punct al reactorului egala cu cea de la iesirea din reactor. Reactorul cu agitare perfecta se regaseste in practica industriala atunci cand se lucreaza in sisteme deschise in care are loc un transfer de masa intre acestea si mediul exterior (continuu se introduce si se evacueaza din reactor amestec de reactie).
Studiul cinetic al unei reactii intr-un reactor cu agitare perfecta trebuie sa tina cont de transferul de masa dintre reactor si mediul exterior. Amestecul de reactie este trecut prin reactor cu debitul volumetric u (exprimat, de exemplu, in L/s).
Daca in reactor are loc o reactie unilaterala de ordinul intai. (7)
k
![]() A B
A B
Variatia in timp a concentratiei lui A in reactor se datoreaza alimentarii cu reactant (u[A]0 /V ) consumarii prin reactia chimica si evacuarii din reactor, conform relatiei (8).
![]() (8)
(8)
In (8) v=k[A] este viteza de reactie, iar V=volumul reactorului. Ecuatia (8) este o ecuatie diferentiala de ordinul I cu variabile separabile. Prin integrare se obtine ecuatia (9) reprezentata grafic in figura 4.3
[A]=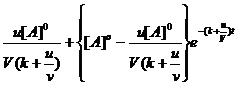 (9)
(9)
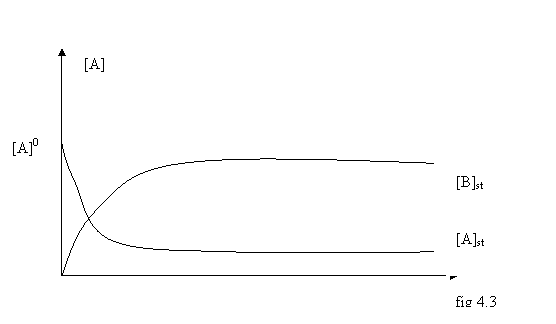
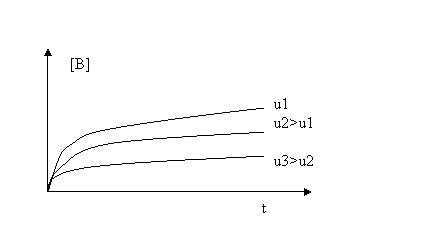
Fig 4.3 Profile de concentratie pentru reactantul [A] si produsul [B] intr-un reactor cu agitare perfecta.
Din figura 4.3 se observa ca dupa un interval de timp se atinge un regim stationar (concentratia lui A nu se mai modifica) la care [A]=[A]st= ct si d[A]dt=0. Valoarea [A]st se obtine din limita pentru [A] la t →∞ (din relatia 9).
[A]st=![]()
Rezulta: [A]st=![]() (10)
(10)
Relatia (10) se poate obtine direct din (7) punand conditia d[A]/dt=0, adica:
0=![]() (11)
(11)
ceea ce conduce la aceeasi relatie de mai sus(10).
Variatia concentratiei componentului B se datoreaza reactiei si evacuarii acestuia din reactor. Daca se considera ca mai este prezent in amestecul de alimentare ([B =0), conform ecuatiei (12)
![]() (12)
(12)
Concentratia produsului de reactie [B] atinge de asemenea o valoare stationara (fig 4.3). Din (12) punand conditia d[B]/dt=0 rezulta (13) din care se obtine (14).
k[A]st=![]() (13)
(13)
[B]st![]() (14)
(14)
Expresiile obtinute pentru [A]st si [B]st respecta conditia de bilant (15)
[A +[B]0=[A]st+[B]st (15)
Se verifica astfel ca:
[A =![]()
Din expresiile pentru [A]st si [B]st se poate explicita constanta de viteza k astfel:
k=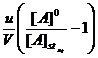 (16)
(16)
k=![]() (17)
(17)
Relatiile (16) si (17) permit determinarea experimentala a constantei de viteza k daca se cunosc debitul u. Volumul reactorului V si raportul dintre concentratia stationara si concentratia initiala a reactantului A.
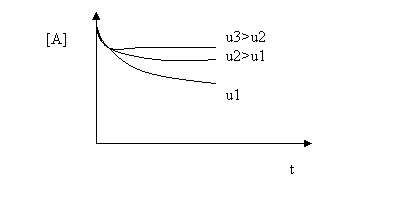
Valoriile concentratiilor stationare sunt influentate de debit dupa cum rezulta din figurile 4.4 si 4.5. Dependentele observate in aceste figuri rezulta si din derivarea expresiilor [A]st si [B]st in functie de debit:
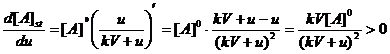 ==> functie
crescatoare
==> functie
crescatoare
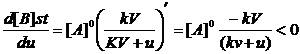 ==> functie
descrescatoare
==> functie
descrescatoare
Copyright © 2025 - Toate drepturile rezervate