 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Cinetica reactiilor cu lanturi drepte
Pentru a caracteriza aceasta categorie de reactii sa analizam cateva exemple clasice.
v Formarea acidului bromhidric din elemente. Ecuatia vitezei de reactie stabilita de Bodenstein:
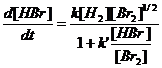 (5)
(5)
Concentratia [Br] obtinuta prin initierea fotochimica este mai mare decat cea obtinuta prin echilibru chimic, dar si viteza de reactie este diferita de cea obtinuta prin initiere termica.
v Formarea acidului clorhidric din elemente. In acest caz, disocierea Cl2 in atomi este neglijabila, dar odata formati atomii o cale oarecare, reactia se va desfasura in lant mult mai usor decat in cazul HBr.
Cl· +H2 → HCl + H· E=6,0 kcal ΔrH=1,0 kcal
Reactia fiind slab endoterma, energia de activare nu prea mare, se desfasoara usor cu lanturi mai lungi decat HBr.
v In cazul formarii HI din elemente, atomii de iod nu pot initia reactia, valoarea experimentala a energiei de activare fiind mai mare, reactia de formare a acidului iodhidric se produce dupa un mecanism simplu, bimolecular si nu printr-o reactie inlantuita.
v Reactiile de halogenare a compusilor organici. Halogenarile compusilor organici au loc prin reactii in lant liniar, cu 2 centri activi. Ele pot fi initiate atat termic cat si fotochimic. Aceste reactii au fost studiate de Benson si Laidler care au propus urmatoarea schema generala, considerand o initiere termica:
X2 + RH → RX + HX
v Descompunerile termice ale substantelor organice. Majoritatea descompunerilor termice nu decurg ca reactii moleculare ci dupa mecanisme complexe in lant. Rice si Herzfeld au propus un mecanism radicalic, care incepe cu formarea radicalilor prin ruperea legaturii cea mai slaba, continua cu formarea unei molecule saturate si a unui nou radical prin extragerea hidrogenului de la reactant de catre radical si se termina prin asocierea radicalilor care conduc la ruperea lantului.
Radicalii liberi de tipul R - CH2 - CH2 - se pot autostabiliza formand etilena:
R - CH2 - CH2- → R· + CH2=CH2
O reactie tipica este piroliza etanului care se descompune termic in etilena si H2 intre 800 - 1000°C.
Initiere: ![]()
![]()
Propagare: ![]()
Intrerupere: ![]()
Copyright © 2025 - Toate drepturile rezervate