 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Cinetica reactiilor cu lanturi ramificate
In studiul cinetic al reactiilor inlantuite ramificate se observa ca ramificarea se poate produce la fiecare veriga (ramificare densa) sau numai la unele (ramificare rara). Lungimea lantului se poate scrie:
![]() (6)
(6)
unde: ρ este probabilitatea de ramificare, iar β e probabilitatea de intrerupere a lantului.
Viteza de reactie este:
![]() (7)
(7)
Pentru o probabilitate de ramificare mica, viteza ractiei va fi finita si deci avem o reactie cu lanturi drepte. Pentru valori ρ>>β numitorul devine 0 sau negativ, iar viteza devine infinita. Reactia se transforma in explozie.
Exemple de reactii in lant ramificate sunt arderile care pot duce la explozii, reactiile oxigenului cu hidrogenul, cu hidrocarburile, autooxidarile.
Deflagratia. Explozia declansata intr-un anumit punct al amestecului gazos produce:
radicali sau atomi liberi ce vor difuza in traturile vecine iar reactia se va propaga in intreg amestecul de la strat la strat;
in locurile unde se produce reactia va creste temperatura care se va transmite prin conductie termica;
cresterea temperaturii va ridica presiunea provocand o unda de presiune ce se va propaga in restul gazului cu viteza sunetului.
Prin masa de reactie se va propaga unda de combustie. Deplasarea amestecului gazos sub forma undei de combustie se numeste deflagratie. Atunci cand gazele alimenteaza reactia se propaga cu o viteza comparabila cu cea a undei de combustie se formeaza o flacara. Temperaturile atinse sunt foarte inalte, peste 1000°C. In aceste conditii de temperaturi foarte inalte se produc excitari electronice ale atomilor, moleculelor si radicalilor liberi, cu emisie de lumina. In analiza spectrala a emisiei de lumina in flacara s-au putut identifica si analiza intermediari cu viata scurta ce joaca rol de centri activi in reactie. S-a observat insa si fenomenul de flacara rece (emisie luminoasa in domeniul an care reactia se produce lent la temperaturi mult mai joase decat ale flacarilor obisnuite). Acesta este un fenomen tipic de chemiluminescenta in care produsii ce au aparut intr-o stare excitata revin la starea fundamentala cu emisie de lumina.
Detonatia. Acest fenomen apare atunci cand unda de combustie devine unda de soc iar aceasta este intretinuta de reactoi. La detonatie se realizeaza temperaturi si presiuni foarte inalte in timp scurt, iar unda de soc se deplaseaza dincolo de limitele amestecului exploziv. Ea acumuleaza si deplaseaza o cantiate mare de energie care dezvolta o capacitate deosebita de distrugere.
Reactii in lant ramificat in cadrul sistemelor farmaceutice
In cadrul sistemelor farmaceutice, care sunt in general sisteme chimice, se regasesc numeroase exemple de reactii ce se desfasoara in lant ramificat.
Reactia dintre hidrogen si oxigen. Mecanismul aceste reactii este format din 9 etape:
![]()
![]()
![]()
![]() ΔH=
-109 kcal/mol
ΔH=
-109 kcal/mol
![]() dezactivare la suprafata
dezactivare la suprafata
![]()
![]()
![]() dezactivare la suprafata
dezactivare la suprafata
![]() dezactivare la suprafata
dezactivare la suprafata
Semenov propune o initiere prin reactia:
H2 + O2→ HO2 + H· ΔH= -56,3 kcal/mol
Aceasta reactie este mult mai plauzibila din motive energetice.
Oxidarile cu oxigen molecular
Reactia dintre o substanta cu oxigen molecular din aer se numeste autooxidare. Aceste reactii se desfasoara prin radicali liberi dupa mecanisme in lant. Medicamentele cau numeroase astfel de reactii.
Un exemplu in constituie oxidarea aldehidelor lichide (cum ar fi benzaldehidele) care are loc dupa un mecanism radicalic in lant in prezenta luminii.
In majoritatea ractiilor viteza de reactie este proportionala cu concentratia moleculei oxidat dar poate fi independenta de concentratia oxigenului. Reactiile sunt de obicei catalizate de cantitati mici de pulberi fine ale metalelor usoare sau peroxizi organici.
Oxidarea grasimilor naturale si a uleiurilor are loc in prezenta luminii prin mecanism in lant radicalic.
R· + R`- CH2 - CH = CH - R`` → R`- CH2 - CH = CH - R`` + RH (1)
O - O·
R`- CH2 - CH = CH - R`` + O2 → R`- CH - CH = CH - R`` (2)
O - O·
R`- CH - CH = CH - R`` + R - CH2 - CH = CH - R →
O - OH (3)
→ R`- CH - CH = CH - R`` + R - CH - CH = CH - R
In urma reactii (3) se formeaza un hidroperoxid care ar putea fi indepartat prin descompunere si reactia ar continua fara radicalii formati in reactiile (1) si (2). Ruperea lantului se poate realiza si prin utilizarea de inhibitori sau antioxidanti. Actiunea inhibitorilor sau antioxidantilor se bazeaza pe furnizarea de electroni sau de atomi de hidrogen catre radicalii liberi pentru a stopa reactia in lant. Exemple de inhibitori sunt grupele: OH- si NH- componente ale pirogalolului, amoniacului si al altor amine.
Compusii polihidroxifenolici ce au multe grupari hidroxil in pozitiile orto si para dar nu si in meta sunt de asemenea antioxidanti. Forma meta este inactiva deoarece nu poate forma structura chinoida. Atomii reactivi de hidrogen dintr-un antioxidant, de exemplu hidrochinona, sunt donati radicalului R din reactia (1) sau radicalului peroxid din reactia (2).

Inhibitorul este transformat intr-o semichinona, care este stabilizata prin structurile de rezonanta si de aceea nu poate fi propagata reactia in lant.
Actiunea inhibitoare a hidrochinonelor este proportionala cu potentialul de oxido-reducere al antioxidantilor si usurinta cedarii unui electron sau atom de hidrogen.
Farmacopeea SUA permite adaugarea unui stabilizator convenabil cum ar fi α-tocoferolul la petrolat pentru a inhiba oxidarea si rancezirea.
Un alt exemplu studiat a fost oxidarea acidului ascorbic prin mecanism inlantuit.
Acidul ascorbic este un acid organic cu proprietati antioxidante. Apare sub forma unei pudre sau unor cristale albe spre galben deschis. Este solubil in apa. Enantiomerul L al acidului ascorbic este cunoscut sub numele comun de vitamina C.
Deficienta de vitamina C, rara in tarile dezvoltate, reduce rezistenta la infectii, provoaca stari de oboseala, gingivita si hemoragii. Factorii de risc in carenta de vitamina C sunt: fumatul, expunerea la poluare, consumul de cafeina, stresul si varsta (peste 55 ani). Rezistenta scazuta la infectii, lipsa de energie, sangerarea gingiilor, hemoragia nazala si invinetirea rapida sunt semne ale lipsei de vitamina C.
Carenta grava duce la aparitia unei boli numite scorbut, care se manifesta prin oboseala extrema, dureri osteoarticulare si afectarea gingiilor.
Doza zilnica recomandata de vitamina C este de 60 mg, iar unii nutritionisti sustin ca 500 mg pot fi luate zilnic pe o perioada lunga de timp, fara efecte adverse. La fumatori, se recomanda un aport crescut de vitamina C - aproximativ 120 mg pe zi.
Hipervitaminoza poate duce la stari de agitatie si insomnie, dar nu este periculoasa deoarece excesul de vitamina C este eliminat prin urina. Pentru doze de 1g pe zi de vitamina C nu exista contraindicatii; in schimb, doze mai mari de 5 g pot cauza diaree sau pot afecta ficatul. Dozele excesive de vitamina C sunt contraindicate in cazul calculilor renali sau a insuficientei renale.
Contrar parerii generale, dozele excesive de vitamina C nu pot vindeca raceala sau gripa. Administrarea de vitamina C nu poate vindeca decat bolile cauzate de o carenta a vitaminei C.
Barron a studiat autooxidarea acidului ascorbic la acid dehidroascorbic.
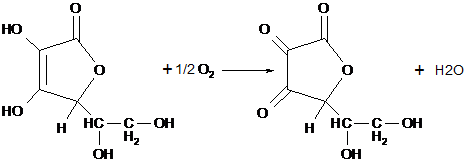
acid ascorbic acid dehidroascorbic
Compusii KCN si CO rup lantul prin formarea unui complex stabil cu cupru.
De asemenea, acidul ascorbic se poate degrada ireversibil si prin hidroliza cu formarea acidului dicetoglutonic sau prin descompunere in conditii anaerobe cu formare de furfural si CO2. Degradarea acidului ascorbic depdinde de pH-ul mediului si este maxima la pH=4. S-au constat insa ca stabilitatea acidului ascorbic in formele solide de conditionare este buna daca este controlata umiditatea, putandu-se mentine circa 5 ani in conditii normale de umiditate, de 57% si temperatura camerei. In prezenta apei, dupa degradarea sa in acid dicetoglutonic, si acesta poate fi oxidat succesiv cu formarea a trei molecule de acid oxalic. Acest proces a fost de asemenea studiat cinetic.
Stabilitatea in solutie poate fi imbunatatita in functie de alegerea judicioasa a vehiculului si de folosirea unor stabilizatori. Stabilitatea a mai fost imbunatatita prin includerea in siropuri medicamentoase ce contin complexul de vitamine B.
Degradarea termica in prezenta oxigenului a prometazinei
Prometazina este un antihistaminic puternic, avand si proprietati antiemetice, anticolinergice, hipnotice, sedative/calmante, analgezice si anestezice locale, identificand 9 produsi de descompunere oxidativa.
 Durata efectului
antihistaminic, care este in functie de proprietatile
farmacocinetice, difera cu compusul. Pentru o buna parte dintre
antihistaminice efectul dureaza 4-8 ore - ceea ce obliga la administrarea
a 3 - 4 doze/zi. Cateva antihistaminice au efect de durata mai lunga -
se mentine 12- 24 ore, ceea ce permite administrarea in 2 prize sau intr-o
singura doza/zi; din aceasta categorie face parte si prometazina,
alaturi de clorfenoxamina,
clemastina, meclozina.
Durata efectului
antihistaminic, care este in functie de proprietatile
farmacocinetice, difera cu compusul. Pentru o buna parte dintre
antihistaminice efectul dureaza 4-8 ore - ceea ce obliga la administrarea
a 3 - 4 doze/zi. Cateva antihistaminice au efect de durata mai lunga -
se mentine 12- 24 ore, ceea ce permite administrarea in 2 prize sau intr-o
singura doza/zi; din aceasta categorie face parte si prometazina,
alaturi de clorfenoxamina,
clemastina, meclozina.
Prin studii cinetice s-a aratat ca pH-ul, ionii metalici si antioxidantii influenteaza reactia care decurge dupa un mecanism de degradare oxidativa in lant.
Prometazina se absoarbe bine in organism, iar timpul de injumatatire este relativ scrut.
Romergan este un medicament care are ca substanta activa prometazina. Acesta se gaseste sub forma de sirop, drajeuri, fiole.
Sunt numeroase exemple de compusi farmaceutici care degradeaza prin oxidare, dintre care amintim: morfina (care se transforma in pseudomorfina si in morfin-N-oxid), clordiazepoxidul, vitamina B1, vitamina A etc.
Copyright © 2026 - Toate drepturile rezervate