 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Volumetria
Analiza volumetrica este o metoda de baza pentru determinarea calitatii produselor alimentare, cu o larga utilizare in laboratoare. Aceasta analiza permite sa se efectueze determinarile foarte rapid, deoarece, in majoritatea cazurilor, o singura determinare prin metoda volumetrica se face in citeva minute, in timp ce aceeasi determinare prin metoda gravimetrica necesita citeva ore. Rapiditatea determinarilor volumetrice permite sa se repete cu usurinta de citeva ori si sa se obtina o medie aritmetica mai exacta. Domeniul de aplicare al analizei volumetrice este foarte mare si majoritatea substantelor pot fi determinate prin aceasta metoda.
Principiul procesului in analiza volumetrica, titrarea, consta in faptul ca la solutia substantei care trebiue determinata se adauga treptat dintr-o biureta, solutia de lucru, titrata, pina se atinge punctul de echivalenta.
Punctul de echivalenta se pune in evidenta prin diferite metode. De obicei acest punct este decelat prin schimbarea culorii solutiei, masurindu-se apoi volumul solutiei consumate pentru titrare.
In cazurile cind este dificil sa se puna in evidenta punctul de echivalenta, se recurge la urmatoarele procedee ajutatoare:
- titrarea substituientului, care consta in titrarea compusului chimic ce se formeaza in urma reactiei cu substanta ce trebuie determinata;
- retitrarea, care consta in titrarea excesului de substanta adaugata (se mai numeste si titrare inversa).
Pentru determinari in analiza volumetrica se folosesc solutii titrate, care reprezinta solutiile cu o concentratie determinata
la 1 ml. Solutiile titrate cele mai folosite sint cele ce au o anumita normalitate (l n; 0,1 n 0,01 n), Normalitatea unei solutii indica numarul de echivalenti-gram de substanta intr-un litru de solutie titrata. Echivalentul-gram se obtine impartind greutatea moleculara, exprimata in grame, la sarcina activa din molecula substantei corespunzatoare reactiei date.
Exprimarea concentratiei solutiilor prin normalitate este.convenabila, deoarece numarul de miliechivalenti-gram ai ambelor substante care reactioneaza este acelasi, deci:
n1 x V1 = n2 x V2 → ![]()
in care:
n este normalitatea;
V volumul.
Din aceasta egalitate rezulta ca volumele solutiilor care reactioneaza sint invers proportionale cu normalitatile :
Deoarece majoritatea substantelor nu se gasesc in stare chimica pura, titrul exact al solutiilor se stabileste numai dupa prepararea lor, folosind substante etalon.Pentru determinarea titrului unei solutii de NaOH se foloseste acid oxalic ca solutie etalon
Ca urmare, se determina factorul F al solutiei respective, care reprezinta raportul dintre titrul real tr si titful teoretic: tt
Metodele folosite in analizele volumetrice sint urmatoarele:
- Metoda de neutralizare, prin care se determina concentratia acizilor si bazelor, precum si a altor substante care reactioneaza cu ele. Folosind metode indirecte, se pot determina si diferiti cationi.
- Acidimetria este o metoda larg folosita pentru a determina concentratia acizilor din produsele alimentare, prin titrarea cu o baza de normalitate cunoscuta :
H+ + OH' = H2O
Reactia este terminata cind toti ionii de hidrogen au fost inlocuiti cu metalele respective. Daca se utilizeaza o singura molecula de NaOH, acidul neutralizat a continut un singur atom de hidrogen ; in acest fel se determina orice acid, indiferent daca este tare (clorhidric, azotic, sulfuric) sau slab (acid acetic, oxalic etc.), deoarece taria acidului depinde de cantitatea de ioni.de hidrogen pe care o disociaza cind este dizolvat in apa si nu de cantitatea totala de hidrogen din molecula sa. Se deosebesc, de aceea, doua aciditati: aciditatea actuala, pusa in evidenta de indicatori, care este legata de gradul de disociere in solutie a acidului respectiv :si aciditatea totala, care corespunde cantitatii totale de hidrogen din molecula si se determina prin neutralizare cu o baza tare.
In acidimetrie se utilizeaza, in mod frecvent, o solutie titrata n/10 (0,1 n) de NaOH sau KOH, folosind un indicator de neutralizare ales convenabil. Pentru determinarea factorului solutiei de NaOH sau KOH 0,1 n se foloseste o solutie de acid oxalic 0,1 n si ca indicator fenolftaleina.
-Alcalimetria se utilizeaza pentru determinarea alcalinitatii unor solutii folosind solutii titrate de acizi 0,1 n. Se foloseste, in acest scop, o solutie de aproximativ 0,1 n de HCl si se determina titrul cu o solutie etalon de NaOH 0,1 n, obtinutacu fixanal sau avind factorul cunoscut.
Pentru punerea in evidenta a punctului de echivalenta, se folosesc indicatori acid-baza. Indicatorii cei mai folositi sint: metiloranjul (punct de viraj in mediu acid) si fenolftaleina (in mediu bazic).
in tabelul 21.1 se dau caracteristicile celor mai utilizati indicatori acid-baza de culoare.
- Metodele de precipitare si de formare a combinatiilor complexe stau la baza metodelor argentometrice folosite pe larg in industria alimentara. Ca indicator al metodelor argentometrice se foloseste cromatul de potasiu.
Tabelai 21.1
Caracteristicile unur Indicatori acid-baza de culoare
|
Indicatorul |
Intervalul de viraj. pH |
Culoarea solutiilor |
Solutia de indicator |
|
|
inainte de viraj |
dupa viraj |
|||
|
Tropeolinft |
1,2 - 3,2 |
Rosie |
Galbena |
Sol. apoasa 1% |
|
Metiloranj |
Rosie |
Galbena |
Sol. apoasa 0,03% |
|
|
Rosu-metil |
Rosie |
Galbena |
Sol. alcoolica 0,2% iin alcool 90% |
|
|
Rosii-neutru |
Rosie |
Galbena |
Sol. alcoolica 0,1% iin alcool 70% |
|
|
Rosu-fenol |
6,4 - 8,0 |
Galbena |
Rosie |
Sol. apoasa 0,1% |
|
Turnesol-. |
Rosie |
Albastra |
Sol. apoasa 0,5% |
|
|
Fenolftaleina |
Incolora |
Rosie |
Sol. alcoolica 0,1% in alcool 70% |
|
|
Timolftaleina |
Incolora |
Albastra |
Sol. alcoolica 0,1% in alcool 90% |
|
|
Nitramina |
13 |
Incolora |
Portocalie- bruna |
Solutie alcoolica 0,1% in alcool 70% |
- Metodele de oxid-reducere se bazeaza pe determinarea volumetrica a diferitilor oxidanti si reducatori. Din aceasta grupa de metode fac parte manganometria, iodometria, bicromatometria, bromatometria si cerimetria.
-- Manganometria. Consta in determinarea cantitativa a diferitilor ioni cu ajutorul urunor solutii titrate de KMnO4. Reactia este urmatoarea:
2KMnO4 H + 3H2SO4 = 2MnS04 + 3HaO + K2S04 + 5 O
Indicatorul folosit este insasi solutia colorata de KMn04, care dupa ce a oxidat substanta reducatoare din pahar, se decoloreaza.
Pentru stabilirea titrului solutiei de permanganat, in mod curent se utilizeaza acid oxalic.
- lodomeiria permite dozarea indirecta a substantelor care pun in libertate iodul din iodura de potasiu, iar dupa cantitatea de iod determinata se poate determina cantitatea de substanta care 1-a pus in libertate.
Iodul liber se dozeaza cu o solutie titrata de tiosulfat de sodiu (Na2S203) in prezenta de amidon ca indicator. Reactia este foarte sensibila si coloratia apare chiar la urme de iod.
Determinarea aciditatii
Aciditatea naturala a produselor alimentare este diferita pentru fiecare categorie de produs si o crestere a acesteia indica interventia agentilor de descompunere, in primul rind al celor microbieni.
Aciditatea se poate exprima prin concentratia de acid (aciditate totala) si prin pH'(aciditate reala sau actuala)..
Pozitia corecta la pipetarea
Titrarea solutiilor
Pentru determinarea aciditatii titrabile se intrebuinteaza metode bazate pe titrarea directa a unui volum determinat din lichidul de analizat, folosind o solutie alcalina titrata pina la reactie neutra, stabilita cu ajutorul indicatorilor acidobazici (fenolftaleina, turnesol, metiloranj, rosul .de fenol)
Aciditatea se poate exprima in diferite moduri asa cum se prezinta in continuare.
Exprimarea aciditatii in grade aciditate adica ml solutie de baza de concentratie normala (1 n) necesari sa neutralizeze aciditatea din 100 g produs
Exprimarea aciditatii in procente, adica in grame de acid anorganic sau organic, ales conventional, conform indicatiilor din standard, respectiv la 100 ml sau 100 g produs. Numarul de ml de solutie alcalina, folosit la titrare, se inmulteste cu factorul de corectie al acestuia si cu un factor de transformare, care exprima titrul solutiei acide de aceeasi normalitate.
Formula de calcul este urmatoarea:
% aciditate = ![]()
in care:
V1 - reprezinta volumul de solutie O, l n NaOH folosit la titrare, in ml;
V 2 - volumul total al solutiei de analizat, in ml;
V 3 - volumul luat pentru titrare, in ml;
F - factorul de corectie al solutiei 0,1 n NaOH;
T -factorul de transformare al solutiei 0,1 n NaOH, in diversi acizi in grame;
m - masa probei luata pentru analiza, in g.
Indicele de aciditate reprezinta cantitatea de hidroxid de potasiu, in mg, necesara pentru a neutraliza acizii grasi liberi dintr-un gram de produs.
Exprimarea aciditatii in grade Thorner se face la lapte si produse lactate, care reprezinta volumul in ml de hidroxid de sodiu, 0,1 n, necesare pentru neutralizarea aciditatii din 100 ml lapte sau 100 g produse lactate.
Determinarea aciditatii prin masurarea pH-ului permite stabilirea mai precisa a punctului de neutralizare, care corespunde la pH 7.
PH-ul se defineste ca fiind logaritmul cu semn schimbat al concentratiei ionilor de hidrogen dintr-o solutie sau logaritmul numarului de ml derapa, in care se gaseste un atom gram de hidrogen in stare de ion.
Determinarea pH-ului se face prin metode colorimetrice si metode electrometrice (potentiometrice).
a). Metodele optice pe'ntru.masurarea pH-ului se bazeaza pe proprietatea unor substante, numite indicatori acidobazici, de a-si schimba culoarea atunci cind variaza activitatea ionilor de hidrogen din solutie. Modificarea culorii indicatorului are loc gradat, intr-un interval de pH, numit domeniu de viraj sau interval de tranzitie.
- Metoda cu hirtie indicator se bazeaza pe umezirea hirtiei indicator cu solutie al carui pH dorim sa-1 aflam si compararea culorii cu o scara etalon.
- Metoda cu solutii indicatoare din seria nitrofenolului (metoda Michae-lis) se bazeaza pe modificarea nuantei de culoare a .indicatorilor monocromi din seria nitrofenolului in functie de pH-ul solutiei. Valoarea pHr-ului se stabileste prin compararea fata de un standard de referinta.
b). Determinarea pH-ului prin metoda potentiometrica se bazeaza pe masurarea diferentei de potential intre un electrod de referinta si un electrod de masurare, introdusi in proba de cercetat.. Aparatul folosit este un pH-metru, echipat cu un electrod de calomel (electrod de referinta) si elec-trgd de sticla (electrodul de masurare) (fig. 4.21).
Determinarea alcalinitatii
Alcalinitatea produselor alimentare se datoreste folosirii afinatorilor chimici.
Alcalinitatea reprezinta cantitatea de baza dintr-un produs, care se exprima prin concentratia totala a bazei sau prin concentratia ionilor OH~, respectiv pOH.
Principiul metodei consta in titrarea substantei alcaline din proba de analizat cu o solutie de acid clorhidric 0,1 n, in prezenta indicatorului albastru de bromtimol.
Alcalinitatea se exprima in grade de alcalinitate dupa formula:
Grade alcalinitate= ![]() 100=10
100=10 ![]() V
V
in care:
V este volumul de acid clorhidric 0,1 n folosit la titrare, in ml.
de compozitia chimica complexa a acestora.
Determinarea polarimetrica a zaharurilor
Determinarea polarimetrica a zaharurilor se bazeaza pe proprietatile optic active ale acestora, putind devia planul de polarizare a luminii care strabate solutia, spre dreapta sau spre stinga, cu un anumit unghi, care depiride de natura, concentratia si grosimea stratului de solutie.
Lumina polarizata, ale carei raze oscileaza intr-un singur plan, se obtine prin trecerea luminii prin substante solide cristaline (ex: carbonatul de sodiu cristalizat in sistem rombic numit si spat de Islanda)
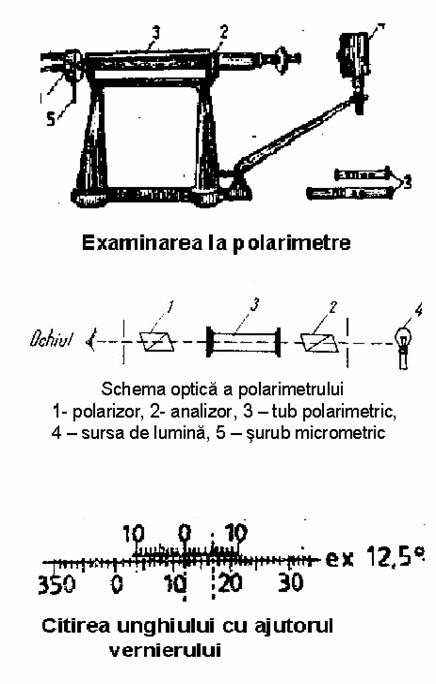
Examinarea se face la 20°C si in lumina monocromatica de sodiu. Aparatele folosite sint polarimetrul si zaharimetrul .
Polarimetrul este un aparat optic alcatuit din doua parti principale: polarizorul si analizorul, montati la capetele unui tub in care se introduce substanta de analizat Polarizorul este orientat spre sursa de lumna si are rolul de a transforma lumina normala in lumina polarizata, iar analizorul prin care se priveste si care permite analiza imaginii se poate roti la dreapta sau la stinga cu un surub micrometric determinind marimea unghiului a cu care a fost rotit planul de polarizare a luminii, care a strabatut stratul de solutie. Solutia de cercetat se introduce intr-un tub polarimetric din portelan sau sticla, cu o lungimedeterminata de 200 mm sau 100 mm
 Determinarile se fac
intr-o camera obscura, inainte de a incepe analiza, se
controleaza punctul zero al aparatului. Pentru aceasta se aduce analizorul
intr-o astfel de pozitie incit una dintre cele doua
jumatati ale cimpului sa fie bine luminata, iar
cealalta intunecata. Se pune la punct linia despartitoare
ale celor doua cimpuri, rotind usor luneta analizorului, dupa
care, manevrind surubul micrometric cimpul trebuie sa apara
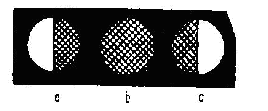
uniform luminat.Se introduce tubul polarimetric cu solutia de analizat:
daca solutia este levogira, se va lumina jumatatea cimpului din
stinga si se va intuneca cea din dreapta. Pentru a cunoaste unghiul α
cu care a fost deviat planul luminii polarizate, analizorul este rotit
pina se revine la luminozitatea cimpului, corespunzatoare punctului
zero. Marimea unghiului α se citeste pe scala gradata a
polarimetrului cu ajutorul unui vernier, care se deplaseaza solidar cu
analizorul. Se determina puterea rotatorie specifica substantei,
care reprezinta unghiul cu care este rotit planul luminii polarizate, care
strabate un strat de solutie, cu grosimea de 1 dm si care
contine un g de substanta dizolvata intr-un ml de
solutie. Puterea rotatorie specifica este data de relatia:
Determinarile se fac
intr-o camera obscura, inainte de a incepe analiza, se
controleaza punctul zero al aparatului. Pentru aceasta se aduce analizorul
intr-o astfel de pozitie incit una dintre cele doua
jumatati ale cimpului sa fie bine luminata, iar
cealalta intunecata. Se pune la punct linia despartitoare
ale celor doua cimpuri, rotind usor luneta analizorului, dupa
care, manevrind surubul micrometric cimpul trebuie sa apara
uniform luminat.Se introduce tubul polarimetric cu solutia de analizat:
daca solutia este levogira, se va lumina jumatatea cimpului din
stinga si se va intuneca cea din dreapta. Pentru a cunoaste unghiul α
cu care a fost deviat planul luminii polarizate, analizorul este rotit
pina se revine la luminozitatea cimpului, corespunzatoare punctului
zero. Marimea unghiului α se citeste pe scala gradata a
polarimetrului cu ajutorul unui vernier, care se deplaseaza solidar cu
analizorul. Se determina puterea rotatorie specifica substantei,
care reprezinta unghiul cu care este rotit planul luminii polarizate, care
strabate un strat de solutie, cu grosimea de 1 dm si care
contine un g de substanta dizolvata intr-un ml de
solutie. Puterea rotatorie specifica este data de relatia:
![]() in care:
in care:
α = reprezinta unghiul citit la polarimetru, in grade;
l = lungimea tubului polarimetric, in dm;
c = concentratia solutiei, in g la 100 ml solutie.
Din aceasta relatie se poate calcula concentratia c, cind se cunoaste unghiul de deviere α:
![]()
Zaharimetrul este un polarimetru special gradat incit permite citirea directa in procente, a continutului de zaharoza dintr-o substanta solida sau dintr-o solutie. Este folosit in laboratoarele fabricilor de zahar.
Zaharimetrul este etalonat pentru o anumita cantitate de substanta solida, sau solutie, numita masa normala. Pentru majoritatea zaharimetrelor masa normala este de 26 g. In aceasta scara punctul 100, corespunde unghiului de rotatie obtinut cu o solutie care contine 26 g zaharoza in 100 ml solutie, examinata intr-un tub polarimetric de 2 dm, la temperatura de 20°C.
1° zaharimetric=0,26 g zaharoza in 100 ml solutie
Modul de lucru la zaharimetru este identic cu cel folosit la polarimetre.
Determinarea concentratiei alcoolice la vin prin metoda ebuliometrica
Metoda se aplica numai vinului sec, cu un extract sub 30 g/1, sanatos si limpede. Nu se aplica vinurilor tulburi, alterate(otetite etc.), cu aciditate volatila mai mare de 1,2 g/1 acid acetic.
In buletinul de analiza se va specifica metoda folosita. Metoda ebuliometrica determina concentratia alcoolica cu o eroare de +/-(0,1-0,3) % voi.
Principiul metodei:
Determinarea punctului de fierbere al vinului, care se gaseste intre punctul de fierbere al apei (100°C) si cel al alcoolului etilic (78,3°C), vinul fiind un amestec hidroalcoolic.
Materiale necesare
Ebuliometrul
Proba de vin
Se deduce concentratia alcoolica a vinului, folosind un disc sau o rigla speciala de corespondenta, cunoscand punctul de fierbere, determinat cu ebuliometrul. Concentratia alcoolica a vinului este cu atat mai mare, cu cat punctul de fierbere este mai scazut fata de cel al apei.
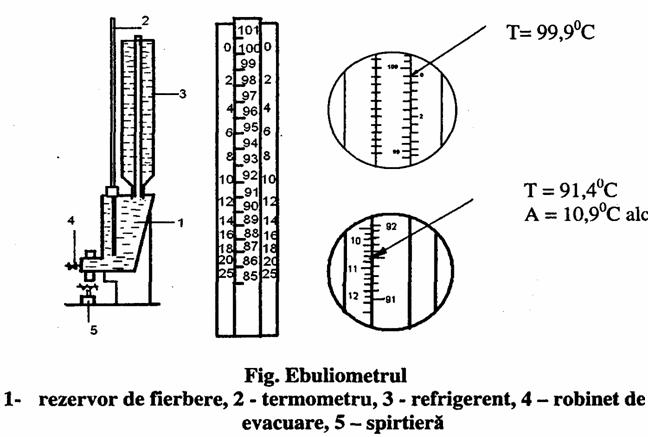
Descrierea aparatului.
Ebuliometrul este format din
- rezervor pentru fierbere de circa 90 ml, prevazut cu refrigerent ascendent, termosifon cu robinet de evacuare;
termometrul special, gradat in zecimi de grad intre 86°C si 120°C;
lampa de incalzire cu spirt;
disc special de calcul (corespondenta), care prezinta o scara alcoolmetrica exterioara si un cerc mobil cu gradatii termometrice (scara temperaturilor), in loc de disc se poate folosi o rigla speciala cu rigleta glisanta, construita dupa principiul discului.
Mod de lucru
Modul de lucru cuprinde:
stabilirea punctului de fierbere al apei
starea punctului de fierbere al vinului
calculul concentratie alcoolice.
a.) Stabilirea punctului de fierbere al apei
in rezervorul curat al aparatului, spalat in prealabil de doua ori cu apa distilata, se toarna 20 ml apa distilata.
Se adapteaza termometrul si refrigerentul (mantaua de racire a refrigerentului, fiind goala, fara apa) si se incalzeste termosifonul pana Ia fierberea apei in rezervor.
incalzirea se regleaza astfel incat vaporii de apa sa iasa din refrigerent dupa l-5 min si, din acest moment, se observa coloana de mercur.
Se citeste punctul de fierbere al apei, cand apar vaporii si coloana de mercur ramane stationara cel putin 2 min.
b) Stabilirea punctului de fierbere al vinului.
Rezervorul aparatului se clateste de doua ori cu cate 20-30 ml din vinul de analizat si se sterge bine.
Se introduc apoi in rezervor 50 ml vin, se monteaza refrigerentul (cu apa in mantaua de racire) si se adapteaza termometrul.
Se incalzeste termosifonul si se urmareste ascensiunea coloanei de mercur pana devine stationara, timp de 1 - 2 min.
Temperatura de fierbere a vinului se noteaza in grade si zecimi de grad.
c) Calculul concentratiei alcoolice.
Se fixeaza discul mobil astfel incat diviziunea corespunzatoare punctului de fierbere al apei sa corespunda punctului zero de pe scara alcoolmetrica.
Concentratia alcoolica (gradul alcoolic) se stabileste citind diviziunea de pe scara alcoolmetrica care coincide cu diviziunea corespunzatoare punctului de fierbere a vinului.
Reguli pentru folosirea ebuliometrului.
- Metoda se foloseste numai la vinurile seci, cu un extract sub 30 g/1. Vinul trebuie sa fie sanatos si limpede.
Nu se aplica la vinurile dulci, tulburi, otetite, cu aciditate volatila mai mare de 1,2 g/1 acid acetic.
- Ebuliometrele trebuie verificate periodic de catre laboratoarele de metrologie, autorizate in acest scop, care elibereaza buletinul de verificare a aparatului.
Termometrele ebuliometrelor trebuie mentinute curate prin spalare periodica, inainte de fiecare determinare se observa coloana mercur, care nu trebuie sa fie intrerupta.
Punctul de fierbere al apei nu trebuie stabilit pentru fiecare determinare; el se determina de 2-3 ori/zi in raport cu variatia presiunii atmosferice.
Metoda are o eroare de +0,1, pana la 0,3% volume alcool/litru.
Copyright © 2025 - Toate drepturile rezervate