 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
Peter C. Heinrich, Iris Behrmann, Serge Haan, Heike M. Hermanns, Gerhard Muller-Newen si Ferd Schaper; "Review Article. Principles of Interleukin (IL)-6-type Cytokine Signaling and its Regulation", Biochem. J. (2003) 374, 1-20
Principiile semnalizarii citochinelor interleucine (IL) de tip 6 si reglarea acestora
Rezumat
Citochinele interleucine IL de tip 6 IL-6, IL-11, LIF (factorul inhibitor leucenic), OSM (oncostatin M), factorul neurotropic ciliar, citochinele de tip cardiotropin-1 si se tip cardiotropin reprezinta o familie importanta a mediatorilor implicate in reglarea rasunsului in faza acuta la leziuni si infectii. In afara de functiile acestora in inflamatii si raspunsul imun, aceste citochine joaca un rol foarte important in hematopoeza, regenerarea ficatului si neuronala, dezvoltarea embrionala si fertilitate. O reglare proasta a semnalului citochinelor de tip IL-6 contribuie la instalarea si dezvoltarea catorva boli, ca artrita reumatoida, boala inflamatorie a intestinului, oseoporoza, screloza multipla si diversele tipuri de cancer (spre exemplu, mielomul multiplu si cancerul de prostate). Citochinele de tip IL-6 isi exercita actiunea prin semnalul transductorilor gp (glicoproteici) 130, receptorilor LIF, iar receptorul OSM ducand la activarea actiunilor JAK/STAT (Janus chinaza / semnal la transductor si activarea transciptiei) si MAPK (chinaza proteica activate prin mitogeneza).
In acest articol se pune accentul pe progresul recent in intelegerea mecanismelor moleculare ale transductiei semnalului citochinelor de tip IL-6. Atentia este indreptata asupra etapei de terminatie si modelare caii semnalului JAK/STAT mediate prin fosfatazele tirozinice, inhibitorii de feedback SOCS (supresor al semnalului citochinic) si proteinele PIAS (inhibitor proteic al STAT activat). De asemenea, se face o analiza a caii JAK/STAT in comparatie cu alte secvente de semnalizare.
Cuvinte cheie:
Semnalul citochinic, interleuchin-6 (IL-6) glicoproteinic 130 (gp 130), Janus chinaza (JAK), protein chinaza mitogen-activata (MAPK), transductor de semnal si activator al transcriptiei (STAT).
Introducere
Familia de citochine de tip IL (interleucine)-6 cuprinde IL-6, IL-11, LIF (factorul de inhibare leucemic), OSM (oncostatin M), CNTF (factorul neurotrofic ciliar), CT-1 (cardiotropina-1) si CLC (citochina de tip cardiotropina). Acestea activeaza genele ttinta implicate in diferentiarea, supravietuirea, apoptoza si proliferare. Membrii acestei famili citochinice au proprietati pro-, cat si anti-inflamatorii si sunt niste factori importanti in hematopoeza, cat si in raspunsurile in faza acuta si imune ale organismului. Citochinele de til IL-6 se leaga de complexele de receptori din membrama plasmei care contin lantul comun gp 130 (glicoproteina 130) din receptorul de transducere a semnalului. Transductia semnalului implica activarea membrilor familiei cineaza tirozina JAK (chineaza Janus), ducand la activarea factorilor de transcriptie ai familiei STAT (transductori ai semnalului si activatori ai transcriptiei). O alta cale importanta de semnalizare pentru citochinele de tip IL-6 este secventa MAPK (chineaza proteica activata mitogenic) din figura 1.
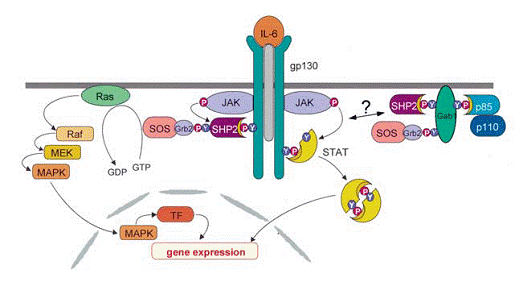
Figura 1. IL-6 activeaza calea JAK/STAT si secventa MAPK
Recent, s-au publicat articole asupra subiectului transducerii semnalului prin calea JAK/STAT. Atentia in acest articol este indreptata asupra progreselor realizate pe parcursul ultimilor 5 ani cu privire la aspectele structurale/functionale ale activarii receptorilor citochinici de tip IL-6, interactiunilor JAK-receptori, activarii STAT, modularea semnalului si, in special, asupra mecanismului de reglare negativa din domeniul semalizarii citochinelor de tip IL-6. In contrast cu articolul precedent, nu facem referire la numeroasele studii in care se aplica tintirea genelor la soareci. In schimb, se pune accentul asupra asepctelor necanistice ale semnalizarii citochinice de tip IL-6.
Mecanisme generale
Complexele receptoare formate de citochinele de tip IL-6: gp 130 joaca rolul cel mai important
Receptorii implicati in recunoasterea citochinelor de tip IL-6 pot fi impartiti in a-receptori nesemnalizanti (IL-6Ra, IL-11Ra si CNTFRa, unde R se semnifica receptor) si receptori de transducere a semnalului (gp130, LIFR si OSMR). Cei din urma se asociaza cu JAK si devin tirozin fosforilate in raspuns la stimularea citochinelor. Fiecare dintre citochinele de tip IL-6 sunt careacterizate printr-un anumit profil al recrutarii receptorilor care, in toate cazurile, implica cel putin o molecula de gp130.
IL-6, IL-11 si CNTF se leaga mai intai in mod specific de subunitatile receptorilor a corespunzatoare. Aici, doar complexul de citochina si receptor a recruteaza in mod eficient subunitatile receptor care semnalizeaza. De asemenea, s-a postulat o subunitate a receptorului a pentru CT-1, dar din moment ce proteina receptorului putativ nu s-a clonat deocamdata, existenta acestuia ridica semne de intrebare. IL-6 si IL-11sunt singurele citochine se tip IL-6 care semnalizeaza prin homodimerii gp130. Celelalte citochine de tip IL-6 semnalozeaza prin heterodimerii gp130 sau cei ai OSMR (OSM). OSM uman prezinta o capacitate exceptionala de a recruta doua complexe receptoare diferite. Acesta formeaza heterodimeri atat LIFR-gp130, cat si OSMR-gp130. LIF si OSM isi implica in mod direct subunitatile receptoare de semnal fara sa fie necesare alte unitati a-receptoare (a se vedea figura 2).
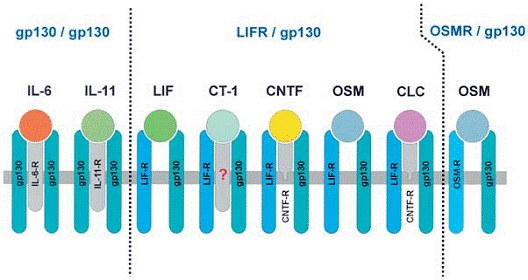
Figura 2. Complexele receptoare ale citochinelor de tip IL-6
Desi expresia gp130 este nesigura, numarul de celule care raspund unei anumite citochinede de tip IL-6 este limitat, din moment ce expresia altor subunitati receptoare, in special cele ale receptorilor a este mai restrictiva su mai regulata. Functia receptorilor a de a face ca celulele sa fie sensibile la citochina respecitva este totusi surclasata de forma solubila a receptorilor a fara transmembrana si a partilor citoplasmatice. Aceasta este una dintre rarele situantii in care un complex format din citochina si receptor solubil poate actiona in mod agonistic, ci nu antagonistic. Formele solubile ale receptorilor citochinici in vivo sunt formate fie prin proteoliza limitata a receptorilor legati de membrana sau prin translatia de la un mARN scindat. In cazul IL-6, scenariul este mai complex din moment ce formele solubile pentru IL-6Ra (sIL-6Ra) si gp130 (sgp130) sunt ambele prezente in serul uman. S- demonstrat faptul ca sIL-6Ra activeaza activitatea antagonistica a sgp130. prin urmare, combinatia care are loc in mod natural intre sIL-6Ra si sgp130 poate actiona ca un fel de tampon pentru a modula sistematic raspunsurile la IL-6 circulant.
Desi partea citoplasmatica a IL-6Ra este dispensabila pentru functionarea receptorului complex si transductia semnalului, recent, acestei portiuni a proteinei i s-a atribuit o functie: aceata contine o secventa pe baza de tirozina, de tip dileucina care realizeaza trierea directa a Il-6Ra in membrana baso-laterala a celulelor polarizate. In mod similar, tintirea fragmentului gp130 din membrana bazo-laterala depinde de secventa de treiere cuprinsa in partea citoplasmatica. In anumite tipuri de celule, s-a observat o localizare a gp130 in microdomeniile membranei plasmatice, ca bistraturile lipidice si caveoline. Aceasta poate fi o pemisa obligatorie pentru functiile speciale de semnalizare ale receptorului.
Pentru citochina asemanatoare cardiotrofinei (CLC), citochinele de tip IL-6 descoperite cel mai recent, s-a descris un mecanism foarte special de secretie si recrutare a receptorilor. Pentru a fi secretat, CLC trebuie sa fie co-exprimate fie cu CLF-1 (factorul -1 asamanator citochinelor), fie cu CNTFRa. CLF-1 se aseamana cu un receptor citochinic solubil si se leaga in mod specific de CLC. Dupa secretia complexelor CLC-CLF-1 sau a CLC-CNTFRa, semnalizarea depinde de CNTFRa si are loc prin heterodimerii gp130-LIFR.
KSHV-IL-6 (virusul herpes IL-6 asociat cu sarcoma Kaposi) si radinovirusul macaque Rhesus IL-6 sunt variantele virale ale citochinelor de tip Il-6 care prezinta o similaritate scazuta cu Il-6 si sunt semnalizate de recrutarea gp130. in mod interesant, KSHV-IL-6 se leaga de homodimerul gp130 in absenta oricarul receptor a, dar cu o afinitate mai scazuta in comparatie cu complexele ternare IL-6-IL-6Ra-gp130.
Structura si functia citochinelor de tip IL-6 si receptorii acestora: elicele-a si segmentele-b
Citochinele de tip IL-6 formeaza o subfamilie de citochine cu elice impachetate. Toate citochinele de tip IL-6 cuprind patru elice-a notate A, B, C si D care sunt aranjate in asa fel incat sa formeze o topologie sus-sus-jos-jos (figura 3). Spre deosebire de IL-11 unde toate elicele sunt drepte, elicea A a LIF, OSM si CNTF sunt sub forma de bucla. Aceasta divergenta structurala poate determina diferentele in mecanismele de recrutare a receptorilor deoarece citochinele drepte semnalizeaza prin homodimerii gp130, iar citochinel rotunde semnalizeaza prin heterodimeri LIFR-gp130 sau OSMR-gp130.
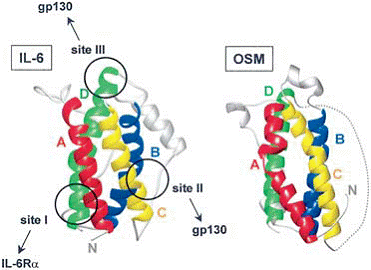
Figura 3. Structurile IL-6 si OSM
Cele patru elice lungi A, B, C si D sunt evidentiate prin culori diferite. Siturile de legare a receptorilor I, II si III ale Il-6 sunt indicate prin cercuri (numerele asocitate pentru IL-6 si OSM sunt 1IL6 si 1EVS).
Ectodomeniile receptorilor implicati in semnalizarea citochinelor de tip IL-6 cuprind un ansamblu de domenii de tip FNII (fibronectina de tip III) si Ig (figura 4). Fiecare receptor contine cel putin un modul de legare a citochinelor (CBM) care cuprinde doua domenii FNIII. Un CBM este descris prin caracteristici structurale conservate, ca spre exemplu un model distinct al reziduurilor cisteina din domeniul terminal N si un motiv WSXWS in domeniul terminal C. In fiecare receptor, un domeniul asemanator Ig este localizat N termninal in memebrana proximal CBM. Spre deosebire cu receptorii-a, receptorii care initiaza transductia semnalului au inca trei domenii FNII in proximitatea membranei.
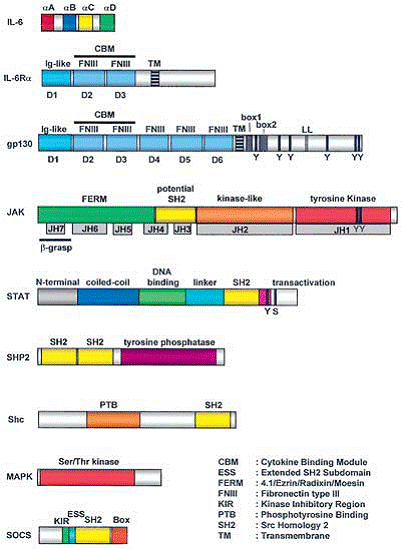
Figura 4. Organizarea structurala a diferitelor componente de semnalizare a citochinelor de tip IL-6.
Sunt indicate reziduurile tirozina (Y) si serina (S) fosforilate din proteinele componente ale gp130, JAK si STAT. Pentru gp130 sunt puse in evidenta regiunile box1 si box 2, ca se asemenea si motivul dileucina (LL, Leu786-Leu787). JH si JAK sunt domenii omoloage.
Prin studii de mutageneza s-a identificat diferitele zone de pe suprafata citochinelor (denumite situri) care internactioneaza in mod specific cu receptorii. Comun tuturor citochinelor de tip IL-6 este situl II care interactioneaza cu CBM din gp130. Al doilea receptor de semnalizare, care este fie un al doilea gp130 sau LIFR sau OSMR, este recrutat la situl III. Prin urmare, situl III este recunoscut de domniul asemanator Ig al gp130, LIFR sau OSMR. In acest homodimer, doua epitopuri diferite ale gp 130 sunt implicate in recunoasterea liganzilor. Atunci cand in complexul de receptori este implicat un receptor a non-semnalizant, acesta se leaga cu situl CBM de situl I. Interactiunea siturilor presupusa prin studiile de mutageneza a fost confirmata prin studirea cu ajutorul razelor X a structurii KSHV-IL-6 legate de un fragment solubil al gp130 care cuprinde CBM si domeniul asemanator IL-6. In figura urmatoare (figura 5) este prezentat modelul hexameric al complexului Il-6-sIL-6Ra-sgp130(D1-D3).
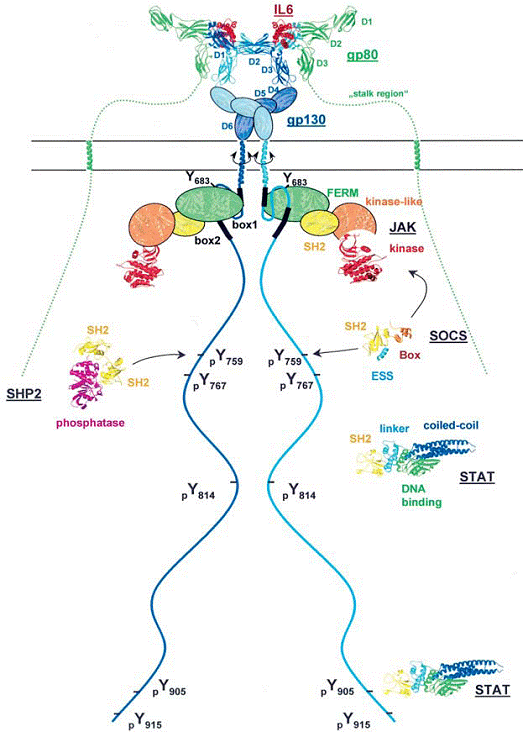
Figura 5. Modelul structual al complexului semanlizant al receptorului IL-6
Sunt reprezentate structurile vIL-6/gp130, gp80, STAT3 si SHP2 (numerele asociate prin Brookhaven Databank sunt 1I1R, 1N26, 1BG1 si 2SHP respectively), ca de asemenea si modelel moleculare ale domeniului chinazei JAK2 si SOCS1 (aminoacizii 65-212). In partea extracelulara, Il-6 este reprezentat prin culoarea rosie, Il-6Rα in verde si cele doua molecule gp130 ale homodimerului in cian si albastru. Domeniile D4-D6 din gp130, ca de asemenea si FERM, SH2 si domeniile asemenea chinazelor din JAKs sunt reperzentate drept ovaluri colorate cu domensiunile corespunzatoare domeniilor tenascinei FNIII, moesinei FERM, SH2 si receptorului insulin chinazei. Partile citoplasmatice ale gp130 si gp80, ca si regiunea extracelulara nestructurala a regiunii gp80, sunt reprezentate prin linii albastre si verzi cu lungimile corespunzatoare polipeptidelor nestructurale. Sunt indicate si pozitiile celor sase reziduuri tirozina din gp130, iar regiunile box1 si box2 sunt desenate drept linii negre. Proteinele asociate citoplasmatic sunt reprezentate in aceleasi culori corespunzatoare figurii 3. In cazul STATs nu sunt reprezentate domeniul N-terminal, cat si domeniul de transactivare C-terminal. Reorientarea regiunii transmembranare in functie de legarea liganzilor este indicata prin sageti circulare.
Legarea citochinelor de tip IL-6 de receptori duce la interiorizare rapida a ligandului. Pana in prezent, nu s-au identificat semnale de interiorizare a receptorilor a. Prin urmare, interiorizarea este mediata de subunitatile de transductie a receptorilor. Intr-adevar, in motivele gp130 si LIFR asemenea dileucinelor s-a identifiat necesitatea interiorizarii liganzilor mediati de receptori. Interiorizarea gp130 pare a fi independenta de legarea liganzilor si est emodulata de fosforilarea Ser782 care este localizata adiacent de motivul dileucina.
Domeniile FNIII din apropierea menebranei sunt necesare pentru cuplarea liganzilor si transductia semnalului. Acest lucru s-a constata cand s-a realizat taierea acestor domenii, determinandu-se semnalizarea receptorilor incompetenti. Prin studii de raze X s-a determinat faptul ca distanta intre partea C-terminala a CBM-urilor din homodimenul gp130 este de circa 9 nm. Domeniile FNIII din apropierea membranei pot acoperi aceasta distanta, astfel incat partile citoplasmatice sunt indeajuns d eapropiate pentru a se putea activa prin asocierea JAK-urilor (figura 5).
Spre deosebire de alti receptori, o activare eficicienta a gp130 nu se poate realiza doar cu un singur anticorp, ci este necesara actiunea a doi anticorpi monoclonali diferiti. Cerinta minima pentru activarea receptorilor este un anticorp intactsi un fragment antigenic de legare (Fab) al celui de al doilea anticorp. Acest lucru s-a interpretat prin faptul ca anticorpul bivalent intact forteaza dimerizarea receptorului si Fab monovlaent ajusteaza conformarea necesare pentru activarea JAK si semnalizarea.
In cazul unor receptori, inclusiv receptorii citochinici, liganzii nu induc in mod activ dimerizarea, dar stabilizeaza un complex receptor preformat si initiaza activarea receptorului printr-o inductie aditionala a sarcinii.
Pentru a transfera informatia intr-o conformatie cu liganzi ajustati de la exteriorul in interiorul celulei, se presupune ca domeniul transmembranar al receotorilor citochinici adopta o structura rigida. Intr-adevar, in urma unor studii recente s-a sugerat faptul ca regiunile transmembranare si intracelulare din apropierea membranei ale receptorilor citochinici adopta o conformatie de elice a
Interactia receptor-JAK
Citochinele de tip IL-6 induc in mod rapid activarea tirozin chinazelor din familia JAK. Lanturile de transductie a smenalului gp130, LIFR si OSMR se leaga de JAK1, JAK2 si TYK2. Dintre acestea, JAK1 joaca un rol esential deoarece in cazul in care lipsesc celuel din JAK1 IL-6, transductia semnalului este foarte mult inrautatia.
Interactia intre gp130 si JAK1 este foarte stransa si rezistenta. JAK1 nu difuzeaza ca o proteina citoplasmatica tipica. In schimb, mobilitatea sa este de aproximativ 100 de ori mai mica si similara cu cea a proteinei transmembranare gp130. in mod interesant, imobilizarea gp130 de catre anticorpi duce la o imobilizare concomitenta a JAK1, indicand faptul ca nu este un shcimb rapid al JAK1 intre diferitii receptori.
JAK se leaga de regiunea din apropierea membranei receptorilor citochinici care contine asa-numitele motive box1 si box2. Stergerea box1 bogat in prolina sau mutatia unor reziduuri prolinice foarte importante din box1 anuleaza legarea receptorului din JAK de gp130, OSMR sau LIFR. Box2 din gp130 este o secventa dominata de aminoacizii hidrofobici, urmati de cei incarcati si contibuie la legarea JAK, crescandu-i acestui aafinitatea.
In contrast cu caracterul modular al motivelor de recrutare STAT, regiunea de recturare a JAK isi pierde functionalitatea la transferul sin lantul receptor al citochinei. Acest lucru poate pune in evidenta posibilitatea ca apropierea de membrana sa fie foarte importanta pentru ca interactia receptor-JAK sa aibe loc. Totusi, nu se paote exclude faptul ca integritatea structurala a interfetei de interactiune a JAK din interiorul receptorului sa depinda de secventele N-terminale adiacente.
Structura generala a JAK este prezentata in figura 4. domeniul C-terminal tirozin chinaza este precesat de un domeniu preudochinazic, fara activitate catalitica, dar care regleaza activitatea domeniului chinazic. JAK contin un domeniu SH2 (Src omolog 2).
Regiunea N-terminala a JAK cuprinde un domeniu FERM (patru-punct-unu, eozin, radixin si moezin), foarte important pentru asocierea receptorului. Acest doemniu are o structura compacta, sub forma ce trifoi.
Desi activitatea cataliztica a JAK est dispensabila pentru recrutarea receptorilor, alterarea structurii domeniuluii chinazic al JAK3 de catre inhibitorul chianza staurisporina scade abilitatea de legare. Aceasta indica o interactie posibila intre domeniul chinaza si domeniul FERM.
In afara de transductia semnalului, JAK sunt importanti pentru reglarea experesiei suprafetei in celputin cativa receptori citochinici.
Coexpresia JAK1, JAK2 si TYK2 imbunatateste in mod substantial expresia surpafetei OSMR uman. In timp ce activitatea chinazei este dispensabila pentru acest estect, asocierea JAK -urilor la regiunea box1/box2 duce la mascarea unui semnal negativ de reglare, posibil un semnal de retentie/revenire a reticulului endoplasmatic. Acest efect este de asemenea observat in celule cu nivele endogene de expresi ale OSMR si JAK: celulelor umane fibrosarcoma carora le lipseste Jak1 exprima mai putin OSMR la surpafata lor in comparatie cu celulele parinte, dar transferul de JAK1 poate creste din nou cantitatea de receptori exprimati la surpafata.
In mod similar, JAK2 joaca un rol foarte important pentru expresia suprafetei EpoR. In acest caz s-a emis ipoteza conform careia JAK2 suporta impaturirea corespunzatoare a receptorului.
TYK2 este important pentru expresia suprafetei lantului IFNa receptor 1. De asemenea, s-a constata recent faptulca TYK2 previne interiorizarea receptorului. Prin urmare, mecanismele prin care JAK-urile sunt implicate in reglarea expresiei suprafetei difera in functe de sistemele receptoare.
Factorii de transcriptie STAT
In urma unor stucii extinse s-a constata rolul cental al STAT in semnalizarea citochinelor de tip IL-6. Familia STAT a factorilor de transcriptie cuprinde sapte membrii mamiferi, desemnati STAT1, -2, -3, -4, -5a, -5b si -6. Structura domeniului proteinelor STAT cuprinde de la N la C-terminali un domeniu de oligomerizare, asa-numitul domeniul infasurat-infasurare, domeniul de legare a ADN, domeniul de legatura, domeniul SH2 si domeniul de transactivare (figura 4). O denominalizare alternativa a domeniului infasurat-infasurare, domeniului de legare a ADN si domeniul de legaturaeste manunchiul 4-elice, b-tambur si, respectiv, domeniul conector. Aceste detalii sunt derivate din structurile cristaline solvate partial ale STAT4, ca de asmeenea si STAT1 si STAT3.
Activarea membrilor familiei STAT necesita asocierea receptorilor citochinici STAT. In modelul clasic se descrie recrutarea proteinelor STAT monomerice la receptorii activati, dar sunt dovezi in favoarea existentei unor factori STAT preasociati in complexe cu mase moleuculare mari inainte de stimulare. Desi numele exact si rolul acestor complexe nu este inca stabilit si prezenta acestora nu exclude recrutarea factorilor STAT intr-o stare monomerica, totusi existanta acestora sugereaza faptul ca activarea STAT este mai complexa decat s-a presupus.
Toate citochinele de tip IL-6 activeaza STAT3 si, intr-o masura mai mica, si STAT1 prin unitatea receptor comuna gp130. in cazurile LIFR si OSMR, STAT3, STAT1 si STAT5 este activata o activare cu OSMR fiind cel mai potent activator al STAT5. aceasta activare nu poate necesita fosforilare tirozinei receptorului, dar rezulta dintr-o interactiune directa a STAT5 cu JAK-urile. Pentru activarea STAT5 mediata de OSMR s-au observat ambele mecanisme. Recrutarea STAT-urilor la receptorii activati este medaita de domeniul SH2 al acestora si necesita fosforilare motivelor tirozina a receptorilor.
Pe langa fosforilarea tirozinei s-au observat alte modificari post-translationale care afecteaza functionarea STAT.
Fosforilarea serinei a fost descrisa pentru STAT1, -3, -5a si -5b. Situl fosforilarea serinei in STAT1 si STAT3 a fost identificat drept Ser727.
In majoritatea studiilor s-au folosit inhibitori cu masa moleculara mica, ca chinazele dominant negative, pentru a se identifica chinazele serin/treonina. In functie de sistemul experimental, adica de tipul celulelor si de citochina / factor de crestere investigate, s-a demonstrat implicarea PKCδ, p38 MAPK, MEKK1 (MAPK/ERK chinaz-chinaza 1), ERK, JNK (c-Jun N-terminal chinaza) si chinaza Ca2+/calmodul independenta.
O alta modificare post-translationala care joaca un rol importanta in functionarea STAT este metilare Arg31 din STAT1 de catre PRMT-1 (protein arginin metiltransferaza-1).
Metilarea STAT1 este observata in absenta stimularii citochinei, independent de fosforilarea tirozinei sau serinei, dar necesita un domeniul STAT1 SH2 intact. In comparative cu proteina nemetilata, STAT1 metliat are o tendinta mai mare pentru a se asocia cu AND, din moment ce interactia cu PIAS (inhibotir proteic activate de STAT) 1 este mai slaba. Arg31 este conservat in toate STAT-urile.
In urma mai multor studii s-a constatat faptul ca fosforilarea tirozinei STAT-urilor rezulta in dimerizare si translocare nulceara. Dfosforilarea STAT din nucleu duce la exportul din nucleu. Astfel s-a stability o evacaure continua nucleocitoplasmatica a proteinelor STAT care este independanta de stimularea extracelulara si fosforilare. Gasirea proteinelor STAT nefosfrilate in nucleu pune in evidenta rolul bine-stabilit al STAT-urilor nefosfrilate drept coacivatori transcriptionali. Semnalurile de localizare nucleara (NLS-uri) pentru aceasta evacuare independenta de fosfrilare sunt diferite de cele pentru acumularea nucleara indusa de fosfrilare, dar nu au fost inca identificate. Alte dovezi sugereaza faptul ca o evacuare mucleocitoplasmatica continua a proteinelor STAT chiar si dupa stimulare si acumulare nucleara.
Dimerizarea receptorilor citochinici de tip IL-6 duce la activarea caii de semnalizare JAK/STAT si la inductia cascadei MARK. O analiza initiala cu privire la activarea mediate de gp130 si LIFR a MAPK a dus la identificarea sitului de legare SHP2 (domeniul SH2 ce contine tirozina fosforilata) Tyr759 sin gp130 si Tyr974 a LIFR, foarte importante pentru activarea cascadei MAPK. Spre deosebire cu gp130 si LIFR, OSMR nu recruteaza SHP2. OSMR poate induce activarea caii Ras-Raf-MAPK. S-a demonstrat faptul ca proteina activatoare Shc (proteina SH2 si domeniul ce contine proteina collagen-omoloaga, figura 4) este recrutata cu receptorul prin Tyr861 in regiunea citoplasmatica a PSMR (figura 6).
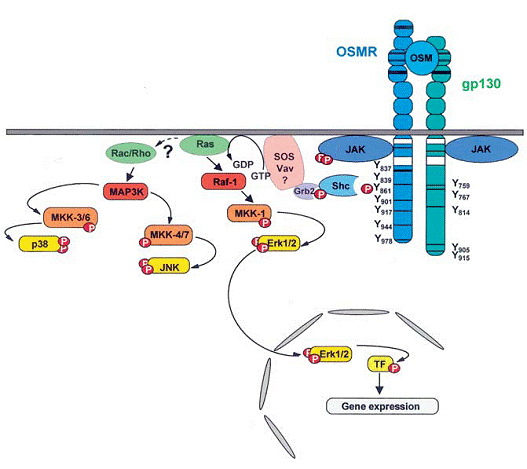
Figura 6. Activarea cascadei MAPK prin receptorul OSM. Activarea mediata de PSMR din calea MAPK prn moleculra adaptatoare Shc. Tf - factor de transcriptie
Conform cu conceptul actual privind activarea dependenta de SHP2 a MAPK adoptat din transductia semnalului EGF si PDGF (factorul de crestere derivat trombocit), SHP2 leaga complexul Grb2-SOS (factor de crestere - receptor - proteina legata / Son of Sevenless) si/sau Gab1 (Grb2 - ligand asociat - 1) la gp130. SHP2 este recrutt in mod rapid la tirozina fosforilata a gp130 si devine fosfrilat intr-o maniera dependenta JAK-1. Apoi, SHP2 tirozin-fosforilat interactioneaza cu Grab2. Se crede ca doua reziduuri tirozina C-terminale din SHP2 (Tyr542 si Tyr580) interactioneaza cu complexul Grb2-SOS. O cale alternativa mediata de Shc, mediata de Osm implica proteina adaptatoare GrG2 care este recrutata de Shc Tyr317-fosforilat. In final, recrutarea SOS la complexul receptor din membrana permite activarea ras ca, in schimb, duce la activarea cascadei Ras-Raf-MAPK. Prin urmare, PSMR, spre deosebire de gp130 sau LIFR, foloseste calea Shc-Grb2-SOS pentru activarea MAPK-urilor.
Un alt grad de complexitate este dat de faptul ca Gab1 este de asemenea implicat in activarea cascadei Ras-Raf-MAPK. Gab1 este o proteina adaptoare esafod care este tintita prin domeniul PH la menbrana plasmatica. Mai mult, contine siturile de legare pentru Grb2, SHP2, PI3K, Crk, Cg fosfolipaza si receptorul c-Met. In raspuns la IL-6, Gab2 este tirozin-fosforilat si interactioneaza in mod subsecvent cu SHP1 si PI3K. In mod interesant, nu este necesata nici o interactie a Gab1 si gp130 pentru fosforilarea tirozinica. Totusi, mutatia Tyr759, situl de recrutare a SHP2 din gp130, scade interactiunea Gab1 cu SHP2 si PI3K, sugerand faptul ca legarea SHP2 la gp130 si fisforilarea ulterioara este o cerinta pentru interactiuena cu Gab1. In final, asocierea indusa de IL-6 a Gab1 cu SHP2 duce la activarea ERK2. Precum se poate estima, fibroblastele deficiente in Gab-1 prezinta o activitate MAPK redusa considerabil in raspuns la IL-6.
Desi Gab1 integreaza cateva cai de transductie a semnalului, translocarea SHP2 la membrana, in vecinatatea Ras ancorat de membrana, pare a fi suficienta pentru a media activarea ERK din moment ce expresia unei proteine de fuziune corespunde domeniului PH al Gab1 si SHP2 activ induce o activare MEK1 (MAPK/ERK chinaza) si ERK2 constitutiva. Duoa stimularea EGF, SHP2 aociat cu Gab1 regleaza si contra-ataca legatura PI3K de Gab1.
Citochinele de tip IL-6 pot due la activarea a inca unei alte cascade de semnalizare care implica PI3K. Aceasta enzima modifica anumite fosfatidilinositide, astfel incat proteina serin/tirozin chinaza B/Akt este recrutata in membrana plasmei, unde se activeaza prin fosforilarea prin PDK1 (chinaz-1 fosfoinositid-dependent).
Mecanismele terminarii semnalului
Pentru a preveni o suprastimulare, au loc mecanisme de oprire a transductiei semnalului mediata de citochina.
Un eveniment foarte important in transductia semnalului citochinelor de tip IL-6 este fosforilarea componentelor cascadei de transductie a semnalului. Prin urmare, pe langa de chinaza, fosfatazele sunt de asemenea implicate in transmisia corespunzatoare a semnalului. Prima dovada a contributiei fosfatzei in semnalizarea IL-6 s-a gasit prin determinarea faptului ca PTP SHP2 este recrutat la Tyr759 citoplasmatic a gp130 activat.
SHP2 este un PTP citoplasmatic care contine doua domenii SH2 N-terminale si un domeniu fosfataza catalitic in jumatatea C-terminala a proteinei (a se vedea figura 4). Structura cristalina a SHP2 sugereaza faptul ca, in absenta partenerului de legare a tirozinei fosforilate, doeniul SH2 N-terminal acopera situl activ si inhiba activitatea enzimatica. Legarea domeniului SH2 de motivele fosfotirozinice ale receptorilor sau adaptatorilor dezpcheteaza proteina, ducand la activitate enziamtica. SHP2 se activeaza de fosforilarea reziduurilor tirozinici 542 sau 580 din partea C-terminala a enzimei. In mod succesiv, aceste fosfotiirozine interactioneaza cu domeniul SH2 N- si C-terminal, punand in evidenta domeniul PTP prin inhibarea mediata de domeniul SH5 N-terminal (figura 7).
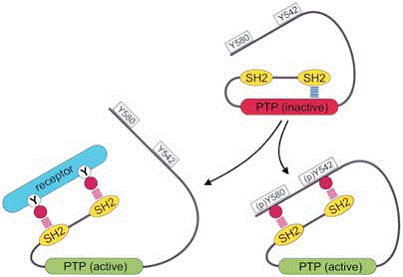
Figura 7. Reglarea SHP2
In starea inactiva, domeniul SH2 N-terminal al SHP2 impiedica steric accesul substraturilor fosfotirozinice la domeniul PTP si blocheaza activitatea PTPazei. Legarea de domeniul SH2 N- sau C-terminal de catre motivele specifice continand fosfotirozina elimina blocajul. Aceste reziduuri fosfotirozinice pot lua parte la un receptor activat sau o coada C-terminala tirozin-fosforilata a SHP2.
Tyr759 din gp130 pare a avea functii multivalente pentru semnalizare. Substituirea fenilalanilei impiedica recrutarea si fosforilarea SHP2 si duce la o transductie marita a semnalului pentru IL-6, LIF si OSM. Pe langa SHP2, inhibitorul de feedback SOCS3 contribuie la inhibarea mediata de pTyr759 (a se vedea figura 8). Pe de alta parte, activarea indusa de Il-6 a cascadei MAPK este scazuta de mutatia Tyr759 din gp130, indicand faptul ca SHP2, ca un adaptor, are o functie pozitiva asurpa activarii cascadei MAPK (precum se poate vedea din figura 1). Totusi, SHP2 joaca si un rol negativ de reglare drept o tirozin fosfataza in calea Jak/STAT (precum este indicat in figura 8). Experimentele in vivo au subliniat rezultatele experimentelor in vitro in ceea ce priveste demonstrarea faptului ca expresia la soarece a lipsei Tyr759 din gp130 determina splenomegalie, limfadenopatie si o reactie in faza acuta.
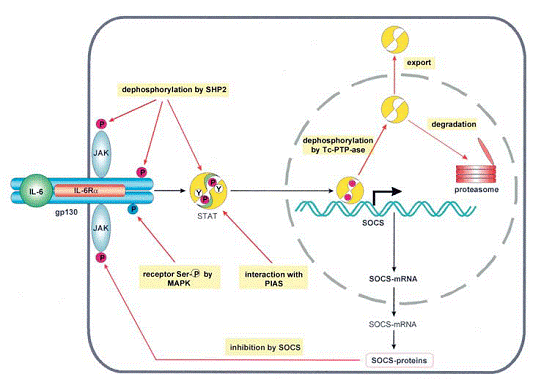
Figura 8. Mecanismele de reglare negativa in semnalizarea citochinelor de tip IL-6
Reprezentarea reglatorilor negativi si siturilor lor de actiune (sageti rosii).
Copyright © 2024 - Toate drepturile rezervate