 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
MEDICINA VETERINARA
DISCIPLINA - BOLI INFECTIOASE
DETECTIA IMUNOENZIMATICA
SI HISTOPATOLOGICA A PROTEINEI PRIONICE
MOTTO:
INVATATURA IL FACE PE
Pana in anul 1985 , cand in Marea Britanie a aparut epidemia de ESB , erau cunoscute doar 6 boli prionice, si anume:
trei la animale, (scrapie, encefalita transmisibila a nurcilor si boala cahectizanta a cervideelor),
trei la om, (boala Creutzfeldt-Jakob, sindromul Gerstmann-Straussler Scheinker si boala Kuru).
La animale se credea ca agentul etiologic, ar fi un virus neindentificat, iar la om se cunostea ca sunt boli cu origine genetica.
Epidemia de ESB din Anglia , dar mai ales
aparitia in
Preocuparea pentru bolile prionice, a depasit interesul comunitatii stiintifice medicale si a intrat in atentia societatii civile, atat datorita problemelor majore de sanatate publica ridicate, cat si datorita implicatiilor acestora in relatiile economice si politice statale si interstatale. Din punct de vedere medical erau informatii insuficiente referitoare la perioada de incubatie a bolii si a originii acesteia.
Lumea stiintifica din domeniul biologiei s-a pus in miscare si au inceput sa apara mai multe informatii despre structura proteinei infectante si modul cum aceasta reuseste sa transforme o proteina normala intr-una patologica.
S-au diversificat si metodele de laborator unele din ele reusind intr-un timp foarte scurt un diagnostic precis care ulterior trebuie confirmat prin alte metode de laborator.
Absenta timp indelungat a oricarui semn clinic si lipsa totala a vreunui raspuns inflamator in maladiile prionice, au constituit dificultati majore in gasirea unor posibitati de diagnostic precoce in stadiul subclinic, astfel creand mari probleme in domeniul sanatatii publice, in domeniul sanatatii animalelor, cu consecinte dezastruoase pentru sectorul economic.
Avand in vedere ca diagnosticul de certitudine al bolilor prionice se stabileste "post mortem", cercetarile ar trebuie indreptate catrea gasirea unei metode de diagnostic usor de aplicat si sigura in timpul vietii animalelor.
Prionii sunt particule proteice infectioase, care nu detin in structura lor acizi nucleici si care produc atat la om cat si la animale asa numitele encefalopatii spongiforme transmisibile. (Gonzalez L. si col.2003)
Declansarea acestor boli non conventionale cu caracter neurodegenerativ, cu evolutie fatala, se datoreaza consumului de furaje contaminete cu prioni. Procesul intim de determinare a aparitiei acestor entitati morbide are lor ca urmare a unor mecanisme de conversie prin care proteina prionica normala PrPcel (proteina normala sintetizata in mod natural la nivel celular) este transformata in PrPres (proteina prionica patologica sau anormala), in cadru unui sistem de tip matrita.
Maladiile prionice reprezinta un grup heterogen de disfunctii neurodegenerative, cunoscute ca encefalopatii spongiforme transmisibile, ce au in comun leziuni cerebrale produse prin degenerescenta vacuolara a neuronilor.
Prionii reprezinta o categorie de agenti infectiosi, considerati un mister din punct de vedere biologic, deoarece in structura lor intra doar o molecula proteica. Fiind lipsiti de genom, difera de toate categoriile de agenti infectiosi cunoscuti pana in prezent, motiv pentru care sunt considerate a fi boli non conventionale.
In incercarea de a descifra cauza care sta la baza aparitiei acestor maladii, au fost formulate mai multe ipoteze:
ipoteza etiologiei virale, este sustinuta pe baza autoreplicarii agentului etiologic si a variabilitatii constante la tulpinile de EST. Aceasta autoreplicare si variabilitate a fost asociata cu prezenta unui acid nucleic. Ipoteza este infirmata prin rezistenta neobisnuita a agentilor EST la actiunea factorilor fizici si chimici care inactiveaza toate virusurile. De asemenea nu a fost identificat un acid nucleic asociat cu infectivitatea, nu exista raspuns imun si reactii inflamatorii din partea gazdei. Nu e vizibil la ME. (Manzat Radu Moga si col.,2005).
ipoteza etiologiei viroizilor. Aceasta ipoteza pare a fi cea mai apropiata de realitate deoarece viroizii sunt considerati agenti infectiosi , subvirali, alcatuiti din ARN liber, lipsiti de capsida. Viroizii sunt sensibili la digestia cu ribonucleaze dar rezistenti la actiunea solventilor organici, a radiatiilor ultraviolete probabil datorita dimensiunilor foarte mici. Totusi prionii sunt de 10 ori mai rezistenti decat viroizii si in plus nu au in structura lor acizi nucleici.( Israil Anca-Michaela,2005
ipoteza etiologiei virino, in care o molecula de acid nucleic care contine informatia biologica, ar fi protejata de o molecula de proteina a gazdei formand impreuna o particula infectioasa capabila de replicare activa. Acest agent are informatie genetica proprie, dar pentru ca este inconjurat de o molecula proteica a gazdei ar explica de ce nu se declanseaza reactii imunologice. Caracterele acestor agenti infectiosi ar explica replicarea, variabilitatea tulpinilor si absenta raspunsului imun al gazdei. Dar in cazul agentului de EST, infectivitatea nu depinde de acidul nucleic care nu a fost izolat ci de proteina gazdei. .( Israil Anca-Michaela,2005, Manzat Radu Moga,2005),
ipoteza cea mai vehiculata si care a revolutionat conceptia despre etiologia EST-urilor, a fost ca agentul infectios al acestor maladii, ar fi o proteina autoreplicabila denumita proteina prionica. Ipoteza a fost formulata in 1982 de catre Stanley Prusiner. (Campeanu Marius Valer,2001)

El denumeste aceasta proteina autoreplicabila, cu termenul de prion, care inseamna "particula proteica infectanta" (proteinaceous infectious particles). Prionii sunt molecule mici de proteina infectanta, rezistenti la majoritatea procedeelor de denaturare a acizilor nucleici.
Una din lacunele acestei ipoteze este faptul ca, nu poate explica cum o molecula proteica poate determina proprietati biologice diferite, precum si diferite forme de EST. Totusi diferitele forme de EST ar fi determinate, de diferite conformatii de glicozilare a proteinei prionice.
In 1985 doi colaboratori a lui PRUSINER, WEISSMAN si CHESEBRO identifica o proteina prionica celulara, proprie gazdei, produsa de celulele neinfectate. Aceasta proteina celulara, s-a dovedit ca are aceeasi structura primara cu particula proteica infectanta, descoperita de Prusiner in 1982 si care de fapt este izoforma proteinei prionice celulare.
Ambele proteine sunt codificate de aceeasi gena, notata cu acronimul PRNP, ce a fost identificata la numeroase specii de vertebrate, (om, oaie, capra, hamster, soarece, sobolan, etc.) cat si la unele nevertebrate, (drosofila). Faptul ca aceasta gena este conservata pe scara filogenetica, sugereaza ca produsul sau de expresie, care contribuie la formarea unei glicoproteine de suprafata, are rol important in organism. Acest rol este inca necunoscut, dar se presupune ca ar interveni in recunoasterea celulara.
Mai exista si alte ipoteze privind rolul proteinei prionice normale. Astfel au fost efectuate numeroase studii pentru stabilirea rolului fiziologic al proteinei la suprafata celulara si s-a constatat ca poate actiona ca un receptor celular, pentru un ligand extracelular care nu a fost inca identificat. (Matthews D,
O alta ipoteza sugereaza ca proteina prionica normala la suprafata celulei, leaga ionii de cupru, fiind implicata in transportul si metabolizarea acestora. Mai are rol in mentinerea somnului si alternanta veghe-somn. Mediaza transmisia sinaptica, are rol trofic pentru celulele cerebeloase Purkinje, carora le asigura longevitate.
Pentru diferentierea celor doua izoforme, s-au propus urmatoarele simboluri:
☻ PrPc ("c" de la cell = celula) - pentru proteina prionica normala denumita si PrPsen (sen = sensibila la proteinaza K);
☻ PrPsc (sc = scrapie) pentru proteina prionica patogena denumita si PrPres (res = rezistenta la proteinaza K).(Manzat Radu Moga si col.,2005)
Se presupune ca, PrPsc ar actiona ca matrice in conversia izoformei PrPcel in PrPsc asociata cu boala.(Allison GG si col.2008).
Astfel, in aceasta viziune proteina prionica se autopropaga, prin contactul cu proteina normala, pe care o determina intr-un anume fel, sa adopte o conformatie diferita, fata de cea initiala, luand forma prionica. Aceste modificari se propaga in lant astfel incat, noile particule infectioase modifica in continuare alte proteine prionice normale cu care vin in contact. S-a demostrat ca in absenta acestei proteine normale, PrPsc este incapabila de a determina aparitia bolii.
Un exemplu ar fi ca, in cursul evolutiei scrapiei, nivelul de ARNm nu a variat deloc in conditiile in care infectivitatea a crescut de la 0 la 100 000 000 unitati infectioase de tesut cerebral.
De asemenea la animalul de experienta (hamster), ARNm a fost totdeauna normal si constant, atat in tesutul cerebral normal, cat si in cel infectat cu agentul prionic al srcapiei. De aici s-a putut trage concluzia ca ARNm celular nu este implicat direct in producerea PrPsc.
La soarecii transgenici, care nu exprima gena PrPc si care au fost inoculati cu agentul prionic, la 2 ani de la inoculare nu au prezentat semne detectabile de boala prionica. Acest aspect este un argument evident pentru a sustine ideea ca, PrPc este unicul component al agentului prionic infectios. (Di Guardo G si col.2008).
In functie de factorul care induce conversia proteinei prionice normale in proteina prionica infectioasa, natura afectiunii poate fi:
▲genetica - mutatii punctiforme ale genei PRNP transmisa autozomal dominant;
▲infectioasa - urmare a consumului alimentelor contaminate; folosirea unor instrumente nesterile; injectarea unor hormoni derivati din hipofiza prelevata de la cadavre;
▲sporadica - mutatie spontana a genei PRNP, care intensifica rata conversiei proteinei prionice, cat si a unor factori necunoscuti.
Conversia formei prionice normale, sensibila la proteinaza K, la o forma rezistenta la proteinaza, care reprezinta marca specifica pentru toate encefalopatiile spongiforme transmisibile, are loc dupa ce proteina prionica a fost ancorata la nivelul membranei celulare. (Muller H. si col.2006)
Studiul prionilor si a bolilor prionice reprezinta o arie noua a investigatiei biomedicale. Prionii reprezinta o mare enigma a biologiei moleculare, deoarece admiterea unor agenti infectiosi lipsiti de acid nucleic si formati exclusiv din proteina, vine in contradictie totala cu dogma centrala a biologiei moleculare, care sustinea existenta exclusiv a agentilor infectiosi, avand in constructia lor acid nucleic si care se multiplica numai prin replicarea acestui acid nucleic din propria lor structura.
Aceasta dogma clasica a biologiei moleculare a fost "daramata" in momentul in care s-a admis si existenta unor agenti prionici infectiosi lipsiti de acid nucleic si formati exclusiv din proteina.
Totodata aceasta proteina infectioasa, lipsita de acid nucleic propriu, se poate codifica si multiplica prin acidul nucleic al celulei gazda. Studiul bolilor prionice, au contribuit la conturarea unui concept nou referitor la ereditate si anume acela de "concept al mostenirii conformationale", pe baza caruia se incearca explicarea aparitiei unui numar tot mai mare de boli de origine neurologica si hematologica. Prionii au devenit in ultimii ani, paradigma patologiei nongenetice.
Procesul care declanseaza boala, este reprezentat, de conversia unei proteine normale, sintetizata in mod normal in creierul tuturor mamiferelor (PrPc), intr-una mutanta, anormala (PrPsc).
Plecand de la acest aspect, se poate specula ideea, conform careia, prin interactiunea proteina - proteina (cu referire si la alte situatii decat cea din bolile prionice ale SNC), organismul ar putea castiga noi trasaturi structurale. Acest fenomen ar putea juca un rol esential in existenta unui principiu fundamental in biologie, principiu al carui rol in sistemele biologice ar putea fi mult mai important decat cel pe care reusim noi astazi sa-l sesizam.
Prionul este o forma alterata a proteinei anormale, care a castigat capacitatea de a converti forma normala a proteinei, intr-o forma anormala infectioasa. Conceptul de prion a capatat in ultimii ani un inteles mult mai larg decat cel de alterare, in care sunt implicate doar o gena si o proteina. Alterarea care are loc in proteina normala, care devine proteina patogena, necesita atat o modificare conformationala, cat si o alterare biochimica (metilare, acetilare, clivare, glicozilare). (Israil Anca-Michaela,2005)
Proteina prionica normala (celulara), este exprimata la nivelul sistemului nervos si periferic, in tesutul limfatic si la nivelul jonctiunilor neuromusculare. Este o proteina situata la suprafata celulei, fiind ancorata de membrana celulara, prin intermediul unei ancore glicolipidice - glicozil - fosfatidil - inozitol - GPI. Aceasta forma de proteina este produsa in creierul tuturor mamiferelor si este inofensiva. Este sensibila la actiunea enzimatica a proteinazelor (proteinaza K).
PrPc este o sialoglicoproteina si are in componenta, o molecula de mucopoliglucid omogena si una de polipeptid. Acizii sialici din sialoproteine au rol important in fixarea si patrunderea particulelor virale, membranele celulare alcatuite din acesti compusi, asigurand o protectie mai buna a celulelor, fata de atacul enzimelor sau a noxelor chimice.(Campeanu Marius Valer,2001).
PrPcel are doua situsuri de glicozilare N-linkate. Zaharurile N-linkate pot proteja zone largi ale suprafetei proteice. Ancora GPI, se pare ca permite proteinei prionice, sa fie mobila in bistratul lipidic al membranei celulare.
Cea mai mare cantitate de PrPcel, se gaseste in sistemul nervos, cantitati moderate in alte tesuturi, inclusiv in sangele periferic, pe membrana celulelor mononucleate ale tuturor liniilor celulare. (Hubert Laude,2006)
PrPcel are un turnover relativ inalt. Molecula de PrPc are aproximativ 250-254 de aminoacizi, in functie de specie, cu o greutate moleculara de 33-35KDa ,cu o structura tridimensionala unica. Proteina prionica normala e sintetizata in reticulul endoplasmatic, pe baza informatiilor genetice continute in gena PRNP, care la mamifere contine 3 exoni si un ORF (open reading frame), iar la om e situat pe bratul scurt al cromozomului 20.
PrPcel devine functional, dupa un numar de fractionari post translationale, de ordin biochimic si conformational, la nivelul aparatului Golgi. Este transportata la suprafata membranei celulare, ca ulterior sa fie metabolizata. Structura primara a PrPcel, e reprezentata de un capat NH2-terminal, o regiune centrala si un capat COOH-terminal. Domeniul NH2-terminal contine 80-90 de aminoacizi, cu un peptid semnal de 22 aminoacizi nepliat (fara structura secundara si tertiara).(Vezi fig.1)
Acest peptid semnal, contine un situs de clivare, unde are loc clivarea moleculei de proteina in momentul maturarii. La nivelul capatului NH2 terminal se gasesc cinci copii (6 copii la bovine), ale unui octapeptid (prolina - histidina - 3glicine - triptofan - glicina - glutamina), care au un grad inalt de conservare in seria animala ceea ce inseamna ca indeplinesc un rol important in functionarea proteinei. La nivelul acestor copii octapeptidice, se gaseste un situs de legare, pentru ionii unor metale, in special pentru ionii de cupru si se presupune ca activitatea proteinei, ar depinde de prezenta acestor ioni. Aceste unitati octapeptidice, reprezentand secventele 51-91, au rol in stabilizarea helixului.(vezi fig.1)(Prusiner SB,2006)
La mijlocul moleculei, exista o secventa hidrofoba, care reactioneaza intens cu lanturile laterale. Exista o punte disulfurica, intre cistinele dintre pozitiile 179-214. Exista doua situsuri de N-glicozilare, la asparaginele 181-197. In cursul procesului de maturare al proteinei, un domeniu hidrofob de la capatul carboxiterminal ( COO-), este indepartat si in locul sau, la nivelul unui rest de serina, se leaga gruparea GPI prin intermediul careia se ancoreaza de membrana celulara.(Nystrom S. Hammarstrom).
A mai fost identificat in structura primara a PrPc, un rest de arginina modificata, la nivelul codonului 25.
Proteina prionica patogena, are aceeasi structura primara cu PrPc, avand aceleasi modificari biochimice, in plus are o modificare la nivelul restului de arginina din pozitia 37.
FIGURA.1 REPREZENTAREA SCHEMATICA A STRUCTURII PRIMARE PrP
Gena PrP
PRNP 254

PrPc
PS CHO CHO
![]()
![]()
![]() NH 25arg TM
NH 25arg TM
GPI

![]()
![]() 51 91 179 214 231
51 91 179 214 231
S-S
PrPs
CHO CHO
![]()
![]()
![]()
![]() PS 25arg 34arg
PS 25arg 34arg
NH TM GPI

51 91 179 214 231
S-S
![]()
![]()
![]()
![]()
![]()
![]()
![]()
 CHO CHO
CHO CHO
71 TM GPI
PrP27-30
SAF
S-S
PS = peptid semnal
S-S = punte disulfurica 179-214
CHO = situsurile de glicozilare 181-197
GPI = ancora glicozil-fosfatidil-inozitolul de la capatul carboxiterminal
TM = domeniul transmembranal cu secventa hidrofoba
51-91 = unitati repetitive octapeptidice
25 si 34 = resturi de arginina modificate
SAF = fibrile asociate scrapiei
Modificarile conformationale, au loc la nivelul structurilor secundare si tertiare. Aceste modificari, presupun replierea proteinei structurale, intr-o anumita configuratie de structura secundara si tertiara de tip alfa helix si beta plieri.( Prusiner S.B., 1998; Prusiner,S.B., 1991).
In aceasta forma PrPc din celula neuronala normala, isi poate pastra viabilitatea si functia normala. Pentru realizarea acestei replieri, este necesara o sursa de energie.
Conform ipotezei lui Prusiner, se admite ca rolul de enzima (sursa de energie) l-ar avea chiar proteina PrPcel, pentru a-si cataliza propria plisare (rol de autofoldaza = proteina chaperone).
Proteinele chaperone (cu rol de enzime), ar declansa reactii enzimatice, prin care s-ar elibera energia necesara pentru realizarea respectivului proces de plisare.
Se cunoaste faptul ca unele proteine au rol de chaperone in declansarea propriei plieri (autofoldaze). PrPcel are in structura sa secundara si tertiara 3 alfa helixuri si 2 beta plieri. Iar PrPsc are 2 alfa helixuri si peste 40% beta plieri.(Vezi fig.2)
Prin metoda de spectroscopie a fost identificata in PrPcel, o predominanta a alfa helixurilor de circa 42% si o cantitate foarte mica sau o absenta totala a beta plierilor in comparatie cu PrPsc unde au fost descrise cantitati mai mici de alfa helixuri aproximativ 30% dar in schimb o cantitate foarte inalta de beta plieri de apozimativ 43%.( Guest si col.2008)
FIGURA.2 MODEL PENTRU STRUCTUTA TERTIARA A PrPc SI PrPsc (PRUSINER)
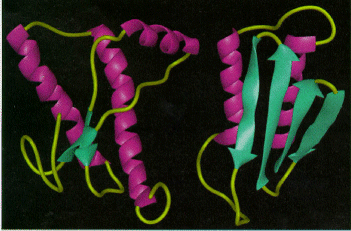
PrPc PrPsc
Cele doua proteine prionice, PrPcel de la animalul neinfectat si PrPsc de la animalul infectat, desi au structuri primare aproape identice (aceleasi secvente de aminoacizi si aceleasi modificari chimice), au structuri secundare si tertiare diferite, ceea ce explica diferentele biochimice, biofizice si functionale intre cele doua proteine, motiv pentru care acestea sunt cunoscute sub numele de "proteine izoforme". Procesul de conversie al PrPcel catre PrPsc este un eveniment post translational, care are loc prin reducerea structurilor alfa helix si cresterea structurilor beta plieri.
PrPcel
este o proteina de membrana celulara, situata pe
suprafata celulei si are o concentratie
Procesul de conversie a PrPcel catre PrPsc, implica probabil atat conversia structurilor helix cat si a altor regiuni catre beta plieri.(Gravenor MB si col.,2003)
Modificarile post translationale ale PrPsc, atrag dupa sine rezistenta marcanta la proteinaza K. Prin tratarea PrPsc cu proteinaza K, se obtin doua lanturi polipeptidice si anume: un miez cu greutate moleculara de 27-30Kda care reprezinta PrP27-30 si poseda intreaga infectivitate si un segment N-terminal format din 70 aminoacizi care nu este implicat in procesul infectios (Muller H. si col.2006),(Vezi FIG.1).
PrP27-30 duce la formarea fibrilelor amiloide SAF, ( fibre asociate cu scrapie) cu grad inalt de infectivitate, la nivel celular si depozite de placi amiloide extra celulare care alaturi de rezistenta la proteinaza K, reprezinta markeri de diagnostic in bolile prionice.( Caughey B, 2006)
Amiloidoza reprezinta o stare de agregare sub forma de bastonase, fibrile si placi, a unei proteine anormale, care apare prin alterarea metabolismului proteic celular.
Cercetarile de biologie moleculara din ultimii ani, au indicat faptul ca, un rol central in patogeneza unor boli neurodegenerative, il ocupa capacitatea celulei neuronale, de a degrada si indeparta o proteina anormala, care se depoziteaza in interiorul si in jurul neuronilor.
Neuronii, neputantu-se multiplica in viata adulta, au nevoie totusi, de o modalitate eficienta de reinnoire, (turn-over) al proteinelor si de indepartare a proteinelor anormale. Acesta activitate, se concentreaza la nivelul formatiunilor lizozomale din celulele neuronale.
In infectiile prionice experimentale pe animale, s-a demostrat, ca proteina prionica anormala, PrPsc, este captata de sistemele lizozomale celulare, printr-un proces de fagocitoza. In cursul acestui proces, se incorporeaza simultan si portiuni din mebrana celulara, (incluzand proteina prionica normala) in endozomi. Cresterea cantitatii de PrPsc, in formatiunile lizozomale, prin acumulare, duce la ruperea membranei lizozomale si la eliberarea unei cantitati de enzime lizozomale hidrolitice, care duc la moartea celulara si la acumularea de PrPsc in spatiul extracelular. Deci lizozomii ar juca rolul unui bioreactor pentru replicarea agentului scrapiei intracelular.
Aparitia maladiilor prionice, depind in mare masura de prezenta agentilor infectiosi reprezentati de prioni, cat si de prezenta proteinei prionice normale, care este sintetizata de gena PRNP.( Gonzalez L si col.2003)
Asa cum s-a enuntat mai sus, in lipsa genei PRNP si implicit a proteinei normale in infectiile experimentale cu PrPsc, s-a constatat ca boala nu se exprima clinic. De aici se poate concluziona, ca gena si proteina prionica normala, au un rol important in aparitia bolilor prionice.
Analizele de genetica moleculara, au scos in evidenta polimorfismul genei PRNP. Se pare ca polimorfismul din pozitia 129, este capabil sa influenteze aparitia maladiilor prionice, nu numai in formele ereditare, dar si in cele sporadice si infectioase. La ovine, sensibilitatea la scrapie este legata de polimorfismul a 3 codoni si anume 136, 154 si 171 cu varianta alelica VRQ (adesea asociata cu scrapia). (Ducrot C si col.2008)
Specialistii subliniaza insa, ca aceste genotipuri nu determina direct boala scrapie, ci confera doar susceptibilitate la aceasta infectie, deoarece aceste genotipuri au fost identificate si la oile sanatoase din Australia si Noua Zeelanda (tari indemne la scrapie), iar cand au fost aduse in Marea Britanie au facut scrapie (cauza ar putea fi prezenta agentului infectios).
Transmiterea agentilor prionici, de la un
individ la altul, depinde de bariera de
specie. Receptivitatea unei specii
Prin pasaje repetate la noua specie, (gazda) perioada de incubatie se scurteaza, iar PrPsc inoculat la specia de origine, are nevoie de o perioada de adaptare, tradusa printr-o perioada lunga de incubatie.
Acest fenomen al barierei de specie, poate fi explicat prin caracterul specific al prionilor, produs de fiecare specie.
Se cunoaste ca PrPc este caracteristica fiecarei specii. O tulpina PrPsc care produce boala la o specie, pentru a transforma PrPc-ul altei specii in proteina patogena, trebuie sa existe o asemanare a secventelor de aminoacizi intre cele doua proteine, respectiv o asemanare a bazelor genei PRNP a celor doua specii. Diferentele dintre cele doua secvente, duce la receptivitate diferita, exprimata prin prelungirea perioadei de incubatie, la primul pasaj (daca diferentele sunt mici), receptivitate selectiva (in cazul in care calea de administrare este intracerebrala), sau lipsa totala de receptivitate ( in cazul diferentelor mari de secvente).
Lipsa totala de receptivitate, poate fi depasita, daca agentul infectant este inoculat la o specie heteroloaga receptiva si apropiata genetic sub raportul PrPc de cele doua specii,de exemplu: hamsterul nu este receptiv la infectia cu agentul scrapie de la oaie, dar poate fi infectat daca acesta a fost trecut pe soarece. Daca speciile implicate in transmiterea bolii sunt filogenetic apropiate, trecerea agentului patogen de la o specie la alta se face mai usor.(Manzat Radu Moga si col., 2005)
Totusi apropierea filogenetica, nu este confirmata intotdeauna, de exemplu nurca face boala, atat cu agentul scrapie cat si cu cel al ESB-ului, pe cand dihorul, "ruda" apropiata cu nurca, nu este receptiv la agentii prionici ai celor doua boli.
De asemenea, numai o parte din carnivore si anume pisicile, exprima boala prionica, daca sunt expuse contactului cu materialul infectant, fata de caini, la care nu s-a semnalat pana acum nici un caz de EST .
Exemplele prezentate demonstreaza ca, gena PRNP nu este un indicator fidel al inrudirii filogenetice. Unele specii, apropiate dupa caracterele controlate de totalitatea genomului, pot prezenta diferente remarcabile in ceea ce priveste gena PRNP. Cu cat doua specii sunt mai apropiate sub raportul acestei gene, cu atat mai usor va fi traversata barierea de specie dintre ele.( Hubert Laude, 2006).
Agentii etiologici ai EST-urilor, au proprietati fizico-chimice si biologice comune, intre care cele mai importante sunt:
►dimensiunile sub nivelul virusurilor mici;
►rezistenta la actiunea agentilor fizici si chimici;
►efectul patogen si-l manifesta dupa o perioada de incubatie lunga (luni, ani, zeci de ani) , cu o evolutie clinica lenta, tacuta, progresiva, fara remisie sau posibilitati de recuperare;
►histopatologic, se caracterizeaza prin degenerescenta vacolara a neuronilor si a neuropilului - aspect spongiform; (vezi fig.4)
►nu sunt antigeni si nu determina nici un fel de reactie imuna;
►nu produc interferon si nu sunt sensibili la alti interferoni;
►nu au nici un efect citopatogen in vitro si nu produc nici o alterare a limfocitelor B si T, nici in vivo, nici in vitro;
►in structura lor nu se gaseste acid nucleic;
►nu au fost vizualizati la microscopul electronic;
►exista mai multe tulpini cu particularitati distincte ;
►actiunea patogena este dependenta de susceptibilitatea genetica a gazdei, doza infectanta si calea de infectie. Houston F si col., 2003)
Doza infectanta este data de nivelul de infectiozitate al diferitelor tesuturi in bolile prionice naturale, astfel:
■ din categora I cu infectiozitate inalta, fac parte: creierul, maduva spinarii, ochiul si urechea;
■ din categoria a IIa, cu infectiozitate scazuta, fac parte: splina, amigdalele, ganglionii limfatici, intestinul, hipofiza, ficatul, pulmonul, pancreasul;
■ din categoria a IIIa fara infectiozitate deosebita, fac parte: sangele, laptele, glanda mamara, muschii scheletici, inima, rinichii, glandele salivare, fecalele. (Matthews D,
Calea de infectie naturala in majoritatea bolilor prionice este calea orala, digestiva.
Daca ne raportam la doza infectanta pe cale intracerebrala, pentru a se produce infectia pe cale digestiva, trebuie 125.000 de doze intracerebrale. Pe cale intravenoasa trebuie 7 pana la 10 doze intracerebrale, 50 de doze intracerebrale pe cale intraperitoneala, si 25.000 de doze pe cale subcutanata. Un gram de creier de bovina contaminat cu prion, reprezinta o doza infectanta pe cale orala.
Rezistenta prionilor la actiunea factorilor chimici este deosebit de mare , astfel tratarea suspensiilor cu aldehida formica nu modifica infectivitatea, dar creste rezistenta fata de actiunea autoclavarii. Deci utilizarea caldurii pentru sterilizarea pieselor histologice de creier fixate in formol este contraindicata.
O substanta cu puternic efect inactivant fata de agentii scapiei si ESB , este acidul formic. Acesta este activ atat fata de materialul infectant ca atare, cat si asupra celui fixat in aldehida formica.
Acidul formic este recomandat pentru
tratarea lamelor cu sectiuni histologice, care raman infectante in urma
tehnicilor uzuale de prelucrare si colorare. Dintre substantele
dezinfectante, cele mai active fata de agentii prionici, sunt
hidroxidul de sodiu 1-
Rezistenta fata de actiunea factorilor fizici si chimici, poate varia in functie de tulpina de agenti prionici. O solutie de 2,5% hipoclorit de sodiu este activa pentru agentul scrapiei, dar nu si pentru o tulpina izolata de la un caz de MCJ. Autoclavarea la 134-138 grade Celsius timp de 18 minute, duce la inactivarea tulpinelor prionice.(DESLYS Jean-Philippe, 2008).
Sunt maladii strict neurologice. Incubatia este foarte lunga, uneori de ordinul anilor. Evolutia clinica este lenta, progresiva, afebrila (contrar evolutiei clasice a bolilor infectioase) fara perioada de remitere, cu sfarsit letal.
Absenta totala a oricarei reactii inflamatorii specifice, precum si lipsa oricarui raspuns imun celular sau umoral. (Arnold M si col.2003)
Diagnosticul in viata se stabileste foarte greu. Nu sunt contagioase si difuzeaza lent in afara focarului. De regula evolutia este sporadica cu exceptia ESB si ESN unde evolutia este epidemica.
In mod experimental boala se poate transmite intra si hetero specific. Agentii cauzali ai EST sunt prionii. In prezent se cunosc 12 boli prionice, acestea intalnindu-se atat la oameni cat si la animale.( Israil Anca-Michaela,2005)
La animale se intalnesc 6 entitati morbide ce recunosc ca agent cauzal prionii in bolile:
scrapie;
encefalopatia transmisibila a nurcilor;
boala cronica cahectizanta a cervideelor;
encefalopatia spongiforma a ungulatelor exotice;
encefalopatia spongiforma felina;
encefalopatia spongiforma bovina.
La om evolueaza entitati morbide ce recunosc ca agent cauzal prionii in bolile:
boala Kuru;
boala Creuzfeldt-Jacob;
noua varianta a bolii Creuzfeldt-Jacob;
sindromul Gerstmann Sträussler Scheinker;
insomnia fatala familiala;
scleroza multipla.
Scrapia a fost semnalata pentru prima data, la inceputul secolului al XVII-lea in tari ca Marea Britanie, Franta, Germania. Se pare ca din Regatul Unit al Marii Britanii, a fost exportata in numeroase alte tari ca: Grecia, Elvetia, Olanda, Rusia, Canada, S.U.A.,etc. In Romania scrapia a fost diagnosticata pentru prima data in anul 2002 (ALEXANDRU,2002.)
Denumirea bolii deriva din cuvantul englez "scrapi" si este asociata cu simptomele de prurit si tremuraturi.
Scrapia marcheaza inceputul istoriei encefalopatiilor spongiforme transmisibile. Boala evolueaza sporadic sau endemic la ovine, caprine si mufloni.
Perioada de incubatie este de 1-3 ani sau mai mult. Ea incepe prin tulburari de comportament, prin pierderea coordonarii miscarilor, animalele se sprijina de garduri pentru a-si pastra echilibrul (semn de ataxie), ambele simptome fiind functii cerebeloase.
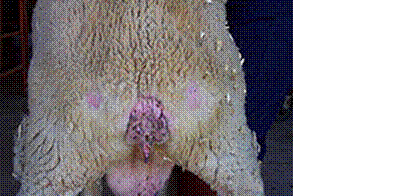
Animalele bolnave prezinta un prurit intens, se freaca de suprafete dure, ranindu-se si pierzandu-si blana, cel mai frecvent la nivelul regiunii dorsale, isi musca extremitatile sau regiunea dorso-lombara.(vezi fig.3)
Apar hiperchinezii, exprimate prin clatinarea intermitenta a capului, gatului si tremuraturi musculare la nivelul membrelor.
Animalele slabesc, desi au apetit permanent. Ele prezinta dezinteres fata de mediul inconjurator. Cel mai frecvent semn clinic descris de crescatorii de ovine, este pruritul, apoi incoordonarea locomotorie si tremuraturile musculare.
Tabloul clinic la ovine poate prezenta variatii in functie de rase. La capre lipseste adesea pruritul, dar sunt frecvente tulburarile locomotorii si excitabilitatea.
Sursa de infectie o reprezinta animalele bolnave. Boala se transmite de la o turma la alta, prin miscarea animalelor aflate in faza preclinica de boala si se difuzeaza larg inaintea aparitiei primului caz clinic.( Gravenor MB si col.2003)
Calea de transmitere cea mai frecventa este de la mama la fat. Un animal contaminat in faza preclinica, poate transmite boala la mai multe generatii de produsi, inainte de aparitia semnelor clinice. Mecanismul transmiterii bolii de la mama la fat, se pare ca are loc consecutiv unei infectii la nivelul uterului. Transmiterea orizontala se face prin consumul invelitorilor fetale contaminate in perioada de stabulatie sau pe pasune. O alta cale de transmitere a bolii este prin folosirea de vaccinuri preparate din tesuturile de la oi, despre care nu se cunostea daca sunt bolnave de scrapie.( Torres J.M si col.2006)
Boala poate evolua endemic sau sporadic. Incidenta anuala in turmele contaminate este pana in 5%, dar ea poate creste la 10%, daca nu se instituie masuri de combatere. Frecvent boala apare la animale in varsta de 3-4 ani, dar se poate intalni si la animale de 10 ani si foarte rar la animale sub 18 luni. Experimental boala se poate transmite la soareci, sobolani, nurci, maimute si bineinteles la speciile ce exprima in mod natural aceasta maladie.
Experimental, caprele sunt mai sensibile decat oile, au o perioada de incubatie mai scurta, fata de imbolnavirile in conditii naturale, care sunt rare, boala fiind transmisa de cele mai multe ori de la oi. Rolul berbecilor in difuzarea bolii este recunoscut, deoarece de multe ori aparitia imbolnavirilor se coreleaza cu achizitionarea de berbeci reproducatori. Se presupune ca berbecii ar da nastere la produsi receptivi la boala. (Perianu Tudor si col.2005)
Anumite animale sunt mai sensibile decat altele, datorita polimorfismului genei PRNP, in special a zonelor corespunzatoare codonilor 136, 154 si 171. Se pare ca varietatile genotipice pot fi cauza existentei diferitelor tulpini de scrapie, cu tropism diferit, in functie de genotip.( Baylis M, 2006)
FIGURA.3
Este o boala infectioasa necontagioasa, specifica nurcilor. Are o evolutie lenta, ce se caracterizeaza prin tulburari neurologice: scade capacitatea de autoingrijire, dificultate in hranire si deglutitie, hiperexcitabilitate, semne de necoordonare a miscarilor, debilitate fizica progresiva. Intotdeauna are sfarsit letal.
Boala a fost descrisa in S.U.A. in 1947 apoi semnalata in Canada in 1968, iar in Germania in 1970.
Agentul etiologic este un prion asemanator celui din scrapie. La infectie sunt receptive nurcile in varsta de peste un an. Experimental, boala a fost transmisa la dihor si raton si nu a fost transmisa la soareci, pisici si vitei.
Transmiterea bolii se face pe cale digestiva, prin consum de hrana provenit de la oile bolnave. O alta cale de transmitere este canibalismul sau transmiterea cutanata prin zgarieturi si muscaturi. Studiile experimentale au condus la concluzia ca prionul, agentul encefalopatiei transmisibile a nurcilor, este deosebit de agentul scrapiei. (Buschamann A si col.2006)
Agentul ETN se transmite experimental la oaie si capra, dar nu este patogen pentru soarece. Tulpinile de prioni identificate la ovinele cu scrapie din S.U.A, sunt patogene pentru nurca, producand o boala asemanatoare cu ETN-ul prin inoculare intracerebrala, dar nu si pe cale digestiva. Tulpinile de prioni de ESB sunt patogene pentru nurca pe ambele cai. Prionii de ETN inoculati la bovine, reproduc tabloul clinic al ESB-ului.
Clinic, la debutul bolii, se produc tulburari de comportament minore: animalele devin hipersensibile, speriate, femelele isi neglijeaza puii, coada este arcuita pe spate, nu mai este preocupat de toaleta corporala.( Perianu Tudor si col.2005). La unele animale se produc automutilari. Evolutia sfarseste prin moarte dupa 1- 6 saptamani.
Este o boala infectioasa de natura prionica, care afecteaza pe cale naturala cerbul si elanul, atat in stare de libertate, cat si in captivitate. Nu se cunoaste cu certitudine data aparitiei bolii si a originii ei geografice. In 1967 in S.U.A. au fost raportate primele cazuri de imbolnavire cu manifestari nervoase si etiologie necunoscuta la cerbi in captivitate.
Diagnosticul de boala cronica cahetizanta a fost stabilit prin examen histopatologic al creierului in 1978. Nu se cunoaste pana la aceasta data originea tulpinei prionice, care a cauzat aparitia bolii la cervideele in libertate sau in captivitate. Este posibila o mutatie somatica spontana a genei PRPN. (Manzat Radu Moga si col.2005)
Tipizarea tulpinilor prionice de BCC pe soarece, a demonstrat ca acesta este diferit de prionul din EBS si de prionul din scrapie.
Sursa de infectie este reprezentata de pasunile contaminate.
Boala naturala se transmite orizontal. Exista dovezi care atesta transmiterea bolii de la cerb la elan, de la elan la cerb, de la cerbul nordamerican, la cerbul cu coada alba.
Experimental BCC-ul a fost transmis pe cale intracerebrala la bizon, dihor, capra domestica, bovine, soareci de laborator.
Intr-o turma de cerbi in captivitate, in decurs de 5 ani, s-au imbolnavit 53 din 67 de animale. Boala s-a transmis si la un grup de elani tinuti intr-un padoc alaturat.
Perioada de incubatie a bolii este minim 15 luni. Frecvent s-au observat modificari de comportament si slabire progresiva. Animalele prezinta o stare de somnolenta sau depresie, tin capul in jos si urechile aplecate. (Campeanu Marius Valer, 2001)
Apetitul este prezent, dar consumul de hrana este redus, motiv pentru care pierderea in greutate este progresiva, pe parcursul evolutiei bolii. Frecvent s-au observat hipersalivatie si sialoree, polidipsie, poliurie.
Animalele se deplaseaza greoi, in nesiguranta, prezinta tremuraturi ale capului, hiperexcitabilitate, decubit. Boala are intotdeauna sfarsit letal.
Boala a aparut in Regatul Unit in 1985, cand s-au semnalat cazuri sporadice la bovideele exotice din parcurile zoologice.
In declansarea bolii a fost incriminat consumul de faina de carne si oase. Chiar daca are o etiologie comuna cu ESB-ul exista totusi diferente sub raportul caracterelor epidimiologice.
Boala apare la varsta mult mai mica, la 18-36 de luni. Evolutia clinica cu simptomatologie nervoasa, in care predomina ataxia, este la 1-3 zile. (Manzat Radu Moga si col.2005)
Procentul de imbolnavire este foarte ridicat, de 62%. La bovideele exotice boala are un anumit grad de contagiozitate . La un grup de 8 antilope Kudu , nascute incepand cu anul 1987, 5 animale s-au imbolnavit. Din cele 5 animale care s-au imbolnavit, se pare ca numai primul caz a consumat faina de carne si oase, iar celelalte au fost in contact cu acesta. Bovideele exotice au o receptivitate ridicata si nu exista bariera de specie, astfel agentul prionic trece de la o specie la alta.
Boala a aparut in 1990 in Marea Britanie la o pisica domestica. In perioada 1990-1995 s-au diagnosticat 67 de cazuri. Cei mai afectati au fost masculii, varsta medie a animalelor bolnave a fost 7 ani. Nu s-au semnalat cazuri de boala la pisici sub 2 ani. Boala evolueaza lent, iar moartea survine la o luna sau 5 luni dupa aparitia bolii. O boala similara a fost semnalata si la felinele salbatice aflate in captivitate: 4 cazuri la ghepard, 3 la puma, unul la tigru. Datele epidemiologice atesta contaminarea animalelor pe cale digestiva.( Perianu Tudor si col.2005)
Simptomatologia este foarte diversa. Se produc tulburari de comportament, nu iese din casa sau adapost, prezinta tremuraturi la membrele inferioare, ataxie, agresivitate fata de membrii familiei sau fata de animalele din casa.
ESB a aparut pentru prima data in 1985 in Anglia (Wells si col.,1987 citat de Perianu Tudor 2005 ).
Diagnosticul a fost stabilit histopatologic, confirmat prin transmitere experimentala la soareci si prin izolarea SAF (fibrile asociate scrapiei ) din sistemul nervos central al animalelor bolnave. Boala s-a extins in mai multe ferme din Marea Britanie, Irlanda, Franta si alte state europene.
In 1994 au fost semnalate in Regatul Unit si Franta, primele cazuri umane ale variantei noi de Boala Creuzfeldt-Jacob care au fost asociate cu agentul ESB declansand, o justificata ingrijorare a specialistilor si populatiei. In afara de Marea Britanie, Franta si Irlanda, boala a mai fost semnalata in Portugalia, Elvetia, Germania, Austria, Belgia, Cehia. (Arnold M si col.2009)
Prezenta bolii la bovine este suspectata si in S.U.A., unde s-au constatat cazuri de encefolopatie transmisibila a nurcilor din crescatorii, in care s-au administrat in hrana carne si organe de la bovinele sacrificate de necesitate in special ca urmare a sindromului vacii culcate.
Boala nu a fost semnalata pana in prezent in Romania, dar comitetul pentru ESB al U.E. a clasificat tara noastra alaturi de alte state, in care existenta ESB este probabila.
Aparitia ESB-ului a avut consecinte grave asupra economiei agrare a statelor in care a aparut. In fermele afectate, s-au sacrificat toate bovinele in varsta de 30 de luni, indiferent de situatia sanitara a acestor efective. La acestea s-au adaugat cheltuielile legate de transportul animalelor, de distrugerea cadavrelor. A fost perturbat comertul intern si international cu bovine vii, cu carne si produse din carne de vita, mai ales dupa asparitia cazurilor de noua varianta a maladiei Creuzfeldt-Jacob, asociate cu ESB. S-au impus noi reguli de procesare in abator prin eliminarea din consum a unor zone anatomice (capul, coloana vertebrala).
Pierderi considerabile a inregistrat industria fainurilor proteice de origine animala. Ancheta epidimiologica a focarelor de ESB din Anglia a demonstrat ca toate au avut o sursa unica, aceasta fiind faina din carne-oase, care intra in componenta furajului combinat destinat vacilor de lapte.( Matthews D,2003)
S-au emis 2 ipoteze privind originea bolii:
Tot mai mult credit capata a doua ipoteza.
Spre deosebire de scrapie, toate izolatele din ESB, atat din Anglia cat si din alte tari se comporta identic in infectia experimentala a soarecilor. Agentul ESB fata de cel al scrapiei are capacitatea de a infecta felinele domestice sau salbatice si omul. (Gravenor MB.si col.2003)
Profilul electroforetic al agentului ESB, este identic cu cel observat in cazurile de noua varianta Creuzfeldt-Jacob.( Israil Anca-Michaela
Tinand seama de perioada de incubatie a bolii, se apreciaza ca bovinele au fost expuse infectiei in anii 1981-1982, perioada ce coincide cu momentul modificarii tehnologiei de fabricare a fainii carne - oase.
Toate aceste date subliniaza rolul fainii de carne - oase in declansarea bolii si apoi in extinderea acesteia ca urmare a reciclarii cadavrelor rezultate din cazurile ESB. Odata cu interdictia producerii si furajarii cu faina de carne-oase la rumegatoare in 1994, numarul cazurilor de ESB a inceput sa scada rapid. Aparitia si extinderea ESB-ului in alte tari are mai multe explicatii: in unele tari au aparut cazuri sporadice la animalele importate din Anglia.
Evolutiile epidemice s-au inregistrat in tarile care au folosit in hrana bovinelor faina de carne-oase importata din Anglia. In tarile in care s-au diagnosticat doar cate un caz de ESB, o explicatie ipotetica, este ca in urma aplicarii unui program riguros de supraveghere au fost depistate cazuri spontane de ESB. Spre deosebire de scrapie, nu exista date care sa ateste transmiterea orizontala a bolii. Transmiterea in conditii naturale la alte specii (feline, om) se realizeaza pe cale digestiva. Perioada de incubatie poate dura de la 2 la 5-8 ani. (Manzat Radu Moga si col.,2005, Perianu Tudor si col.,2005)
In fermele afectate, varsta aparitiilor clinice a variat in limite largi. Cel mai tanar animal are 22 luni ,iar cel mai batran are 15 ani. Majoritatea cazurilor s-au depistat la varsta de 3-6 ani (incidenta bolii este variabila, dar nu depaseste 4% in cele mai grave cazuri).
Tabloul clinic. ESB-ul debuteaza prin tulburari de comportament mai intai discrete, apoi amplificate progresiv: teama, neliniste, animalele raman in urma turmei, refuza intrarea in padoc sau grajd, evita fara motiv unele locuri, prezinta diferite miscari anormale, repetate. Uneori se constata miscari de extensie ale capului si gatului si chiar un tremur al buzelor, atunci cand se palpeaza regiunea dorso-lombara.
Simptomele de hiperexcitabilitate se dezvolta treptat: animalele reactioneaza exagerat la cel mai mic zgomot prin tremuraturi, sarituri bruste care pot genera cazaturi, miscari ale capului, uneori chiar prurit. Pot fi observate deasemeni: lingerea persistenta a botului si flancului, sensibilitate exagerata la atingerea cu mana sau la cel mai mic zgomot, atitudine refractara la muls, lovirea cu piciorul fara motiv, si chiar agresivitate fata de oameni si animale.
Simptomele locomotorii se adauga precedentelor si sunt in principal exprimate printr-un pas inalt si scurt, realizat pe trenul posterior, iar ulterior printr-un mers nesigur si din ce in ce mai ezitand. Frecvent se constata alunecari sau dificultati de schimbare a directiei. Sunt evidente eforturile efectuate la trecerea unor obstacole. (Perianu Tudor si col.2005)
Se mai intalnesc tremuraturi si pozitii anormale ale capului, urechilor si cozii. Starea generala se altereaza progresiv, se constata slabire evidenta si diminuarea productiei lactate.
Temperatura ramane in limite normale. Boala se termina sistematic prin moarte in cateva saptamani pana la 6 luni, dupa evolutia graduala a simptomelor fara faze de remisie.
Este o boala prionica cu transmitere orizontala, observata incepand cu 1956 la un grup de populatie din Papua Noua Guinee. Boala a aparut intr-o regiune circumscrisa muntoasa la circa 17.000 de indigeni raspanditi in 160 sate, ca urmare a practicarii unui ritual antropofag, prin care femeile si copii erau obligati sa manance creierul celor decedati. Femeile se ocupau cu transarea cadavrelor decedatilor, manipulau organele interne si creierul si le consumau impreuna cu copii. Barbatii mancau musculatura cadavrelor, fiind expusi in mai mica masura. (Israil Anca-Michaela, 2005)
La triburile vecine, care nu aveau acest ritual, nu a existat aceasta boala. Dupa scoaterea in afara legii a acestui ritual antropofag, boala a inceput sa dea semne de declin, iar in prezent se considera eradicata.
Frecventa bolii este de 1-10%, mai mult de ¾ din victime au fost femei si copii, dar simptomele nu au fost prezente niciodata inaintea varstei de 4 ani. Perioada de incubatie este de ordinul anilor, in unele cazuri depasind 4 decenii.
Calea principala de contaminare este calea orala,dar contaminarea se poate realiza si conjuctival, nazal sau prin leziuni si escoriatii la nivelul pielii.
Ca posibilitati de aparitie a bolii Kuru, pe langa infectarea cu agent prionic specific bolii, s-a sugerat si posibilitatea transmiterii printr-un pasaj de ritual canibalistic serial al agentului prionic, dintr-un caz al bolii CREUZFELDT-JACOB sporadic indigen.
Clinic, boala se manifesta printr-un dezechilibru in mers, observat de familie, si nu de catre pacient. Mai intai apare un tremur permanent al membrelor, care da impresia de tremurat, de dardait, de unde se trage si numele bolii KURU (a-ti fi frica, a tremura, a dardai). (Campeanu Marius Valer ,2001)
Apoi apare tremuratul capului, a trunchiului. Deplasarea devine din ce in ce mai grea, intr-o faza tardiva a bolii si nu mai poate fi realizata fara insotitor. Apare nistagmusul si strabismul convergent. In cateva saptamani pana la cateva luni, activitatea motorie voluntara este alterata, pacientii nu mai pot sta pe scaune neajutati. Se considera ca au intrat in faza a -III-a terminala a bolii, bolnavul ramane tintuit la pat, prezinta incontinenta urinara si de fecale, devine apatic, prezinta o stare de subnutritie.
Durata medie a bolii este de 6-9 luni. Indivizii care contracteaza boala sunt homozigoti, in special pentru metionina la codonul 129 al proteinei corespunzatoare genei PRNP. Boala este pe cale de disparitie, o data cu incetarea practicilor antropofage.
Este cea mai frecventa manifestare clinica de encefalita spongiforma subacuta la om. Descrisa in 1920 si 1921 de catre CREUZFELDT si JACOB, este o maladie sporadica, rara cu o frecventa de un caz la un milion de locuitori. Evolueaza de regula sporadic, expeptie facand Europa Occidentala si Centrala, Israel, Chile, S.U.A., unde incidenta este de 25 de cazuri la milionul de locuitori (in Franta in jur de 80 cazuri pe an). Se intalnesc 3 forme evolutive: (Manzat Radu Moga si col.2005)
a) sporadica
b) familiala
c) iatrogena
a) MALADIA CREUZFELDT- JACOB -forma sporadica
Este cea mai frecventa, reprezinta 80 % din totalul prionozelor umane. Varsta medie a debutului maladiei este de 62 ani cu limite cuprinse intre 50-75 ani.
Simptomele bolii sunt: deteriorare mentala progresiva la 40% din bolnavi, cu pierderi de memorie, tulburari de judecata; la 25 % din bolnavi apar simultan tulburari neurologice si psihice, ataxie cerebrala, intr-un context nonfebril, sindrom piramidal si extrapiramidal. (Israil Anca-Michaela, 2005)
La 35 % din bolnavi apar numai tulburari neurologice.
Electroencefalograma nu este normala la 60 % dintre cazuri, (anomalii pseudoperiodice tranzitorii, pe un fond de retardare generala).
Evolutia bolii este intre 6 saptamani pana la 6 luni, spre o dementa evolutiva rapida de la zi la zi si mutenie. Foarte rar apare o tulburare majora piramidala a neuronilor motori, tulburari epileptiforme.
b) MALADIA CREUZFELDT- JACOB-forma familiala
Este o maladie genetic asociata unei mutatii genetice la nivelul genei PRNP Reprezinta 5-10% din totalul cazurilor de maladie CREUZFELDT-JACOB.
Mutatiile au loc la nivelul codonilor 178, 200, 208 si 210.
Mutatia in codonul
Individul se naste cu aceasta proteina muta care dupa varsta de 35 ani, devine patogena si declanseaza maladia.
Acesti homozigoti sunt cei mai receptivi la expunerea iatrogena si la contactarea noii variante a maladiei CREUZFELDT-JACOB.
c) MALADIA CREUZFELDT-JACOB-forma iatrogena
Maladia apare ca urmare a administrarii la om a unor biopreparate ce contin izoforma infectioasa a PrPc, sau prin utilizarea unui instrumentar infectat cu agent infectios prionic. Folosirea materialului neurochirurgical sau a electrozilor stereotactici pentru encefalograma, transmit agentul prionic de la bolnavul cu maladia CREUZFELDT-JACOB, in tesutul cerebral sanatos a pacientului ulterior investigat. Israil Anca-Michaela, 2005)
Transplantul de cornee infectata, transplantul de timpan, de duramater au produs cazuri de imbolnavire astfel: prin trasplant de cornee - 3 cazuri, prin transplant de timpan - 1 caz, de duramater - peste 25 de cazuri. Utilizarea terapeutica a derivatilor de origine hipofizara, hormonul de crestere pituitar, pot produce maladia. Preparatele de hormoni pituitari, provenind din hipofize prelevate de la cadavre si administrate la pacienti, s-au dovedit, dupa o perioada de latenta de la 3 luni la 10 ani ca ar fi fost infectate cu agent prionic, determinand boala in 40 de cazuri.
In cazurile de CREUZFELDT-JACOB de origine iatrogena, s-a identificat genotipul 129 valina-valina, de unde s-a tras concluzia ca maladia CREUZFELDT-JACOB e iatrogena ar apare pe un teren cu predispozitie genetica.
Tabloul clinic al maladiei variaza in functie de calea de introducere in organism. Inocularea directa in SNC, are ca efect o incubatie scurta, de 10-30 luni. Inocularea pe cale periferica duce la incubare de la 5-35 ani. Inocularea prionilor prin implant de electrozi stereotactici pentru encefalograma, are ca efect o perioada de incubatie de 18 luni, cu simptome de dementa. Hormonul de crestere prelevat de la cadavre cu maladia CREUZFELDT-JACOB, are ca efect o perioada de incubatie de 15 ani, cu simtomatologie de ataxie.
In 1994, s-au inregistrat in Marea Britanie si Irlanda cazuri de maladie CREUZFELDT-JACOB cu un tablou morfo-clinic diferit de cel cunoscut pana atunci. Diferentele fata de maladia CREUZFELDT-JACOB cunoscuta se refera la tabloul clinic.
Varsta aparitiei semnelor clinice este de 19-41 ani la noua varianta, fata de 61-65 la maladia CREUZFELDT-JACOB. Durata fazei clinice in noua varianta este de 7-22 luni, iar la maladia CREUZFELDT-JACOB de 4 luni. Leziunile histologice in noua varianta difera fata de cele din maladia CREUZFELDT-JACOB, dar sunt asemanatoare cu cele observate in boala KURU si ESB. (Manzat Radu Moga si col.,2005)
Proteina prionica patogena a fost pusa in evidenta in amigdale, splina, limfonoduri. Aceste localizari nu au fost observate niciodata in alte forme ale maladiei CREUZFELDT-JACOB. Acest element pledeaza pentru o etiologie comuna a noii variante a maladiei CREUZFELDT-JACOB si ESB. Toate cazurile examinate genetic pana in prezent sunt homozigote pentru metionina la codonul 129 al genei PRNP.
Calea de infectie este digestiva. S-a emis ipoteza ca subiectii homozigoti pentru metionina la codonul 129, fiind deosebit de receptivi la toate bolile prionice, au facut o noua varianta a maladiei CREUZFELDT-JACOB, dupa o perioada mai scurta de incubatie si ca este posibil ca indivizi cu un alt genotip sa faca boala dupa o perioada mai lunga de incubatie. Boala in noua varianta CREUZFELDT-JACOB, se caracterizeaza prin simptome psihice: tulburari afective tip disforie, iritabillitate, depresie, retragere din societate, urmate dupa ceva timp (cateva luni), de disfunctii neurologice progresive: parestezii, crampe la nivelul membrelor, ataxie precoce, mioclonii, deteriorare treptata a memoriei, dementa progresiva, exitus.
Reprezinta forma genetica de predilectie a bolilor prionice . Frecventa la om este de 2 % din cea a bolii CREUZFELDT-JACOB . Este o boala extrem de rara, prionica, eredofamiliala, mostenita dominant autozomal, mai frecvent intalnita in Japonia, inrudita simtomatic cu boala KURU.
Boala apare de varsta de 34-52 de ani. Durata fazei clinice este de 2-8 ani, mult mai lunga decat la maladia CREUZFELDT-JACOB.
Simptome: ataxia cerebeloasa, tulburari de inghitire, mutism. Evolutia duce spre o stare de zacere la pat, tulburari de memorie, care evolueaza totdeauna spre dementa. Mutatiile in gena PRNP asociate cu maladia GERSTMANN STRAUSSLER SCHEINKER sunt: la nivelul codonului 102, unde prolina este substituita cu leucina, codonul 117 unde alanina este substituita cu valina, codonul 198, fenilalanina este substituita cu serina, codonul 217 unde glutamina este substituita cu asparagina. Durata totala a maladiei este variabila, uneori poate depasi 50 luni. Boala se poate transmite experimental la soarece si cimpazeu pe cale intracerebrala. . (Israil Anca-Michaela,2005)
A fost descrisa in 1986 drept o boala afectand 5 membri ai aceeasi familii italiene.
Este o boala genetica de origine prionica transmisibila, dominant autozomala. Debuteaza intre varsta de 35 si 60 ani si are o evolutie de 7- 12 luni.
Clinic, boala se manifesta prin tulburari profunde de ritm circadian, cu insomnie pana la pierderea totala a somnului. Este insensibila la toata terapeutica, tulburarile de somn progreseaza in cateva saptamani sau luni pana cand somnul nu mai este posibil, fiind inlocuit cu o stare de apatie, indiferenta, insensibilitate, cu halucinatii vizuale, auditive, tactile. Disfunctia cerebeloasa si piramidala culmineaza cu dificultati de mers, mioclonii spontane si reflexe. Apar tulburari de memorie, confuzie, dezorientare. Moartea survine ca urmare a unor infectii intercurente, de exemplu pneumonie. (Israil Anca-Michaela,2005)
Boala apare in urma a doua mutatii la nivelul genei PRNP, localizata pe cromozomul 20. Mutatiile au loc la nivelul 178 si 129.
Diagnosticul clinic al EST-urilor, este doar un diagnostic prezumtiv, confirmarea sa se face prin examene de laborator.
Examenele de laborator pot stabili prezenta proteinei prionice patogene, cu mult timp inainte de aparitia primelor semne clinice, dar au un mare dezavantaj, deoarece sunt aplicate numai postmortem.
Punerea la punct a unor teste de laborator cat mai eficiente, pentru diagnosticarea precoce, "intra vitam" a bolilor prionice, este deosebit de importanta, atat pentru medicina umana si veterinara, cat si pentru economia agricola.
In ultimii ani, s-a lucrat la stabilirea unui numar de teste de laborator pentru diagnosticarea "intra vitam" a bolilor prionice, dar s-au intampinat o serie de dificultati, metodele uzitate nu au dus constant la detectia PrPsc-ului in probele biopsice.
S-a constatat ca prezenta PrPsc-ului, nu poate fi detectata sub valoarea de un milion de particule infectioase / gramul de tesut.
Metodele de identificare a PrPsc-ului post mortem, ofera un diagnostic de certitudine in toate cazurile de suspiciune de boala prionica, dar nu au aceeasi valoare ca si in cazul identificarii "intra vitam ". Absenta unui raspuns imun al gazdei infectate, exclude posibilitatea unui diagnostic serologic.
Examenul histopatologic a fost prima metoda de diagnostic folosita si a ramas principalul mijloc de confirmare a bolilor prionice in numeroase tari. (Dustan BH,2008)
Se examineaza diferite zone ale sistemului nervos central. Leziunile sunt identice la toate speciile, difera doar localizarea, fregventa si intensitatea modificarilor histologice. Acestea se gasesc cu predilectie in trunchiul cerebral (bulbul rahidian, protuberanta anulara, mezencefal), maduva, cerebel.
Leziunile decelabile prin examen histopatologic sunt de degenerescenta vacuolara, de cele mai multe ori simetrica, a neuropilului substantei cenusii si a neuronilor din centrii nervosi. Vacuolele pot fi unice sau multiple, rotunde sau ovale, cu contur neted si regulat, de " bule de sapun". Vacuolele sunt optic vide, nu se coloreaza prin metodele specifice pentru lipide sau glicogen si dizloca nucleul catre periferie, devenind picnotic.
Aceste leziuni pot fi insotite de alte modificari degenerative ale neuronilor, (neuronofagie, necroze solitare), de astrocitoza (prezenta constant in bolile prionice umane, si inconstant in cele la animale) , mansoane perivasculare, placi amiloide. (Dustan BH,2008)
Vacuolizarile trebuie diferentiate de vacuolizarile substantei albe, rezultate in urma fixarii sau prelucrarii necorespunzatoare a probei.(vezi fig.4)
In vederea efectuarii examenului histopatologic, se preleveaza encefalul in intregime avand grija sa nu fie distrus tesutul nervos, iar organul in intregime sa fie introdus in cel mai scurt timp in solutia de fixare, fomol salin 10%.
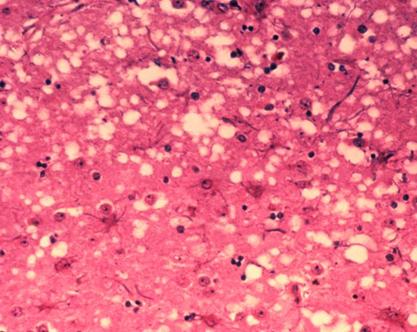
FIGURA.4 Vacuolizari neuronale
Este folosita ca o alternativa a diagnosticului histopatologic, atunci cand proba este partial autolizata sau congelata.
Metoda se bazeaza pe proprietatea PrPsc-ului de a nu fi solubilizata de detergenti si de a rezista la actiunea proteinazei K .
Proba de tesut nervos omogenizata, recoltata din mai multe zone, este supusa extractiei cu un detergent, este purificata si concentrata prin centrifugari succesive si tratata cu proteinaza K.
Produsul final este supus coloratiei negative, cu acid fosfotungstic si examinata la microscopul electronic pentru evidentierea SAF. (Israil Anca-Michaela,2005)
La examinarea in microscopie electronica, SAF se prezinta sub forma unor structuri cu aspect fibrilar, filamentos, de lungimi variabile. Morfologia si distributia SAF difera in functie de boala si specia afectata. Marele dezavantaj al metodei il reprezinta faptul ca necesita aparatura extrem de performanta si costisitoare.
Testele imunoenzimatice, se bazeaza pe rezistenta PrPsc-ului la actiunea solutiilor de detergenti si pe rezistenta fata de proteinaza K .
Aceste teste au avantajul ca pot fi folosite si in cazul probelor de tesut nervos, partial autolizat, impropriu examenului histologic, si nu necesita utilizarea microscopiei electronice.
Sunt mai multe metode de lucru propuse:
Metodele enumerate mai sus, sunt tehnici de scrining in supravegherea efectivelor de rumegatoare domestice si salbatice, pentru EST in Romania.(PROGRAMUL DE SUPRAVEGHERE A BOLILOR LA ANIMALE 2008.)
Metoda Western blotting prevede extractia probei de tesut nervos, cu o solutie de detergent, purificare si concentrare prin centrifugari si tratare cu proteinaza K . Urmeaza electroforeza in gel de poliacrilamida si ulterior trecuta intr-o caseta de blotting . La incheierea transferului, membrana este supusa imunomarcarii cu anticorpi antiproteina prionica obtinuti pe iepure .
Rezultatele se obtin dupa cel putin 24 de ore de la inceputul prelucrarii probei.
In ultimii ani firma Prionics foloseste direct omogenatul de tesut nervos, fara a fi supus operatiunilor de purificare si concentrare, iar imunomarcarea se realizeaza cu anticorpi monoclonari de mare afinitate. Aceasta este metoda Priostrip, care se realizeaza in 6-8 ore, si are sensibilitate si specificitate de 100% . (Torres J.M., si col.,2006)
Ambele metode sunt propuse de catre firma Prionics.
Metoda Bio -Rad TeSeE este o metoda propusa de firma Bio-Rad din SUA si Franta, care are la baza evidentierea proteinei prionice patogene din omogenate de tesut nervos, prin tratare cu proteinaza K, prin purificare si centrifugari succesive si prin detectie cu doi anticorpi monoclonali in sistem sandwich.
Durata testului este de 4-6 ore si are o specificitate si sensibilitate de 100%. Metoda foloseste patru martori negativi si doi martori pozitivi.
O metoda imunoenzimatica, dar care nu foloseste ca marker de diagnostic proteinaza K, este si metoda Herd Check BSE-Scrapie Antigen, propusa de firma IDEXX din Elvetia. Metoda se bazeaza pe capturarea PrPsc-ului, cu un ligant Sepiron ( un polimer sintetic), in prezenta PrPc-ului, dintr-un omogenat de tesut nervos, splina si limfonoduri.( Toomik. R., 2006).
Durata este de 90 de minute si are o specificitate si sensibilitate de 100%.
Acest test permite vizualizarea PrPsc-ului in tesutul nervos, in structuri limfoide, (amigdale, placile Payer), membrana nictitanta, permitand un diagnostic pe probe biopsice.
Sectiunile histologice de parafinate sunt tratate cu proteinaze si apoi cu anticorpi monoclonali, ce sunt conjugati cu o enzima , care produce o reactie de culoare cand se adauga substratul corespunzator. (Dustan BH si col.2008)
Examinarea microscopica permite localizarea citologica a PrPsc-ului.
Testul biologic pe animalele de experienta (soarece, hamster), a tulpinilor prionice, este considerat astazi, metoda standard in vederea cofirmarii identitatii agentilor prionici infectiosi. Dezavantajele acestei metode sunt:
●este foarte scumpa,
●cere timp indelungat(18 luni-2 ani),
●nu poate fi aplicata in diagnosticul de rutina, ci doar in cercetare.
In scopul gasirii unei metode de diagnostic precoce "intra vitam", se cauta alti markeri ai infectiei decat PrP27-30.( Baylis M, 2006).
S-a demonstrat prezenta in lichidul cefalorahidian a unor proteine anormale, rezultate din necrobioza neuronilor si pusa in evidenta in cazurile de BCJ la om, ESB la bovine si scrapie la ovine.( Raeber,A.si col., 2008).
Este necesar introducerea in diagnosticul curent de laborator a unei metode "intra vitam", pentru evidentierea PrPsc, in tesuturile non-neuronale (sange, amigdale, ganglioni, apendice).( Soto Claudio, 2006).
Metoda recoltarii membranei nictitante la oi si a amigdalelor la om, sa poata fi utilizata in viitor ca mijloc de diagnostic precoce.
Se incearca depistarea unor proteine anormale in urina bovinelor cu ESB. Companiile Priosense din Israel si Prionix din Elvetia, au pus la punct un test de diagnostic precoce "intra vitam", bazat pe decelarea PrPsc-ului, in urina, pentru diagnosticul BCJ, vBCJ, ESB, si scrapie, cu mult timp inainte de aparitia semnelor clinice.
Aparitia noii variante de BCJ (v BCJ), a ridicat problema riscului pentru consumatori, pe care l-ar putea reprezenta contaminarea carcaselor de bovine cu tesut nervos. Pentru verificarea carcaselor, firma germana Schebo-Biotech A.G., propune un test imunoenzimatic, pentru detectarea tesutului nervos de pe carcase si mesele de transare. Testul se bazeaza pe decelarea enolazei neuron-specifice cu ajutorul anticorpilor monoclonali .
Dintre bolile prionice , care se intalnesc la animale, la noi in tara in ultimii ani , a fost diagnosticata scrapia. Pana in anul 2002 se cunostea ca in Romania, efectivele de ovine si caprine erau indemne la scrapie.
Odata cu instituirea programelor nationale de supraveghere a bolilor prionice, dar mai ales prin diversificarea metodelor de laborator, s-a diagnosticat scrapie la ovine si caprine.
Se pare ca aceasta boala a evoluat de mult timp la noi in tara, dar este posibil sa fi fost confundata cu alte maladii cu manifestari nervoase, ce evolueaza la ovine, ca: cenuroza, listerioza, etc.
Scopul prezentei lucrari este de a vedea prevalenta prionilor in populatiile de ovine si caprine dintr-un areal geografic.
Cercetarile au fost facute in
►zona de campie,
►cu efectiv de peste 250.000 de ovine si caprine.
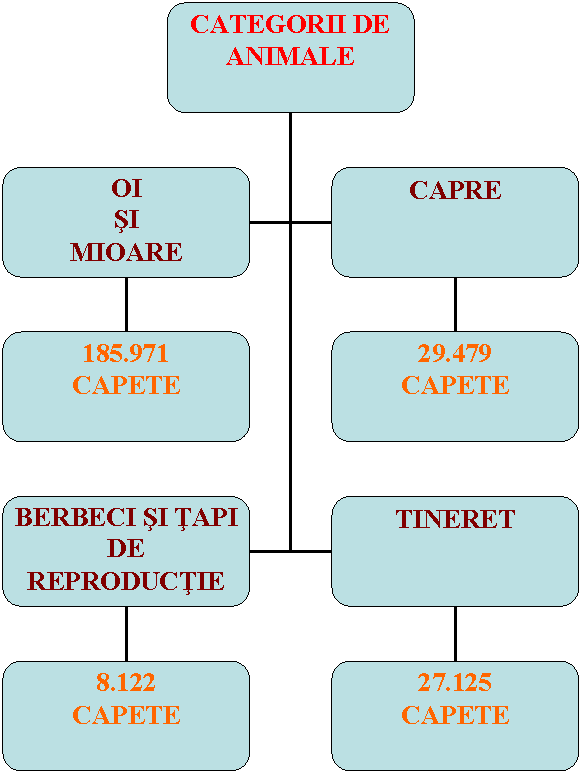
►categorii de animale:
oi si mioare : 185.971 de capete;
capre : 29.479 de capete;
berbeci si tapi de reproductie : 8.122 de capete;
tineret : 27.125 de capete.(vezi diagrama 1)
DIAGRAMA 1
Ovinele din aceasta zona, se afla in proprietatea gospodariilor populatiei, in proportie covarsitoare. Din datele culese de la autoritatea sanitar-veterinara locala si de la medicii de libera practica, proprietarii de ovine si caprine pot fi impartiti in mai multe categorii:
■ proprietari cu numar mic de animale :
-de la 3-4 capete la 150-200 capete. Acesti proprietari isi cresc ovinele si caprinele in perioada de stabulatie in gospodaria proprie, cu furaje recoltate de pe pamantul proprietate personala.
In perioada de pasunat se constituie in carduri ( turme) de aproximativ 300-500 de capete, ce pasuneaza pe pasunea localitatii de resedinta. Miscarea ovinelor si caprinelor din aceasta categorie de proprietari, se face rar , iar cand se intampla schimburi de animale, cumparari sau mosteniri, se fac cu proprietarii din aceeasi localitate, exceptional cu proprietarii din localitatile invecinate.
■ proprietari cu numar mediu de ovine si caprine :
- de la 200-300 capete pana la 600 capete .
Acesti proprietari isi cresc animalele in perioada de stabulatie in gospodaria proprie, iar la pasune, constituie carduri separate, sau impreuna cu foarte putini proprietari cu numar mic de animale. Miscarea animalelor la acesti proprietari se face mai ales prin cumparari de reproducatori masculi. Berbecii de reproductie sunt cumparati din zona respectiva, sau rar din alte zone din tara.
■ proprietari cu numar mare de animale:
- incepand de la 600 de capete si peste 1000 de capete.
Acestia isi cresc animalele in spatii reamenajate de la fostele C.A.P.-uri sau I.A.S.-uri, sau in saivane construite la marginea localitatilor. Miscarea animalelor la aceasta categorie de proprietari se face prin cumparari de berbeci de reproductie si femele de reproductie, din toate zonele din tara sau din afara tarii.
In arealul geografic cercetat nu se practica transhumanta.
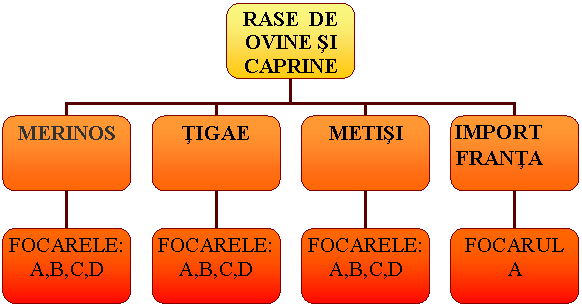
Rasele de ovine intalnite in arealul geografic studiat, sunt:
tigae ,
merinos si metisii acestora,
rase de lapte si carne, importate.
Controlul starii de sanatate la ovinele si caprinele luate in studiu, se face de catre medicii veterinari de libera practica. Conform programului de supraveghere a bolilor prionice, stabilit de Autoritatea Nationala Sanitar-Veterinara , trebuie afluite catre Laboratorul Sanitar-Veterinar Judetean , probe de creier sau creier in intregime, de la toate ovinele si caprinele moarte sau sacrificate in varsta de peste 18 luni .
La solicitarea proprietarilor de animale , medicii veterinari de libera practica
examineaza ovinele si caprinele moarte sau sacrificate , iar la animalele de peste 18 luni obligatoriu trebuie trimise probe pentru supravegherea scrapiei.
La ovinele si caprinele din arealul geografic analizat, au fost declarate , incepand cu anul 2002 mai multe focare de scrapie.
Din acestea sunt cercetate in prezenta lucrare ultimile patru focare, care au aparut in ultimii doi ani in localitati diferite, invecinate , asezate pe o raza de 30 km.
Focarele vor fi denumite in continuare:
Focarul A,
Focarul B,
Focarul C ,
Focarul D.
Animalele din focarele de boala au fost lichidate prin sacrificare sau eutanasiere.
Scrapia a aparut in efectivele mari de animale , avand rase diverse :
■ Focarele B,C,D:
tigae,
merinos,
metisi.
■ Focarul A:
tigae,
merinos,
metisi,
rasele de lapte si carne( importate din Franta).
(Vezi diagrama 2 .
DIAGRAMA 2
TABEL 1.
Numarul de animale din fiecare focar
|
Denumirea focarelor |
Ovine |
Caprine |
||||
|
Total |
Adulte |
Tineret |
Total |
Adulte |
Tineret |
|
|
Focarul A |
2651 |
2406 |
245 |
397 |
337 |
60 |
|
Focarul B |
1109 |
970 |
139 |
197 |
172 |
25 |
|
Focarul C |
1312 |
785 |
527 |
89 |
46 |
43 |
|
Focarul D |
273 |
182 |
91 |
145 |
126 |
19 |
TABEL 2.
Structura raselor de ovine la focarele luate in studiu
|
Rasa |
Focarul A |
Focarul B |
Focarul C |
Focarul D |
|
Merinos |
242 |
305 |
- |
- |
|
Lacaune |
339 |
- |
- |
- |
|
Linie de carne |
417 |
- |
- |
- |
|
Linie de lapte |
705 |
- |
- |
- |
|
Tigae cu capul negru |
728 |
- |
- |
- |
|
|
213 |
25 |
- |
- |
|
|
4 |
- |
- |
- |
|
Turcana |
3 |
- |
- |
- |
|
Tigae |
- |
265 |
- |
- |
|
Metisi Merinos |
- |
514 |
1312 |
273 |
|
Total |
2651 |
1109 |
1312 |
273 |
TABEL 3.
Structura raselor de caprine la focarele luate in studiu
|
Rasa |
Focarul A |
Focarul B |
Focarul C |
Focarul D |
|
Friza |
269 |
- |
- |
- |
|
Alba de Banat |
106 |
- |
- |
- |
|
Saanen |
6 |
- |
- |
- |
|
Alpina |
4 |
- |
- |
- |
|
Carpatina |
12 |
- |
- |
- |
|
Metisi |
- |
197 |
89 |
145 |
|
Total |
397 |
197 |
89 |
145 |
Structura de varsta a animalelor din focarele A si B nu depaseste 5-6 ani, majoritatea fiind pana la 4 ani , iar la animalele din focarele C si D , varsta este de maxim 7-8 ani.
Toate animalele sunt identificate prin crotaliere de catre medicii veterinari de libera practica, incepand cu anul 2005-2006.
Evidenta acestor animale este tinuta in baza de date informatizata , denumita :
- S. N. I. A.-Sistemul National de Identificare al Animalelor.
Animalele din focarul A au fost cazate in spatiile reamenajate ale unui fost I.A.S. In aceste spatii , I.A.S.-ul respectiv a crescut bovine la ingrasat.
Animalele din focarele B, C, si D au fost cazate in spatii de tip saivan, construite de catre proprietarii respectivi.
Furajarea animalelor:
se facea pe pasunele localitatilor de resedinta, sau pe miristile unor ferme vegetale.
furajarea se facea cu fan de lucerna, resturi vegetale (coceni, paie, vreji de leguminoase), mai ales la animalele din focarele B, C, si D. Deasemeni se mai foloseau in furajare, boabe de cereale, siloz de porumb, mai ales la focarul A.
Nu s-au folosit in hrana animalelor din focarele luate in studiu, fainuri proteice de origine animala.
Originea animalelor de la toate focarele este din prasila proprie si cumparari, mai putin la focarul C, unde proprietarul a declarat ca toate animalele sunt din prasila proprie.
Intrarile de ovine prin cumparari s-au facut in anii anterior diagnosticarii scrapiei, astfel:
☻proprietarul animalelor din focarul A, a declarat ca a cumparat ovine din rasele Merinos si Tigae cu capul negru, din diferite zone ale tarii, iar din Franta a importat ovine si caprine din rasele:
Lacaune,
Friza,
Alpina,
Saanen.
☻proprietarul animalelor din focarul B , a cumparat ovine din
localitatea de resedinta, dar si de la proprietarul
animalelor din focarul A, cu mult inaintea declararii scrapiei.
☻proprietarul animalelor din focarul D a cumparat si mostenit ovine de la proprietarul animalelor din focarul C. Intre cei doi proprietari existau relatii de rudenie.
La animalele luate in studiu au fost semnalate manifestari nervoase anterior declararii scrapiei, dar aceste manifestari au fost puse pe seama cenurozei, animalele respective fiind sacrificate, fara a fi anuntat medicul veterinar de libera practica.
Alte boli cu manifestari nervoase , cum ar fi:
listerioza,
rabia,
boala lui Aujeszky, nu au fost diagnosticate in ultimii ani la efectivele de animale luate in studiu.
Focarul A si C au fost declarate in urma diagnosticului de laborator, efectuat din probe de creier in anul 2007.
Din focarul A au fost trimise probe de creier de la 4 ovine si una caprina, moarte, ce au prezentat manifestari nervoase. La toate cele 5 probe de creier cercetate, s-au stabilit diagnostice de scrapie. Caprina avea varsta de 3 ani si era din rasa Alba de Banat, 3 ovine erau din rasa Tigae cu capul negru si avea varsta de 2 ani (doua dintre ele ) si respectiv 4 ani. A patra ovina era din rasa Merinos si avea varsta de 5 ani. (Vezi tabelul 4.)
TABEL 4.
DATELE ANIMALELOR DE LA CARE S-AU RECOLATAT PROBELE DE CREIER
FOCARUL A
|
NR.ANIMALE |
SPECIA |
RASA |
VARSTA |
DIAGNOSTIC |
|
1 |
Caprina |
Alba de Banat |
3 ani |
SCRAPIE POZITIV |
|
2 |
Ovine |
Tigae cu capul negru |
2 ani |
SCRAPIE POZITIV |
|
1 |
Ovina |
Tigae cu capul negru |
4 ani |
SCRAPIE POZITIV |
|
1 |
Ovina |
Merinos |
5 ani |
SCRAPIE POZITIV |
Focarele de boala B si D au fost declarate in anul 2008 si 2009. Din focarul B au fost trimise probe de creier la laborator, de la 4 ovine moarte si una sacrificata, care anterior prezentase manifestari nervoase. In urma cercetarilor de laborator , la una din ovine a fost diagnosticata scrapie. Avea varsta de 2 ani si era din rasa Tigae. (Vezi tabelul 5.)
TABELUL 5.
DATELE ANIMALELOR DE LA CARE S-AU RECOLATAT PROBELE DE CREIER
FOCARUL B
|
NR.ANIMALE |
SPECIA |
RASA |
VARSTA |
DIAGNOSTICUL |
|
1 |
OVINA |
METIS MERINOS |
3 ANI |
SCRAPIE NEGATIV |
|
1 |
OVINA |
TIGAE CU CAPUL NEGRU |
2 ANI |
SCRAPIE NEGATIV |
|
1 |
OVINA |
TIGAE |
2 ANI |
SCRAPIE POZITIV |
|
1 |
OVINA |
METIS MERINOS |
3 ANI |
SCRAPIE NEGATIV |
Din focarul C au fost trimise, de catre medicul veterinar de libera practica , 4 probe de creier , recoltate de la 4 ovine sacrificate , deoarece prezentau manifestari nervoase. La una dintre probe s-a diagnosticat cenuroza, iar la celelalte scrapie. Varsta animalelor a fost intre 2 si 4 ani(Vezi tabelul 6.) .
TABELUL 6.
DATELE ANIMALELOR DE LA CARE S-AU RECOLTAT PROBELE DE CREIER
FOCARUL C
|
NR.ANIMALE |
SPECIA |
RASA |
VARSTA |
DIAGNOSTIC |
|
1 |
OVINA |
METIS MERINOS |
2 ANI |
CENUROZA SCRAPIE NEGATIV |
|
1 |
OVINA |
METIS MERINOS |
3ANI |
SCRAPIE POZITIV |
|
1 |
OVINA |
METIS MERINOS |
3ANI |
SCRAPIE POZITIV |
|
1 |
OVINA |
METIS MERINOS |
4 ANI |
SCRAPIE POZITIV |
Focarul D a fost declarat in 2009, in urma diagnosticarii scrapiei prin metode de laborator, la una din cele doua probe de creier trimise de catre medicul veterinar de libera practica. (Vezi tabelul 7)
TABELUL 7.
DATELE ANIMALELOR DE LA CARE S-AU RECOLTAT PROBELE DE CREIER
FOCARUL D
|
NR.ANIMALE |
SPECIA |
RASA |
VARSTA |
DIAGNOSTIC |
|
1 |
OVINA |
METIS MERINOS |
3 ANI |
SRAPIE NEGATIV |
|
1 |
OVINA |
METIS MERINOS |
4 ANI |
SCRAPIE POZITIV |
Autoritatea Nationala Sanitar-Veterinara a hotarat , ca animalele din focarul A, B si C sa fie sacrificate in totalitate , iar animalele din focarul D sa fie eutanasiate.
Din focarul A, un numar de 688 de capete ovine si caprine, au fost sacrificate in abatoarele din aria geografica studiata, si au fost controlate sub raportul scrapiei la laboratorul sanitar veterinar prin testul Bio Rad Te Se E. Din cele 688 de capete ovine si caprine controlate, la 7 capete ovine si o caprina, s-a diagnosticat scrapie, confirmata si de laboratorul national de referinta.(vezi tabelele 8 si 9
TABEL 8.
OVINELE POZITIVE DIN FOCARUL A
|
Nr.crt. |
Varsta |
Sexul |
Rasa |
|
1 |
2 ani |
F |
Merinos |
|
2 |
3 ani |
F |
Merinos |
|
3 |
5 ani |
F |
Metis carne |
|
4 |
5 ani |
F |
Metis Merinos |
|
5 |
4 ani |
F |
Metis Tigaie |
|
6 |
2 ani |
F |
Metis carne |
|
7 |
2 ani |
F |
Metis lapte |
TABEL 9
CAPRINELE POZITIVE DIN FOCARUL A
|
Nr.crt. |
Varsta |
Sexul |
Rasa |
|
1 |
3 ani |
F |
Alba de Banat |
Restul animalelor din focarul A au fost sacrificate in afara ariei geografice luate in studiu.
Animalele din focarul B in numar de 1109, au fost sacrificate in abatoare din afara ariei geografice luate in studiu si un numar de 949, au fost controlate sub raportul scrapiei la Laboratorul National de Referinta. Din examenele efectuate de Laboratorul National de Referinta, toate probele au fost negative pentru scrapie.
La focarul C animalele au fost sacrificate in afara ariei geografice.
La focarul D, Autoritatea Nationala Sanitar Veterinara, a hotarat eutanasierea intregului efectiv si s-a dispus controlul sub raportul scrapiei, la un numar de 117 capete. Din esantioanele prelevate de la cele 117 capete, la niciunul, prin testul Bio Rad Te Se E, nu s-a stabilit diagnostic de scrapie.
Toate cele 18 probe pozitive, de la cele 4 focare de boala luate in studiu, au fost confirmate de Laboratorul National de Referinta si prin alte metode de laborator decat metoda Bio Rad Te Se E.
Tabloul clinic observat la cele 18 cazuri de scrapie diagnosticate si confirmate de Laboratorul National de Referinta pentru Encefalopatii Spongiforme Transmisibile vizeaza urmatoarele simptome:
Debut insidios,
Agitatie,
Ortopnee,
Agresivitate,
Tendinta la izolare,
Prurit intens,
Miscari reflexe ale buzelor,
Tremuraturi,
Leganat,
Miscari anormale ale capului,
Pareze,
Paralizii,
Slabire.
Sintetizarea pe sindroame a semnelor clinice observate, au permis identificarea in principal a urmatoarelor 4 categorii :
DIAGRAMA 3.
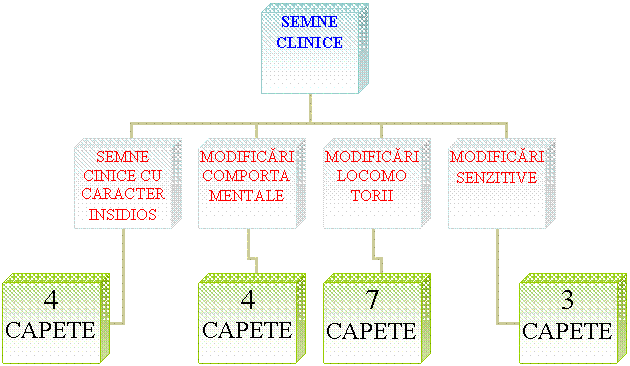
Cercetarile le-am efectuat atat in ferme, cat si in Laboratorul de Morfopatologie care efectueaza examene de laborator pentru E.S.T., din cadrul D.S.V.S.A.
Au fost luate in observatie un numar de 18 animale clinic bolnave, suspecte de scrapie.
Concomitent am urmarit, in abator, sacrificarile in regim de taiere normala a ovinelor, provenite din aceste ferme pentru a observa eventualele cazuri de scrapie, la care nu au fost evidentiate semne clinice, nici in ferma, nici la imbarcare si nici la examenul ante mortem.
De la ovinele cu semne clinice de scrapie a fost prelevat creierul integral.
De la ovinele sacrificate in abator, in regim de taiere normala, probele de creier au fost prelevate prin tehnica "foramen magnum".
Pentru examenul morfologic, probele de creier au fost procesate histologic prin tehnica de includere la parafina, aplicarea metodei de colorare H-E, sectiunile histologice obtinute fiind examinate la microscopul MC-5 A, la :
Detectia proteinei prionice patologice a fost efectuala in laborator, metoda utilizata fiind cea imunoenzimatica.
Diagnosticul histopatologic in cazul encefalopatiilor spongiforme transmisibile, comporta un protocol de lucru special, care presupune parcurgerea unor etape obligatorii astfel:
Pentru efectuarea examenului histopatologic de laborator se recolteaza tesut nervos central, atat prin tehnica foramen magnum, cat si creier integral. Recoltarea creierului integral se realizeaza, prin sectionarea cutiei craniene astfel: se efectueaza o sectiune trnsversala, pe cutia craniana, in spatele arcadelor orbitale, apoi doua sectiuni laterale longitudinale, plecand de la unghiul extern al ochiului, pana la condilii occipitali.
Se detaseaza portiunea craniana sectionata si se evidentiaza creierul invelit de meninge.(vezi figura 1)
FIGURA 1
Sectionarea cutiei craniene,cu evidentierea creierului invelit in meninge
Se sectioneaza meningele, pe linia mediana, la nivelul emisferelor cerebrale, cerebel si bulb, apoi se efectueaza 2 sectiuni transversale pe linia mediana, si se incearca scoaterea creierului, incepand cu sectionarea nervilor optici, apoi sectionarea tijei hipofizare si prin miscari lente si foarte atente, se scoate creierul integral din cutia craniana.(vezi figura 2. si 3.)
Meninge
![]() FIGURA 2.
FIGURA 2.
 Sectionarea meningelui
Sectionarea meningelui
![]()
![]()

FIGURA 3.
Creier
Creierul astfel recoltat, se fixeaza in formol salin 10%, asezandu-l cu emisferele cerebrale in jos si trunchiul cerbral in sus.(vezi fig 4.)
FIGURA 4.
Creierul pregatit pentru fixarea in formol salin 10%
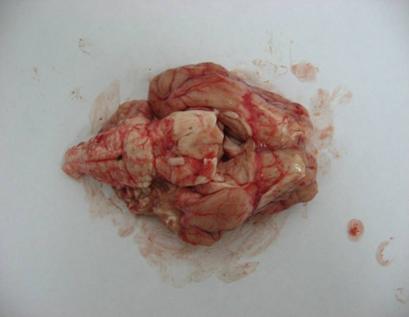 trunchiul cerebral
trunchiul cerebral
Din creier, astfel recoltat, inainte de a fi introdus in formol salin, se preleveaza tesut nervos, pentru efectuarea metodei imunoenzimatice.
Solutia de fixare se prepara astfel:
- 100ml formol Merck,
- 900 ml apa distilata,
- 8,5 g clorura de sodiu.
Se dizolva clorura de sodiu in apa distilata, se adauga formolul si se amesteca.
Solutia de formol salin, se pastreaza la temperatura camerei timp indelungat.
Dupa 2 saptamani, din creierul fixat in formol salin, se preleveaza portiuni de bulb rahidian, protuberanta anulara si mezencefal, ce se lasa pentru refixare pana a doua zi.
Sectiunile, in grosime de maxim 2-3 mm, sunt trecute din recipienti cu fixator, in casetele de platic, pentru a fi procesate histologic.(vezi figurile 5 si 6).
FIGURA 5
Fasonarea pieselor de tesut nervos sub hota

Piesele de tesut nervos
FIGURA 6. Piesele de tesut nervos
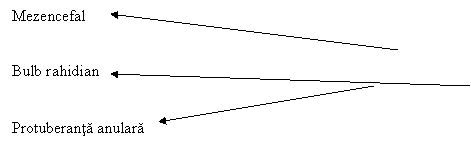
![]()
![]()

Procesarea histologica, se efectueaza in 3 etape sucesive:
- deshidratare si includere in parafina,
- sectionarea si etalarea pe lama,
- colorarea.
Din recipientii cu fixator, dupa refixare si fasonare, probele se reintroduc in casete de plastic si se trec prin recipienti, continand urmatorii reactivi si parcurgand urmatoarele etape: (vezi tabelul 10).
TABEL 10
ETAPELE SI RECIPIENTII METODEI MANUALE
|
Nr curent |
Reactiv/baie |
Timp de reactie |
|
Alcool etilic absolut I |
15 minute |
|
|
Alcool etilic absolut II |
15 minute |
|
|
3 |
Alcool etilic absolut III |
15 minute |
|
4 |
Alcool-acetona(1/1) I |
10 minute |
|
5 |
Alcool-acetona(1/1) II |
20 minute |
|
6 |
Alcool-acetona(1/1) III |
30 minute |
|
7 |
Acetona I |
20 minute la tremostat |
|
8 |
Acetona II |
40 minute la termostat sau peste noapte la temperatura camerei |
|
9 |
Toluen I |
20 |
|
10 |
Toluen II |
20 |
|
11 |
ParafinaI |
20 |
|
12 |
Parafina II |
20 |
|
13 |
Parafina III |
20 |
|
14 |
Includere la parafina |
20 |
Lamele histologice se trateaza cu albumina MAYER, fiind gata pregatite pentru a se etala sectiunile obtinute la microtom. Cubul de parafina, cu fragmentul de tesut inclus, se fixeaza in microtom , se regleaza microtomul, pentru obtinerea de sectiuni in grosime de 4-5 microni.
Sectiunile sunt colectate cu o ansa si sunt asezate in baia histologica termostata, de unde sunt etalate pe lama histologica tratata cu albumina Mayer. Lama cu sectiuni, se aseaza pe plita histologica termostata, pentru a se etala cat mai bine. Etalarea sectiunilor pe lama, se face cu mare grija, pentru a nu se rupe proba.
Dupa aceea, se aseaza pe stativ si se introduc in termostat timp de cateva minute, pentru a se obtine o etalare cat mai buna. Microsectiunile histologice, astfel obtinute, inainte de a fi colorate, sunt supuse unei etape de deparafinare si hidratare.
Microsectiunile histologice astfel obtinute, inainte de a fi colorate, sunt supuse unei etape de deparafinare si hidratare. Deparafinarea s-a efectuat prin trecerea lamelor cu sectiunile etalate prin bai cu toluent(solvent al parafinei).
Metoda de colorare uzuala folosita in laboratoare, pentru supravegherea EST-urilor este metoda HEMATOXILINA-EOZINA. Cu aceasta metoda de colorare, s-a pus in evidenta vacuolizarile specifice, intalnite in scrapie.
Lamele cu sectiunile histologice permanente, sunt scoase din cuva cu toluen pentru deparafinare si mutate in cuva cu reactivi din baile de hidratare si colorare.(vezi tabelul 11)
TABELUL 11
ETAPELE COLORARII SECTIUNILOR PRIN PROCESARE MANUALA.
|
NR.CURENT |
REACTIVI/BAIE DE COLORARE |
TIMP DE REACTIE |
|
Alcool etilic absolut |
5 minute |
|
|
2 |
Alcool etilic 96° |
5 minute |
|
3 |
Alcool etilic 70° |
5 minute |
|
4 |
Apa distilata |
10 minute |
|
5 |
Hematoxilina Meyer(solutie alcoolica) |
10 minute |
|
6 |
Apa distilata |
Spalare |
|
7 |
Apa robinet |
2 minute |
|
8 |
Apa litinata |
2 minute |
|
9 |
Apa robinet |
Spalare |
|
10 |
Apa distilata |
Spalare |
|
11 |
Eozina(solutie alcoolica) |
7 secunde |
|
12 |
Apa distilata |
Spalare |
|
13 |
Apa distilata |
Spalare |
|
14 |
Toaletarea lamelor cu atentie pentru evitarea uscarii sectiunilor | |
|
15 |
Alcool 70° |
Spalare |
|
16 |
Alcool 96° |
Spalare |
|
17 |
Alcool etilic absolut |
Spalare |
|
18 |
Toluen |
Clarificare |
|
19 |
Montare cu balsam de Canada |
Sectiunile histopalogice s-au montat cu balsam de Canada, si au fost examinate la microscopul optic MC 5, cu ob.4-20, pentru a localiza zonele de interes, iar dupa aceea, s-au examinat in detaliu cu ob.40,63,100, folosind ocularele de 10. Sursa de lumina se regleaza din condesator in functie de obiectivul cu care se examineaza.(vezi figura 7).
In preparatele histopatologice obtinute de la ovinele din focarele analizate, au aparut modificari vacuolare la nivelul pericarionilor , degenerescenta pericarionilor, atrofia si liza acestora.(vezi figurile 8,9,10
De asemenea au fost modificari spongiforme la nivelul neuropilului.
FIGURA 7
EXAMINAREA IN MICROSCOPUL OPTIC

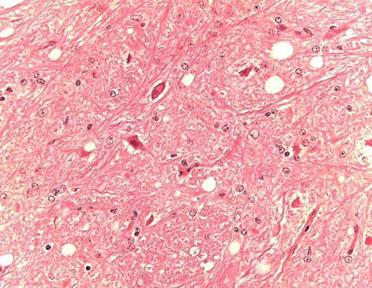
FIGURA 8 Modificari spongiforme ale neuropilului cu degenerscenta,
atrofia si liza pericarionilor
FIGURA 9 Modificari
spongiforme ale neuropilului cu liza pericarionilor
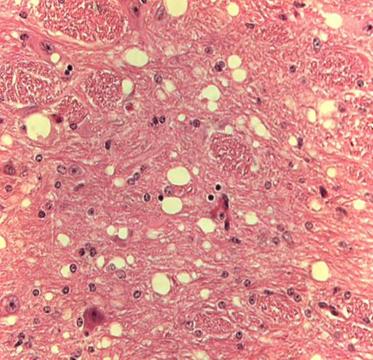
FIGURA 10 Pericarion retractat,cu nucleu picnotic si cu o vacuola
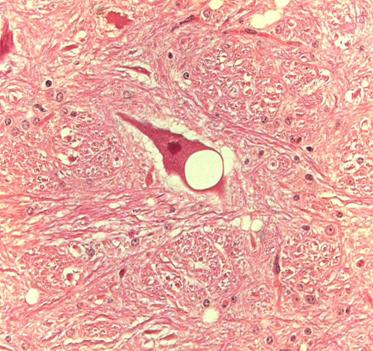
Informatiile primite din examenul clinic al animalelor, nu sunt elemente determinante in precizarea diagnosticului de scrapie. Pornind de la realitatile prezente, (lipsa raspunsului imun si a unui test de diagnostic intravitam), elementele obtinute prin examen clinic, sunt esentiale in diagnosticul scrapiei, dar nu determinante.
Diagnosticul postmortem pe probe de creier este unica posibilitate, de a stabili cu certitudine , prin metode de laborator, scrapia.
In laboratorul din aria geografica a focarelor de scrapie mai sus amintite, am efectuat teste pentru detectia proteinei prionice anormale, pe probe de creier recoltate postmortem, folosind trusa Te Se E-BioRad.
Detectia se bazeaza pe doua etape de reactie:
► Etapa de purificarea PrPsc,
► Etapa de detectie PrPsc.
Reactivii trusei de purificare TeSeE permit :
► purificarea,
► concentrarea,
► solubilizarea , PrPsc din esantioane de tesut nervos prelevate de la animalele infectate.
Sunt cuprinse urmatoarele momente:
Purificarea PrPsc-ului s-a efectuat din esantioane de tesut nervos. Deoarece PrPsc este distribuit in mod eterogen in sistemul nervos central, pentru asigurarea unei detectii optime, prelevarile au fost facute cu precadere din obexul trunchiului cerebral, cu seringi de prelevare, care au permis o prelevare rapida si facila. Daca purificarea se facea a doua zi, esantioanele erau pastrate la temperatura frigiderului, intre +2° Celsius si +8° Celsius, sau la congelator , daca purificarea se facea dupa un timp indelungat.
Tubul de omogenizare
Este un tub cu capac cu filet, ce contine bile de ceramica, in solutie tampon si are un volum de 1,5 ml;
Reactivul A
Este o solutie denaturanta si constituie tamponul de diluare a proteinazei K;
Reactivul B
Este o solutie de clarificare, contine albastru de bromfenol;
Reactivul C
Este tamponul de resolubilizare ;
Proteinaza K
Este o enzima , ce contine rosu de fenol.
Toti reactivii din trusa de purificare TeSeE, cu exceptia proteinazei K, sunt gata de utilizare. Proteinaza K se dilueaza cu reactivul A.
Solutia de lucru de proteinaza K se prepara dupa cum urmeaza (4 μl proteinaza K intr-un ml de reactiv A) (vezi tabelul 12)
TABELUL 12
PREPARAREA SOLUTIEI DE PROTEINAZA K
|
Numarul de probe |
Reactiv A |
Proteinaza K |
|
2 |
1 ml |
4 μl |
|
10 |
3 ml |
12 μ |
|
18 |
5 ml |
20 μl |
|
26 |
7 ml |
28 μl |
|
34 |
9 ml |
36 μl |
|
42 |
11 ml |
44 μl |
|
50 |
13 ml |
52 μl |
|
58 |
15 ml |
60 μl |
|
66 |
17 ml |
68 μl |
|
74 |
19 ml |
76 μl |
|
82 |
21 ml |
84 μl |
|
90 |
23 ml |
92 μl |
Volumele indicate, pentru reconstituirea solutiei de lucru de proteinaza K, trebuie pipetate exact. Varful pipetei ce contine proteinaza K, trebuie clatit corect, prin cicluri succesive de aspiratie/ejectie in reactivul A.
Solutia de lucru de proteinaza K, a fost preparata, intr-un tub de polipropilen de 50 ml. Dupa reconstituiere, s-a omogenizat solutia, prin rasturnari usoare a flaconului, de cateva ori, pana la obtinerea unei solutii de culoare rosie uniforma.
Omogenizarea trebuie facuta in asa fel, incat sa se evite formarea spumei.
Reactivii din trusa de purificare Te Se E, sunt pastrati la o temperatura cuprinsa intre
+ 2° Celsius si +8° Celsius. Toti reactivii la aceasta temperatura, sunt stabili pana la data indicata pe trusa.
Dupa reconstituire, solutia de proteinaza K, poate fi pastrata la temperatura camerei (+18° Celsius/+30° Celsius) maxim 6 ore.
Testul Bio Rad, Te Se E , se executa din prelevate de tesut nervos central, in greutate de 350 mg ± 40 mg.
Regiunea anatomica, specifica destinata detectiei PrPsc la animalele infectate, este trunchiul cerebral (bulbul rahidian), mai exact aria nucleului nervului vag, in regiunea obexului.
Aceasta regiune, este aria trunchiului cerebral in care PrPsc, are cea mai mare concentratie.
Trunchiul cerebral (bulbul rahidian ), se preleveaza usor si repede, cu ajutorul unei spatule speciale, prin foramenul occipital, fara deschiderea cavitatii craniene.
☻Tehnica recoltarii bulbului rahidian prin "foramen magnum"
■Materiale necesare(vezi figura 11).
▲Trusa de recolatre:
☺-spatula speciala de polipropilen;
☺-borcan de polipropilen cu capac infiletat;
☺-eticheta pentru identificarea probei;
☺-punga de palstic pentru ambalare.
▲Foarfec chirurgical;
▲Pensa anatomica;
▲Manusi.
FIGURA 11.
Materiale necesare pentru recoltarea bulbului rahidian
■ Modul de lucru:
Capul rumegatorului mic, se aseaza pe masa de lucru, cu regiunea mandibulara orientata in sus. Se prinde meningele cu pensa anatomica, iar cu foarfecul chirurgical, se sectioaneaza, lateral stanga/dreapta bulbului rahidian, nervii cranieni si se detaseaza cat mai mult meningele de trunchiul cerebral.
Se introduce spatula speciala, intre meninge si bulb, cat mai profund si printr-o miscare in jos, se incearca detasarea bulbului rahidian de restul trunchiului cerebral.(vezi figura 12)
Bulbul rahidian este introdus in flaconul de polipropilen, cu capac infiletat, se lipeste eticheta, se identifica proba si se ambaleaza in punga de plastic, urmand a fi expediata la laboratul sanitar veterinar, insotite de documentele sanitar veterinare, respectand masurile de biosecuritate.
FIGURA 12.
Cap de ovina
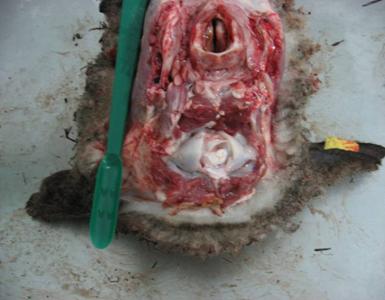
In laborator, probele sunt inregistrate in registrul de diagnostic si fisa de lucru . Sunt desigilate in hota cu fluz laminar, de catre specialistul echipat corespunzator:
Zona hotei este cea mai contaminata din intreg laboratorul.
Prelevarea tesutului nervos se face cu seringa Bio Rad ce este alcatuita dintr-un piston de culoare verde si un corp de seringa transparent. Corpul seringii este gradat prin serii de forme geometrice( ∆ │). (Vezi figurile 13,14)
FIGURA 13
SERINGA BIO RAD
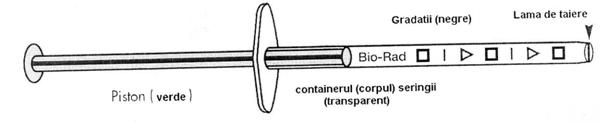
FIGURA 14
SERINGA BIO RAD

Masa de proba recoltata trebuie sa ocupe spatiul dintre doua simboluri de aceeasi forma corespunzator unei mase(m) de 350 mg ± 40 mg.(vezi figura 15
FIGURA 15
SCHEMA CU MODUL DE RECOLTARE AL PROBEI, CU SERINGA BIO RAD
Se ia seringa de prelevare, se trage in afara pistonul verde, pana la aproximativ 1cm de garda corpului seringii, apoi se impinge pistonul inapoi in pozitia de baza.(vezi figura 18)
Aceasta operatiune faciliteaza aspirarea mai usoara a tesutului nervos in seringa.
Bulbul rahidian se scoate din flaconul de polipropilen, se aseaza pe o bucata de folie de unica folosinta. Cu o mana se prinde ferm bulbul rahidian, folosind bucata de folie pe care a fost asezat, pentru evitarea contaminarii probelor intre ele. Capatul terminal al bulbului rahidian trebuie sa ramana accesibil. Cu cealalta mana, se plaseaza capatul deschis al seringii de prelevare, in partea dreapta, sau in partea stanga a capatului caudal al bulbului rahidian.
Se introduce treptat corpul seringii in bulbul rahidian, in timp ce se trage pistonul verde pentru aspirarea tesutului nervos. Se opreste aceasta miscare de inaintare a corpului seringii, cand s-a atins limita superioara a zonei de prelevare (obex). Se taie miezul probei prin rasucirea corpului seringii cu o tura completa.(vezi figurile 16,17)
FIGURA 17. Recoltarea tesutului nervos din bulbul rahidian cu ajutorul
seringii Bio Rad FIGURA 16. Recoltarea tesutului nervos din bulbul rahidian sub hota


Se scoate seringa de prelevare din bulbul rahidian, avand grija sa nu se deterioreze tesuturile din jur.
FIGURA18
RECOLTAREA DIN BULBUL RAHIDIAN
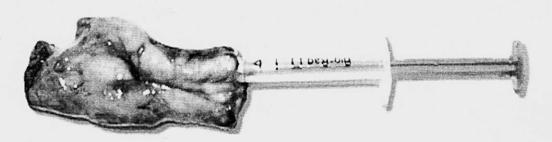
Bulbul rahidian ramas, se introduce in flaconul sau original. Se verifica daca au fost prinse bule de aer, in portiunea de proba recolatata. Bulele de aer se elimina prin comprimarea probei astfel: se inchide capatul corpului seringii, si se preseaza pistonul verde avand grija sa nu se piarda tesut nervos recoltat.
Se ia un tub Greending cu bile ceramice care in prealabil se cantareste la balanta analitica.(vezi figura 19)
FIGURA 19.
BALANTA ANALITICA

Se scoate capacul tubului, iar cu seringa de prelevare se impinge cu grija pistonul verde in intervalul dintre doua simboluri identice, care reprezinta cantitatea corecta de tesut nervos.
Se taie proba prin presarea capatului seringii de prelevare, contra marginii interioare a tubului de omogenizare.
Se insurubeaza capacul tubului, apoi se aseaza in sistemul RIBOLYSER. (vezi figurile 20,21). Probele de calitate proasta, ce prezentau un grad avansat de autoliza se pipeteaza direct din flaconul cu care s-a transportat proba.
Seringa de prelevare si folia de unica folosinta, sunt depuse in containerul marcat cu dunga rosie, unde se colecteaza materialele cu risc maxim de contaminare.

OMOGENIZAREA PROBELOR
Tuburile de omogenizare cu tesut nervos in ele, se aseaza pe suportul circular al omogenizatorului (sistemul RIBOLYSER) Se fixeaza tuburile in aparat, pentru a se evita dislocarea capacelor si contaminarea aparatului. Se efectueaza un ciclu de agitare la anumiti parametri.(vezi tabelul 13)
TABELUL 13
PARAMETRII CICLULUI DE OMOGENIZARE
|
RIBOLYSER |
|
|
TIMP(SECUNDE) |
45 |
|
VITEZA |
6,5 |
Acesti parametri se seteaza din meniul aparatului. Daca omogenizarea nu este suficienta se efectueaza unul, doua, cicluri suplimentare de agitare avand grija ca temperatura tubului sa revina la temperatura ambiamta intre fiecare ciclu, prin mentinerea pe gheata.
CALIBRAREA PROBELOR
Se scot tuburile de omogenizare, din sistemul RIBOLYSER, iar inainte de a le deschide, se resuspenda continutul, prin rasturnare. Se transfera 250 μl de suspensie de tesut nervos din tubul de omogenizare, in eprubetele Eppendorf de 2 ml, cu ajutorul unei seringi de calibrare.
Acul seringii de calibrare se introduce dedesuptul startului de sfere ceramice, pentru a preintampina aspirarea fragmentelor de tesut nervos omogenizate necorespunzator.
Omogenatele din tuburile de omogenizare, cat si cele transferate dupa calibrare, se pot pastra la temperatura ambianta, 8 ore pe gheata sau la frigider 15 ore, la congelator la -20° un an de zile. In cazul utilizarii ulterioare, decongelarea se face la temperatura ambianta, intre +18° si +30°
TRATAMENTUL CU PROTEINAZA K
Se repartizeaza 250μl de proteinaza K diluata, in fiecare eprubeta Eppendorf ce contine omogenat de tesut nervos.(vezi figura 22)
Se omogenizeaza continutul din eprubete, prin rasturnari repetate si se incubeaza la 37° ± 2° intr-o baie uscata termostata (termobloc), timp de 10 minute ± 1 minut.(vezi figura23)
O atentie deosebita in aceasta etapa, trebuie acordata omogenizarii solutiei diluate de proteinaza K, cu suspensia de tesut nervos. Operatiunea se efectueaza prin rasturnari repetate de cel putin 10 ori. De asemenea nu trebuie depasit intervalul de 5 minute de la pipetarea proteinazei K reconstituite, de la prima pana la ultima eprubeta.Totodata nu trebuie depasite 2 minute intre omogenizarea cu proteinaza K si introducerea eprubetelor in termobloc pentru incubare la 37°.
FIGURA 22 FIGURA 23
Repartizarea proteinazei K diluate Incubarea la termobloc


PRECIPITAREA PrPsc CU TAMPONUL B
Se scot microtuburile din termobloc si se aseaza in blocurile pentru centrifugare.(vezi figura 24)
Se deschid capacele tuburilor Eppendorf si se adauga 250μl de tampon B in fiecare eprubeta .(vezi figura 25)
Se omogenizeaza continutul prin rasturnari repetate, pana la obtinerea unei culori albastre uniforme. Si in acesta etapa se respecta intervalele stabilite la tratamentul cu proteinaza K.
Repartizarea tamponului B se face la hota, deoarece este clasificata ca fiind o substanta nociva, continand mai mult de 25% alcool.
FIGURA 24 FIGURA 25
Scoaterea microtuburilor din termobloc Precipitarea cu tamponul B

CONCENTRAREA PrPsc PRIN CENTRIFUGARE
Dupa distribuirea si amestecarea tamponului B, eprubetele Eppendorf asezate in blocurile de centrifugare echilibrate, se centrifugheaza timp de 7 minute la 15.000xg la 20° Celsius.(vezi figurile 26,27)
FIGURA 26 FIGURA 27
Centrifugarea eprubetelor Eppendorf Centrifuga
CLARIFICAREA PROBELOR
Dupa centrifugare, se elimina supernatantul, prin rasturnare, deasupra unui recipient de deseuri biologice, apoi eprubetele se lasa rasturnate pe o hartie de filtru absorbanta, pentru scurgere, timp de 5 minute. Se perforeaza capacele eprubetelor Eppendorf.
Aceste operatiuni se efectueaza in hota.
Se adauga 25μl de reactiv C, in fiecare eprubeta Eppendorf, apoi se incubeaza in termobloc la 100° Celsius ± 5° Celsius timp de 5 minute ± 1 minut.(vezi figura 28)
Se scot eprubetele din termobloc si se omogenizeaza la vortex timp de 5 secunde.(vezi figura 29)
Probele astfel obtinute pot fi conservate 5 ore la frigider sau 24 ore la congelator, la -20° Celsius. Probele congelate, trebuie dezghetate la temperatura camerei si omogenizate prin vortexare, timp de 5 secunde, inainte de utilizare.
Aceasta operatiune reprezinta sfarsitul etapei de purificare.
FIGURA 28 FIGURA 29
Incubarea la termobloc Vortexarea eprubetelor
dupa ce a fost adaugat reactivul C

Etapa de detectie Te Se E, este conceputa, pe baza unei tehnici imunoenzimatice, ce foloseste doi anticorpi monoclonali pentru detectia in tesuturile nervoase prelevate de la animalele infectate, a proteinei prionice anormale, rezistenta la proteinaza K .
Cu trusa de detectie se pot efectua 192 de teste, in care sunt incluse controalele negative si pozitive.
Faza solida a trusei de detectie, este alcatuita din 12 barete de 8 godeuri de poliestiren ai caror pereti sunt acoperiti cu primul anticorp monoclonal. Cel de-al doilea anticorp monoclonal este marcat cu peroxidaza.
Testarea cuprinde urmatoarele etape de reactie:
|
ETICHETA |
TIPUL REACTIVULUI |
|
R1 |
MICROPLACA:12 barete de 8 godeuri sensibilizate cu anticorp monoclonal anti PrP: 2 bucati |
|
R2 |
SOLUTIE DE SPALARE: concentrat 10X de tampon TRIS-NaCl PH 7,4. Conservant: mertiolat de sodiu(0,01%) |
|
R3 |
CONTROL (martor negativ): tampon TFS PH 7,2 suplimentat cu albumina serica bovina (ASB).Conservant : ProClin 300 ,0.1% |
|
R4 |
CONTROL (martor pozitiv): Tampon TFS PH 7,4 suplimentat cu peptide de sinteza neinfectioase liofilizat. Conservant: ProClin 300, 0,1% |
|
R6 |
DILUANT DE PROBE: Tampon TFS PH 7,2 suplimentat cu ASB si Rosu de Fenol. Conservant ProClin 300, 0,1%. |
|
R7 |
CONJUGAT: Solutie concentrata 10X de anticorpi monoclonali anti PrP marcati cu peroxidaza, in tampon TFS, PH 7,1 suplimentat cu proteine bovine si colorat cu Rosu de Fenol. Conservant: ProClin 300, 0,1%. |
|
R8 |
TAMPON SUBSTART PENTRU PEROXIDAZA: Solutie de acid citric si acetat de sodiu, PH 4,0 ce contine 0,015% H2O2 si 4% dimetil sulfoxid(DMSO). |
|
R9 |
CROMOGEN: Solutie de tetrametil benzidina(TMB) |
|
R10 |
SOLUTIA DE STOPARE: Acid sulfurin 1N |
|
FOLIE ADEZIVA |
Urmatorii reactivi, sunt componente generice: diluantul de probe (R6), solutia de spalare(R2), tamponul substrat pentru peroxidaza(R8), cromogenul(R9) si solutia de stopare(R10).
Reactivii generici se pot folosi cu toate loturile de truse de detectie Te Se E.
Inainte de a fi utilizati, reactivii trusei de detectie, se lasa la temperatura camerei timp de 30 minute.
Reactivi gata de utilizare:
micoplacile(R1): inainte de deschiderea ambalajului vidat, se lasa microplaca sa ajunga la temperatura camerei, in ambalajul de protectie in scopul prevenirii condensarii apei in godeuri. Deschiderea ambalajului se face la punctul de sudura si se scot atatea barete, cate avem nevoie si se reintroduc baretele nefolosite in ambalaj, se inchide ermetic, avand grija, sa scoatem pe cat posibil aerul din interior. Se pastreaza la frigider,
controlul negative (R3),
diluantul probelor (R6),
solutia de stopare (R10).
Reactivi de preparat:
- solutia de spalare (R2) se prepara prin diluarea solutiei de spalare R2, care e concentrata de 10X, cu apa distilata sau apa ultra pura.
Exemplu:100 ml de reactiv R2 se amesteca cu 900ml de apa distilata.
- controlul (martorul) pozitiv (R4): se loveste cu blandete flaconul ce contine contolul pozitiv R4, de masa, in scopul desprinderii substantei ce adera eventual la dopul de cauciuc.
Se deschide flaconul si se dizolva continutul acestuia, in 4ml de diluant R6. Se astupa la loc flaconul si se lasa in asteptare timp de 1 minut, amestecand delicat si regulat pentru a favoriza dizolvarea.
- conjugatul (R7): se dizolva reactivul R7 in proportie de 1/10, cu solutia de spalare reconstituita.
Exemplu:0,1 ml (100μl) de reactiv R7 in 0,9 ml(900μl )de solutie spalare reconstituita.
Cantitatea de 1ml (100μl) de conjugat reconstituit, este suficienta pentru o bareta cu 8 godeuri.
Solutia obtinuta se omogenizeaza delicat.
- solutia de developare enzimatica (R8+R9): se dilueaza reactivul R9, in proportie de 1/11 cu reactivul R8.
Exemplu: 0,1ml de reactiv R9, cu 1ml de reactiv R8. Cantitatea obtinuta de 1,1ml de solutie de developare enzimatica, este suficienta pentru o bareta cu 8 godeuri. Solutia astfel obtinuta, se omogenizeaza delicat.
Inainte de utilizare, reactivii din trusa, se pastreaza la temperatura frigiderului(+2° la +8°).
La aceasta temperatura, toti reactivii sunt stabili, pana la data expirarii inscrisa pe ambalaj. Dupa reconstituire reactivii au urmatoarea valabilitate:
|
ETICHETARE |
REACTIVI |
VALABILITATE |
|
R1 |
Microplaca in punga inchisa ermetic |
1 luna la frigider |
|
R2 |
Solutie de spalare diluata |
24 ore la temperatura camerei/2 saptamani la frigider |
|
R4 |
Control pozitiv reconstituit |
2 ore la temperatura camerei/4 ore la frigider/6 luni la congelator(-20° celsius); se alicoteaza solutia reconstituita in fractii de 250μl care se congeleaza imediat la -20°celsius |
|
R7 |
Conjugat reconstituit (in solutia de spalare diluata) |
8 ore la temperatura camerei |
|
R8+R9 |
Solutia de developare enzimatica |
6ore la temperatura camerei obilatoriu la intuneric |
Esantioanele obtinute in etapa de purificare, se dilueaza cu 125 μl de reactiv R6. Se omogenizeaza la vortex, 5 secunde. Esantioanele astfel diluate, sunt gata de a fi pipetate in microplaca.
FIGURA 30
CADRU SUPORT SI BARETE

2. Se pipeteaza in godeuri in urmatoarea ordine:
- in godeurile A1, B1, C1, D1 cate 100μl de martor negativ R3.
- in godeurile E1 si F1 cate 100 μl de martor pozitiv R4, ce a fost scos de la congelare cu cel putin 30 minute inainte.
- in godeurile G1, H1 si urmatoarele, se pipeteaza, 100 μl din esantioanele probelor de cercetat diluate cu R6.(vezi figura 31)
FIGURA 31
PROBELE PIPETATE

FIGURA 32
INCUBAREA PLACII

4. Se prepara solutia de spalare R2, sau se scoate de la frigider, daca a fost preparata in ultimile 2 saptamani.
5. Se prepara solutia de conjugat.
6. La expirarea celor 30 minute, se scoate placa din incubator, se indeparteaza folia adeziva si se efectueaza 3 cicluri de spalare la spalatorul de microplaci, selectionaduse programul PV40.(vezi figura 33)
FIGURA 33
SPALAREA MICROPLACII

Nu se lasa microplaca, sa stea mai mult de 5 minute dupa ultimul ciclu de spalare, pentru a preveni uscarea godeurilor. Inainte de a trece la etapa urmatoare, se scurg bine baretele prin rasturnare si tapotare deasupra unei hartii de filtru absorbante.
7. Se adauga 100μl de solutie conjugat in fiecare godeu.
8. Se acopera cu folie adeziva si se incubeaza 30 minute ±2 minte, la temperatura frigiderului.
9. Se prepara solutia de revelare enzimatica.
La sfarsitul celor 30 de minute, se scoate microplaca din frigider, se indeparteaza folia adeziva si se efectueaza 5 cicluri de spalare la spalatorul de microplaci PV40, la care s-a setat programul TSE5.
Se respecta observatiile facute la punctul 6.
10. Se adauga 100 μl de solutie de developare enzimatica, in fiecare godeu si se aseaza microplaca la intuneric, la temperatura camerei timp, de 30 minute± 5 minute.
Nu se acopera placa cu folie adeziva, pe durata acestei incubari.
11. Se adauga 100 μl de solutie de stopare in fiecare godeu.(vezi figura 34)
FIGURA 34
SOLUTIA DE STOPARE
12. Se sterge cu grija fundul godeurilor de umezeala si eventualele amprente si se citeste densitatea optica (la 2 lungimi de unda, una de referinta), la 450nm-620nm, in maxim 30 de minute de la stoparea reactiei enzimatice.(vezi figura 35)
FIGURA 35
CITIREA DENSITATII OPTICE

AUTORITATEA SANITARA VETERINARA SI PENTRU SIGURANTA ALIMENTELOR
DIRECTIA SANITARA VETERINARA SI PENTRU SIGURANTA ALIMENTELOR
LABORATORUL SANITAR VETERINAR DE STAT
Se valideaza rezultatele obtinute
Sef Laborator -EST
FISA DE LUCRU
TEST TeSeE BIO-RAD PLACA NR./DATE
|
Unitatea . . . . . . . . . . . . . . . Felul si nr. Probelor . . . . . . .. Nr.R.U . . . . . . . . Nr.B.A . . . . . . . |
Numar proba T P A L B A E C L A |
E T A P A |
OPERATIUNEA |
TIMPUL |
Preparare reactivi |
|
|
1 |
G1 |
PRELEVARE TESUT NERVOS |
Preparare Proteinaza K: 2 probe: 1ml reactiv A + 4 ul proteinaza K Preparare control (martor) pozitiv (R4): Se dizolva liofilizatul cu 4 ml de diluant R6 |
|||
|
2 |
H1 |
CANTARIREA PROBEI | ||||
|
3 |
A2 |
OMOGENIZAREA AUTOMA- TA +2-3 rasturnari |
45 sec/ set |
|||
|
4 |
B2 |
|||||
|
5 |
C2 |
TRANSFER OMOGENAT/250ul in tuburi Eppendorf | ||||
|
6 |
D2 |
|||||
|
7 |
E2 |
PROTEINAZA/250ul | ||||
|
8 |
F2 |
VORTEX |
2 min |
|||
|
9 |
G2 |
INCUBARE 37 gr.C/10min. |
||||
|
10 |
H2 |
Scoatere de la incubare |
2 min |
|||
|
11 |
A3 |
TRANSFER/suport centrifuga |
||||
|
12 |
B3 |
Reactiv B/250ul-la nisa T.clarificare |
||||
|
13 |
C3 |
|||||
|
14 |
D3 |
Vortex la nisa |
||||
|
15 |
E3 |
Centrifugare 20000g/15000rot./min. |
7 min |
|||
|
16 |
F3 |
|||||
|
17 |
G3 |
USCARE/HARTIE DE FILTRU |
5 min |
|||
|
18 |
H3 |
Reactiv C1/25ul |
2 min |
|||
|
19 |
A4 |
T.Solubilizare |
||||
|
20 |
B4 |
Incubare la 100 gr.C/5 min |
||||
|
21 |
C4 |
Scoatere de la incubare | ||||
|
22 |
D4 |
Vortex |
5±2 sec. |
|||
|
23 |
E4 |
Diluant R6/125ul (dupa diluare probele se pot pastra la frigider 5 ore) | ||||
|
24 |
F4 |
|||||
|
25 |
G4 |
|||||
|
26 |
H4 |
Vortex |
5±2 sec. |
|||
|
27 |
A5 |
Pregatirea microplacii | ||||
|
28 |
B5 |
Preparare R4(M+) (liofilizat +2 ml R6) | ||||
|
29 |
C5 |
|||||
|
30 |
D5 |
Distribuirea R3(M-)100ul A1-B1-C1-D1 | ||||
|
31 |
E5 |
|||||
|
32 |
F5 |
Distribuirea R4(M+)/100ul E1-F1 | ||||
|
33 |
G5 |
|||||
|
34 |
H5 |
Distribuire probe in microplaca G1->/100ul | ||||
|
35 |
A6 |
|||||
|
36 |
B6 |
Folie/microplaca | ||||
|
37 |
C6 |
Incubare/37 gr.C/30±2 min |
30±2 min |
|||
|
38 |
D6 |
|||||
|
39 |
E6 |
|||||
Formular cod:5.4.7.1.-LHS-EST-02
|
40 |
F6 |
Preparare solutie de spalare (100ml R2+900ml AP) |
Preparare sol.spalare ( 100 ml R2 + 900 ml AP) Preparare sol.conjugat Pt. 1 rand godeuri: 0,1 ml R7+ 0,9 ml sol.spalare Practic: 1,5 ml R7+ 13,5 ml sol.spalare Dilutia este 1/10 Preparare sol.develo- pare 0,1 ml R9+ 1 ml R8 sau 1 ml R9+10 ml R8 Dilutia este 1/11 |
|||
|
41 |
G6 |
|||||
|
42 |
H6 |
|||||
|
43 |
A7 |
|||||
|
44 |
B7 |
|||||
|
45 |
C7 |
Preparare solutie conjugat Ex:R7 Solutie spalare -1 rind 0,1 ml 0,9 ml - practic 1,5 ml 13,5 ml Dilutia este 1/10 | ||||
|
46 |
D7 |
|||||
|
47 |
E7 |
|||||
|
48 |
F7 |
|||||
|
49 |
G7 |
|||||
|
50 |
H7 |
La expirarea celor 30 min.± 2 min. scoatere de la incubare scoaterea foliei | ||||
|
51 |
A8 |
|||||
|
52 |
B8 |
|||||
|
53 |
C8 |
Spalator PW 40 Program TSE-3 Tamponare pe hartie de filtru |
max.5 minute |
|||
|
54 |
D8 |
|||||
|
55 |
E8 |
|||||
|
56 |
F8 |
Distribuire solutie conjugat/100ul godeu | ||||
|
57 |
G8 |
|||||
|
58 |
H8 |
|||||
|
59 |
A9 |
|||||
|
60 |
B9 |
Se acopera cu folie | ||||
|
61 |
C9 |
|||||
|
62 |
D9 |
Incubare la + |
30 ± 2 min. |
|||
|
63 |
E9 |
|||||
|
64 |
F9 |
Preparare solutie developare(cu 15 min.inainte de expirarea celor 30 ± 2min.):0,1 ml R9+1ml R8 sau:1 ml R9+10ml R8(dilutie 1/11) | ||||
|
65 |
G9 |
|||||
|
66 |
H9 |
|||||
|
67 |
A10 |
|||||
|
68 |
B10 |
Scoatere de la incubare | ||||
|
69 |
C10 |
|||||
|
70 |
D10 |
Scoaterea foliei | ||||
|
71 |
E10 |
Spalator PW 40 Program TSE -5 Tamponare pe hartie filtru |
max.5 minute |
|||
|
72 |
F10 |
|||||
|
73 |
G10 |
|||||
|
74 |
H10 |
|||||
|
75 |
A11 |
Distribuire sol. de developare-cromogen/100ul godeu | ||||
|
76 |
B11 |
|||||
|
77 |
C11 |
|||||
|
78 |
D11 |
|||||
|
79 |
E11 |
Incubare la temp. camerei si intuneric |
30 ± 2 min. |
|||
|
80 |
F11 |
|||||
|
81 |
G11 |
|||||
|
82 |
H11 |
|||||
|
83 |
A12 |
|||||
|
84 |
B12 |
Distribuire sol. de stopare/100ul godeu | ||||
|
85 |
C12 |
|||||
|
86 |
D12 |
Citire DO in bicromatic (450nm/620nm) |
Max. 30 min. de la stopa-re |
|||
|
87 |
E12 |
|||||
|
88 |
F12 |
|||||
|
89 |
G12 |
|||||
|
90 |
H12 |
Lotul . . . . . . . ..Seria . . . . . . . ..Valabilitatea . . . . . . ..
Medic veterinar, Semnatura si parafa Asistent veterinar Semnatura
FIGURA 36
SCHEMA ETAPA DE DETECTIE

FIGURA 37
SCHEMA ETAPA DE PURIFICARE
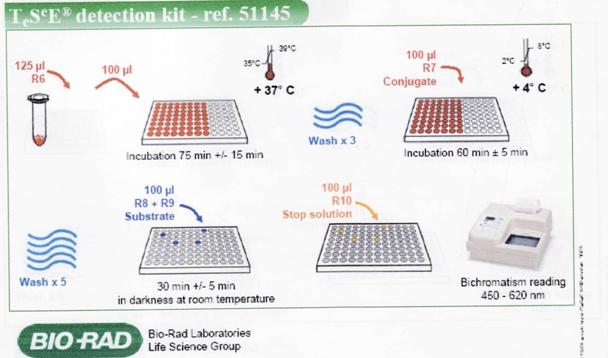
1. Calculul densitatii optice(DO) medii a controalelor negative
DO R3=media celor patru valori ale godeurilor R3
2. Calculul valorii cut off(prag)=valoarea prag este egala cu DO R3 + 0,210
Exemplu: DO R3 = 0,020
Valoarea prag = 0,020+0,210=0.230
3. Conditiile de validare a testului
Controlul negative R3
a. validarea valorilor individuale ale controlului negativ
Densitatea optica a fiecarui control negativ, trebuie sa fie neaparat mai mica decat 0,150.
Se poate elimina cel mult o valoare aberanta a contolului negativ, daca este mai mare sau egala cu 0,150. Daca mai mult de 2 valori ale controlului negativ, depasesc limita de 0.150 testul se repeta.
b. omogenitatea valorilor controlului negativ
Se calculeaza media densitatilor optice a controalelor negative valide ramase si se compara cu fiecare valoare individuala a negativului. Valoarea individuala ce depaseste media controalelor negative cu 40%, trebuie eliminata. Se poate elimina cel mult o valoare aberanta. Dupa eliminarea valorii aberante, se calculeaza media densitatii optice a controalelor negative ramase. Daca si una din valorile ramase, este mai mare cu 40% fata de valoarea medie a controalelor negative, testul trebuie repatat.
Controlul pozitiv R4
Cel putin una din valorile controalelor pozitive, trebuie sa fie mai mare sau egal cu 1.000.
Daca ambele valori ale controlului pozitiv, sunt mai mici decat 1.000 ,testul trebuie repetat.
Probele, a caror densitate optica este mai mica decat valoarea prag, se considera negative, in conformitate cu testul TSE. Totusi rezultatele situate chiar sub valoarea prag (valoarea prag minus 10%), trebuie interpretate cu prudenta, iar probele respective trebuie retestate in duplicat. Esantioanele a caror densitati optice sunt mai mari sau egale cu valoarea prag, sunt considerate initial reactive si trebuie retestate in duplicat, inainte de interpretarea definitiva.
Dupa retestare, esantioanele se reclasifica ca pozitive, in conformitate cu testul TSE daca cel putin una, la repetare, este pozitiva. (DO este ≥ cu valoarea prag)
Un esantion se clasifica ca negativ, in conformitate cu testul TSE, daca cele 2 duplicate la retestare, sunt mai mici decat valoarea prag.
Probele retestate in duplicat si gasite negative cu testul TSE, dar pentru care una din cele 2 valori la repetare este aproape de valoarea prag, (valoarea prag minus 10%), trebuie interpretate cu prudenta.
Orice proba, care genereaza un rezultat pozitiv, reproductibil, in conformitate cu criteriile de interpretare ale testului, trebuie confirmat si prin alte metode.
BULETIN DE REZULTATE NR.1
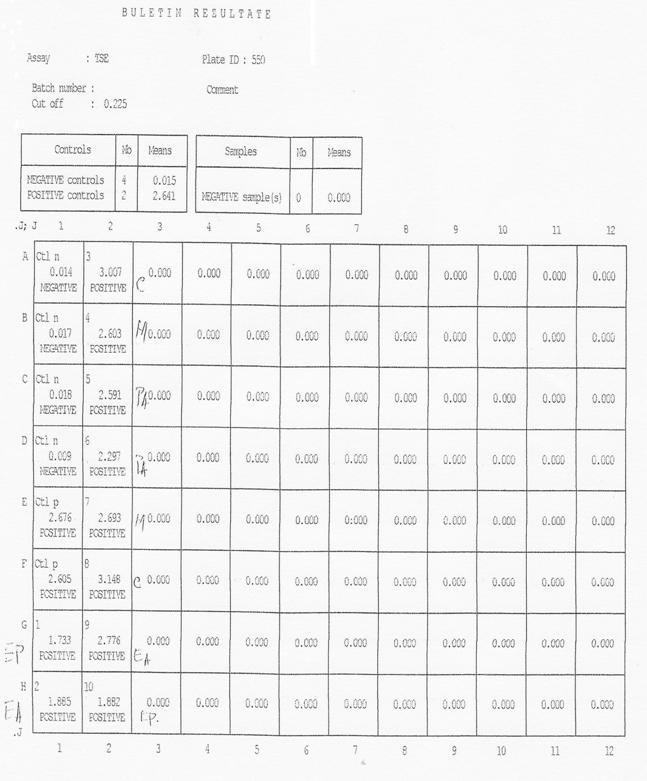
BULETINUL DE RAZULTATE NR.2
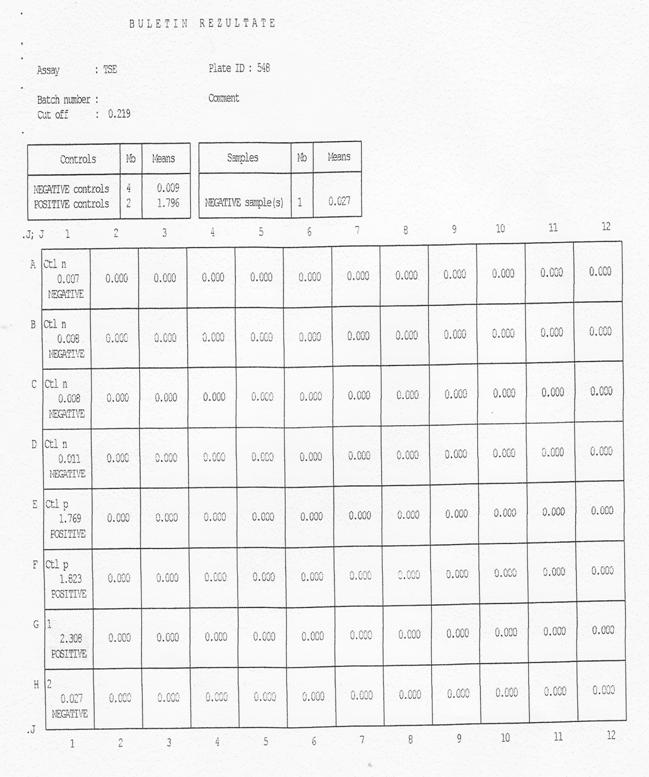
BULETINUL DE REZULTATE NR.3
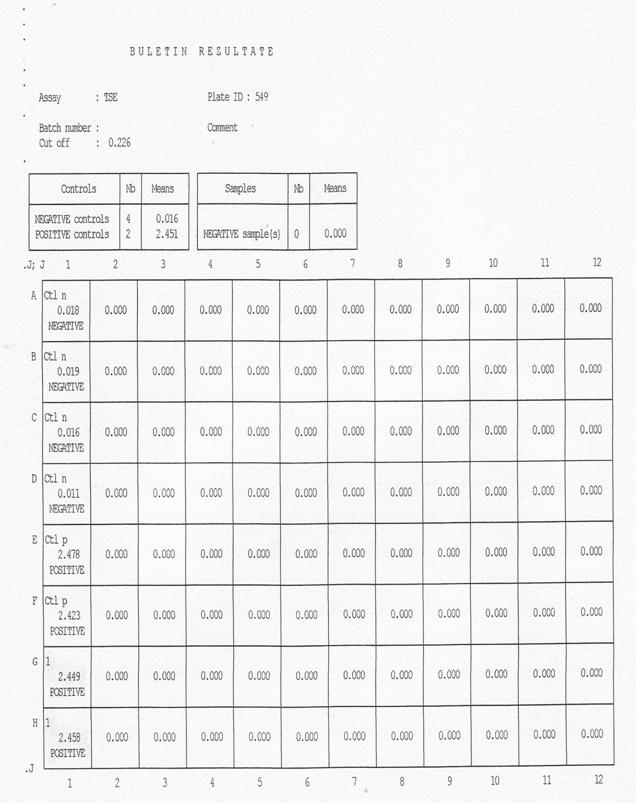
Diversificarea metodelor de laborator si stabilirea unui program de supraveghere national al EST-urilor, a condus la diagnosticarea scrapiei si in tara noastra.
Tabloul clinic intalnit la ovinele si caprinele luate in studiu, este cel citat de literatura de specialitate, referitor la srapie, fapt confirmat si prin testele de laborator.
Proteina prionica patogena, identificata la ovinele luate in studiu, a fost prezenta atat in bulbul rahidian, zona obex, cat si in celelalte regiuni ale sistemului nervos central: protuberanta anulara, mezencefal, cerebel, emisfere cerebrale.(conform buletinului de rezultat nr.1)
Se pune urmatoarea intrebare: Este justificata sacrificarea unui efectiv de ovine doar pentru ca a aparut un singur caz de boala?
Programele nationale de supraveghere si combatere a srapiei, precum si metodele de laborator, ar putea fi imbunatatite, pentru a se evita sacrificarea unui numar mare de ovine clinic sanatoase.
Incidenta scrapiei in focarele anlizate, a fost de sub 0,5% , lucru care demonstreaza ca boala a fost depistata in fazele incipiente.
Testul Bio Rad, Te Se E, s-a dovedit a fi un test rapid, robust si sensibil, fapt dovedit prin confirmarile si prin alte metode de laborator.
1.Alexandru Nicolae, "Morfopatologie: investigatii histologice in diagnostic" tipo. L.C.S.V.D., Bucuresti ,1995, pag.34-45
2.Allison GG; Rees Stevens P; Heasman L;
"Effect of scrapie incubation on the concentrations of plasma amino acids and L-lactate in infected lambs." Veterinary Research Communications 32 (8) pag.591-597
3.
Proceedings of the Royal Society of London Series B 270 (1529) pag.2141-2145
4.
"Pathogenesis of experimental bovine spongiform encephalopathy (BSE): estimation of tissue
infectivity according to incubation period.",Veterinary Research 40:08,
5. Baylis
M.-"THE EPIDEMIOLOGY OF SCRAPIE",
6.Birkamann E., F.Henke, D.Willlbold and
D.Riesner - "SURFACE-FIDA: A NEW DIAGNOSTIC TOOL FOR PRION DISEASES",
7. Buschamann A. ,M.Eiden, A.Gretzschel, C.Hoffmann, M.H.Groschup-"TSE STRAIN VARIABILITY IN SHEEP", TORINO,ITALY,PRION 2006, pag.44,
8.Caughey B.- "STRUCTURE, TRAFICKING
AND INHIBITION OF INFECTIOUS SCRAPIE PARTICLES",
9.Campeanu Marius Valer -"ENCEFALOPATIILE SPONGIFORME TRANSMISIBILE" ed. Viata medicala Romaneasca, Bucuresti , 2001, pag.32-35
10.DESLYS
Jean-Philippe (MD.PhD), "DECONTAMINATING PRIONS-REQUIREMENTS AND
SOLUTIONS", CEA/DSV/DRM/GIDTIP, 18 route
11.Di Guardo G; Windl O; Vacarri G; Lipp HP
"Prion potein amino acid determinants of differential susceptibility and molecular feature of prion strains in mice and voles". PLoS Pathogens 4 (7): e1000113,
12.Dustan BH; Spencer YI; Casalone C; Brownlie J; Simmons MM
"A histopathologic and immunohistochemical review of archived
Veterinary Pathology 45 (4) 443-454,
13.Ducrot C; Arnold M; Koeijer A de; Heim D; Calavas D,
Review on the epidemiology and dynamics of BSE epidemics."
Veterinary Research 39:15.
14.Gonzalez L, Martin S, Jeffrey M , 2003, "Distinct profiles of PrPd immunoreactivity in the brain of scrapie- and BSE-infected sheep: implications for differential cell targeting and PrP processing." Journal of General Virology 84 (5) 1339-1350,
15.Gravenor MB, Ryder SJ, Gubbins S, Hunter N, Baylis M, Kao RR,
"Searching for BSE in sheep: interpreting the results so far.",
Veterinary Record 152 (10) 298-299,
16.Green K.M., S.R.Browing, T.S.Seward,
M.Green, E.A.Hoover, G.C. Telling-"INTERSPECIES PRION TRANSMISSION IS
CONTROLLED BY CONFORMATIONAL COMPATIBILITY BETWEEN PRPsc AND HETEROTYPIC,
17.Guest, W.Plotkin, S.Cashman-"AN
ESTIMATE OF PrPc BETA SHEET DISSOCIATION GIBBS FREE ENERGY:IMPLICATIONS FOR
PRION CONVERSION",
18. Hubert Laude, "DIVERSITY AND
COMPLEXITY OF NATURAL RUMINANT PRIONS", Virologie Immunologie Moleculaires, INRA,
78350
19.Houston F, Goldmann W, Chong A, Jeffrey M, Gonzalez L, Foster J, Parnham D, Hunter , 2003," BSE in sheep bred for resistance to infection." Nature pag.423- 498
20. Israil Anca-Michaela -"PRIONI SI PRIONOZE: prezent si perspective", ed.Humanitas 2005, pag.11-
21.Matthews D, BSE: a global update.", Journal of Applied Microbiology 94 (Supplement 32) 120S-125S,
22.Manzat Radu Moga si col.-"BOLI VIROTICE SI PRIONICE ALE ANIMALELOR", ed.Brumar Timisoara 2005,pag.660-684,
23.Muller H., L.Stitz, D.Riesner - "PRIONS
AND FATS: PROTECTION OR DESTRUCTION?",
24.Nystrom,S.Hammarstrom-"IN VITRO FIBRILLATION OF RECOMBINAT HUMAN PRP90-231 ELUCIDATES THE ROLE OF POSITION 129 IN PRION CONVERSION INTO AMYLOID", MADRID, SPAIN, PRION 2008, pag.57
25.Perianu Tudor si col.-"BOLI INFECTIOASE ALE ANIMALELOR VIROZE VOL.2" ed.Universitas XXI, Iasi , 2005, pag.484-499,
26.Prusiner S.B.-"SINTHETIC PRION
STRAINS AND PLASMA LIPOPROTEINS",
27. Prusiner,S.B.:"PRIONS",Proc.Natl.Acad.Sci.USA, 1998,
28. Prusiner,S.B.:"SCRAPIE PRIONS"; molecular Genetics and Biology.Virology, 1991,
29.Prusiner,S.B.:"THE PRION DISEASES".Brain Pathol.1998,
30. Raeber,A.;Schimd,J;.. , "EVALUATION
OF THE DIAGNOSTIC PEROFRMANCE OF THE PRIONICS"
31.Soto Claudio, Joaquin Castilla, Rodrigo Morales and Paula Saa-"BIOCHEMICAL DETECTION OF PRIONS IN BLOOD", TORINO, ITALY, PRION 2006, pag.65
32. Torres J.M., J.C.Espinosa, O.Andreoletti, .E.Herva, E.Alamillo, C.Lacroux,"BSE AGENT SHOWS AN ENHANCED VIRULENCE AFTER PASSAGE IN SHEEP", TORINO,ITALY, PRION 2006, pag.39,
33. Toomik.R., "DETECTION OF OVINE SCRAPIE IN RAMALT TISSUE USING
AN ELISA", TORINO, ITALY, PRION 2006, pag.401,
34. HERD CHECK BSE+SCRAPIE ANTIGEN, IDEXX LABORATORIES,
35. BIO RAD Te Se E ,
36. PROGRAMUL DE SUPRAVEGHERE A BOLILOR LA ANIMALE 2008.
Copyright © 2026 - Toate drepturile rezervate